2. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院全军烧伤研究所,创伤、烧伤与复合伤国家重点实验室
2. State Key Laboratory of Trauma, Burn and Combined Injury, Institute of Burn Research, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
近年来,越来越多的研究表明硼替佐米(bortezomib, BTZ)能够降低肾移植受体体内的供体特异性抗体(donor specific antibody, DSA)水平,达到治疗抗体介导排斥反应(antibody-mediated rejection, ABMR)的目的[1-3]。但是T淋巴细胞作为同种免疫排斥反应的效应细胞之一,BTZ能否抑制T细胞的活性与功能,降低急性T细胞介导排斥反应(T cell- mediated rejection, TCMR)对移植器官损伤的研究却少见报道。BLANCO等[4]研究发现BTZ可清除同种反应性T细胞,可用于移植物抗宿主疾病(graft versus host disease, GVHD)治疗,这为我们用于治疗肾移植急性排斥反应提供了可能性。因此,我们建立体外混合淋巴培养体系(mixed lymphocyte culture, MLC)模拟TCMR,观察BTZ对同种抗原反应性T细胞凋亡的影响,为进一步探索BTZ在器官移植领域的使用提供实验依据。
1 材料与方法 1.1 材料C57BL/6及BALB/c小鼠,均为雄性,8~12周龄,体质量为20~25 g,购于陆军军医大学(第三军医大学)实验动物中心。RPMI 1640培养基和胎牛血清购于美国Gibco公司;重组小鼠IL-2和细胞凋亡检测试剂盒购于美国R&D公司;红细胞裂解液购于北京鼎国昌盛生物;EasySepTM小鼠T细胞磁珠分离试剂盒购于加拿大Stemcell公司;丝裂霉素C和硼替佐米购于美国Selleck公司;细胞计数试剂盒(CCK-8)和细胞周期检测试剂盒购于中国碧云天生物公司;BV421-抗CD25抗体和PE-抗CD69抗体试剂购于美国Biolegend公司;Cyclin D1试剂盒和Cleaved caspase 3试剂盒购于美国CST公司;小鼠细胞因子IL-4、TNF-α及IFN-γ酶联免疫检测试剂盒购于深圳达科为生物公司。
1.2 方法 1.2.1 单向混合淋巴细胞培养体系建立分别取BALB/c及C57BL/6小鼠脾脏制成单细胞悬液,BALB/c小鼠脾细胞经丝裂霉素C处理后,计数板计数并调整细胞含量至1×106/mL作为刺激细胞。C57BL/6小鼠脾细胞经EasySepTM小鼠T细胞磁珠分选试剂分选出T细胞,调整细胞数为1×106/mL作为反应细胞。通过流式细胞仪结合抗小鼠CD3-PE抗体染色对T细胞进行纯度检测。此时T细胞纯度已达到95%,可用于后续实验。两种淋巴细胞1 :1混合后加入48孔板,每孔加入上述混合细胞悬液500 μL,在5% CO2、37 ℃培养箱孵育进行培养。
1.2.2 T细胞增殖分析混合淋巴细胞培养24 h后, 用EasySepTM小鼠T细胞磁珠分选试剂从混合培养细胞中分选出高纯度T细胞,分别加入不同浓度的硼替佐米(0、0.01、0.1、1 μmol/L和10 μmol/L),继续培养12 h。CCK-8试剂盒检测细胞的增殖。细胞增殖抑制率(%)=[(Ac-At)/(Ac-Ab)] × 100%。Ac:对照组;At:实验组;Ab:空白组。
1.2.3 细胞凋亡分析混合淋巴细胞培养0、4、8、12、24 h后,EasySepTM小鼠T细胞磁珠分选试剂从混合培养细胞中分选出高纯度T细胞,设立实验组和对照组,实验组分别加硼替佐米(0.01 μmol/L)干预12 h,对照组不加硼替佐米。收集细胞和上清液,采用Annexin V-FITC和PI双染试剂盒检测T细胞凋亡情况。根据试剂盒说明书,每1×105细胞加入5 μL Annexin V-FITC和5 μL PI在室温、避光条件下孵育15 min。用PBS清洗细胞后,通过流式细胞术对细胞凋亡情况进行分析。Annexin V阳性细胞均认为是凋亡细胞。
1.2.4 细胞周期分析混合淋巴细胞培养24 h后,加入硼替佐米(0.01 μmol/L)作用12 h后,收集细胞并用70 %酒精固定过夜。根据细胞周期检测试剂盒说明书对细胞进行处理,采用流式细胞术对细胞进行分析。
1.2.5 T细胞活化相关表面标志分析细胞培养和干预与凋亡分析中过程相同。收集细胞,洗涤后加BV 421-抗CD25抗体和PE-抗CD69抗体,室温、避光孵育30 min后流式细胞术检测。
1.2.6 Western blot检测按照蛋白提取试剂说明提取细胞总蛋白,BCA法测定蛋白浓度后,SDS-PAGE凝胶电泳,湿转膜后,5%脱脂牛奶封闭,一抗孵育过夜,漂洗过后,孵育二抗,ECL试剂盒化学发光,凝胶成像采集系统采集结果。
1.2.7 ELISA检测按照ELISA试剂盒说明书,检测细胞培养上清中细胞因子IL-4、IFN-γ及TNF-α的浓度。
1.3 统计学分析应用SPSS 23.0统计软件分析。结果均以x±s表示。两独立样本均数比较采用t检验,两组以上样本均数比较采用单因素方差分析。检验水准:α=0.05。所有统计结果采用Graphpad Prism 6软件作图。
2 结果 2.1 硼替佐米对T细胞增殖的影响我们首先检测了不同浓度的硼替佐米作用于培养T细胞12 h后的增殖情况。如表 1所示,T细胞在不同浓度的硼替佐米处理后的光密度值明显小于对照组(0 μmol/L),而且随着药物浓度的增加,细胞增殖抑制率逐渐升高(P<0.05)。当药物浓度达到0.1 μmol/L后,抑制率达到68.4%。因此,在后续实验中,我们均选用药物毒性较小浓度0.01 μmol/L硼替佐米处理细胞。
| (n=9, x±s) | ||
| 药物浓度 /μmol·L-1 |
光密度值 | 增殖抑制/% |
| 0.00 | 0.81±0.04 | 0.00±6.14 |
| 0.01 | 0.63±0.03 | 25.14±4.90a |
| 0.10 | 0.33±0.02 | 68.40±3.84a |
| 1.00 | 0.23±0.04 | 82.79±5.42a |
| 10.00 | 0.22±0.05 | 83.64±7.45a |
| 静息性T细胞 | 0.18±0.00 | |
| a: P<0.05,与0.00 μmol/L比较 | ||
2.2 硼替佐米对T细胞凋亡的影响
为了探究硼替佐米对T细胞的活性影响,我们采用了Annexin V和PI双染细胞,通过流式细胞术检测细胞的凋亡情况和Western blot分析细胞凋亡相关蛋白Cleaved caspase 3的表达。如图 1A、B显示,除未混合细胞培养组(0 h)外,与对照组相比,BTZ组T细胞Annexin V阳性细胞所占百分比明显增加(P<0.05)。而且,混合细胞培养时间越长,BTZ组T细胞的凋亡百分比越高(P<0.05),而未混合培养组T细胞(静息性T细胞)的凋亡百分比差异无统计学意义[(12.19±0.76)% vs (12.34±0.51)%, P=0.787]。此外,细胞经混合培养后,BTZ组T细胞凋亡相关蛋白Cleaved caspase 3表达量也较未混合培养细胞组增加(图 1C、D)。

|
| A:流式细胞术检测细胞混合培养不同时间T细胞凋亡比例;B: T细胞凋亡比例统计分析 b: P<0.01; c: P<0.001,与前一时间点比较;C: Western blot检测结果;D:半定量分析 a: P<0.05, 与0 h组比较 图 1 硼替佐米对混合淋巴细胞培养不同时间T细胞凋亡的影响 |
2.3 硼替佐米对T细胞周期的影响
为了探究硼替佐米对T细胞周期的影响,我们采用流式细胞术检测T细胞内DNA在各细胞周期含量和Western blot分析细胞周期蛋白D1表达。如图 2A、B所示,与对照组相比,BTZ组T细胞DNA在G1期的百分比明显增加,而在S期和G2期的百分比相对减少[P<0.05, G1期:(62.15±2.27)% vs (48.14±0.99)%,S期:(13.38±2.49)% vs (35.28±3.67)%,G2期:(1.48±0.31) % vs (2.55±0.15) %]。如图 2C所示,BTZ组T细胞的细胞周期蛋白D1表达量(0.51±0.09)较对照组(1.00)明显降低(P<0.05)。

|
| A:流式细胞术检测T细胞周期;B: T细胞周期比例统计分析 a: P<0.05, 与对照组比较;C: Western blot检测结果 图 2 硼替佐米对T细胞周期及细胞周期蛋白D1的影响 |
2.4 硼替佐米对T细胞活化的影响
为了探究硼替佐米对T细胞活化的影响,我们检测了T细胞活化表面标记CD25和CD69表达。如图 3所示,除未混合培养组T细胞(静息性T细胞)百分比差异无统计学意义[CD25:(5.77±0.09) % vs (5.82± 0.08) %,P=0.43;CD69:(9.49±0.06) % vs (9.48±0.04) %,P=0.86],BTZ组T细胞活化表面标志CD25和CD69表达均低于对照组,且CD25表达下调比CD69更加明显(P<0.05)。

|
| A:流式细胞术检测T细胞活化相关标志CD25和CD69表达;B: CD25表达比例统计分析;C: CD69表达比例统计分析 a:P<0.05, 与对照组比较;D: CD25和CD69表达抑制率统计分析 图 3 硼替佐米对T细胞活化的影响 |
2.5 硼替佐米对T细胞分泌细胞因子的影响
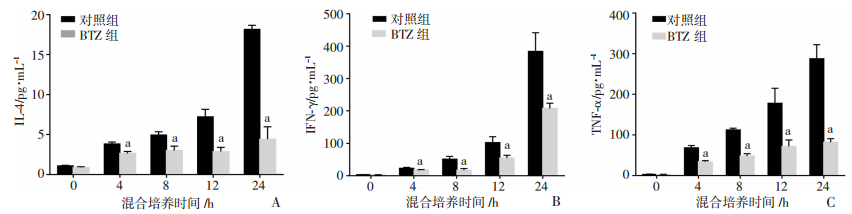
为了探究BTZ对T细胞分泌细胞因子的影响,我们采用ELISA法检测了细胞上清液中细胞因子IL-4、TNF-α及IFN-γ浓度。如图 4A~C所示,BTZ组上清液中细胞因子IL-4、TNF-α及IFN-γ浓度均明显低于对照组(P<0.05)。
|
| A~C: ELISA检测T细胞分泌的细胞因子IL-4、IFN-γ和TNF-α浓度 a: P<0.05, 与对照组比较 图 4 硼替佐米对T细胞分泌细胞因子的影响 |
3 讨论
研究表明,近年来影响移植肾脏长期存活的最主要因素仍是免疫因素[5-6],虽然钙调磷酸酶抑制剂、雷帕霉素和抗增殖类药物等免疫抑制剂在临床上大量使用,但是移植后急性排异反应仍不能完全避免[7-10]。而且免疫抑制剂不仅仅只影响免疫细胞,对其他细胞或组织也有较大的毒副作用,长期使用的患者都有可能遭受药物潜在的副作用,包括机会性感染、代谢综合征、肾脏损害等[11]。因此改善肾移植术后排斥反应治疗方案,选择合适药物对改善移植肾功能及维持肾移植受者良好状态至关重要。
T淋巴细胞长期以来在介导移植排斥反应中发挥着核心作用,是急性排斥反应和激活B淋巴细胞的主要参与者。硼替佐米是抑制NF-κB信号通路26 S蛋白酶体的抑制剂,临床用于治疗ABMR时能显著降低患者血清中的DSA水平,在改善移植肾功能和延长移植肾存活时间方面取得了良好的效果[3, 12-14]。但是BTZ对于治疗T细胞介导排斥反应的研究较少,为此本实验着重研究BTZ对T淋巴细胞的免疫抑制作用,探讨BTZ治疗移植排斥反应的临床运用价值。我们研究发现,即使给予药物浓度0.01 μmol/L,T细胞的增殖能力既能明显降低,当BTZ药物浓度达到0.1 μmol/L时,T细胞的增殖能力显著受到抑制,但当浓度持续增加时并没有完全抑制T细胞的活性。
另外我们发现,BTZ可诱导T细胞凋亡,尤其是细胞混合培养时间越长,凋亡细胞所占的百分比越大,但对静息性T细胞(0 h)的活性影响不明显;而且,T细胞经混合培养活化后,BTZ组细胞的凋亡相关蛋白Cleaved caspase 3表达量也较静息性T细胞组增加,尤其细胞混合培养24 h后,Cleaved caspase 3蛋白的表达量增加更明显。这一现象可能与T细胞内的NF-κB信号通路是否激活有关,同种抗原活化T细胞,NF-κB信号通路被激活后,BTZ抑制NF-κB信号通路活性,引起内质网应激反应,导致T细胞凋亡[15-16],因此细胞混合培养时间越长,反应性T细胞数量越多,凋亡细胞比例就越大。所以我们推测反应性T细胞对BTZ诱导的凋亡比静止T细胞更敏感。此外,BTZ也可诱导T细胞停滞于G1期,Western blot结果显示周期蛋白D1表达量明显降低,表明BTZ还可通过调节T细胞的细胞周期,促进增殖的细胞凋亡,从而减少T细胞扩增。这为临床上减少移植肾特异反应性T细胞数量,保护肾脏功能提供可能性。
T细胞侵犯移植肾脏需要经过抗原的激活,从而进行特异性扩增、分泌炎性细胞因子等。因此我们还评估了硼替佐米是否能改变激活T细胞的活化方式和细胞因子分泌。在我们结果中显示,BTZ干预后T细胞活化相关表面标志CD69和CD25明显下降,尤其CD25是IL-2受体,它的下降会大大减少T细胞的增殖[17],可作为分子靶向治疗耐受型TCMR。BTZ可下调CXCR3/CXCL9的表达来调控T细胞的趋化特性,减少Th1细胞分泌炎性细胞因子IFN-γ和IL-2,控制异基因干细胞移植后GVHD [4, 18]。我们实验结果显示BTZ除了减少T细胞分泌炎性细胞因子IFN-γ、TNF-α外,还减少了IL-4分泌。IL-4能促进Th2细胞生成,在刺激B细胞增殖、分化过程中发挥着重要的作用,所以BTZ抑制T细胞分泌IL-4可能会影响B细胞的活化、增殖,减少分泌抗体的浆细胞数量[19-20],从而可达到抑制抗体介导排斥反应发生的目的。
综上所述,硼替佐米不仅可通过抑制T细胞的增殖能力以及诱导活化T细胞凋亡来减少同种抗原反应性T细胞的数量,还可降低T细胞免疫相关细胞因子分泌。由于我们的实验结果只有体外研究结果,缺乏更多的相关数据研究和相应的体内实验结果,所以硼替佐米治疗急性排斥反应的证据略显不足。但是结合已有的研究报道,我们认为对于肾移植术后的移植排斥反应,BTZ可能会发挥其对反应性T细胞和B细胞的免疫抑制作用,减少移植物中T细胞浸润和炎性细胞因子释放,抑制分泌同种特异性抗体浆细胞产生。因此,BTZ不仅可用于ABMR治疗,还在治疗TCMR或混合型排斥反应也有潜在的使用价值,对移植排斥反应的治疗具有良好的运用前景。
| [1] |
许晓婷, 范明齐, 黄赤兵. 肾移植后早期抗体介导排斥反应治疗的42例临床分析[J]. 中华器官移植杂志, 2017, 38(7): 397-402. XU X T, FAN M Q, HUANG C B. Treatment for early-onset antibody-mediated rejection after kidney transplantation[J]. ChinJOrgan Transplant, 2017, 38(7): 397-402. DOI:10.3760/cma.j.issn.0254-1785.2017.07.003 |
| [2] |
SHAH N, MEOUCHY J, QAZI Y. Bortezomib in kidney transplantation[J]. Curr Opin Organ Transplant, 2015, 20(6): 652-656. DOI:10.1097/MOT.0000000000000252 |
| [3] |
KIZILBASH S, CLAES D, ASHOOR I, et al. Bortezomib in the treatment of antibody-mediated rejection in pediatric kidney transplant recipients:Amulticenter Midwest Pediatric Nephrology Consortium study[J]. Pediatr Transplant, 2017, 21(3). DOI:10.1111/petr.12873 |
| [4] |
BLANCO B, PÉREZ-SIMÓN J A, SÁNCHEZ-ABARCA L I, et al. Bortezomib induces selective depletion of alloreactiveTlymphocytes and decreases the production of Th1 cytokines[J]. Blood, 2006, 107(9): 3575-3583. DOI:10.1182/blood-2005-05-2118 |
| [5] |
LOUPY A, HAAS M, SOLEZ K, et al. The Banff 2015 kidney meeting report: current challenges in rejection classification and prospects for adopting molecular pathology[J]. AmJTransplant, 2017, 17(1): 28-41. DOI:10.1111/ajt.14107 |
| [6] |
ZHANG R B. Donor-specific antibodies in kidney transplant recipients[J]. ClinJAm Soc Nephrol, 2018, 13(1): 182-192. DOI:10.2215/cjn.00700117 |
| [7] |
RANDHAWA P. T-cell-mediated rejection of the kidney in the era of donor-specific antibodies: diagnostic challenges and clinical significance[J]. Curr Opin Organ Transplant, 2015, 20(3): 325-332. DOI:10.1097/MOT.0000000000000189 |
| [8] |
LEFAUCHEUR C, GOSSET C, RABANT M, et al. Tcell-mediated rejection isamajor determinant of inflammation in scarred areas in kidney allografts[J]. AmJTransplant, 2018, 18(2): 377-390. DOI:10.1111/ajt.14565 |
| [9] |
EL TERS M, GRANDE J P, KEDDIS M T, et al. Kidney allograft survival after acute rejection, the value of follow-up biopsies[J]. AmJTransplant, 2013, 13(9): 2334-2341. DOI:10.1111/ajt.12370 |
| [10] |
LOUPY A, VERNEREY D, TINEL C, et al. Subclinical rejection phenotypes at 1 year post-transplant and outcome of kidney allografts[J]. JAm Soc Nephrol, 2015, 26(7): 1721-1731. DOI:10.1681/ASN.2014040399 |
| [11] |
WONG T C, LO C M, FUNG J Y. Emerging drugs for prevention of T-cell mediated rejection in liver and kidney transplantation[J]. Expert Opin Emerg Drugs, 2017, 22(2): 123-136. DOI:10.1080/14728214.2017.1330884 |
| [12] |
JEONG J C, JAMBALDORJ E, KWON H Y, et al. Desensitization using bortezomib and high-dose immunoglobulin increases rate of deceased donor kidney transplantation[J]. Medicine (Baltimore), 2016, 95(5): e2635. DOI:10.1097/MD.0000000000002635 |
| [13] |
LEE J, KIM B S, PARK Y, et al. The effect of bortezomib on antibody-mediated rejection after kidney transplantation[J]. Yonsei Med J, 2015, 56(6): 1638-1642. DOI:10.3349/ymj.2015.56.6.1638 |
| [14] |
YANG K S, JEON H, PARK Y, et al. Use of bortezomib as anti-humoral therapy in kidney transplantation[J]. JKorean Med Sci, 2014, 29(5): 648-651. DOI:10.3346/jkms.2014.29.5.648 |
| [15] |
WEIL R, ISRAËL A. T-cell-receptor- and B-cell-receptor-mediated activation of NF-κB in lymphocytes[J]. Curr Opin Immunol, 2004, 16(3): 374-381. DOI:10.1016/j.coi.2004.03.003 |
| [16] |
DONG H J, CHEN L, CHEN X Q, et al. Dysregulation of unfolded protein response partially underlies proapoptotic activity of bortezomib in multiple myeloma cells[J]. Leuk Lymphoma, 2009, 50(6): 974-984. DOI:10.1080/10428190902895780 |
| [17] |
ZHANG Y, JIN W, CAI X. Anti-interleukin-2 receptor antibodies for the prevention of rejection in liver transplant recipients:asystematic review and meta-analysis[J]. Ann Med, 2017, 49(5): 365-376. DOI:10.1080/07853890.2016.1257862 |
| [18] |
LIU W, REN H Y, DONG Y J, et al. Bortezomib regulates the chemotactic characteristics ofTcells through downregulation of CXCR3/CXCL9 expression and induction of apoptosis[J]. IntJHematol, 2012, 96(6): 764-772. DOI:10.1007/s12185-012-1195-6 |
| [19] |
KOENIG A, THAUNAT O. Lymphoid neogenesis and tertiary lymphoid organs in transplanted organs[J]. Front Immunol, 2016, 7: 646. DOI:10.3389/fimmu.2016.00646 |
| [20] |
KWUN J, MANOOK M, PAGE E, et al. Crosstalk betweenTandBcells in the germinal center after transplantation[J]. Transplantation, 2017, 101(4): 704-712. DOI:10.1097/TP.0000000000001588 |



