2. 450003 郑州,郑州大学人民医院,河南省人民医院,河南省立眼科研究所,河南眼科医院
2. People's Hospital of Zhengzhou University and Henan Provincial People's Hospital, Henan Eye Institute, Zhengzhou, Henan Province, 450003, China
血管紧张素Ⅱ(angiotensin Ⅱ, Ang Ⅱ)是肾素-血管紧张素系统(renin-angiotensin-system, RAS)中重要的效应分子,与年龄相关性黄斑变性(age-related macular degeneration,AMD)及糖尿病视网膜病变(diabetic retinopathy,DR)等多种眼病的发生、发展密切相关[1-4]。Ang Ⅱ在血管紧张素转化酶2(angiotensin converting enzyme2, ACE2)的作用下可转变为Ang-(1-7) [5]。后者可通过激活其内源性配体--MAS受体(MAS receptor)发挥抑制炎症、改善内皮细胞功能及血管舒张等保护性作用[6-7]。关于RAS中保护性ACE2/Ang-(1-7)/MAS受体轴的研究表明,通过该轴可减轻实验性自身免疫性葡萄膜炎(experimental autoimmune uveitis, EAU)动物模型及β-淀粉样蛋白(Aβ1-42)诱导的人视网膜色素上皮细胞(human retinal pigment epithelium, hRPE)中的炎症反应[8-9],可见ACE2/Ang-(1-7)/MAS受体轴是眼部炎性疾病治疗的重要靶点。
TO901317(TO90)是一种人工合成的外源性类固醇,主要通过激活肝脏X受体(liver x receptor, LXR)发挥调节胆固醇代谢、抗炎及抗氧化的作用[10-12]。在眼部疾病中发现,使用TO90激活LXR可减轻实验性内毒素诱导性葡萄膜炎(endotoxin-induced uveitis, EIU)中的炎症反应[13];在N-甲基-D-天冬氨酸(NMDA)诱导的视网膜神经毒性反应中发挥保护作用[14]。近年研究发现LXR激活剂GW3965可通过MAS受体减轻DR中视网膜的血管渗漏[15]。上述研究表明TO90很有可能通过ACE2/Ang-(1-7)/MAS受体轴发挥抗炎作用。因此,本研究将依靠体外细胞实验,探讨TO90能否通过ACE2/Ang-(1-7)/MAS受体轴在Ang Ⅱ诱导的人视网膜色素上皮细胞(ARPE-19)炎症反应中发挥保护作用。
1 材料与方法 1.1 材料ARPE-19细胞株购于美国ATCC细胞库;胎牛血清、DMEM细胞培养基购于Gibco公司;细胞计数试剂盒(Cell Counting Kit-8, CCK-8)、青链霉素混合液、牛血清白蛋白(BSA)购于美国Genview公司;胰蛋白酶购于重庆博培公司; RNA提取试剂(TRIzol)购于美国Invitrogen公司;逆转录试剂盒购于TaKaRa公司;Real-time PCR试剂购于Vazyme公司;PCR引物由中国生工生物工程公司合成;IL-6、IL-8及MCP-1 ELISA试剂盒购于美国RD公司; MAS受体抗体购于Novus公司;β-actin抗体购于CST公司;ACE2抗体购于武汉塞维尔公司;辣根过氧化物酶(HRP)标记的二抗购于Solarbio公司;TO90购于Sigma公司;Ang Ⅱ购于RD公司;A779购于MCE公司。
1.2 方法 1.2.1 细胞培养将ARPE-19于含10% FBS的完全DMEM培养基中培养(37 ℃、5% CO2),每24小时观察细胞生长状态,待细胞融合度为80%~90%时使用胰酶消化细胞进行传代。传代至15~20代时进行体外细胞实验。
1.2.2 细胞分组第一步:比较①空白对照组:不做任何处理;②Ang Ⅱ模型组:Ang Ⅱ(1 μmol/L)刺激细胞48 h,判断是否成功建立Ang Ⅱ炎症模型。第二步:比较②及③TO90+ Ang Ⅱ治疗组:Ang Ⅱ刺激前TO90(5 μmol/L)预处理1 h,探究TO90在Ang Ⅱ炎症模型中的作用。第三步:比较②、③、④A779+ TO90+ Ang Ⅱ抑制剂组:TO90治疗前A779(10 μmol/L)预处理1 h;⑤A779+Ang Ⅱ抑制剂对照组:Ang Ⅱ刺激前A779(10 μmol/L)预处理1 h,验证TO90在Ang Ⅱ炎症模型中的作用。以上所有分组在Ang Ⅱ诱导后继续培养48h。
1.2.3 CCK-8检测Ang Ⅱ及TO90对ARPE-19细胞存活率的影响ARPE-19细胞接种于96孔板中,待细胞长满后使用不含FBS的DMEM培养基继续培养24 h。随后加入终浓度为0、1、10、100 μmol/L的AngⅡ以及终浓度为0、5、10、100 μmol/L的TO90刺激ARPE-19细胞24 h和48 h。刺激结束后,每孔重新加入100 μL按说明书稀释的CCK-8试剂,37 ℃、5% CO2孵箱中培养细胞4 h,酶标仪检测各样本光密度值。无Ang Ⅱ及TO90刺激的细胞为空白对照。
1.2.4 Real-time PCR检测细胞IL-6、IL-8、MCP-1、ACE2及MAS受体的mRNA表达ARPE-19细胞接种于12孔板中。细胞刺激结束后,按说明书步骤提取RNA,并逆转录成cDNA用于Real-time PCR实验。Real-time PCR反应体系为20 μL:Mix 10 μL、ROX 0.4 μL、cDNA 2 μL、上游引物0.8 μL、下游引物0.8 μL及无酶水6 μL。实验中使用的引物序列见表 1。
| 基因名称 | 产物长度 | 引物序列 |
| IL-6 | 137 bp | 上游:5′-AGTGAGGAACAAGCCAGAGC-3′ |
| 下游:5′-CAGGGGTGGTTATTGCATCT-3′ | ||
| IL-8 | 147 bp | 上游:5′-GACATACTCCAAACCTTTCCACCC-3′ |
| 下游:5′-CCAGACAGAGCTCTCTTCCATCAG-3′ | ||
| MCP-1 | 183 bp | 上游:5′-CTCATAGCAGCCACCTTCATTC-3′ |
| 下游:5′-TCACAGCTTCTTTGGGACACTT-3′ | ||
| MAS | 245 bp | 上游:5′-CCCAAGTACCAGTCGGCAT-3′ |
| 下游:5′-AGCTTGGAGGAATGGGAAGC-3′ | ||
| ACE2 | 132 bp | 上游:5′-CATTGGAGCAAGTGTTGGATCTT-3′ |
| 下游:5′-GAGCTAATGCATGCCATTCTC-3′ | ||
| β-actin | 131 bp | 上游:5′-GGATGCAGAAGGAGATCACTG-3′ |
| 下游:5′-CGATCCACACGGAGTACTTG-3′ |
1.2.5 ELISA检测细胞上清中IL-6、IL-8及MCP-1的蛋白表达
收集细胞上清液, 检测炎症因子的蛋白表达。ELISA试剂盒一抗按说明书稀释过夜;RD液封闭2 h;对应孔加入100 μL标准品及样本,37 ℃孵育2 h;加入100 μL二抗稀释液孵育1 h;随后加入100 μL HRP溶液后孵育30 min;100 μL AB显色液孵育15 min;最后加入50 μL H2SO4终止反应,并立即使用酶标仪检测各样本光密度值,绘制标准曲线。
1.2.6 Western blot检测ACE2、MAS受体的蛋白表达提取各组总蛋白,BCA检测各样品蛋白浓度。随后进行SDS-PAGE凝胶电泳,电泳完毕后将蛋白印迹转移至PVDF膜上,5%封闭液(2 g脱脂奶粉+40 mL TBST)室温封闭2 h。分别加入ACE2、MAS或β-actin抗体(1 :1 000稀释)孵育条带,4 ℃过夜。加入二抗抗体(1 :5 000稀释),室温孵育1 h,TBST清洗后ECL化学发光显影,上述步骤重复3次。
1.3 统计学分析数据均使用GraphPad prism 5.0进行分析并处理。所有数据采用x±s表示,两组数据采用独立样本t检验;多组数据采用双因素方差分析,组间采用LSD法进行两两比较。检验水准:α=0.05。
2 结果 2.1 Ang Ⅱ及TO90对ARPE-19细胞存活率的影响与空白对照组相比,不同浓度Ang Ⅱ(1、10、100 μmol/L)在24 h和48 h对ARPE-19的细胞存活率均无影响(图 1);100 μmol/L的TO90刺激AR PE-19细胞24 h或48 h均能明显降低其细胞活性(P<0.05,图 1)。因此选用1 μmol/L Ang Ⅱ和5 μmol/L TO90, 处理48 h作为后续研究的浓度及时间。

|
| a:P<0.05, 与100 μmol/L比较;b:P<0.05, 与100 μmol/L比较 图 1 CCK-8检测不同浓度的AngⅡ及TO90刺激24 h和48 h后对ARPE-19细胞存活率的影响 |
2.2 Ang Ⅱ对ARPE-19细胞产生炎症因子的影响
Real-time PCR及ELISA检测结果显示:与空白组相比较,Ang Ⅱ模型组中炎症因子(IL-6、IL-8及MCP-1)的mRNA及蛋白表达水平明显升高,差异有统计学意义(P<0.05,图 2)。

|
| a: P<0.05, b: P<0.01, c: P<0.001, 与空白组比较 图 2 Real-time PCR及ELISA检测空白组与Ang Ⅱ组IL-6, IL-8及MCP-1在mRNA及蛋白水平的表达变化 |
2.3 TO90对Ang Ⅱ诱导的ARPE-19细胞中炎症因子表达的影响
Real-time PCR及ELISA检测结果显示:TO90能显著降低炎症因子(IL-6、IL-8及MCP-1)在mRNA水平及蛋白水平的表达(P<0.05,图 3)。

|
| a: P<0.05, b: P<0.01, 与Ang Ⅱ组比较 图 3 Real-time PCR及ELISA检测Ang Ⅱ组与TO90+Ang Ⅱ组IL-6, IL-8及MCP-1在mRNA及蛋白水平的表达变化 |
2.4 TO90对ACE2及MAS受体表达的影响
Real-time PCR及Western blot检测结果显示,与Ang Ⅱ模型组相比较,TO90能显著升高ACE2及MAS受体在mRNA水平及蛋白水平的表达(P<0.05,图 4)。

|
| 1:Ang Ⅱ组; 2:TO90+Ang Ⅱ组; a: P<0.05, b: P<0.01, c: P<0.001, 与Ang Ⅱ组比较 图 4 Real-time PCR及Western blot检测各组ACE2及MAS受体的表达变化 |
2.5 A779对ACE2及MAS受体表达的影响
Real-time PCR及Western blot检测结果显示:与TO90+Ang Ⅱ组相比较,A779+TO90+Ang Ⅱ组中ACE2、MAS受体在mRNA及蛋白水平表达量均明显降低,差异有统计学意义(P<0.05,图 5)。
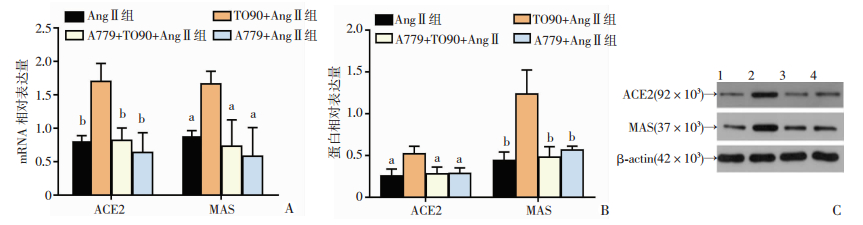
|
| 1:Ang Ⅱ组; 2:TO90+Ang Ⅱ组; 3: A779+ TO90+ Ang Ⅱ组; 4: A779+ Ang Ⅱ组; a: P<0.05, b: P<0.01, c: P<0.001, 与TO90+Ang Ⅱ组比较 图 5 Real-time PCR及Western blot检测各组ACE2及MAS受体的表达变化 |
2.6 A779对炎症因子表达的影响
Real-time PCR及ELISA检测结果显示:A779使用后与TO90治疗组相比较,炎症因子(IL-6、IL-8及MCP-1)的表达量在mRNA及蛋白水平升高,差异有统计学意义(P<0.05,图 6)。
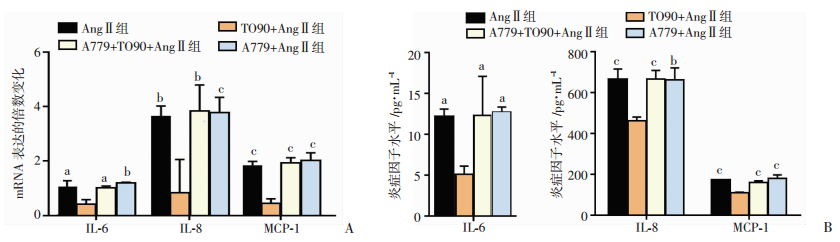
|
| a: P<0.05, b: P<0.01, c: P<0.001, 与TO90+Ang Ⅱ组比较 图 6 Real-time PCR及ELISA检测各组IL-6, IL-8及MCP-1的表达变化 |
3 讨论
我们研究发现,Ang Ⅱ可诱导ARPE-19产生炎症反应,而TO90可减轻Ang Ⅱ诱导的炎症反应。进一步的实验结果显示,TO90可通过RAS保护性ACE2/Ang-(1-7)/MAS受体轴在AngⅡ诱导产生的炎症反应中发挥保护作用。Ang Ⅱ作为RAS中最重要的血管活性物质,其含量在组织局部升高时可诱导特异性的炎症、趋化因子产生,从而促进组织周围炎症细胞的黏附、聚集[18]。在AMD及DR等炎症相关眼病发生时局部Ang Ⅱ及血管紧张素Ⅱ1型受体(angiotensin Ⅱ Type 1 Receptor,AT1R)表达量升高,使用AT1R抑制剂可抑制MCP-1及IL-6等炎症因子的表达,从而改善眼部疾病的病变程度[19-20]。因此本实验选择与眼部炎性疾病密切相关的Ang Ⅱ诱导ARPE-19细胞产生炎症反应,并进行相关的机制研究。此前研究表明,TO90可减轻胆固醇代谢紊乱、神经退行性变中的炎症反应[13-14]。而我们的研究发现,当Ang Ⅱ诱导ARPE-19细胞产生炎症反应时,使用TO90可明显减少IL-6、IL-8及MCP-1等炎症因子的表达,从而减轻炎症反应,这一研究结果证实了TO90在不同病理条件下均可发挥保护作用。近年来HAZRA等[15]在研究DR时发现使用LXR激动剂可诱导MAS受体表达升高。我们在研究TO90的作用机制时也发现,TO90可通过ACE2/Ang-(1-7)/MAS受体轴减轻Ang Ⅱ诱导RPE细胞产生的炎症反应。为进一步验证TO90与ACE2/Ang-(1-7)/MAS受体轴的关系,我们使用了MAS受体特异性抑制剂A779,实验结果显示,A779抑制TO90对ACE2/Ang-(1-7)/MAS受体轴的作用后,TO90的抗炎作用被抑制,该结果进一步说明了TO90与ACE2/Ang-(1-7)/MAS受体轴在炎症反应中的关系。
当炎症反应发生时,细胞内许多信号通路都被激活,从而产生大量的炎症因子。其中核因子κB(nuclear factor kappa-B,NF-κB)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路是相当重要的两个信号通路。既往研究已证实NF-κB和MAPK通路过度激活与Ang Ⅱ诱导RPE细胞产生的炎症反应密切相关[16]。通过ACE2/Ang-(1-7)/MAS保护性轴抑制NF-κB和MAPK通路的磷酸化,可在Aβ和脂多糖(lipopolysaccharide, LPS)诱导的眼部炎性疾病中发挥保护作用[9, 21]。而TO90也可抑制NF-κB和MAPK通路磷酸化从而减轻氧化刺激、凋亡、免疫反应或衰老诱导产生的炎症反应[13-14, 22]。因此,TO90通过ACE2/Ang-(1-7)/MAS受体轴抑制炎症反应的作用可能与抑制NF-κB和MAPK通路的磷酸化相关。此外,在AMD和DR等疾病的研究过程中发现Ang Ⅱ可通过血管紧张素转化酶Ⅰ (angiotensin converting enzyme Ⅰ, ACE)/Ang Ⅱ/AT1R轴发挥促进新生血管生成、炎症以及纤维化等损伤性作用[23-24]。此时通过ACE2/Ang-(1-7)/MAS受体轴可发挥抗炎及抗氧化等保护性作用,从而减轻ACE/Ang Ⅱ/AT1R轴引起的各种不良效应[25-26]。由此可知,TO90抑制Ang Ⅱ诱导细胞产生炎症反应的作用可能也与抑制ACE/Ang Ⅱ/AT1R轴的表达相关。
综上所述,我们的研究证实了LXR激动剂TO90可通过ACE2/Ang-(1-7)/MAS受体轴在Ang Ⅱ诱导ARPE-19细胞产生的炎症反应中发挥保护作用。TO90的多种作用机制使得其在多种疾病包括眼部疾病有广泛的应用前景。但TO90作为LXR激动剂,在此过程中LXR受体发挥作用的具体机制还不明确。因此,今后更加深入的研究LXR受体与RAS两条轴的关系以及具体的作用机制将成为我们的研究方向。
| [1] |
CHEN M, XU H P. Parainflammation, chronic inflammation, and age-related macular degeneration[J]. JLeukoc Biol, 2015, 98(5): 713-725. DOI:10.1189/jlb.3RI0615-239R |
| [2] |
MELETHAD, AGRÓN E, CHAN C C, et al. Serum inflammatory markers in diabetic retinopathy[J]. Invest Ophthalmol Vis Sci, 2005, 46(11): 4295-4301. DOI:10.1167/iovs.04-1057 |
| [3] |
SAKURAI E, ANAND A, AMBATI B K, et al. Macrophage depletion inhibits experimental choroidal neovascularization[J]. Invest Ophthalmol Vis Sci, 2003, 44(8): 3578-3585. DOI:10.1167/iovs.03-0097 |
| [4] |
CASCELLA R, RAGAZZO M, STRAFELLA C, et al. Age-related macular degeneration: insights into inflammatory genes[J]. JOphthalmol, 2014, 2014: 1-9. DOI:10.1155/2014/582842 |
| [5] |
CHAPPELL M C. Nonclassical renin-angiotensin system and renal function[J]. Compr Physiol, 2012, 2(4): 2733-2752. DOI:10.1002/cphy.c120002 |
| [6] |
LEUNG P S. The peptide hormone angiotensin Ⅱ: its new functions in tissues and organs[J]. Curr Protein Pept Sci, 2004, 5(4): 267-273. DOI:10.2174/1389203043379693 |
| [7] |
XU P, SRIRAMULA S, LAZARTIGUES E. ACE2/ANG-(1-7)/Mas pathway in the brain: the axis of good[J]. AmJPhysiol Regul Integr Comp Physiol, 2011, 300(4): R804-R817. DOI:10.1152/ajpregu.00222.2010 |
| [8] |
QIU Y G, TAO L F, ZHENG S J, et al. AAV8-mediated angiotensin-converting enzyme 2 gene delivery prevents experimental autoimmune uveitis by regulating MAPK, NF-κB and STAT3 pathways[J]. Sci Rep, 2016, 6: 31912. DOI:10.1038/srep31912 |
| [9] |
FU X Y, LIN R, QIU Y G, et al. Overexpression of angiotensin-converting enzyme 2 ameliorates amyloid β-induced inflammatory response in human primary retinal pigment epithelium[J]. Invest Ophthalmol Vis Sci, 2017, 58(7): 3018-3028. DOI:10.1167/iovs.17-21546 |
| [10] |
CALKIN A C, TONTONOZ P. Liverxreceptor signaling pathways and atherosclerosis[J]. Arterioscler Thromb Vasc Biol, 2010, 30(8): 1513-1518. DOI:10.1161/ATVBAHA.109.191197 |
| [11] |
GUIDEZ F, IVINS S, ZHU J, et al. Reduced retinoic acid-sensitivities of nuclear receptor corepressor binding to PML- and PLZF-RARalpha underlie molecular pathogenesis and treatment of acute promyelocytic leukemia[J]. Blood, 1998, 91(8): 2634-2642. DOI:10.1182/blood.V91.8.2634.2634_2634_2642 |
| [12] |
IMAYAMA I, ICHIKI T, PATTON D, et al. LiverXreceptor activator downregulates angiotensin Ⅱ type 1 receptor expression through dephosphorylation of Sp1[J]. Hypertension, 2008, 51(6): 1631-1636. DOI:10.1161/HYPERTENSIONAHA.107.106963 |
| [13] |
YANG H X, ZHENG S J, QIU Y G, et al. Activation of liverXreceptor alleviates ocular inflammation in experimental autoimmune uveitis[J]. Invest Ophthalmol Vis Sci, 2014, 55(4): 2795-2804. DOI:10.1167/iovs.13-13323 |
| [14] |
ZHENG S J, YANG H X, CHEN Z H, et al. Activation of liverXreceptor protects inner retinal damage induced by N-methyl-D-aspartate[J]. Invest Ophthalmol Vis Sci, 2015, 56(2): 1168-1180. DOI:10.1167/iovs.14-15612 |
| [15] |
HAZRA S, RASHEED A, BHATWADEKAR A, et al. LiverXreceptor modulates diabetic retinopathy outcome inamouse model of streptozotocin-induced diabetes[J]. Diabetes, 2012, 61(12): 3270-3279. DOI:10.2337/db11-1596 |
| [16] |
QIU Y G, TAO L F, LEI C Y, et al. Downregulating p22phox ameliorates inflammatory response in Angiotensin Ⅱ-induced oxidative stress by regulating MAPK and NF-κB pathways in ARPE-19 cells[J]. Sci Rep, 2015, 5: 14362. DOI:10.1038/srep14362 |
| [17] |
DAI B L, LEI C Y, LIN R, et al. Activation of liverXreceptor α protects amyloid β1-40 induced inflammatory and senescent responses in human retinal pigment epithelial cells[J]. et al, 2017, 66(6): 523-534. DOI:10.1007/s00011-017-1036-4 |
| [18] |
SUZUKI Y, RUIZ-ORTEGA M, LORENZO O, et al. Inflammation and angiotensin Ⅱ[J]. IntJBiochem Cell Biol, 2003, 35(6): 881-900. DOI:10.1016/s1357-2725(02)00271-6 |
| [19] |
NAGAI N, OIKE Y, IZUMI-NAGAI K, et al. Angiotensin Ⅱ type 1 receptor-mediated inflammation is required for choroidal neovascularization[J]. Arterioscler Thromb Vasc Biol, 2006, 26(10): 2252-2259. DOI:10.1161/01.ATV.0000240050.15321.fe |
| [20] |
KIM J H, KIM J H, YU Y S, et al. Blockade of angiotensin Ⅱ attenuates VEGF-mediated blood-retinal barrier breakdown in diabetic retinopathy[J]. JCereb Blood Flow Metab, 2009, 29(3): 621-628. DOI:10.1038/jcbfm.2008.154 |
| [21] |
TAO L F, QIU Y G, FU X Y, et al. Angiotensin-converting enzyme 2 activator diminazene aceturate prevents lipopolysaccharide-induced inflammation by inhibiting MAPK and NF-κB pathways in human retinal pigment epithelium[J]. JNeuroinflammation, 2016, 13: 35. DOI:10.1186/s12974-016-0489-7 |
| [22] |
LEI P, BAYSA A, NEBB H I, et al. Activation of LiverXreceptors in the heart leads to accumulation of intracellular lipids and attenuation of ischemia-reperfusion injury[J]. Basic Res Cardiol, 2013, 108(1): 323. DOI:10.1007/s00395-012-0323-z |
| [23] |
KURIHARA T, OZAWA Y, ISHIDA S, et al. Renin-Angiotensin system hyperactivation can induce inflammation and retinal neural dysfunction[J]. IntJInflam, 2012, 2012: 581695. DOI:10.1155/2012/581695 |
| [24] |
STRAIN W D, CHATURVEDI N. The renin-angiotensin-aldosterone system and the eye in diabetes[J]. JRenin Angiotensin Aldosterone Syst, 2002, 3(4): 243-246. DOI:10.3317/jraas.2002.045 |
| [25] |
PASSOS-SILVA D G, VERANO-BRAGA T, SANTOS R A. Angiotensin-(1-7): beyond the cardio-renal actions[J]. Clin Sci, 2013, 124(7): 443-456. DOI:10.1042/CS20120461 |
| [26] |
SIMÕE S ESILVA A C, SILVEIRA K D, FERREIRA A J, et al. ACE2, angiotensin-(1-7) and Mas receptor axis in inflammation and fibrosis[J]. BrJPharmacol, 2013, 169(3): 477-492. DOI:10.1111/bph.12159 |



