2. 100084 北京,北京体育大学运动生理学教研室;
3. 210033 南京,江苏省体育科学研究所竞技体育与科研服务二中心
2. Department of Exercise Physiology, Beijing Sport University, Beijing, 100084;
3. Second Center of Competitive Sports Science Research, Jiangsu Provincial Research Institute of Sports Science, Nanjing, Jiangsu Province, 210033, China
近年来炎症学说在胰岛素抵抗发病机制中的作用备受关注[1, 2],巨噬细胞是慢性炎症中重要的炎症细胞,且在不同微环境下可极化为功能迥异的促炎型M1型或抗炎型M2型[3, 4]。骨骼肌萎缩加快胰岛素抵抗的发生发展[5, 6],因此研究巨噬细胞与骨骼肌细胞肌生成间的相互作用及机制对于探讨胰岛素抵抗发生发展的病理机制具有重要意义。
单独培养的巨噬细胞和骨骼肌细胞无法在体外研究二者间相互作用,共培养体系能更好地模拟动物体内的生理环境[7],因而受到研究学者们的广泛关注。但是,要探明巨噬细胞与骨骼肌细胞肌生成间的相互作用,需在骨骼肌细胞诱导分化过程中进行共培养,目前尚未见建立稳定的巨噬细胞与诱导分化的骨骼肌细胞共培养体系的研究报道。
本研究以小鼠单核巨噬细胞株RAW264.7细胞和小鼠骨骼肌成肌细胞株C2C12细胞为研究对象,在诱导C2C12分化同时建立Transwell共培养体系,检测该共培养体系下RAW264. 7和C2C12间的相互作用,为进一步研究胰岛素抵抗发生发展中巨噬细胞与骨骼肌重塑间的相互关系提供实验基础。
1 材料与方法 1.1 材料与试剂RAW264.7小鼠巨噬细胞购自中国科学院细胞库,C2C12小鼠成肌细胞购自中国北京协和细胞库。DMEM培养基、fetal bovine serum (FBS)、Horse Serum (HS)、青霉素和链霉素购自Gibco公司;CCK-8购自APExBIO公司;Myf5抗体、MyoD抗体、myogenin抗体、iNOS抗体、Arginase-1抗体购自Abcam公司;β-actin抗体、山羊抗兔和山羊抗小鼠二抗购自北京中山金桥公司;IL-1β和IL-10 ELISA试剂盒购自Andygene公司;6孔和24孔细胞培养板、0.4 μm 6孔和24孔Transwell小室购自Corning公司。
1.2 RAW264. 7和C2C12细胞培养RAW264. 7细胞和C2C12细胞采用细胞生长液(DMEM培养基、100 mL/L FBS、100 IU/mL青霉素、100 μg/mL链霉素),在37℃、50 mL/L CO2孵育箱中培养。依细胞生长状态,1-2 d传代1次。待细胞增殖传代到足够细胞量后统一冻存,选取同一代细胞作为实验对象。
1.3 Transwell共培养与分组本研究主要使用膜孔径0.4 μm的Transwell小室完成细胞共培养体系的建立,实验分为对照组和共培养组。
检测小鼠巨噬细胞对骨骼肌细胞的影响时,共培养组C2C12接种于6孔或24孔Transwell小室下培养室,RAW264.7接种于6孔或24孔Transwell小室上培养室,待接种24 h细胞贴壁后将上培养室移回种有C2C12细胞的Transwell培养板进行共培养,对照组上室不接种RAW264.7细胞。检测小鼠骨骼肌细胞对巨噬细胞的影响时,将RAW264.7接种于Transwell小室下培养室,C2C12接种于上培养室,其余处理方法同上。
细胞贴壁开始共培养时将生长液更换为分化液(DMEM培养基、2%HS、100 IU/mL青霉素、100 μg/mL链霉素),诱导C2C12分化,隔24 h更换分化液。每天在相差显微镜下观察多核肌管形成并采集图像,共培养第5天的C2C12图像导入Image J计算肌管面积和肌管数量。共培养1、3、5 d后收集下培养室细胞和培养上清液进行下一步实验。
1.4 CCK-8法检测细胞活性和细胞增殖情况按1.3中分组和时间点处理细胞后收集24孔板中细胞进行检测。收细胞时每孔加入10 μL CCK-8,混匀,于孵育箱中继续培养2 h后在酶标仪中检测各孔450 nm处的吸光度值[OD(450)]。根据下列公式计算细胞活性和平均增殖率:细胞活性(增殖率)%=[OD(450)实验处理孔-OD(450)空白孔]/[OD(450)对照孔-OD(450)空白孔]×100%,每个样本重复3次,检测共培养体系下骨骼肌细胞活性和巨噬细胞增殖情况。
1.5 Western blot法检测Myf5、MyoD、myogenin、iNOS和Arg-1蛋白表达细胞处理1、3、5天后收集细胞,刮下细胞吸入2 mL EP管,提取蛋白。Western Blot中蛋白上样量为30 μg,经100 V电压电泳和60 V电压电转后取出NC膜,立春红预染剪下对应条带,检测Myf5、MyoD、myogenin、iNOS和Arg-1蛋白以50 g/L BSA封闭2 h,检测β-actin以50 g/L BSA封闭过夜。采用含50 g/L BSA的TBST配制一抗,分别加兔抗Myf5抗体(1:2 000)、鼠抗MyoD抗体(1:1 000)、鼠抗myogenin抗体(1:2 000)、兔抗iNOS抗体(1:1 000)和鼠抗Arg-1抗体(1:1 000),4 ℃孵育过夜;鼠抗β-actin抗体(1:5 000),孵育2 h;洗涤后,加HRP标记的山羊抗兔二抗(1:500)或HRP标记的山羊抗小鼠二抗(1:3 000),孵育2 h。X射线曝光胶片显影。
显影后的胶片扫描导入Image-Pro Plus 6.0进行灰度分析。
1.6 ELISA检测RAW264. 7细胞培养上清液IL-1β、IL-10的水平按1.3中分组和时间点收集细胞时收集各组细胞培养上清液,采用ELISA试剂盒检测上清液中IL-1β和IL-10含量,严格按照试剂盒说明书进行规范操作,在酶标仪中检测吸光度值,制作标准曲线并进行实验分析,实验重复3次,每个样本设3个复孔,取3次实验的均值作为实验结果进行统计学分析。
1.7 统计学分析实验结果均以x±s表示,运用SPSS 16.0进行数据统计分析,采用Levene检验进行方差齐性检验,单因素方差分析(one-way ANOVA)方法处理数据。
2 结果 2.1 共培养不同时长对C2C12形态的影响在倒置相差显微镜下观察诱导分化中与RAW264.7共培养对C2C12形态的影响(图 1)。对照组诱导分化第3天出现汇聚融合现象,仅有少量细小肌管形成,第5天肌管数量增加、面积变大(图 1中红色箭头标示处)。共培养组诱导分化第3天即有较多肌管形成,第5天肌管面积为(8733.24±987.89)μm2,显著高于同时间点对照组(P<0.01),肌管数量相较于同时间点对照组也有增加。以上结果从形态学上显示,分化过程中与RAW264.7共培养明显加快C2C12成肌分化进程,促进多核肌管的形成。

|
| 图 1 倒置相差显微镜观察与RAW264.7细胞共培养不同时长对C2C12细胞形态的影响 |
2.2 共培养不同时长对C2C12活性和增殖的影响
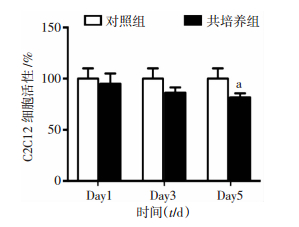
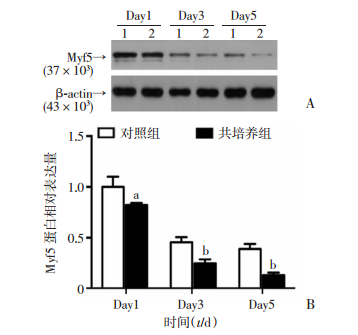
CCK-8法检测结果显示,与同时间点对照组相比,共培养5dC2C12活性出现下降(P<0.05,图 2)。Western blot检测结果显示,随诱导分化时间延长,对照组与共培养组细胞增殖标志蛋白Myf5表达均呈下降趋势且共培养组下降更为明显。与同时间点对照组相比,共培养1 d即抑制Myf5蛋白表达(P<0.05),共培养3 d和5 d显著抑制Myf5蛋白表达(P<0.01,图 3)。以上结果说明,与RAW264.7共培养明显抑制C2C12细胞增殖,且存在时间依赖性,随共培养时间延长抑制作用更加明显。
|
| a:P<0.05, 与对照组比较 图 2 CCK-8法检测与RAW264.7细胞共培养不同时长对C2C12细胞活性的影响 |
|
| A:Western blot检测Myf5蛋白表达;B:Myf5表达半定量分析;1:对照组;2:共培养组;a:P<0.05, b:P<0.01,与对照组比较 图 3 Western blot检测与RAW264.7细胞共培养不同时长对C2C12细胞增殖标志蛋白Myf5表达的影响 |
2.3 共培养不同时长对C2C12成肌分化标志蛋白MyoD和myogenin表达的影响
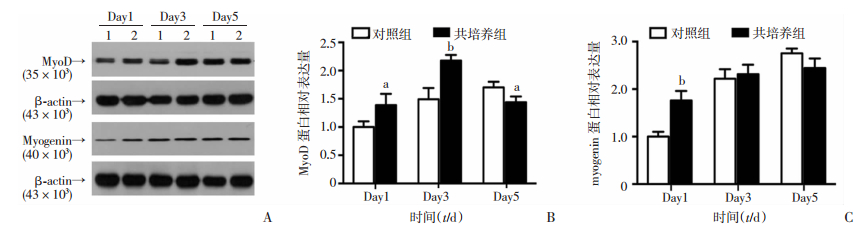
Western blot检测结果显示,随诱导分化时间延长,对照组与共培养组细胞成肌分化标志蛋白MyoD和myogenin表达均呈上升趋势且共培养组上升更为明显(图 4)。与同时间点对照组相比,共培养1 d即显著增加MyoD(P<0.05)和myogenin(P<0.01)蛋白表达,共培养3 d显著增加MyoD蛋白表达(P<0.05),共培养5 d,MyoD蛋白表达下降(P<0.05)。以上蛋白检测结果说明,与RAW264.7共培养明显促进C2C12细胞成肌分化,结合2.1、2.2中结果,进一步说明与RAW264.7共培养明显加快C2C12成肌分化进程。
|
| A:Western blot检测MyoD和myogenin蛋白表达;B:MyoD表达半定量分析;C: myogenin表达半定量分析;1:对照组;2:共培养组 a:P<0.05, b:P<0.01,与对照组比较 图 4 Western blot检测与RAW264.7细胞共培养不同时长对C2C12细胞分化标志蛋白MyoD和myogenin表达的影响 |
2.4 共培养不同时长对RAW264.7形态的影响
在倒置相差显微镜下观察与C2C12共培养对RAW264.7形态的影响(图 5)。对照组细胞大小一致,呈圆形,可见少量伪足,随培养时间延长,细胞增殖明显,培养至第5天出现细胞簇集现象。共培养组细胞在形态上相较于同时间点对照组未见明显差异,但培养至第5天时,细胞簇集现象较同时间点对照组更加明显。以上结果从形态学上显示,与C2C12细胞共培养时对RAW264.7形态无明显影响,共培养后期进一步促进RAW264.7细胞增殖。

|
| 图 5 倒置相差显微镜观察与C2C12细胞共培养不同时长对RAW264.7细胞形态的影响 |
2.5 共培养不同时长对RAW264.7细胞增殖的影响
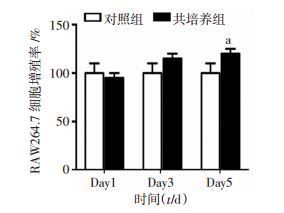
CCK-8法检测结果显示,与同时间点对照组相比,共培养5天明显促进RAW264.7细胞增殖(P<0.05,图 6)。结合2.4中形态学结果,进一步说明与C2C12细胞共培养明显促进RAW264.7细胞增殖,且存在时间依赖性。
|
| a:P<0.05, 与对照组比较 图 6 CCK-8法检测与C2C12细胞共培养不同时长对RAW264.7细胞增殖的影响 |
2.6 共培养不同时长对RAW264.7极化标志蛋白iNOS和Arg-1的影响
Western blot检测结果显示,与同时间点对照组相比,共培养1、3、5 d均显著抑制M1型巨噬细胞标志蛋白iNOS表达(P<0.01),共培养1、3 d均显著增加M2型巨噬细胞标志蛋白Arg-1表达(P<0.01) (图 7)。以上蛋白检测结果说明,与C2C12共培养明显减少RAW264.7 M1型极化,增加RAW264.7 M2型极化。
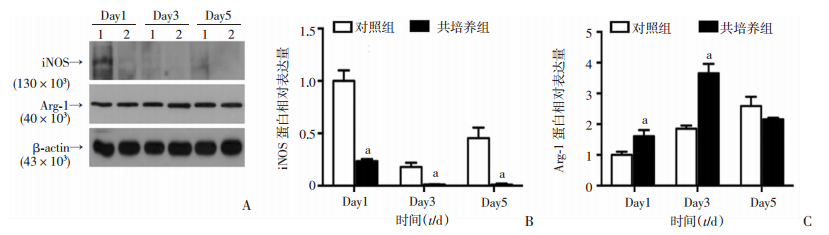
|
| A: Western blot检测iNOS和Arg-1蛋白表达;B: iNOS表达半定量分析;C: Arg-1表达半定量分析;1:对照组;2:共培养组;a:P<0.01, 与对照组比较 图 7 Western blot检测与C2C12细胞共培养不同时长对RAW264.7细胞iNOS和Arg-1蛋白表达的影响 |
2.7 共培养不同时长对RAW264.7细胞分泌IL-1β和IL-10的影响
ELISA检测结果显示,随培养时间延长对照组与共培养组细胞IL-1β分泌量均呈下降趋势且共培养组下降更为明显(图 8A),IL-10分泌量均呈上升趋势且共培养组上升更为明显(图 8B)。与同时间点对照组相比,共培养1 d即明显抑制RAW264.7细胞IL-1β分泌量(P<0.05),共培养3 d和5 d对IL-1β分泌量的抑制作用进一步明显(P<0.01);共培养3 d和5 d还明显增加细胞IL-10分泌量(P<0.05)。以上结果说明与C2C12共培养明显减少RAW264.7细胞促炎因子的分泌并增加RAW264.7细胞抗炎因子的分泌。
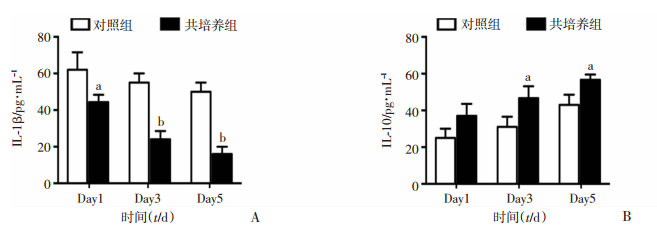
|
| A: RAW264.7细胞IL-1β分泌量;B: RAW264.7细胞IL-10分泌量;1:对照组;2:共培养组;a:P<0.05, b:P<0.01,与对照组比较 图 8 ELISA检测与C2C12细胞共培养不同时长对RAW264.7细胞IL-1β和IL-10分泌的影响 |
3 讨论
胰岛素抵抗是慢性炎症性疾病[8],巨噬细胞是重要的炎症细胞,调节机体炎症水平[9-10],骨骼肌萎缩加快胰岛素抵抗的发生发展[11],因此研究巨噬细胞与骨骼肌细胞肌生成间的相互作用对于探讨胰岛素抵抗发生发展的病理机制具有重要意义。骨骼肌肌生成过程中成肌细胞融合成多核肌管,最终分化为成熟骨骼肌细胞[12],因此成肌分化在骨骼肌质量维持和重塑的中发挥关键作用,这对于提高机体胰岛素敏感性尤为重要,反之则加快胰岛素抵抗发展进程[13-14]。本研究在诱导骨骼肌成肌细胞C2C12成肌分化的同时建立巨噬细胞RAW264.7和C2C12共培养体系,研究巨噬细胞与骨骼肌肌生成间的相互作用,旨在为进一步研究胰岛素抵抗发生发展中巨噬细胞与骨骼肌重塑间的相互关系提供实验基础。
Myf5、MyoD和myogenin同属于生肌调节因子家族,是成肌细胞增殖分化的关键调控因子。Myf5是生肌调节因子家族中最早表达的蛋白,可以看作是激活状态成肌细胞增殖的标志蛋白,进入分化期后,MyoD和myogenin大量表达,可以看作是激活状态成肌细胞分化的标志蛋白[15-17]。为探讨与RAW264.7共培养不同时长对C2C12增殖分化的影响,本研究观察共培养过程中C2C12的形态变化并对共培养不同时长肌管数量和面积、细胞增殖、增殖分化标志蛋白Myf5、MyoD和myogenin表达进行检测。形态学结果显示,与RAW264.7共培养明显加快C2C12成肌分化进程,促进多核肌管的形成;CCK-8和细胞增殖标志蛋白Myf5蛋白检测结果显示共培养明显抑制C2C12细胞增殖,且存在时间依赖性,随共培养时间延长抑制作用更加明显;成肌分化标志蛋白MyoD和myogenin蛋白检测结果显示共培养明显促进C2C12细胞成肌分化,以上结果共同说明与巨噬细胞RAW264.7共培养在抑制成肌细胞增殖的同时明显促进成肌分化,加快分化进程,进而促进多核肌管的形成,促进骨骼肌重塑。
诱导性一氧化氮合酶(Inducible nitric oxide synthase,iNOS)是M1型巨噬细胞的标记蛋白,精氨酸酶1(Arginase-1,Arg-1)是M2型巨噬细胞的标记蛋白[18]。在巨噬细胞中IL-1β为促炎因子主要由M1型巨噬细胞表达和分泌,增强炎症反应[19];IL-10为抗炎因子主要由M2型巨噬细胞分泌,抑制炎症反应[20]。有研究发现在高糖环境和LPS刺激下,巨噬细胞M1型标记蛋白iNOS表达且IL-1β水平明显升高,M2型标记物Arg-1、IL-10则明显降低,呈明显的促炎表型[21]。因此为探讨与C2C12共培养不同时长对RAW264.7极化的影响,本研究观察共培养过程中RAW264.7的形态变化并对共培养不同时长RAW264.7增殖情况、极化标志蛋白iNOS、Arg-1以及炎症因子IL-1β、IL-10分泌情况进行检测。形态学和CCK-8结果共同显示共培养对RAW264.7形态无明显影响,且在共培养后期明显促进细胞增殖。iNOS、Arg-1蛋白和IL-1β、IL-10分泌量检测结果显示共培养明显减少RAW264.7 M1型标记蛋白表达及促炎因子分泌,促进M2型标记蛋白表达及抗炎因子分泌。以上结果共同说明与C2C12共培养在促进RAW264.7增殖的同时明显减少RAW264.7 M1型极化,增加其M2型极化。
已有研究证明M1型巨噬细胞分泌TNF-α、IL-1和IL-6等炎症因子,增强炎症反应,引发骨骼肌蛋白降解。M2型巨噬细胞分泌IL-10等抗炎因子,抑制失控的组织损伤和炎症反应,促进组织重塑[22]。结合本研究所建立共培养体系一方面明显促进成肌分化,加快分化进程,促进骨骼肌重塑,另一方面促进RAW264.7增殖和M2型极化,提示该共培养体系中骨骼肌细胞成肌分化与巨噬细胞M2型极化可能存在相互促进的良性作用,最终降低机体炎症水平并促进骨骼肌再生和重塑。
综合以上,小鼠骨骼肌成肌细胞C2C12和小鼠巨噬细胞RAW264.7可在Transwell小室内以分化液作为培养基建立共培养体系,该共培养体系中C2C12细胞和RAW264.7细胞存在相互作用,一方面促进成肌分化并加快分化进程,另一方面促进RAW264.7增殖和M2型极化。
| [1] |
ZHAO L, ZOU T D, GOMEZ N A, et al. Raspberry alleviates obesity-induced inflammation and insulin resistance in skeletal muscle through activation of AMP-activated protein kinase (AMPK) α1[J]. Nutr Diabetes, 2018, 8(1): 39. DOI:10.1038/s41387-018-0049-6 |
| [2] |
JIAO N, BAKER S S, NUGENT C A, et al. Gut microbiome May contribute to insulin resistance and systemic inflammation in obese rodents: a meta-analysis[J]. Physiol Genomics, 2018, 50(4): 244-254. DOI:10.1152/physiolgenomics.00114.2017 |
| [3] |
LIN Y W, LEE B, LIU P S, et al. Receptor-interacting protein 140 orchestrates the dynamics of macrophage M1/M2 polarization[J]. J Innate Immun, 2016, 8(1): 97-107. DOI:10.1159/000433539 |
| [4] |
PONZONI M, PASTORINO F, DI PAOLO D, et al. Targeting macrophages as a potential therapeutic intervention: impact on inflammatory diseases and cancer[J]. Int J Mol Sci, 2018, 19(7): E1953. DOI:10.3390/ijms19071953 |
| [5] |
ORLANDO G, BALDUCCI S, BAZZUCCHI I, et al. Neuromuscular dysfunction in type 2 diabetes: underlying mechanisms and effect of resistance training[J]. Diabetes Metab Res Rev, 2016, 32(1): 40-50. DOI:10.1002/dmrr.2658 |
| [6] |
ORLANDO G, BALDUCCI S, BAZZUCCHI I, et al. Muscle fatigability in type 2 diabetes[J]. Diabetes Metab Res Rev, 2017, 33(1): 44-52. DOI:10.1002/dmrr.2821 |
| [7] |
ZHAO D W, LIU L J, CHEN Q, et al. Hypoxia with Wharton's jelly mesenchymal stem cell coculture maintains stemness of umbilical cord blood-derived CD34+ cells[J]. Stem Cell Res Ther, 2018, 9(1): 158. DOI:10.1186/s13287-018-0902-5 |
| [8] |
ATHYROS V G, TZIOMALOS K, KARAGIANNIS A, et al. Should adipokines be considered in the choice of the treatment of obesity-related health problems?[J]. Curr Drug Targets, 2010, 11(1): 122-135. DOI:10.2174/138945010790030992 |
| [9] |
HARWANI S C. Macrophages under pressure: the role of macrophage polarization in hypertension[J]. Transl Res, 2018, 191: 45-63. DOI:10.1016/j.trsl.2017.10.011 |
| [10] |
DASKALAKI M G, TSATSANIS C, KAMPRANIS S C. Histone methylation and acetylation in macrophages as a mechanism for regulation of inflammatory responses[J]. J Cell Physiol, 2018, 233(9): 6495-6507. DOI:10.1002/jcp.26497 |
| [11] |
罗维, 张鹏, 李文炯, 等. 红益胶囊对猕猴28天头低位卧床肌萎缩的保护作用[J]. 航天医学与医学工程, 2013, 26(6): 455-458. LUO W, ZHANG P, LI W J, et al. Hongyi capsules protect rhesus monkey muscle against atrophy induced by 28 d head-down bed rest[J]. Space Med Med Eng, 2013, 26(6): 455-458. DOI:10.16289/j.cnki.1002-0837.2013.06.004 |
| [12] |
TESTA S, D'ADDABBO P, FORNETTI E, et al. Myoblast myogenic differentiation but not fusion process is inhibited via MyoD tetraplex interaction[J]. Oxid Med Cell Longev, 2018, 2018: 7640272. DOI:10.1155/2018/7640272 |
| [13] |
王继, 周越. 2型糖尿病与肌萎缩研究进展[J]. 中国运动医学杂志, 2017, 36(7): 645-650. WANG J, ZHOU Y. Research progress of type 2 diabetes mellitus and muscular atrophy[J]. Chin J Spo Med, 2017, 36(07): 645-650. DOI:10.3969/j.issn.1000-6710.2017.07.014 |
| [14] |
GAL-LEVI R, LESHEM Y, AOKI S, et al. Hepatocyte growth factor plays a dual role in regulating skeletal muscle satellite cell proliferation and differentiation[J]. Biochim Biophys Acta, 1998, 1402(1): 39-51. DOI:10.1016/s0167-4889(97)00124-9 |
| [15] |
ASFOUR H A, ALLOUH M Z, SAID R S. Myogenic regulatory factors: The orchestrators of myogenesis after 30 years of discovery[J]. Exp Biol Med (Maywood), 2018, 243(2): 118-128. DOI:10.1177/1535370217749494 |
| [16] |
ZHANG P, LI W J, WANG L, et al. Salidroside inhibits myogenesis by modulating p-Smad3-induced Myf5 transcription[J]. Front Pharmacol, 2018, 9: 209. DOI:10.3389/fphar.2018.00209 |
| [17] |
罗维, 张鹏, 艾磊, 等. 不同浓度红景天苷对成肌细胞体外分化的影响及机制初探[J]. 体育科学, 2015, 35(9): 50-57. LUO W, ZHANG P, AI L, et al. Effect of different concentrations of salidroside on myoblast differentiation in vitro and its preliminary mechanism[J]. Chin Spo Sci, 2015, 35(9): 50-57. DOI:10.16469/j.css.201508000 |
| [18] |
LISI L, CIOTTI G M, BRAUN D, et al. Expression of iNOS, CD163 and ARG-1 taken as M1 and M2 markers of microglial polarization in human glioblastoma and the surrounding normal parenchyma[J]. Neurosci Lett, 2017, 645: 106-112. DOI:10.1016/j.neulet.2017.02.076 |
| [19] |
廖鸿雁, 刘杰, 刘菁, 等. 白藜芦醇对氧糖剥夺/再复氧损伤后小胶质细胞系N9活化的影响[J]. 解剖学报, 2019, 50(2): 137-144. LIAO H Y, LIU J, LIU J, et al. Effect of resveratrol on activation of microglia cell line N9 after oxygen-glucose deprivation/reoxygenation injury in vitro[J]. Acta Anat Sin, 2019, 50(2): 137-144. |
| [20] |
周娜, 刘伟江, 李苹, 等. 间充质干细胞通过调控巨噬细胞极化减轻1型糖尿病模型小鼠炎症反应[J]. 中国药理学与毒理学杂志, 2018, 32(11): 876-884. ZHOU N, LIU W, JIANG L P, et al. Mesenchymal stem cells alleviate inflammatory response by regulating macrophage polarization in type 1 diabetes mellitus mouse model[J]. Chin J Pharmacol Toxicol, 2018, 32(11): 876-884. DOI:10.3867/j.issn.1000-3002.2018.11.002 |
| [21] |
郜敏, 杨沛瑯, 余天漪, 等. 胰岛素对高糖环境中巨噬细胞表型转换的影响[J]. 上海交通大学学报(医学版), 2017, 37(5): 595-600. GAO M, YANG P L, YU T Y, et al. Effects of insulin on macrophage phenotype transformation under high glucose condition[J]. J Shanghai Jiaotong Univ Med Sci, 2017, 37(5): 595-600. DOI:10.3969/j.issn.1674-8115.2017.05.005 |
| [22] |
COHEN T V, MANY G M, FLEMING B D, et al. Upregulated IL-1β in dysferlin-deficient muscle attenuates regeneration by blunting the response to pro-inflammatory macrophages[J]. Skelet Muscle, 2015, 5: 24. DOI:10.1186/s13395-015-0048-4 |



