乳腺癌为女性最常见的恶性肿瘤。其中三阴性乳腺癌由于其雌激素受体(ER)、孕激素受体(PR)和原癌基因Her-2均为阴性,导致其对大多数内分泌治疗及分子靶向治疗(针对Her-2基因的分子靶向药物)均不敏感。三阴性乳腺癌占全部乳腺癌的15%~20%,具有侵袭性高、易转移复发及预后差等特点[1]。现阶段临床上对三阴性乳腺癌的治疗出现了诸如肿瘤细胞对化疗药物敏感性差、细胞耐药、化疗药物副作用大等问题,严重影响化疗效果。其中,三阴性乳腺癌对多种化疗药物均不敏感这一状况尤为严重,亟须寻找针对三阴性乳腺癌治疗的新靶点,以解决其对化疗药物不敏感的问题。
自噬(autophagy)是指细胞内部损伤的细胞器、异常功能的蛋白和侵入性病原体等被自噬体包裹,并运送至溶酶体内进行降解的过程[2-3]。近年来,随着对自噬研究的深入,发现自噬对肿瘤发生、发展起着重要的调控作用[4]。大量研究表明:自噬在肿瘤细胞逃避化疗药物诱导的细胞凋亡过程中起到了重要作用,是导致肿瘤细胞对化疗药物不敏感、肿瘤细胞耐药的重要原因[5-6]。近期研究结果发现:随着用药时间和剂量的增加,绝大多数传统的化疗药物会引起肿瘤细胞的保护性自噬,例如铂类药物、多柔比星、伊马替尼、达克替尼等,这是引起肿瘤细胞在治疗后期对药物不敏感,并产生耐药现象的重要原因[7-9]。因此,瞄准自噬这个肿瘤细胞自我保护的重要过程来寻找新的药物靶点,是抗肿瘤药物开发的一个重要的方向。
千金藤素(cepharanthine)是从传统中药防己科千金藤属(Stephania japonica)植物——千金藤的根或茎叶中提取的异喹啉类生物碱,是临床上所用的千金藤素片的主要成分,多用于治疗化疗导致的白细胞减少。千金藤素具有调控细胞自噬、抗肿瘤等作用[10-11]。我们的研究发现千金藤素可以抑制三阴性乳腺癌细胞MDA-MB-231自噬过程并且可以增敏多种化疗药物[12-13],尤其是多柔比星的化疗效果。前期预实验中,我们发现千金藤素联合多柔比星可以明显抑制MDA-MB-231细胞增殖并且诱导细胞线粒体损伤和细胞凋亡。本研究旨在研究千金藤素增敏多柔比星抑制三阴性乳腺癌细胞增殖活性的机制,为将千金藤素开发成为乳腺癌治疗药物的增敏剂提供重要的理论基础。
1 材料与方法 1.1 材料与试剂MDA-MB-231和MDA-MB-468细胞购自ATCC;线粒体示踪染料MitoTrackerTM DeepRed FM、DMEM培养基、胰蛋白酶和胎牛血清均购于美国Invitrogen公司;EGFP-LC3质粒来源于Addgene;质粒提取试剂盒Endo-free Plasmid Mini Kit购自美国OMEGA公司;Lipofectamine 3000转染试剂盒购于美国Invitrogen公司;PARP-1抗体(#9532, 1 :1 000稀释)、SQTM1(p62)抗体(#8025, 1 :1 000稀释)、Ubiquitin抗体(#3933, 1 :1 000稀释)购自美国Cell Signaling Technology公司;Anti-LC3B抗体(L7543,1 :5 000稀释)购于美国Sigma公司;GAPDH(sc-47724, 1 :1 000稀释)、Cyto C (sc-13156, 1 :1 000稀释)抗体购自美国Santa Cruz公司;cleavage-Caspase 3(380169,1 :500)购自成都正能有限公司;千金藤素对照品购自成都曼斯特生物科技有限公司;多柔比星购自生工生物有限公司;JC-1试剂盒购自碧云天公司(C2006)。
1.2 方法 1.2.1 细胞培养与分组MDA-MB-231和MDA-MB-468细胞用DMEM完全培养基(10%胎牛血清)于37 ℃、5%二氧化碳,饱和湿度培养箱培养,隔日传代。4种化疗药物单用组药物浓度:顺铂(2、4、6、8、10 μmol/L),多柔比星(0.2、0.4、0.6、0.8、1.0 μmol/L),长春新碱(0.2、0.4、0.6、0.8、1.0 μmol/L),紫杉醇(10、20、30、40、50 μmol/L)。联用组在以上药物浓度处理下联合千金藤素4 μmol/L共同处理。MTT法检测多柔比星和千金藤素的协同系数:固定多柔比星浓度0.5 μmol/L,千金藤素浓度梯度2、4、6、8、10 μmol/L;固定千金藤素浓度4 μmol/L,多柔比星浓度梯度0.2、0.4、0.6、0.8、1.0 μmol/L。根据MTT结果,选择千金藤素与多柔比星联用,分为:对照组,千金藤素单用组(4 μmol/L),多柔比星单用组(0.5 μmol/L),联合用药组(千金藤素4 μmol/L,多柔比星0.5 μmol/L)。
1.2.2 MTT比色法检测细胞活度处于对数生长期的MDA-MB-231和MDA-MB-468细胞,按每孔5 000个细胞加入90 μL完全培养基置于96孔板培养过夜,加药处理后,继续培养48 h,每孔加20 μL 0.5%的MTT溶液,37 ℃孵育4 h,吸掉孔中的液体,每孔加入150 μL DMSO溶解甲簪,室温振摇10 min,用酶标仪于490 nm处检测光密度值D(490)。细胞活度=[处理组D(490)值-空白孔D(490)值]/[对照组D(490)值-空白孔D(490)值]×100%。
1.2.3 Western blot检测MDA-MB-231和MDA-MB-468细胞加药处理后,提取全细胞蛋白(碧云天P0013蛋白提取试剂盒)、线粒体以及细胞质蛋白(碧云天细胞线粒体分离试剂盒)并测定蛋白浓度(碧云天BCA蛋白浓度测定试剂盒增强型),蛋白液加入Loading buffer,96 ℃,金属浴10 min,保存于-80℃。经聚丙烯酰胺凝胶电泳(SDS-PAGE),电转3~4 h至PVDF膜,5%脱脂奶粉封闭1 h,于4 ℃摇床上孵育抗体过夜,TBST洗涤一抗,加入二抗于室温下孵育2 h,TBST洗涤后显影。
1.2.4 细胞凋亡检测MDA-MB-231和MDA-MB-468细胞计数后分盘于6孔板中(10 000/孔),37 ℃培养24 h,加药培养48 h。去除培养基,Trypsin-EDTA消化细胞,收集于1.5 mL EP管,1 000 r/min 4 ℃离心5 min。2 μL Annexin V-FITC和5 μL PI共同混于100 μL 1×binding buffer,每个EP管加入100 μL混匀的binding buffer,避光染色15 min。加150 μL 1×binding buffer充分重悬细胞,流式细胞仪检测。
1.2.5 JC-1探针检测线粒体膜电位MDA-MB-231细胞1×104/孔铺于24孔板中,药物处理24 h (阳性对照CCCP 10 μmol/L处理6 h),加入500 μL JC-1工作液,染色30 min,置于荧光显微镜下观察,或于全波长酶标仪检测585 nm和488 nm处的荧光强度。
1.2.6 透射电镜检测MDA-MB-231细胞经药物处理48 h后,Trypsin-EDTA消化下细胞,冰PBS洗涤2次,用4 ℃预冷的2.5%戊二醛固定细胞过夜,2%锇酸后固定,系列乙醇-丙酮脱水,环氧树脂包埋,制作切片后在电子显微镜(Hitachi-7500)下观察。
1.2.7 激光共聚焦观察MDA-MB-231细胞1×104个/孔铺于预置有细胞爬片的24孔板内,贴壁24 h后按Lipofectamine 3000说明书进行转染EGFP-LC3荧光质粒,转染24 h后更换新鲜完全DMEM培养基然后加药处理。48 h之后,加入MitoTracker染液染色30 min,干净培养基浸洗3次,每次5 min。弃培养基,固定封片,于共聚焦显微镜下观察。
1.2.8 活性氧检测细胞计数后分盘于6孔板中,37 ℃培养24 h。加药培养12 h。加入活性氧(ROS)探针孵育2 h,收集细胞,用PBS混悬细胞,流式细胞仪检测。
1.3 统计学分析流式检测数据采用FlowJo软件分析,量效关系、协同系数用Calcusyn软件分析,激光共聚焦图片中共定位分析像采用Image J软件中的皮尔森共定位系数分析插件经行统计分析,采用SPSS 19.0统计软件,两样本的组间比较采用t检验。检验水准:α=0.05。
2 结果 2.1 千金藤素增敏多种化疗药物抑制MDA-MB-231和MDA-MB-468细胞增殖效果千金藤素与多柔比星(Doxorubicin)、顺铂(CDDP)、紫杉醇(Paclitaxel)和长春新碱(Vincristine)联合作用于三阴性乳腺癌MDA-MB-231细胞48 h,通过MTT比色法检测细胞活度。结果显示:千金藤素与多种化疗药物联合作用于三阴性乳腺癌MDA-MB-231和MDA-MB-468细胞后均可在一定程度上抑制细胞增殖,且具有统计学差异(P < 0.01),并且随着化疗药物的浓度增加,千金藤素和化疗药物联用抑制细胞增殖的效果增加。在4种化疗药物中,千金藤素联用多柔比星对这两种三阴性乳腺癌细胞系尤其是MDA-MB-231细胞增殖的抑制效果最好(图 1)。
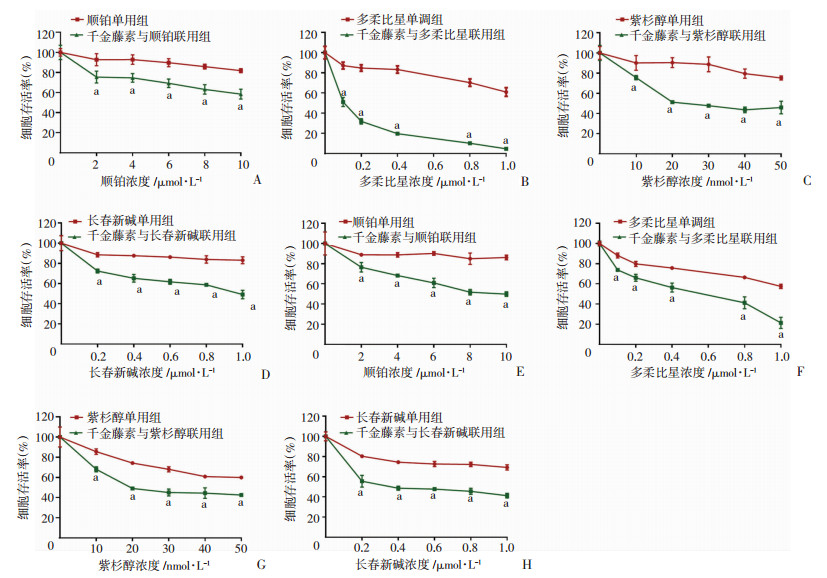
|
| A~D:不同浓度顺铂、多柔比星、紫杉醇、长春新碱单用及与千金藤素联用对MDA-MB-231细胞增殖的影响;E~H:不同浓度顺铂、多柔比星、紫杉醇、长春新碱单用及与千金藤素联用对MDA-MB-468细胞增殖的影响 a:P < 0.01, 与单用化疗药物组比较 图 1 千金藤素增敏多种化疗药物抑制MDA-MB-231和MDA-MB-468细胞增殖效果 |
2.2 千金藤素联合多柔比星对MDA-MB-231和MDA-MB-468细胞增殖有明显抑制作用并呈现协同效果
进一步采用MTT实验检测千金藤素与多柔比星联用对MDA-MB-231和MDA-MB-468细胞增殖抑制的效果。结果显示:单用千金藤素(0~10 μmol/L)或者多柔比星(0~1 μmol/L)对MDA-MB-231细胞增殖均无明显抑制作用,但联合使用后,可以明显抑制MDA-MB-231和MDA-MB-468细胞增殖(P < 0.01),其最佳联用浓度为千金藤素4 μmol/L、多柔比星0.5 μmol/L。通过Calcusyn软件计算得到二者联用的量效关系和协同系数,结果显示:在一定剂量范围内,药物效应与浓度呈正相关,且协同系数小于1,表明两药联合具有协同效果,且对MDA-MB-231细胞增殖抑制的协同效果最好(图 2)。
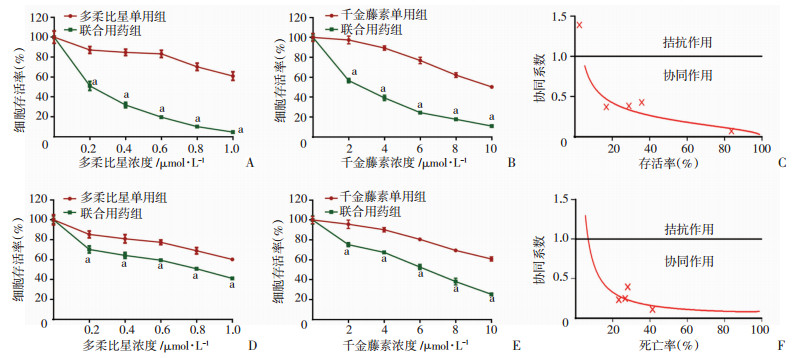
|
| A:不同浓度多柔比星单用及与千金藤素(4 μmol/L)联用对MDA-MB-231细胞的影响;B:不同浓度千金藤素单用及与多柔比星(0.5 μmol/L)联用对MDA-MB-231细胞的影响;C:多柔比星联用千金藤素协同系数(MDA-MB-231细胞);D:不同浓度多柔比星单用及与千金藤素(4 μmol/L)联用对MDA-MB-468细胞的影响;E:不同浓度千金藤素单用及与多柔比星(0.5 μmol/L)联用对MDA-MB-468细胞的影响;F:多柔比星联用千金藤素协同系数(MDA-MB-468细胞) a:P < 0.01, 与单用组比较 图 2 千金藤素增敏多柔比星抑制MDA-MB-231细胞增殖并呈现协同作用 |
2.3 千金藤素联合多柔比星诱导MDA-MB-231和MDA-MB-468细胞凋亡
通过Annexin Ⅴ和PI双染色法观察联合用药对MDA-MB-231和MDA-MB-468细胞凋亡的影响,并对3次独立实验的结果进行分析。结果显示:单用千金藤素(4 μmol/L)和多柔比星(0.5 μmol/L)均不能明显诱导MDA-MB-231和MDA-MB-468细胞凋亡,但是两种药物联用处理后细胞凋亡明显增加,差异具有统计学意义(P < 0.01,图 3A~C)。另外,通过Western blot检测细胞内凋亡相关蛋白的变化,发现两种药物联用可引起PARP-1剪切激活、CF(cleaved-fragment)增加、Caspase 3降解激活以及细胞色素C的释放(图 3D)。另外,使用JC-1探针检测联合用药对线粒体膜电位影响,考虑到MDA-MB-231细胞对联合用药的敏感性更高,重点检测了联合用药对其线粒体膜电位的影响。结果显示:与对照组相比,联合用药组处理的细胞JC-1聚合物在线粒体上聚集明显减少,红色荧光与绿色荧光的比值明显下降,且差异具有统计学意义(P < 0.01,图 4)。以上结果提示千金藤素联合多柔比星可能通过诱导线粒体损伤导致MDA-MB-231细胞发生凋亡。
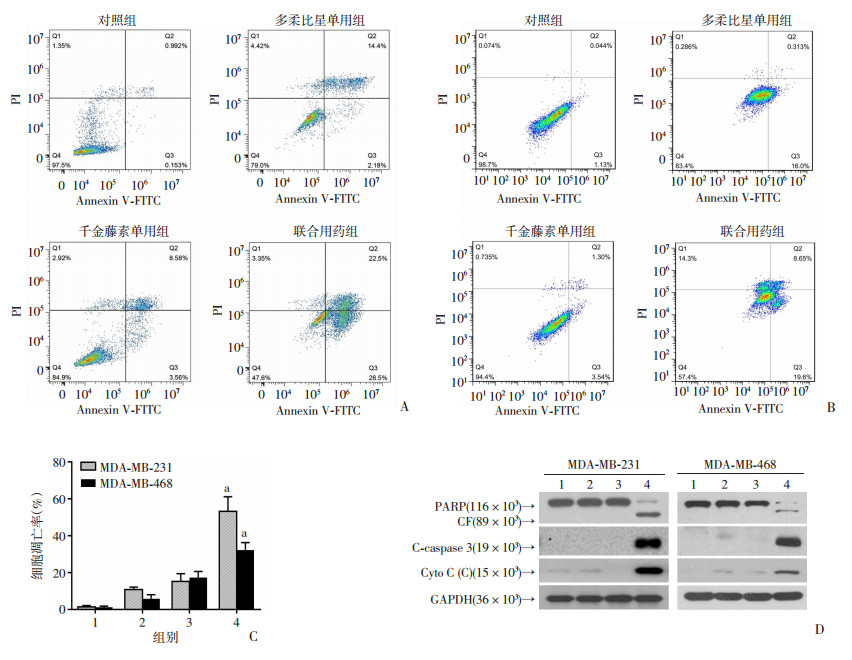
|
| A:流式细胞仪检测单用及联用药物对MDA-MB-231细胞凋亡的影响;B:流式细胞仪检测单用及联用药物对MDA-MB-468细胞凋亡的影响;C:细胞凋亡统计分析 1:对照组;2:千金藤素单用组;3:多柔比星单用组;4:联合用药组;a:P < 0.01,与对照组比较;D:Western blot检测凋亡相关蛋白的表达 1:对照组;2:千金藤素单用组;3:多柔比星单用组;4:联合用药组 图 3 千金藤素联合多柔比星对MDA-MB-231和MDA-MB-468细胞凋亡及凋亡相关蛋白表达的影响 |
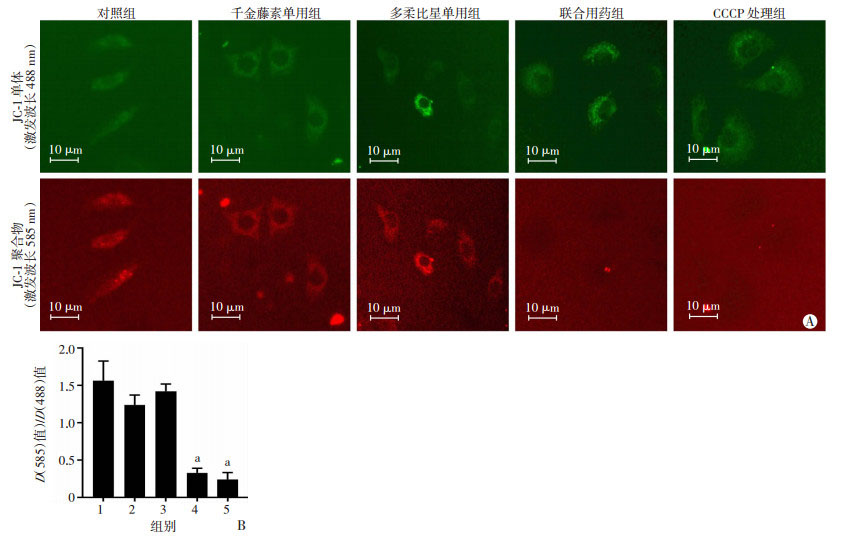
|
| A:荧光显微镜检测JC-1单体和聚合物在线粒体上富集;B:酶标仪检测JC-1探针红色荧光与绿色荧光强度比值 1:对照组;2:千金藤素单用组;3:多柔比星单用组;4:联合用药组;5:CCCP组;a:P <0.01,与对照组比较 图 4 千金藤素联合多柔比星对JC-1单体和聚合物在MDA-MB-231细胞线粒体上的富集的影响 |
2.4 千金藤素联用多柔比星可导致MDA-MB-231细胞线粒体自噬体明显堆积
进一步检测联用处理后MDA-MB-231细胞内线粒体自噬体的变化。分别提取对照组、千金藤素组、多柔比星组、千金藤素和多柔比星组线粒体蛋白,检测SQSTM1 (p62)和LC3蛋白水平,以及全线粒体蛋白泛素化(Ub)水平的变化。结果显示:联用处理后,线粒体SQSTM1 (p62)和LC3表达明显升高,而且线粒体上泛素化蛋白明显聚集(图 5)。采用透射电子显微镜观察MDA-MB-231细胞显微结构的改变,结果显示:联用处理后,细胞内自噬体结构显著增多,线粒体断裂明显,多数受损的线粒体被自噬体包裹,形成线粒体自噬体。还发现细胞核染色质固缩(图 6A)。通过转染EGFP-LC3质粒并且用MitoTracker对细胞内的线粒体进行示踪染色,观察LC3和线粒体的共定位情况,结果显示:联用处理后,自噬体的数量明显增加,自噬体(LC3)和线粒体(Mito)共定位相比于对照组明显增加(P < 0.01),从而进一步证实了线粒体自噬体的增加(图 6B)。单独观察线粒体形态发现:对照组线粒体结构以线状为主,较少发生断裂,线粒体平均长度为4.2 μm,千金藤素处理组的MDA-MB-231细胞线粒体出现少量的线粒体分裂,线粒体平均长度为3.1 μm;多柔比星处理组的线粒体形体与对照组差异不大,线粒体平均长度3.8 μm;但千金藤素与多柔比星联用处理后,线粒体形态发生显著异常,线粒体分裂显著增加,平均长度为0.8 μm,长度明显变短(P < 0.01,图 7)。结果进一步证实:千金藤素与多柔比星联用可明显诱导线粒体损伤,加速线粒体分裂,且可能是由于联用处理后线粒体自噬体大量堆积而不能将受损的线粒体降解导致的。
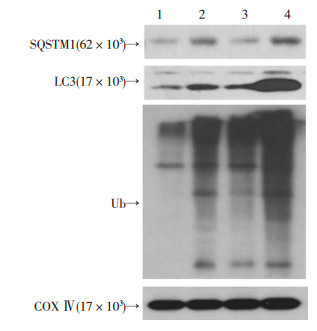
|
| 1:对照组;2:千金藤素单用组;3:多柔比星单用组;4:联合用药组 图 5 Western blot检测MDA-MB-231细胞线粒体部分LC3、SQSTM1、泛素化蛋白表达 |
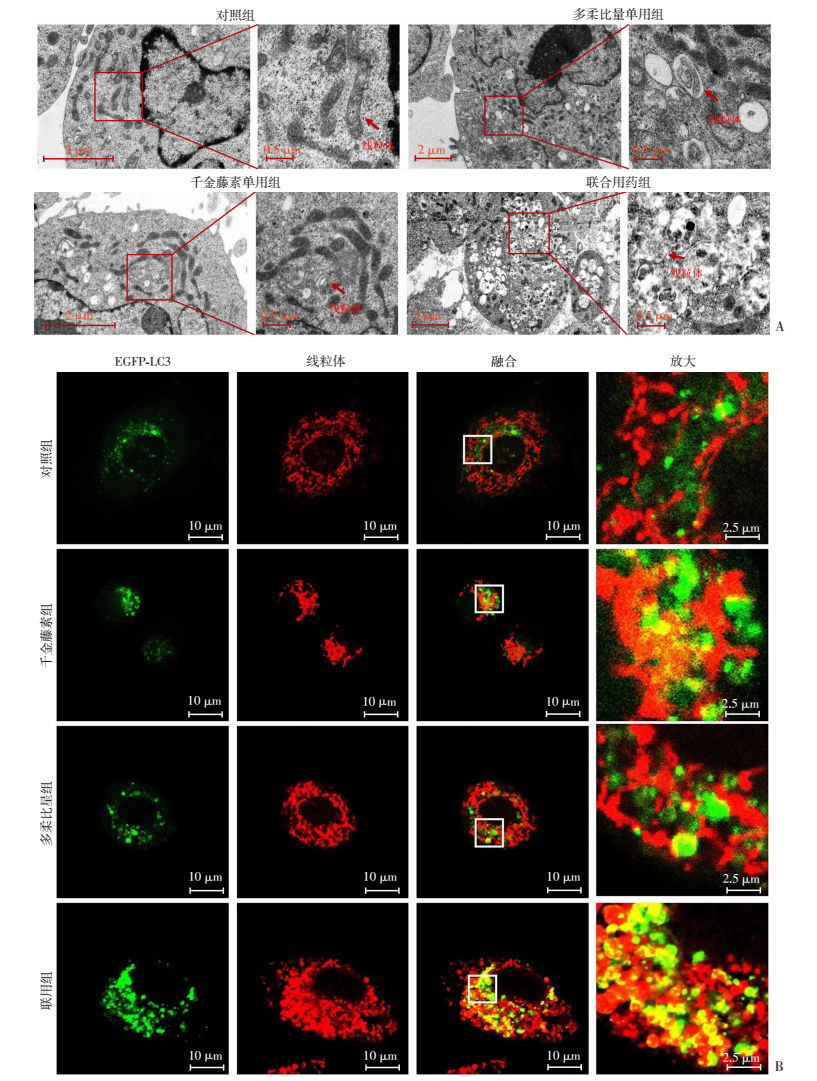
|
| A:透射电镜观察细胞内线粒体自噬体变化;B:激光共聚焦显微镜观察LC3和线粒体共定位及线粒体分裂情况 图 6 千金藤素联用多柔比星导致MDA-MB-231细胞线粒体自噬体明显堆积 |
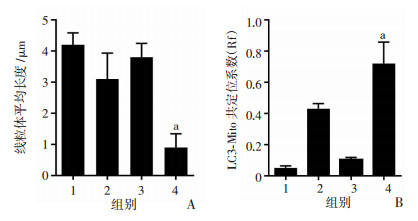
|
| A:线粒体平均长度统计;B:线粒体与LC3共定位系数 1:对照组;2:千金藤单用组;3:多柔比星单用组;4:联合用药用; a:P < 0.01,与对照组比较 图 7 千金藤素联用多柔比星对MDA-MB-231细胞线粒体长度和LC3与线粒体共定位系数的影响 |
2.5 千金藤素联用多柔比星诱导MDA-MB-231细胞内活性氧水平升高
对照组、千金藤素、多柔比星、联用千金藤素和多柔比星分别处理细胞12 h,流式细胞仪检测细胞内活性氧水平。结果显示:千金藤素和多柔比星单独使用处理细胞后,活性氧水平几乎没有明显改变,但是二者联用处理细胞后,细胞内的活性氧明显升高,差异具有统计学意义(P < 0.01,图 8)。结果初步证明:千金藤素和多柔比星联用可以诱导MDA-MB-231细胞内的活性氧水平升高从而导致线粒体分裂,进而诱导细胞凋亡。
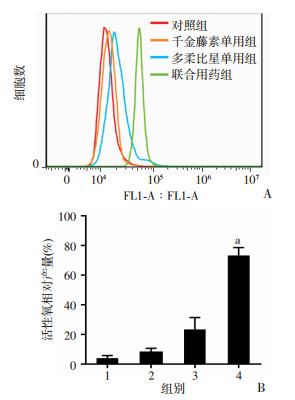
|
| A:流式细胞仪检测活性氧生成量;B:活性氧相对产量统计分析 1:对照组;2:千金藤素单用组;3:多柔比星单用组;4:联合用药组;a:P < 0.01,与对照组比较 图 8 千金藤素联用多柔比星诱导MDA-MB-231细胞内活性氧水平升高 |
3 讨论
现阶段,临床上仍然以传统的化疗作为三阴性乳腺癌的主要治疗手段。但这仍然面临着肿瘤细胞对化疗药物不敏感、细胞耐药和毒副作用大等问题[1]。而细胞自噬在其中扮演了重要角色,是肿瘤细胞逃避各种化疗药物诱导细胞凋亡的重要途径[14]。基于此,临床上也开发了多种自噬抑制剂如氯喹等[15]来增敏化疗药物,解决肿瘤细胞耐药、用药剂量大、毒副作用大等问题。但由于氯喹本身的毒性限制了其在临床上的应用,所以需要寻找更加高效、低毒的自噬抑制剂来解决此问题。
千金藤素由于副作用小,现已应用于临床,用于治疗化疗后白细胞减少症。我们前期的研究结果表明:千金藤素是一种良好的自噬抑制剂,其作用类似氯喹,均为自噬体降解的抑制剂。千金藤素可抑制自噬降解过程中自噬体和溶酶体的融合过程,从而抑制自噬降解[12],并且增敏多柔比星对三阴性乳腺癌细胞MDA-MB-231和MDA-MB-468的化疗效果。进一步的机制研究发现:千金藤素与多柔比星联用可以导致MDA-MB-231和MDA-MB-468细胞线粒体损伤,释放细胞色素C,进而诱导细胞凋亡。
线粒体损伤主要由于药物或者外来刺激导致线粒体结构受损、功能紊乱、线粒体外膜膜通透性增加[16]。受损的线粒体主要通过线粒体自噬降解从而维持细胞内稳态[17]。考虑到千金藤素可以抑制自噬降解过程,我们进一步检测了千金藤素和多柔比星联用对线粒体自噬的影响,发现二者联用会导致大量线粒体自噬体堆积,提示线粒体自噬体被千金藤素阻断,导致受损的线粒体不能被及时清除掉,是导致细胞凋亡的重要原因。
细胞内的活性氧是细胞代谢的产物,但过多的活性氧会引起线粒体损伤。研究报道多柔比星可以诱导肿瘤细胞活性氧产生,但是其可以诱导保护性自噬,清除多余的活性氧[18-19]。本研究发现千金藤素和多柔比星联用可以明显诱导MDA-MB-231细胞活性氧升高,表明千金藤素抑制了多柔比星产生的保护性自噬,从而导致细胞内活性氧升高,引起线粒体损伤。
综上所述,本研究证明千金藤素可以增敏多柔比星对三阴性乳腺癌细胞MDA-MB-231和MDA-MB-468的化疗效果,诱导其细胞凋亡。其可能的机制为千金藤素抑制了多柔比星诱导的保护性自噬,从而导致联用处理后细胞内的ROS升高,线粒体受损。千金藤素也会抑制线粒体自噬,导致受损的线粒体无法被降解,从而导致细胞色素C释放到细胞质内,诱导细胞凋亡。
| [1] |
ANASTASIADI Z, LIANOS G D, IGNATIADOU E, et al. Breast cancer in young women: An overview[J]. Updates Surg, 2017, 69(3): 313-317. DOI:10.1007/s13304-017-0424-1 |
| [2] |
GOLDSMITH J, LEVINE B, DEBNATH J. Autophagy and cancer metabolism[J]. Meth Enzymol, 2014, 542: 25-57. DOI:10.1016/B978-0-12-416618-9.00002-9 |
| [3] |
RABINOWITZ J D, WHITE E. Autophagy and metabolism[J]. Science, 2010, 330(6009): 1344-1348. DOI:10.1126/science.1193497 |
| [4] |
FU Y Y, HUANG Z Y, HONG L, et al. Targeting ATG4 in cancer therapy[J]. Cancers (Basel), 2019, 11(5): E649. DOI:10.3390/cancers11050649 |
| [5] |
LI Y J, LEI Y H, YAO N, et al. Autophagy and multidrug resistance in cancer[J]. Chin J Cancer, 2017, 36(1): 52. DOI:10.1186/s40880-017-0219-2 |
| [6] |
SAMEIYAN E, HAYES A W, KARIMI G. The effect of medicinal plants on multiple drug resistance through autophagy: A review of in vitro studies[J]. Eur J Pharmacol, 2019, 852: 244-253. DOI:10.1016/j.ejphar.2019.04.001 |
| [7] |
CHEN C, LU L, YAN S C, et al. Autophagy and doxorubicin resistance in cancer[J]. Anticancer Drugs, 2018, 29(1): 1-9. DOI:10.1097/CAD.0000000000000572 |
| [8] |
HAN S H, KORM S, HAN Y G, et al. GCA links TRAF6-ULK1-dependent autophagy activation in resistant chronic myeloid leukemia[J]. Autophagy, 2019, 1-15. DOI:10.1080/15548627.2019.1596492 |
| [9] |
WAN B, DAI L, WANG L, et al. Knockdown of BRCA2 enhances cisplatin and cisplatin-induced autophagy in ovarian cancer cells[J]. Endocr Relat Cancer, 2018, 25(1): 69-82. DOI:10.1530/ERC-17-0261 |
| [10] |
LAW B Y, CHAN W K, XU S W, et al. Natural small-molecule enhancers of autophagy induce autophagic cell death in apoptosis-defective cells[J]. Sci Rep, 2014, 4: 5510. DOI:10.1038/srep05510 |
| [11] |
GAO S M, LI X Y, DING X, et al. Cepharanthine induces autophagy, apoptosis and cell cycle arrest in breast cancer cells[J]. Cell Physiol Biochem, 2017, 41(4): 1633-1648. DOI:10.1159/000471234 |
| [12] |
邓琴, 傅若秋, 高宁, 等. 千金藤素对乳腺癌细胞MDA-MB-231自噬降解的影响[J]. 第三军医大学学报, 2017, 39(24): 2352-2358. DENG Q, FU R Q, GAO N, et al. Cepharanthine inhibits autophagic degradation in breast cancer MDA-MB-231 cells[J]. J Third Mil Med Univ, 2017, 39(24): 2352-2358. DOI:10.16016/j.1000-5404.201709083 |
| [13] |
姜秀星, 傅若秋, 高宁, 等. 千金藤素协同多柔比星逆转K562/ADR耐药的分子机制研究[J]. 第三军医大学学报, 2018, 40(23): 2154-2161. JIANG X X, FU R Q, GAO N, et al. Molecular mechanism of cepharanthine synergistically acting with doxorubicin in reversing multidrug resistance of K562/ADR cells[J]. J Third Mil Med Univ, 2018, 40(23): 2154-2161. DOI:10.16016/j.1000-5404.201807166 |
| [14] |
THORBURN A, THAMM D H, GUSTAFSON D L. Autophagy and cancer therapy[J]. Mol Pharmacol, 2014, 85(6): 830-838. DOI:10.1124/mol.114.091850 |
| [15] |
CHUDE C I, AMARAVADI R K. Targeting autophagy in cancer: update on clinical trials and novel inhibitors[J]. Int J Mol Sci, 2017, 18(6): E1279. DOI:10.3390/ijms18061279 |
| [16] |
JAESCHKE H, MCGILL M R, RAMACHANDRAN A. Oxidant stress, mitochondria, and cell death mechanisms in drug-induced liver injury: lessons learned from acetaminophen hepatotoxicity[J]. Drug Metab Rev, 2012, 44(1): 88-106. DOI:10.3109/03602532.2011.602688 |
| [17] |
BERNARDINI J P, LAZAROU M, DEWSON G. Parkin and mitophagy in cancer[J]. Oncogene, 2017, 36(10): 1315-1327. DOI:10.1038/onc.2016.302 |
| [18] |
RUSSELL E G, COTTER T G. New insight into the role of reactive oxygen species (ROS) in cellular signal-transduction processes[J]. Int Rev Cell Mol Biol, 2015, 319: 221-254. DOI:10.1016/bs.ircmb.2015.07.004 |
| [19] |
FONG M Y, JIN S Y, RANE M, et al. Withaferin A synergizes the therapeutic effect of doxorubicin through ROS-mediated autophagy in ovarian cancer[J]. PLoS ONE, 2012, 7(7): e42265. DOI:10.1371/journal.pone.0042265 |



