非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)是一类具有多种亚型、异质性较强的恶性肿瘤[1],其预后与病理类型、疾病分期及治疗方案等多种因素有关。尽管近年来NHL治疗领域取得的进展较多,如单克隆抗体、靶向药物以及肿瘤免疫治疗等新方法的开展,使淋巴瘤患者尤其在复发难治阶段得以有更多的治疗机会[2],但仍难以取得持续稳定的疗效。初诊初治阶段尽可能清除肿瘤负荷,仍然是淋巴瘤患者提高长期生存时间的关键因素,其中,化疗联合自体造血干细胞移植(autologous hematopoietic stem cell transplantation,auto-HSCT)是该阶段的主要治疗手段,对NHL患者总生存时间起着至关重要的作用。
预处理是自体造血干细胞移植重要的环节之一。预处理方案的强度直接影响移植疗效,而其毒性随着其抗肿瘤效力的增强而增加,低强度的预处理方案会因微小残留病灶导致复发的风险高。因此,预处理方案的选择也一直是自体造血干细胞移植的主要研究方向。目前较为经典的预处理方案包括:BEAM(卡莫司汀、依托泊苷、阿糖胞苷及马法兰)、CBV(环磷酰胺、卡莫司汀及依托泊苷)、BuCyE(白消安、环磷酰胺及依托泊苷)和CEAC(洛莫司汀、依托泊苷、阿糖胞苷及环磷酰胺)等,其中CEAC方案在淋巴瘤自体移植中显示出良好的疗效和较低的毒性特征。本研究回顾性分析本院2011-2017年以CEAC预处理方案治疗的102例非霍奇金淋巴瘤患者的资料,旨在评价CEAC预处理方案对非霍奇金淋巴瘤患者行自体造血干细胞移植的疗效和安全性。
1 资料与方法 1.1 病例资料收集本院2011-2017年行自体造血干细胞移植治疗的102例年轻初治经年龄调整的国际预后指数(age-adjusted International Prognostic Index, aaIPI)评分中高危或低危但具有不良预后因素的非霍奇金淋巴瘤患者资料。纳入标准:①经淋巴结活检诊断为非霍奇金淋巴瘤,②符合2008年WHO造血和淋巴组织肿瘤分类标准[3]。排除标准:有严重心、肝、肾脏及精神疾病或认知障碍的患者。
1.2 治疗方案及支持治疗 1.2.1 移植前治疗102例患者移植前有68例为完全缓解(complete response,CR),22例为部分缓解(partial response,PR),12例为疾病进展(progressive disease,PD)。移植前化疗方案包括CHOP、R-CHOP、R-ECHOP等,平均化疗4个周期。
1.2.2 预处理方案所有患者完善移植前相关检查后接受CEAC预处理方案:洛莫司汀(CCNU) 200 mg/m2,qd,-6 d;依托泊苷100 mg/m2,qd,-5~-2 d;阿糖胞苷(Ara-C)100 mg/m2,qd,-5~-2 d;环磷酰胺(CTX)1 500 mg/m2,q12 h,-5~-2 d;-1 d休息。
1.2.3 支持治疗患者移植后均予重组人粒细胞集落刺激因子(rhG-CSF)10 μg/kg直至外周血白细胞≥4.0×109/L。移植前预防感染:予复方磺胺甲噁唑片预防卡氏肺孢子虫感染,阿昔/更昔洛韦预防病毒感染,氟康唑预防真菌感染。另外,予5-羟色胺受体拮抗剂缓解胃肠道反应,呋塞米利尿,水化、碱化尿液以及美司钠预防出血性膀胱炎。血小板<20×109/L时输注单采血小板,血红蛋白<60 g/L时输注红细胞悬液。
1.3 随访出院后通过门诊或电话随访,每4周1次,截止日期为2018年4月30日,结局变量为疾病进展和死亡。总生存期(overall survival,OS)定义为自auto-HSCT至因任何原因导致的死亡或末次随访时间。无进展生存期(progress free survival,PFS)定义为自auto-HSCT至疾病进展、死亡或末次随访时间。随访过程中无患者失访。
1.4 疗效评价指标 1.4.1 造血重建标准中性粒细胞植入定义为没有集落因子刺激下中性粒细胞≥0.5×109/L连续3 d以上的第1天,血小板植入定义为未予血小板输注时血小板≥20×109/L连续3 d以上的第1天[4]。
1.4.2 不良反应及结局指标自预处理方案的第1天开始评价预处理相关毒性及预后,预处理相关毒性评价根据美国国立癌症研究所的常规毒性评定标准(NCI-CTC)[5]。疗效评价根据国际淋巴瘤工作组(IWC)疗效标准进行,具体分为完全缓解、部分缓解、疾病稳定以及疾病进展[6]。结局指标为总生存率和无进展生存率。
1.5 统计学分析采用SPSS 19.0统计软件。计数资料以例(%)表示,组间比较采用χ2检验。总生存率和无进展生存率采用Kaplan-Meier生存分析。Log rank检验用于单因素分析,COX比例风险回归模型用于多因素分析。P < 0.05为差异有统计学意义。
2 结果 2.1 临床特征研究共纳入102例非霍奇金淋巴瘤患者,其中男性71例,女性31例,中位年龄42(16~66)岁。B淋巴细胞淋巴瘤66例,T淋巴细胞淋巴瘤36例;其中弥漫大B细胞淋巴瘤47例,滤泡淋巴瘤5例,套细胞淋巴瘤6例,Burkitt淋巴瘤5例,小淋巴细胞淋巴瘤2例,黏膜相关淋巴组织淋巴瘤2例,前B细胞淋巴母细胞淋巴瘤2例,结外NK/T细胞淋巴瘤9例,外周T细胞淋巴瘤9例,间变大细胞淋巴瘤4例,蕈样霉菌病3例,血管免疫母细胞性T细胞淋巴瘤1例,前T细胞淋巴母细胞淋巴瘤7例。纳入研究的患者移植前临床特征见表 1。
| 临床特征 |
例数 | 无进展生存[例(%)] | P值 | 总生存[例(%)] | P值 |
| 年龄 | |||||
| <35岁 | 28 | 21(75.0) | 0.237 | 21(75.0) | 0.850 |
| ≥35岁 | 74 | 56(75.7) | 63(85.1) | ||
| 性别 | |||||
| 男 | 71 | 53(74.6) | 0.247 | 58(81.6) | 0.844 |
| 女 | 31 | 24(77.4) | 26(83.8) | ||
| 疾病类型 | |||||
| B淋巴细胞淋巴瘤 | 66 | 58(87.9) | <0.001 | 62(93.9) | <0.001 |
| T淋巴细胞淋巴瘤 | 36 | 19(52.7) | 22(61.1) | ||
| Ann Arbor分期 | |||||
| Ⅰ~Ⅱ期 | 16 | 14(87.5) | 0.167 | 14(87.5) | 0.390 |
| Ⅲ~Ⅳ期 | 86 | 63(73.2) | 70(81.4) | ||
| IPI评分 | |||||
| 0~2分 | 79 | 62(78.5) | 0.041 | 67(84.8) | 0.190 |
| 3~4分 | 23 | 15(65.2) | 17(73.9) | ||
| B症状 | |||||
| 有 | 34 | 25(73.5) | 0.956 | 27(79.4) | 0.731 |
| 无 | 68 | 52(76.5) | 57(83.8) | ||
| 移植前疾病状态 | |||||
| 完全缓解CR | 68 | 58(85.3) | 0.106 | 59(86.8) | 0.172 |
| 部分缓解PR | 22 | 15(68.2) | 17(77.3) | ||
| 疾病进展PD | 12 | 4(33.3) | 8(66.7) | ||
2.2 造血重建时间
中性粒细胞植入中位时间10(7~17)d,血小板植入中位时间12(7~33)d。1例中性粒细胞和血小板均未重建成功,1例血小板未重建成功,其余均造血重建成功。
2.3 生存分析 2.3.1 移植后总生存率中位随访时间为42(3~113)个月,25例(24.5%)出现疾病进展,18例(17.6%)死亡,其中9例因疾病进展死亡,3例因脓毒血症死亡,2例因继发性溶血性贫血死亡,2例因肝功能衰竭死亡,1例因恶性心律失常死亡,1例因继发第二肿瘤死亡。截止随访结束,3年总生存率为81.3%,3年无进展生存率为77.5%(图 1)。
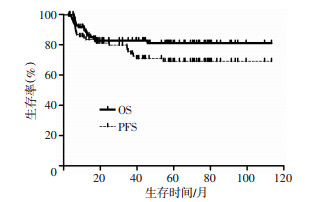
|
| 图 1 CEAC预处理后非霍奇金淋巴瘤患者的总生存和无进展生存曲线 |
2.3.2 生存相关的单因素分析及多因素分析
单因素分析结果显示,疾病类型是影响总生存率(P < 0.001)和无进展生存率(P < 0.001)的预后因素,IPI评分是影响无进展生存率(P=0.041)的预后因素(表 1)。多因素分析结果表明疾病类型(HR=0.144,95%CI 0.052~ 0.400,P < 0.001)是影响总生存率的独立预后因素,同时疾病类型(HR=0.291,95%CI 0.133~0.637,P=0.002)和移植前状态(HR=1.940,95%CI 1.192~3.159,P=0.008)是影响无进展生存率的独立预后因素(表 2)。B淋巴细胞淋巴瘤经CEAC预处理方案联合auto-HSCT治疗后OS、PFS均高于T淋巴细胞淋巴瘤,而移植前达到完全缓解的患者PFS较部分缓解和疾病进展者高(图 2)。经Kruskal-Wallis检验将移植前疾病状态两两比较,显示移植前完全缓解(P=0.023)和部分缓解(P=0.048)者均较疾病进展的总生存率高,而移植前完全缓解和部分缓解间差异无统计学意义;移植前完全缓解(P=0.002)和部分缓解(P=0.010)较疾病进展的无进展生存率高,而移植前完全缓解和部分缓解间差异无统计学意义。
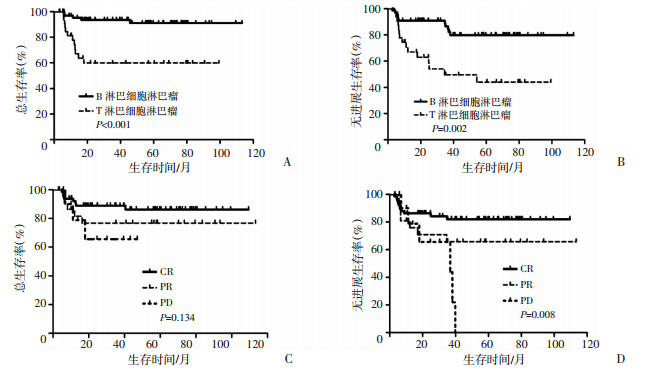
|
| A、B:不同疾病类型以CEAC预处理方案治疗后的总生存曲线(A)和无进展生存曲线(B);C、D:不同移植前疾病状态以CEAC预处理方案治疗后的总生存曲线(C)和无进展生存曲线(D) 图 2 患者不同情况生存相关的多因素分析 |
| 临床特征 | OS | PFS | |||||
| 相对危险度(HR) | 95%可信区间 | P值 | 相对危险度(HR) | 95%可信区间 | P值 | ||
| 年龄 | 0.850 | 0.303 | |||||
| 性别 | 0.844 | 0.211 | |||||
| 疾病类型 | 0.144 | 0.052~0.400 | <0.001 | 0.291 | 0.133~0.637 | 0.002 | |
| Ann Arbor分期 | 0.390 | 0.167 | |||||
| IPI评分 | 0.290 | 0.129 | |||||
| B症状 | 0.731 | 0.859 | |||||
| 移植前状态 | 0.134 | 1.940 | 1.192~3.159 | 0.008 | |||
2.3.3 亚组分析
多因素分析中,移植前获得完全缓解者PFS优于移植前非完全缓解者。进一步对移植前疾病状态的不同病理类型进行亚组分析,结果显示移植前获得完全缓解(P=0.031)或部分缓解(P=0.029)的B淋巴细胞淋巴瘤PFS均优于同一疾病状态的T淋巴细胞淋巴瘤(图 3)。将B淋巴细胞淋巴瘤分为弥漫大B细胞淋巴瘤和非弥漫大B细胞淋巴瘤两大类,T淋巴细胞淋巴瘤分为外周T细胞淋巴瘤和非外周T细胞淋巴瘤两大类进行亚组分析,结果显示弥漫大B细胞淋巴瘤较非弥漫大B细胞淋巴瘤的总生存率(P=0.048)和无进展生存率(P=0.049)高,外周T细胞淋巴瘤较非外周T细胞淋巴瘤的总生存率(P=0.561)和无进展生存率(P=0.837)稍高,但差异无统计学意义。具体见图 4。
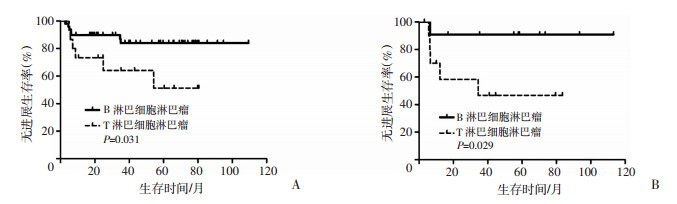
|
| A:移植前完全缓解者不同疾病类型以CEAC预处理方案治疗后的无进展生存曲线;B:移植前部分缓解者不同疾病类型以CEAC预处理方案治疗后的无进展生存曲线 图 3 移植前不同疾病状态对PFS的影响 |
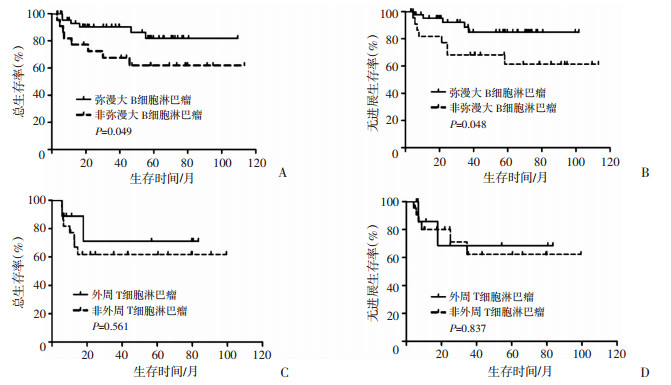
|
| A、B:弥漫大B细胞淋巴瘤与非弥漫大B细胞淋巴瘤经CEAC预处理方案治疗后的总生存曲线(A)和无进展生存曲线(B);C、D:外周T细胞淋巴瘤与非外周T细胞淋巴瘤经CEAC预处理方案治疗后的总生存曲线(C)和无进展生存曲线(D) 图 4 淋巴瘤亚组多因素分析 |
2.4 预处理相关毒性
预处理相关毒性以恶心呕吐、腹泻、发热和感染发生率较高,移植相关病死率为1.96%。
2.4.1 感染移植过程中54例(52.9%)出现有病原学依据的感染,其中肺部感染14例,肠道感染5例,尿路感染1例,粒细胞缺乏伴感染28例,败血症3例,3例因脓毒血症死亡。
2.4.2 其他相关毒性移植过程中68例(66.7%)出现2级以上恶心呕吐, 57例(55.9%)出现2级以上腹泻,26例(25.5%)出现2级以上黏膜炎,87例(85.3%)出现1级以上发热,见表 3。其中出血病例中膀胱出血3例,结膜出血2例,鼻出血2例,皮下出血2例,消化道出血1例,阴道出血1例。2名患者因感染性休克于移植后100 d内死亡,移植相关病死率为1.96%。
| 预处理毒性 | 0级 | 1级 | 2级 | 3级 | 4级 |
| 恶心呕吐 | 5(4.9) | 29(28.4) | 62(60.8) | 6(5.9) | 0(0.0) |
| 腹泻 | 34(33.3) | 11(10.8) | 36(35.3) | 20(19.6) | 1(1.0) |
| 黏膜炎 | 59(57.8) | 17(16.7) | 23(22.5) | 3(3.0) | 0(0.0) |
| 皮疹 | 60(58.8) | 32(31.4) | 8(7.8) | 2(2.0) | 0(0.0) |
| 出血 | 92(90.2) | 2(2.0) | 4(3.9) | 4(3.9) | 0(0.0) |
| 肝损害 | 46(45.1) | 30(29.4) | 26(25.5) | 0(0.0) | 0(0.0) |
| 发热 | 15(14.7) | 49(48.0) | 36(35.3) | 2(2.0) | 0(0.0) |
3 讨论
研究显示自体造血干细胞移植可提高年轻初治高危非霍奇金淋巴瘤的PFS和OS[7],其中,预处理方案作为自体造血干细胞移植的重要步骤,一直是自体造血干细胞移植的研究热点。预处理方案中,CEAC对于复发NHL的患者5年OS率与BEAM相似,优于BEAC/CBV方案;对于复发性HL患者,CEAC方案5年OS率与BEAM/CBV相似[8]。本研究纳入102例年轻初治aaIPI评分中高危或低危但具有不良预后因素的患者,经CEAC预处理方案治疗中位随访42个月后,3年总生存率为81.3%,3年无进展生存率为77.5%。SHI等[9]对CBV、BEAM、BEAC预处理方案的回顾性研究结果显示,CBV、BEAM、BEAC的总生存率分别为68.8%、77.8%、81.8%,无进展生存率分别为43.8%、66.7%、67.5%。本研究结果显示CEAC方案的总生存率较高,与文献[9]报道的BEAC方案相似,优于BEAM/CBV方案,无进展生存率优于BEAC/BEAM/CBV方案。
整体而言,B淋巴细胞淋巴瘤的预后优于T淋巴细胞淋巴瘤[10]。贺莹[11]报道46例B淋巴细胞淋巴瘤经CEAC预处理方案治疗的有效率为60.87%,D’AMORE等[12]报道除外间变性淋巴瘤激酶阳性间变性大细胞淋巴瘤的初治患者一线治疗缓解后经BEAM/BEAC预处理,5年总生存率51%,5年无进展生存率44%。本研究得出相似结论,多因素分析显示疾病类型是总生存率和无进展生存率的独立预后因素,B淋巴细胞淋巴瘤经CEAC预处理方案治疗的OS和PFS均优于T淋巴细胞淋巴瘤。多因素分析还显示移植前疾病状态是影响无进展生存率的独立预后因素,移植前完全缓解可延长无进展生存率,对总生存率的影响差异无统计学意义。多项研究表明移植前完全缓解有利于提高无进展生存率,甚至提高总生存率[13-14],本结果也证实了此观点。我们进一步对移植前不同状态根据病理类型进行亚组分析,结果提示在移植前完全缓解和部分缓解下,B淋巴细胞淋巴瘤的生存率均优于T淋巴细胞淋巴瘤,表明B淋巴细胞淋巴瘤经CEAC方案治疗效果较好。
在靶向治疗时代,将自体造血干细胞移植作为年轻初治高危弥漫大B细胞淋巴瘤的巩固治疗尚存在争议,支持者认为自体造血干细胞移植作为巩固治疗可提高弥漫大B细胞淋巴瘤的无进展生存率和总生存率。PYTLÍK等[15]研究显示年轻高危弥漫大B细胞淋巴瘤经BEAM治疗后,5年PFS率与OS率分别为60%与61%。另一项Ⅲ期临床实验显示年轻高危弥漫大B细胞淋巴瘤经BEAM预处理方案治疗,3年无进展生存率70%,3年总生存率81%[16]。本研究将影响生存率的不同病理类型根据B/T细胞淋巴瘤亚型进行亚组分析,结果显示B淋巴细胞淋巴瘤组的弥漫大B细胞淋巴瘤较非弥漫大B细胞淋巴瘤经CEAC预处理治疗后有更高的生存率;弥漫大B细胞淋巴瘤3年总生存率87%,3年无进展生存率86%,与PYTLÍK等[15]报道的BEAM方案总生存率相似,无进展生存率较高。外周T细胞淋巴瘤对常规化疗疗效较差,自体造血干细胞移植作为一线巩固治疗是其重要的治疗手段,YIN等[17]进行荟萃分析评估自体造血干细胞移植在外周T细胞淋巴瘤治疗中的价值,结果显示自体造血干细胞移植有改善生存的趋势。NLG-T-01研究[12]评估除外间变性淋巴瘤激酶阳性间变性大细胞淋巴瘤(anaplastic large cell lymphoma,ALCL)的160例初治外周T细胞淋巴瘤患者以BEAM/BEAC方案预处理自体造血干细胞移植作为巩固治疗,PFS和OS分别为44%和51%。本研究结果显示外周T细胞淋巴瘤总生存率约64%,无进展生存率约70%,优于BEAM/BEAC方案。亚组分析提示T淋巴细胞淋巴瘤组的外周T细胞淋巴瘤与非外周T细胞淋巴瘤总生存率与无进展生存率差异无统计学意义,可能与纳入病例数较少有关。
本研究中100例造血重建成功,中性粒细胞植入中位时间10(7~17)d,血小板植入中位时间12(7~33)d。与SHI等[9]报道的129例非霍奇金淋巴瘤经CBV(16例)、BEAM(36例)及BEAC(77例)方案治疗后中性粒细胞/血小板中位植入时间(10.5/11.5 d、11/13 d、11/12 d)相似。本研究中2名患者于移植后100 d内死亡,2例均因脓毒血症死亡,TMR为1.96%,明显低于其他文献报道的结果。本研究中预处理相关不良反应主要为恶心呕吐、腹泻、黏膜炎、发热、肝功能损害、皮疹,经积极对症处理,绝大部分患者可耐受,不良反应的发生率与周沙等[18]报道CEAC方案治疗的淋巴瘤结果相似,感染的发生率低于BEAM方案,但较CBV和BEAC方案高。
本研究结果显示,CEAC预处理方案应用于淋巴瘤自体移植具有较好长期缓解率和总生存率,对B淋巴细胞淋巴瘤的疗效优于T淋巴细胞淋巴瘤,其中弥漫大B细胞淋巴瘤的生存率较非弥漫大B细胞淋巴瘤高,在积极支持治疗下,具有可耐受的不良反应。本研究因病例数较少等原因,对各个淋巴瘤亚型分析未细化,今后将积累更多病例并期待多中心前瞻性随机对照研究来全面评估各种预处理方案的优劣,进一步指导临床工作。
| [1] |
CHIHARA D, NASTOUPIL L J, WILLIAMS J N, et al. New insights into the epidemiology of non-Hodgkin lymphoma and implications for therapy[J]. Expert Rev Anticancer Ther, 2015, 15(5): 531-544. DOI:10.1586/14737140.2015.1023712 |
| [2] |
SAKELLARI I, MALLOURI D, BATSIS I, et al. Carmustine, etoposide, cytarabine and melphalan versus a newly designed intravenous busulfan-based Busulfex, etoposide and melphalan conditioning regimen for autologous hematopoietic cell transplant: a retrospective matched-pair analysis in advanced Hodgkin and non-Hodgkin lymphomas[J]. Leuk Lymphoma, 2015, 56(11): 3071-3081. DOI:10.3109/10428194.2015.1028054 |
| [3] |
朱雄增. WHO(2008)恶性淋巴瘤分类解读[J]. 诊断病理学杂志, 2009, 16(4): 241-245. ZHU X Z. Interpretation of malignant lymphoma classification WHO(2008)[J]. Chin J Diagn Pathol, 2009, 16(4): 241-245. DOI:10.3969/j.issn.1007-8096.2009.04.01 |
| [4] |
LIU H, RICH E S, GODLEY L, et al. Reduced-intensity conditioning with combined haploidentical and cord blood transplantation results in rapid engraftment, low GVHD, and durable remissions[J]. Blood, 2011, 118(24): 6438-6445. DOI:10.1182/blood-2011-08-372508 |
| [5] |
CHUNG A E, SHOENBILL K, MITCHELL S A, et al. Patient free text reporting of symptomatic adverse events in cancer clinical research using the national cancer institute's patient-reported outcomes version of the common terminology criteria for adverse events (PRO-CTCAE)[J]. J Am Med Inform Assoc, 2019, 26(4): 276-285. DOI:10.1093/jamia/ocy169 |
| [6] |
CHESON B D, PFISTNER B, JUWEID M E, et al. Revised response criteria for malignant lymphoma[J]. J Clin Oncol, 2007, 25(5): 579-586. DOI:10.1200/jco.2006.09.2403 |
| [7] |
STIFF P J, UNGER J M, COOK J R, et al. Autologous transplantation as consolidation for aggressive non-Hodgkin's lymphoma[J]. N Engl J Med, 2013, 369(18): 1681-1690. DOI:10.1056/NEJMoa1301077 |
| [8] |
GUPTA A, GOKARN A, RAJAMANICKAM D, et al. Lomustine, cytarabine, cyclophosphamide, etoposide—An effective conditioning regimen in autologous hematopoietic stem cell transplant for primary refractory or relapsed lymphoma: Analysis of toxicity, long-term outcome, and prognostic factors[J]. J Cancer Res Ther, 2018, 14(5): 926-933. DOI:10.4103/0973-1482.181183 |
| [9] |
SHI Y W, LIU P, ZHOU S Y, et al. Comparison of CBV, BEAM and BEAC high-dose chemotherapy followed by autologous hematopoietic stem cell transplantation in non-Hodgkin lymphoma: Efficacy and toxicity[J]. Asia Pac J Clin Oncol, 2017, 13(5): e423-e429. DOI:10.1111/ajco.12610 |
| [10] |
勇威本, 郑文, 卫燕, 等. 中、高度恶性T和B细胞淋巴瘤的临床比较[J]. 中华血液学杂志, 2002, 23(8): 428-429. YONG W B, ZHENG W, WEI Y, et al. Clinical comparison of middle-and highly malignant T-and B-cell lymphoma[J]. Chin J Hematol, 2002, 23(8): 428-429. |
| [11] |
贺莹. 利妥昔单抗联合自体造血干细胞移植治疗B细胞非霍奇金淋巴瘤患者的疗效观察[J]. 中国民康医学, 2019, 31(7): 62-64. HE Y. Effect of rituximab combined with autologous hematopoietic stem cell transplantation on patients with B cell non-Hodgkin lymphoma[J]. Med J Chin People Health, 2019, 31(7): 62-64. |
| [12] |
D'AMORE F, RELANDER T, LAURITZSEN G F, et al. Up-front autologous stem-cell transplantation in peripheral T-cell lymphoma: NLG-T-01[J]. J Clin Oncol, 2012, 30(25): 3093-3099. DOI:10.1200/jco.2011.40.2719 |
| [13] |
CORRADINI P, TARELLA C, ZALLIO F, et al. Long-term follow-up of patients with peripheral T-cell lymphomas treated up-front with high-dose chemotherapy followed by autologous stem cell transplantation[J]. Leukemia, 2006, 20(9): 1533-1538. DOI:10.1038/sj.leu.2404306 |
| [14] |
蒲欣, 陈洁平. 自体造血干细胞移植治疗高危难治淋巴瘤生存分析[J]. 重庆医学, 2016, 45(12): 1620-1623, 1626. PU X, CHEN J P. Survival analysis of patients with high risk refractory lymphoma treated by autologous hematopoietic stem cell transplantation[J]. Chongqing Med, 2016, 45(12): 1620-1623, 1626. DOI:10.3969/j.issn.1671-8348.2016.12.011 |
| [15] |
PYTLÍK R, BELADA D, KUBÁ C ˇ KOVÁ K, et al. Treatment of high-risk aggressive B-cell non-Hodgkin lymphomas with rituximab, intensive induction and high-dose consolidation: long-term analysis of the R-MegaCHOP-ESHAP-BEAM Trial[J]. Leuk Lymphoma, 2015, 56(1): 57-64. DOI:10.3109/10428194.2014.904509 |
| [16] |
YOON J H, KIM J W, JEON Y W, et al. Role of frontline autologous stem cell transplantation in young, high-risk diffuse large B-cell lymphoma patients[J]. Korean J Intern Med, 2015, 30(3): 362-371. DOI:10.3904/kjim.2015.30.3.362 |
| [17] |
YIN J, WEI J, XU J H, et al. Autologous stem cell transplantation as the first-line treatment for peripheral T cell lymphoma: results of a comprehensive meta-analysis[J]. Acta Haematol, 2014, 131(2): 114-125. DOI:10.1159/000353778 |
| [18] |
周沙, 曾东风, 张曦, 等. CEAC预处理方案在自体造血干细胞移植治疗恶性淋巴瘤临床观察[J]. 中国输血杂志, 2015, 28(11): 1300-1303. ZHOU S, ZENG D F, ZHANG X, et al. Clinical observation of CEAC preconditioned regimens in autologous hematopoietic stem cell transplantation(ASCT) for patients with malignant lymphoma[J]. Chin J Blood Transfus, 2015, 28(11): 1300-1303. DOI:10.13303/j.cjbt.issn.1004-549x.2015.11.002 |



