巨噬细胞泡沫化(macrophage foam cell, MFC)的形成在动脉粥样硬化(amerosclerosis, As)的发生发展中起到了关键作用[1],其中最为主要的因素是细胞内的胆固醇代谢。维持细胞内胆固醇平衡包括胆固醇流入、合成和流出三个步骤[2],脂肪酸转位酶(CD36)、酯酰辅酶A:胆固醇酰基转移酶(ACAT1)、ATP结合盒转运体A1/G1 (ABCA1/ABCG1)分别在细胞内胆固醇代谢的胆固醇流入、合成和流出中均起到了非常重要的作用,CD36受体是摄取ox-LDL的主要受体(可以无限制地摄取),ACAT1具有催化细胞内游离的胆固醇(FC)和长链酰基辅酶A合成胆固醇酯(CE)的作用,ABCA1/ABCG促进细胞内过量游离胆固醇流出[2]。如果胆固醇流入、合成增多和流出减少,打破细胞内胆固醇代谢的稳态平衡,均会加速泡沫细胞的形成。
人体内胰升血糖素样肽-1(GLP-1)有2种生物活性形式,分别为GLP-1(7-37)和GLP-1 (7-36),GLP-1约80%的循环活性来自GLP-1(7-36),重组GLP-1(rhGLP-1,7-36)与人的活性GLP-1(7-36)结构一致[3],与GLP-1受体有较强亲和力且不易被二肽基肽酶-4(DDP-4)降解。Exendin(9-39)是GLP-1的抑制剂,具有抑制GLP-1的作用。虽然目前发现GLP-1有心血管保护作用[4],但其抗As的分子机制尚不明确,这也限制了GLP-1在心血管疾病中的应用,本研究旨在探讨GLP-1(7-36)是否抑制高脂饮食喂养的ApoE-/-小鼠主动脉粥样硬化斑块的发生发展及对巨噬细胞来源的泡沫细胞内CD36、ACAT1表达的影响。
1 材料与方法 1.1 实验动物6~8周龄雄性ApoE基因敲除小鼠(ApoE-/-小鼠,购自南京君科生物工程有限公司) 40只,体质量18~20 g。所有动物均饲养于SPF级屏障环境,自由饮水。
1.2 实验药物GLP-1(7-36)(货号:249125,由上海吉尔生化有限公司生产),Exendin(9-39)(货号:055285,由上海吉尔生化有限公司生产)。
1.3 实验试剂RAW264.7小鼠单核巨噬细胞白血病细胞、荧光FITC标记IgG二抗、HPR标记二抗(武汉博士德生物工程有限公司);ox-LDL(北京协生生物科技有限公司);ACAT1一抗(武汉三鹰生物有限公司);CD36一抗(上海拜力生物科技有限公司)。
1.4 动物研究方法 1.4.1 小鼠分组及处理动物实验分4组(n=10):普通饮食组和高脂饮食组各喂养16周, GLP-1(7-36)组喂养12周后给予GLP-1(7-36)2.2 nmol/(L·kg·d)腹腔注射4周, GLP-1(7-36)+Exendin(9-39)组喂养12周后给予GLP-1(7-36)2.2 nmol/(L·kg·d)+Exendin(9-39)22 nmol/(L·kg·d)腹腔注射4周,普通饮食组和高脂饮食组均给予等量生理盐水注射。
1.4.2 组织形态学观察处死全部小鼠,无菌条件下取出主动脉根部,分别进行冰冻包埋切片主动脉根部油红O染色,石蜡包埋切片主动脉根部HE染色,用Image pro-Plus6.0分析斑块面积占主动脉内膜面积比例。
1.4.3 小鼠主动脉根部血管内皮细胞CD36、ACAT1抗体染色石蜡包埋切片主动脉根部抗小鼠血管内皮细胞CD36、ACAT1抗体染色,进行免疫组化染色(二步法, 抗体稀释度均为1:200)测定CD36、ACAT1,每组均以PBS液代替一抗作为阴性对照,用Image pro-Plus6.0分析CD36、ACAT1阳性细胞百分比。
1.5 细胞研究方法 1.5.1 细胞培养和分组培养RAW264.7,细胞在第3和5代之间进行实验研究。细胞实验分八组:空白对照组、泡沫细胞组、不同浓度(0、1.5、3、5、10 nmol/L) GLP-1(7-36)干预组、GLP-1(7-36)5 nmol/L+Exendin(9-39)50 nmol/L组。
1.5.2 油红O染色在巨噬细胞中加入50 mg/L的ox-LDL进行干预24 h后,采用油红O染液染色法鉴定,在倒置显微镜下观察干预后的细胞泡沫化的情况。
1.5.3 用实时PCR检测各组细胞中的CD36、ACAT1 mRNA表达水平按照试剂盒法提取总RNA,进行逆转录及进行PCR扩增,CD36上游引物序列为:5′-CTTTGAAAGAACTCTTGTGGGG-3′, 下游引物序列:5′-GTCTGTGCCATTAATCATGTCG-3′;ACAT1上游引物序列为:5′-ACGTAATGAGCAGAGGAGCAACAC-3′, 下游引物序列:5′-CGTATCCTGTTCCTGCCGTGAG-3′。β-Actin上游引物序列为:5′-CGGAGTCAACGGATTTGGTCGTAT-3′。下游引物序列5′-AGCCTTCTCCATGGTGGTGAAGAC-3′。RT-PCR反应结果获得Ct值。mRNA表达相对量用2-△△Ct表示,其中△△CT=(CtCD36或ACAT1-Ctβ-actin)处理组-(Ct实验组-Ctβ-actin)未处理组。
1.5.4 用Western blot法检测各组细胞中的CD36、ACAT1蛋白表达水平使用适当的裂解液收集蛋白样品,BCA法测定蛋白浓度, 行十二烷基酸钠-聚丙烯酰胺凝胶电泳、转膜及牛奶封闭液封闭1 h,一抗(1:1 000)孵育4 ℃过夜,二抗(1:2 000)孵育室温2 h,在凝胶成像分析系统中采集图像,测定条带灰度值。
1.5.5 酶荧光化学法测定细胞内各种胆固醇含量将各组干预后的细胞,参考胆固醇测定试剂盒说明书,在酶标仪仪器发射波长为590 nm处检测荧光值,分别测定TC和FC的含量,CE=TC-FC。
1.5.6 细胞免疫荧光观察各组细胞表面CD36、ACAT1蛋白表达在培养板中将已爬好细胞的玻片加入4%多聚甲醛固定,加入0.5%Triton-100,加入含10%FBS的PBS,加入100 μL稀释好的一抗过夜,加入IGg-FITC二抗(1:1 000稀释),避光1.5 h,加入DAPI工作液(1 μg/mL),覆盖盖玻片,同时晾干载玻片后,盖上盖玻片,在荧光显微镜下观察采集图像。
1.6 统计学方法采用SPSS 19.0统计学软件,计量资料采用x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。
2 结果 2.1 各组小鼠主动脉根部HE染色、油红O染色结果普通饮食组血管壁厚度较均一,内皮较完整,未见泡沫细胞以及粥样斑块;高脂饮食组动脉内膜明显增厚,内膜受损,内膜下可见明显的粥样斑块,可见大量泡沫细胞浸润,HE、油红O染色均可见多处红染,斑块面积占主动脉内膜面积比例(30.3±3.8)%;GLP-1组斑块面积占主动脉内膜面积比例(15.1±4.3)%,与高脂饮食组相比较,GLP-1组主动脉斑块明显减少(P<0.05),红染分布减少,内膜增厚程度降低,泡沫细胞浸润大量减少;GLP-1+Exendin组斑块面积占主动脉内膜面积比例(25.7±3.4)%,较GLP-1组内膜下可见大量的粥样斑块(P<0.05),可见大量泡沫细胞浸润(图 1)。

|
| 图 1 各组小鼠主动脉根部HE(A)、油红O(B)染色病理观察结果 |
2.2 各组小鼠主动脉根部血管内皮细胞CD36、ACAT1表达
普通饮食组主动脉根部CD36、ACAT1表达水平明显升高;与高脂饮食组相比,GLP-1组CD36、ACAT1阳性细胞百分比表达水平明显降低(P<0.05,见图 2);与GLP-1组相比,GLP-1+Exendin组CD36、ACAT1阳性细胞百分比表达水平升高(P<0.05,图 2)。油红O染色ox-LDL干预巨噬细胞后,用油红O染色,镜下观察泡沫细胞形态饱满,细胞内可见大量红色脂滴颗粒,确定泡沫细胞模型建立成功。

|
| 图 2 各组小鼠主动脉根部血管内皮细胞CD36(A)、ACAT1(B)表达 |
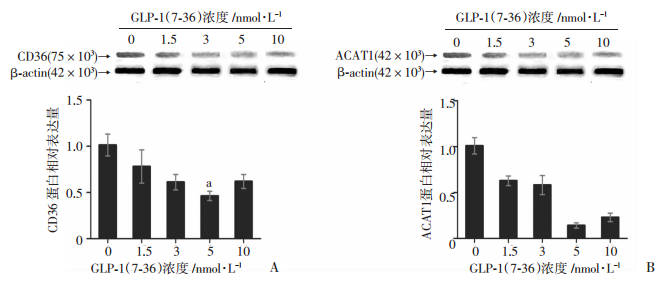
2.2.1 不同浓度GLP-1(7-36)干预CD36、ACAT1的mRNA、蛋白表达
不同浓度(0、1.5、3、5、10 nmol/L) GLP-1(7-36)CD36、ACAT1 mRNA表达低于0 nmol/L组,但只有GLP-1(7-36)5 nmol/L干预时具有统计学意义(P<0.05,图 3);不同浓度(0、1.5、3、5、10 nmol/L) GLP-1(7-36)组CD36、ACAT1蛋白表达低于0 nmol/L组,但只有GLP-1(7-36)5nmol/L干预时具有统计学意义(P<0.05,图 4)。

|
| a:P<0.05,与0 nmol/L比较;a:P<0.05,与0 nmol/L比较 图 3 不同浓度GLP-1(7-36)干预CD36(A)、ACAT1(B)的mRNA表达 (n=5,x±s) |
|
| a:P<0.05,与0 nmol/L比较;a:P<0.05,与0 nmol/L比较 图 4 不同浓度GLP-1(7-36)干预组CD36(A)、ACAT1(B)的蛋白表达 (n=5,x±s) |
2.2.2 各组CD36、ACAT1的mRNA、蛋白表达
与空白对照组相比,泡沫细胞组CD36、ACAT1mRNA表达水平较高(P<0.05);与model组相比,GLP-1组CD36、ACAT1mRNA表达水平明显降低(P<0.05);与GLP-1组相比,GLP-1+Exendin组CD36、ACAT1mRNA表达水平较高(P<0.05)(见图 5);与空白对照组相比,泡沫细胞组CD36、ACAT1蛋白表达水平较高(P<0.05);与泡沫细胞组相比,GLP-1组CD36、ACAT1蛋白表达水平明显降低(P<0.05);与GLP-1组相比,GLP-1+Exendin组CD36、ACAT1蛋白表达水平较高(P<0.05,图 6)。

|
| a:P<0.05,与空白对照组比较;b:P<0.05,与泡沫细胞组比较;c:P<0.05,与GLP-1组比较 图 5 各组细胞间CD36(A)、ACAT1(B)的mRNA相对表达量 (n=4,x±s) |

|
| a:P<0.05,与空白对照组比较;b:P<0.05,与泡沫细胞组比较;c:P<0.05,与GLP-1组比较 图 6 各组细胞间CD36(A)、ACAT1(B)的蛋白相对表达量 (n=4,x±s) |
2.2.3 GLP-1对细胞内胆固醇含量的影响
不同浓度(0、1.5、3、5、10 nmol/L)GLP-1(7-36)组对细胞内胆固醇含量的测定均低于泡沫细胞组,但只有GLP-1(7-36)5 nmol/L干预时具有统计学意义(P<0.05,表 1);与空白对照组相比,泡沫细胞组TC、FC、CE含量较高(P<0.05);与泡沫细胞组相比,GLP-1组TC、FC、CE含量明显降低(P<0.05);与GLP-1组相比,GLP-1+Exendin组TC、FC、CE含量较高(P<0.05,表 2)。
| GLP-1 (7-36)浓度 |
TC /mg·mL-1 |
FC /mg·mL-1 |
CE /mg·mL-1 |
CE/TC/% |
| 0 nmol/L | 81.55±7.56 | 30.58±6.10 | 50.84±5.66 | 62.43±7.02 |
| 1.5 nmol/L | 75.59±4.12 | 31.77±3.90 | 44.18±3.23 | 58.22±4.01 |
| 3 nmol/L | 71.36±3.32 | 30.15±2.36 | 41.47±2.30 | 57.90±3.42 |
| 5 nmol/L | 29.56±1.62a | 18.99±1.29a | 10.23±1.33a | 35.00±1.38a |
| 10 nmol/L | 68.98±4.22 | 31.12±3.34 | 40.14±4.56 | 54.41±4.16 |
| a:P<0.05,与浓度0 nmol/L组比较 | ||||
| 组别 | TC/mg·mL-1 | FC/mg·mL-1 | CE/mg·mL-1 | CE/TC/% |
| Control组 | 20.22±2.99 | 13.47±1.02 | 6.55±1.01 | 32.60±2.03 |
| model组 | 81.43±8.87a | 30.60±7.31a | 50.87±6.56a | 62.43±7.01a |
| GLP-1组 | 29.21±1.65b | 18.99±1.65b | 10.36±1.65b | 34.99±1.01b |
| GLP-1+Exendin组 | 59.29±5.84c | 23.44±5.06c | 35.84±4.78c | 60.46±3.04c |
| a:P<0.05,与空白对照组比较;b:P<0.05,与泡沫细胞组比较;c:P<0.05,与GLP-1组比较 | ||||
2.2.4 免疫荧光染色
与空白对照组相比,泡沫细胞组CD36、ACAT1荧光大量聚集,表达明显上调;与泡沫细胞组相比,GLP-1组CD36、ACAT1荧光聚集明显减少,表达明显下调;与GLP-1组相比,GLP-1+Exendin组CD36、ACAT1荧光聚集增多,表达上调(图 7)。

|
| 图 7 各组细胞分别进行CD36、ACAT1抗体荧光染色后的表达(×20) |
3 讨论
胆固醇流入、合成增多和流出减少,加速了泡沫细胞的形成,胆固醇代谢稳态的失衡贯穿于泡沫细胞形成的整个过程。GLP-1受体激动剂可改善心肌能量代谢、改善血管内皮细胞功能障碍、降低血压、改善心功能、降低心血管病事件的发生[5]。有研究表明,只有在某些病理生理条件下,如胰岛素抵抗状态下,持续静脉滴注GLP-1(7-36a)和GLP-1(9-36a),都能增加心输出量和心肌葡萄糖摄取,9-36a还可减轻高脂饮食喂养小鼠引起的胰岛素抵抗和肥胖、肝脏脂肪变性[6]。GLP-1受体激动剂通过改变高脂血症中的脂肪生成和β-氧化,以此改善循环和肝脏脂质代谢[7]。本研究发现GLP-1(7-36)通过降低巨噬细胞来源的泡沫细胞CD36 mRNA和蛋白的表达,减少细胞内胆固醇流入,通过降低ACAT1 mRNA和蛋白的表达,减少胆固醇酯的合成,抑制巨噬细胞泡沫化,抑制MFC的形成。我们在高脂饮食喂养的Apo E-/-小鼠中观察到严重的高脂血症,这导致脂质斑块在主动脉中的沉积。本研究发现GLP-1(7-36)对小鼠As的发生发展也有抑制作用,主动脉根部HE、油红O染色结果显示GLP-1(7-36)减少主动脉粥样斑块的面积,免疫组化检查结果也显示GLP-1(7-36)通过减少主动脉CD36、ACAT1的表达,减少泡沫细胞浸润,减少脂纹脂斑的形成,进一步减少粥样斑块的形成。GLP-1受体激动剂发挥抗As的作用,不仅独立于降糖作用之外,在一定程度上与体重和胆固醇的降低也无关[8]。有研究发现[9],GLP-1受体激动剂不仅可以减少巨噬细胞浸润,还可发挥稳定As斑块的作用。本研究表明,GLP-1(7-36)通过下调巨噬细胞来源的泡沫细胞CD36、ACAT1的表达,减少细胞内胆固醇的蓄积,抑制巨噬细胞泡沫化,减少主动脉中CD36、ACAT1的表达,减少脂质的积累和脂肪条纹的形成,最终抑制As斑块的形成。
| [1] |
HUANG H, KOELLE P, FENDLER M, et al. Induction of inducible nitric oxide synthase (iNOS) expression by oxLDL inhibits macrophage derived foam cell migration[J]. Atherosclerosis, 2014, 235(1): 213-222. DOI:10.1016/j.atherosclerosis.2014.04.020 |
| [2] |
CHISTIAKOV D A, BOBRYSHEV Y V, OREKHOV A N. Macrophage-mediated cholesterol handling in atherosclerosis[J]. J Cell Mol Med, 2016, 20(1): 17-28. DOI:10.1111/jcmm.12689 |
| [3] |
NADKARNI P, CHEPURNY O G, HOLZ G G. Regulation of glucose homeostasis by GLP-1[M]//Progress in Molecular Biology and Translational Science.Elsevier, 2014: 23-65. DOI: 10.1016/b978-0-12-800101-1.00002-8.
|
| [4] |
GUGLIELMI V, SBRACCIA P. GLP-1 receptor independent pathways: emerging beneficial effects of GLP-1 breakdown products[J]. Eat Weight Disord, 2017, 22(2): 231-240. DOI:10.1007/s40519-016-0352-y |
| [5] |
GALLEGO-COLON E, WOJAKOWSKI W, FRANCUZ T. Incretin drugs as modulators of atherosclerosis[J]. Atherosclerosis, 2018, 278: 29-38. DOI:10.1016/j.atherosclerosis.2018.09.011 |
| [6] |
LI J F, ZHENG J, WANG S, et al. Cardiovascular benefits of native GLP-1 and its metabolites: an indicator for GLP-1-therapy strategies[J]. Front Physiol, 2017, 8: 15. DOI:10.3389/fphys.2017.00015 |
| [7] |
PATEL V, JOHARAPURKAR A, KSHIRSAGAR S, et al. Coagonist of GLP-1 and glucagon decreases liver inflammation and atherosclerosis in dyslipidemic condition[J]. Chem Biol Interact, 2018, 282: 13-21. DOI:10.1016/j.cbi.2018.01.004 |
| [8] |
RAKIPOVSKI G, ROLIN B, NØHR J, et al. The GLP-1 analogs liraglutide and semaglutide reduce atherosclerosis in ApoE-/- and LDLr-/- mice by a mechanism that includes inflammatory pathways[J]. JACC Basic Transl Sci, 2018, 3(6): 844-857. DOI:10.1016/j.jacbts.2018.09.004 |
| [9] |
SUDO M, LI Y X, HIRO T, et al. Inhibition of plaque progression and promotion of plaque stability by glucagon-like peptide-1 receptor agonist: Serial in vivo findings from iMap-IVUS in Watanabe heritable hyperlipidemic rabbits[J]. Atherosclerosis, 2017, 265: 283-291. DOI:10.1016/j.atherosclerosis.2017.06.920 |



