结直肠癌是世界第三常见的恶性肿瘤[1]。据美国最新统计数据显示,其患病人群逐渐呈现年轻化趋势,在≤50岁组中,结直肠癌的发生率与死亡率分别增长了22%和13%[2]。并且超过50%的结直肠癌患者可能会发生肝转移[3]。因此,研究肿瘤转移过程中所涉及的分子机制,为肿瘤有效治疗提供新的靶点,提高患者生存率是至关重要的。
PYCR1(pyrroline-5-carpoxylate reductase-1,吡咯啉-5-羧酸还原酶-1),是P5C(pyrroline-5-carpoxylate)转化为脯氨酸的依赖NADP的关键酶,位于染色体17q25.3,其变异会导致一种使病人出现早衰的罕见皮肤病[4-5]。PYCR1在19种不同肿瘤中均呈高表达[6],研究表明在乳腺癌、肺癌、前列腺癌等中下调PYCR1后会抑制肿瘤细胞的增殖、迁移和侵袭[7-9]。但目前PYCR1对结肠癌细胞生物学的影响尚不清楚。EMT(上皮间充质转化)是细胞失去上皮表型向间充质表型转化的过程。细胞连接附着力减弱,迁移侵袭能力增强,是肿瘤发生远处转移的基础[10]。故本实验通过检测PYCR1在结肠癌中的表达,构建PYCR1干扰质粒,观察细胞转染前后对增殖、迁移和侵袭的影响,检测EMT标志物的表达,初步探讨结肠癌转移可能的机制。
1 材料与方法 1.1 材料 1.1.1 组织标本收集17对2017年6月至12月在重庆医科大学附属第一医院手术室切除的新鲜结肠癌及癌旁组织和62例结肠癌、10例癌旁组织石蜡切片,所有病人术前均未进行放化疗。所有组织均在患者与家属知情同意的情况下收集并且通过重庆医科大学附属第一医院伦理委员会审查。
1.1.2 实验主要材料HCT116、Caco2、SW480、lovo结肠癌细胞株由本院分子肿瘤与表观遗传学实验室惠赠。干扰质粒shPYCR1 (5′-TGAGAAGAAG-CTGTCAGCGTT-3′)和shPYCR1- vector空载质粒由莱格尔生物公司合成提供。LipofectamineTM2000脂质体购自Invitrogen公司。细胞培养所需RPMI1640购自Hyclon公司,胎牛血清为PAN公司。RNA提取、逆转录及qPCR试剂均购自TaKaRa公司。引物由金斯瑞公司合成。RIPA、PMSF、BCA、5X上样缓冲液、SDS-PAGE、ECL试剂盒均购自碧云天公司。兔抗人PYCR1、β-actin单克隆抗体均购自ABGENT公司;兔抗人多克隆E-cadherin、N-cadherin、Vimentin、β-catenin和c-Myc抗体均由万类生物公司提供;β-actin单克隆、HRP标记的羊抗兔多克隆抗体均购自博奥森公司。Matrigel基质胶购自BD公司,transwell小室(8 μm)购自Corning公司。G418购自索莱宝公司。cck8试剂购自日本同仁公司。SP试剂盒购于中杉金桥公司。
1.2 方法 1.2.1 RT-qPCRTolzal法提取总RNA,采用TaKaRa试剂盒逆转录结肠癌组织、各细胞株和转染后HCT116细胞RNA为cDNA。随后根据qPCR试剂说明书进行PCR反应。PYCR1上游引物为:5′-CGCC-GACATTGAGGACAGAC-3′,下游引物为:5′-CGACTG-GAGTGTTGGTCATGC-3′,产物长度为131 bp;β-actin上游引物为:5′-CCACGAAACTACCTTCAACTCC-3′,下游引物为:5′-GTGATCTCCTTCTGCATCCTGT-3′,产物长度为132 bp。结果以2-△△Ct方法计算[11]。
1.2.2 免疫组化石蜡切片脱蜡之后,按照SP试剂盒说明书严格操作,一抗4 ℃孵育过夜,二抗后DAB显色,苏木紫复染,脱水后中性树胶封片,拍照。每张切片随机取5个视野,按照阳性细胞比例进行评分,阳性细胞比例为0%为0分,>0%~1%为1分,≥1%~10%为2分,>10%~33%为3分,>33%~66%为4分,>66%~100%为5分。按照染色强度评分,不着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。将两者相加,总分评判PYCR1的表达情况[12]。
1.2.3 细胞培养HCT116、SW480、Lovo、Caco2细胞用含10%胎牛血清的RPMI1640培养基在37 ℃、5%CO2的细胞孵箱内培养,每1~2天更换细胞培养基,待细胞融合度达到80%~90%时进行传代。用含10%DMSO的胎牛血清冻存液冻存细胞。
1.2.4 细胞转染和G418筛选将适量细胞种至六孔板中,待细胞融合度达到60%~70%时进行转染。先将5 μL LipofectamineTM2000和4 μg质粒分别加入150 μL RPMI1640中,在室温静置5 min,然后轻轻混匀,孵育20 min。将原先六孔板内的培养基弃去,加入混合物和RPMI1640共1 ml,6 h之后更换成含血清的培养基。转染后48 h,在培养基中加入400 μg/mL G418进行筛选,筛选14 d左右可见集落形成,随后G418浓度减半,继续培养。
1.2.5 Western blot细胞转染后48 h,提取蛋白(RIPA、PMSF),检测蛋白浓度(BCA法)。每孔30 μg上样量,10%SDS-PAGE胶电泳分离,之后250 mA恒流转至PVDF膜上。室温下2.5%脱脂牛奶封闭2~3 h,TBST洗3次(每次10 min),随后一抗(稀释浓度均为1:1 000)4 ℃冻库摇床过夜,次日TBST洗膜之后,室温下对应二抗(1:5 000)孵育1~2 h,洗膜3次之后ECL显影,检测蛋白表达情况。
1.2.6 cck8细胞增殖实验细胞转染后48 h,将shPYCR1组和shPYCR1-vector组细胞分别以每孔3 000个左右的数量种于96孔板,每组3个复孔,分别在0、24、48、72 h进行cck8测量。测量时每孔加入100 μL培养基和10 μL cck8试剂混合液,并设立空白对照孔,在孵箱内培养1 h,酶标仪检测450 nm波长处的光密度值,检测时除去孔内气泡。
1.2.7 克隆形成实验分别取稳定转染的shPYCR1组和shPYCR1-vector组细胞,按每孔500个细胞接种于六孔板中,每组3个复孔,培养两周左右,待长出肉眼可见的克隆即可终止培养,固定染色后,拍照计数。
1.2.8 Transwell实验迁移实验:细胞转染后48 h,将shPYCR1-2组和shPYCR1-vector组分别消化,用RPMI1640重悬、计数。小室上室加入200 μL细胞悬液(含5×104个细胞),下室加入800 μL完全培养基后,孵箱培养48 h后取出,固定染色,计数穿膜细胞。
侵袭实验:将Matrigel基质胶与RPMI1640以1:8的比例混合后,在每个小室上室加入90 μL(避免产生气泡),并放入孵箱中4~6 h,待其凝固后,将转染48 h的细胞消化计数,在上室加入200 μL细胞悬液(含1×105个细胞),其余步骤同迁移实验。
1.3 统计分析采用SPSS22.0软件进行统计学分析,Graph Pad 6软件绘制统计结果图。所有实验均进行3次重复,结果以x±s表示,两组间均数比较采取t检验,多组间数据比较采用单因素方差分析,其两两比较采用LSD-t法。重复数据测量采用重复测量方差分析。检验水准为α=0.05。
2 结果 2.1 PYCR1在结肠癌与癌旁组织中的表达通过RT-qPCR检验17对结肠癌病人的癌与癌旁组织中的PYCR1的表达,同癌旁组织相比,癌组织中的PYCR1的mRNA表达升高,差异具有统计学意义(P<0.05)。结果以2-△Ct表示。(图 1A)免疫组化结果显示,同癌旁组织(2.800±1.619)相比,癌组织中的PYCR1蛋白表达(4.953±1.083)明显升高,差异具有统计学意义(P<0.01)(图 1B)。

|
| A: PYCR1 mRNA表达量的比较; B:PYCR1蛋白表达的免疫组化观察 图 1 PYCR1结肠癌组织和癌旁组织中的表达差异 |
2.2 PYCR1在结肠癌细胞株中的表达
分别提取Lovo、SW480、HCT116、和Caco2结肠癌细胞株的mRNA和蛋白,RT-qPCR和Western blot验证PYCR1的表达情况。RT-qPCR结果显示,Lovo、SW480、HCT116、和Caco2的PYCR1 mRNA相对表达水平分别为(1.011±0.177)、(1.790±0.130)、(2.310± 0.217)和(1.226±0.177),差异具有统计学意义(P<0.001)。其中HCT116与SW480相对表达量最高(与Lovo、Caco2相比较,P<0.05)。Western blot结果显示,Lovo、SW480、HCT116和Caco2的PYCR1蛋白表达水平分别为(0.032±0.064)、(0.318±0.064)、(0.552±0.845)和(0.184±0.013),差异具有统计学意义(P<0.001)。与RT-qPCR结果相似,HCT116和SW480相对表达量最高(与Lovo、Caco2相比较,P<0.05)。故后续选择HCT116和SW480为实验对象(图 2)。
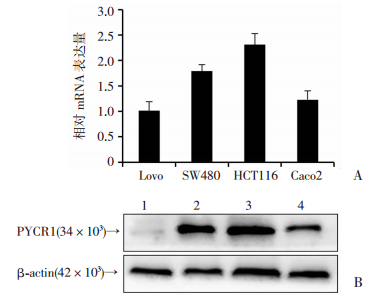
|
|
1: Lovo;2: SW480;3: HCT116;4: Caco2 A: mRNA相对表达量,B:蛋白表达结果 图 2 PYCR1在4种结肠癌细胞株中的表达差异 |
2.3 干扰质粒转染后HCT116和SW480细胞PYCR1的mRNA和蛋白表达
干扰质粒转染HCT116和SW480细胞48 h后,分别提取HCT116和SW480细胞的shPYCR1组和shPYCR1-vector组的总RNA和总蛋白进行RT-qPCR和Western blot的检测。结果显示,RT-qPCR检验HCT116和SW480细胞转染干扰质粒后,shPYCR1组的PYCR1 mRNA相对含量分别为(0.275±0.053)和(0.377±0.070),相比于shPYCR1-vector组的mRNA含量(1.021±0.398)和(1.023±0.277),PYCR1 mRNA表达水平被明显抑制,差异具有统计学意义(P<0.05)。而Western blot显示,shPYCR1组的PYCR1蛋白条带相对灰度值在HCT116和SW480细胞中分别为(0.174±0.070)和(0.214±0.074),相较于shPYCR1-vector组的相对灰度值(0.400±0.040)和(1.085±0.192),PYCR1蛋白表达水平被明显抑制,且差异具有统计学意义(P<0.01)。Western blot结果与RT-qPCR一致,说明干扰质粒成功转染了HCT116和SW480细胞,并且抑制了细胞中PYCR1的表达。(图 3)
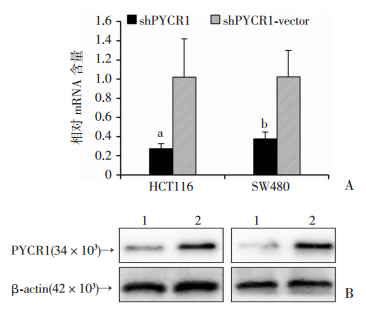
|
|
1: shPYCR1组;2: shPYCR1-vector组 a: P<0.01,b: P<0.05,与shPYCR1-vector组比较 A: mRNA相对表达量,B:蛋白表达结果 图 3 质粒转染后各组细胞PYCR1 mRNA和蛋白的表达 |
2.4 CCK8细胞增殖实验
干扰质粒转染HCT116和SW480细胞后,分别在0、24、48、72 h时检测shPYCR1组和shPYCR1-vetor组在450nm时的光密度值,绘制细胞增殖曲线。结果表明,shPYCR1组细胞增殖活力相对于shPYCR1-vector组受到了明显降低,差异具有统计学意义(P<0.001),说明干扰PYCR1表达能抑制HCT116和SW480细胞的增殖能力(图 4)。
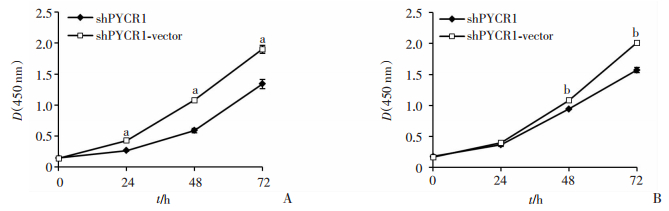
|
| a: P<0.001,b: P<0.001与shPYCR1-vector组比较 A: HCT116; B: SW480 图 4 CCK8实验检测PYCR1对细胞增殖能力的影响 |
2.5 克隆形成实验
克隆形成实验结果显示HCT116细胞shPYCR1组形成的克隆数量(173±7)个明显少于shPYCR1-vetor组(354±26)个,SW480细胞shPYCR1组形成的克隆数量(173±1)个明显少于shPYCR1-vetor组(248±11)个,差异具有统计学意义(P<0.001)。说明干扰PYCR1表达可抑制HCT116和SW480细胞的克隆形成能力(图 5)。
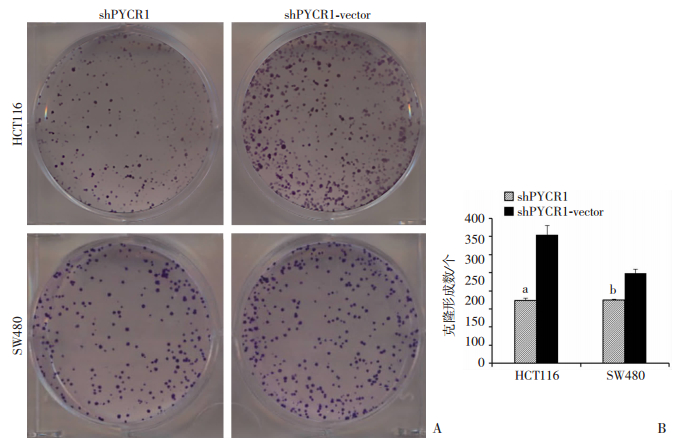
|
|
a: P<0.001, b: P<0.001,与shPYCR1-vector组比较 A:克隆形成试验结果;B:克隆形成数的比较 图 5 克隆形成实验检测PYCR1对细胞克隆形成能力的影响 |
2.6 Transwell实验
Transwell迁移实验:HCT116细胞shPYCR1组穿出细胞数量(152±22)个明显少于shPYCR1-vector组(444±48)个,SW480细胞shPYCR1组穿出细胞数量(229±34)个明显少于shPYCR1-vector组(326±30)个,差异具有统计学意义(P<0.01,P<0.05)。
Transwell侵袭实验:HCT116细胞shPYCR1组穿出细胞数量(110±41)个明显少于shPYCR1-vector组(259±18)个,SW480细胞shPYCR1组穿出细胞数量(163±31)个明显少于shPYCR1-vector组(279±36)个,差异具有统计学意义(P<0.01,P<0.05)。Transwell实验结果说明干扰PYCR1表达可抑制HCT116和SW480细胞的迁移和侵袭的能力(图 6)。

|
|
a: P<0.01,b:P<0.01,c:P<0.05,d:P<0.05与shPYCR1-vector组比较 A: HCT116Transwell实验结果;B: HCT116穿膜细胞数比较;C: SW480Transwell实验结果;D: SW480穿膜细胞数比较, 图 6 Transwell实验检测PYCR1对细胞迁移和侵袭能力的影响 |
2.7 干扰PYCR1表达对EMT相关蛋白的影响
通过前期细胞功能学实验,发现干扰PYCR1的表达会影响细胞的迁移侵袭的能力。进一步通过Western blot检测EMT标志物及下游蛋白,分析灰度值结果显示:相对于HCT116和SW480细胞shPYCR1-vetor组的E-cadherin(0.133±0.068、0.130±0.102)、N-cadherin(1.176±0.361、0.343±0.050)、Vimentin(0.430±0.089,0.445±0.044)、β-catenin(0.408±0.153,0.764±0.223),c-Myc(0.310±0.077,0.714±0.026)shPYCR1组的E-cadherin的蛋白表达量升高(0.473±0.156、0.481±0.153),N-cadherin的蛋白表达量下降(0.106±0.037、0.139±0.090),Vimentin (0.176±0.077,0.139±0.032),β-catenin(0.136±0.036, 0.215± 0.091)和c-Myc(0.094±0.052,0.418±0.067),差异具有统计学意义(P<0.05)(图 7)。
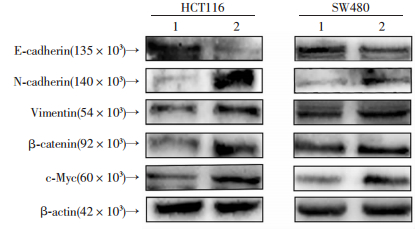
|
| 1: shPYCR1-2组; 2: shPYCR1-vector组 图 7 Western blot检测PYCR1对细胞EMT相关蛋白表达的影响 |
3 讨论
尽管目前肿瘤诊治已经有了一定的发展,但是由于结肠癌早期容易被忽视,所以在中国的死亡率正逐渐攀升[13]。结肠癌的治疗现如今主要是依靠手术和化疗,而之后的复发和转移使患者平均的总生存时间仅为24个月左右[14]。而分子靶向治疗相对于传统化疗药物来说特异性更强、副作用更小,但结肠癌的有效分子靶向药物仍然缺乏[15-16],故寻找新的有关肿瘤转移的分子靶点,可以为结肠癌患者的未来治疗提供方向。
PYCR1定位于线粒体,不仅参与氨基酸、能量代谢,而且还与细胞的氧化应激相关[17-19]。Cai[7]、Zeng[8]等报道在前列腺癌与非小细胞肺癌中,PYCR1与肿瘤的分化、转移、TMN分期等临床特征相关,并且高表达量的PYCR1提示肿瘤的不良预后。Ding[9]等发现敲减PYCR1能够增强乳腺癌细胞对化疗药物的敏感性。但是目前PYCR1与结肠癌关系的研究还未见明确报道。
故本实验首先利用RT-qPCR和免疫组化验证了PYCR1在结肠癌组织中呈高表达,后续在HCT116和SW480结肠癌细胞中转染干扰质粒后,通过CCK8和克隆形成实验验证了下调PYCR1表达后结肠癌细胞的增殖能力减弱,Transwell实验证明了敲低PYCR1会使结肠癌细胞迁移侵袭能力受到影响。E-cadherin的缺失被认为是EMT的开始的重要标志[20], EMT除了相关标志物N-cadherin、Vimentin、Snail、ZNB1等参与外,还受到多种信号通路的影响,经典的Wnt/β-catenin通路就是其中一种[10]。当β-catenin无法磷酸化而在细胞内蓄积并进入细胞核,与TCF/LEF作用激活下游靶基因,如c-Myc,进而促进EMT的发生[21]。因此后续Western blot检测EMT标志物,结果显示E-cadherin表达升高,N-cadherin、Vimentin表达下降,表示干扰PYCR1可抑制肿瘤细胞EMT过程。β-catenin以及其下游靶基因c-Myc表达量的下降,表明PYCR1可能通过Wnt/β-catenin通路抑制EMT从而影响结肠癌细胞的迁移侵袭能力,但PYCR1具体以何种机制影响β-catenin还有待进一步研究。
综上所述,敲减PYCR1的表达,可以抑制结肠癌细胞的增殖、迁移和侵袭的能力,提示PYCR1在肿瘤的发展中可能起着促癌基因的作用,为后续结肠癌的临床治疗提供新的潜在治疗靶点。
| [1] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7-30. DOI:10.3322/caac.21387 |
| [2] |
SIEGEL R L, MILLER K D, FEDEWA S A, et al. Colorectal cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67(3): 177-193. DOI:10.3322/caac.21395 |
| [3] |
VU T, DATTA P K. Regulation of EMT in colorectal cancer: A culprit in metastasis[J]. Cancers (Basel), 2017, 9(12): E171. DOI:10.3390/cancers9120171 |
| [4] |
DE INGENIIS J, RATNIKOV B, RICHARDSON A D, et al. Functional specialization in proline biosynthesis of melanoma[J]. PLoS One, 2012, 7(9): e45190. DOI:10.1371/journal.pone.0045190 |
| [5] |
RAHMATI M, YAZDANPARAST M, JAHANSHAHI K, et al. Congenital cutis laxa type 2 associated with recurrent aspiration pneumonia and growth delay: case report[J]. Electron Physician, 2015, 7(6): 1391-1393. DOI:10.14661/1391 |
| [6] |
NILSSON R, JAIN M, MADHUSUDHAN N, et al. Metabolic enzyme expression highlights a key role for MTHFD2 and the mitochondrial folate pathway in cancer[J]. Nat Commun, 2014, 5: 3128. DOI:10.1038/ncomms4128 |
| [7] |
CAI F, MIAO Y Y, LIU C Y, et al. Pyrroline-5-carboxylate reductase 1 promotes proliferation and inhibits apoptosis in non-small cell lung cancer[J]. Oncol Lett, 2018, 15(1): 731-740. DOI:10.3892/ol.2017.7400 |
| [8] |
ZENG T Y, ZHU L B, LIAO M, et al. Knockdown of PYCR1 inhibits cell proliferation and colony formation via cell cycle arrest and apoptosis in prostate cancer[J]. Med Oncol, 2017, 34(2): 27. DOI:10.1007/s12032-016-0870-5 |
| [9] |
DING J F, KUO M L, SU L L, et al. Human mitochondrial pyrroline-5-carboxylate reductase 1 promotes invasiveness and impacts survival in breast cancers[J]. Carcinogenesis, 2017, 38(5): 519-531. DOI:10.1093/carcin/bgx022 |
| [10] |
GURZU S, SILVEANU C, FETYKO A, et al. Systematic review of the old and new concepts in the epithelial-mesenchymal transition of colorectal cancer[J]. World J Gastroenterol, 2016, 22(30): 6764-6775. DOI:10.3748/wjg.v22.i30.6764 |
| [11] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [12] |
ROKITA M, STEC R, BODNAR L, et al. Overexpression of epidermal growth factor receptor as a prognostic factor in colorectal cancer on the basis of the Allred scoring system[J]. OTT, 2013, 967. DOI:10.2147/ott.s42446 |
| [13] |
CHENG J, DENG R, ZHANG P, et al. MiR-219-5p plays a tumor suppressive role in colon cancer by targeting oncogene Sall4[J]. Oncol Rep, 2015, 34(4): 1923-1932. DOI:10.3892/or.2015.4168 |
| [14] |
PRENEN H, VECCHIONE L, VAN CUTSEM E. Role of targeted agents in metastatic colorectal cancer[J]. Target Oncol, 2013, 8(2): 83-96. DOI:10.1007/s11523-013-0281-x |
| [15] |
ZHANG Z F, BU X L, CHEN H, et al. Bmi-1 promotes the invasion and migration of colon cancer stem cells through the downregulation of E-cadherin[J]. Int J Mol Med, 2016, 38(4): 1199-1207. DOI:10.3892/ijmm.2016.2730 |
| [16] |
XING X K, WU H Y, CHEN H L, et al. NDC80 promotes proliferation and metastasis of colon cancer cells[J]. Genet Mol Res, 2016, 15(2). DOI:10.4238/gmr.15028312 |
| [17] |
CHRISTENSEN E M, PATEL S M, KORASICK D A, et al. Resolving the cofactor-binding site in the proline biosynthetic enzyme human pyrroline-5-carboxylate reductase 1[J]. J Biol Chem, 2017, 292(17): 7233-7243. DOI:10.1074/jbc.M117.780288 |
| [18] |
KUO M L, LEE M B, TANG M, et al. PYCR1 and PYCR2 interact and collaborate with RRM2B to protect cells from overt oxidative stress[J]. Sci Rep, 2016, 6: 18846. DOI:10.1038/srep18846 |
| [19] |
HOLLINSHEAD K E R, MUNFORD H, EALES K L, et al. Oncogenic IDH1 mutations promote enhanced proline synthesis through PYCR1 to support the maintenance of mitochondrial redox homeostasis[J]. Cell Rep, 2018, 22(12): 3107-3114. DOI:10.1016/j.celrep.2018.02.084 |
| [20] |
YANG S C, LIU Y, LI M Y, et al. FOXP3 promotes tumor growth and metastasis by activating Wnt/β-catenin signaling pathway and EMT in non-small cell lung cancer[J]. Mol Cancer, 2017, 16(1): 124. DOI:10.1186/s12943-017-0700-1 |
| [21] |
XIAO C, WU C H, HU H Z. LncRNA UCA1 promotes epithelial-mesenchymal transition (EMT) of breast cancer cells via enhancing Wnt/beta-catenin signaling pathway[J]. Eur Rev Med Pharmacol Sci, 2016, 20(13): 2819-2824. |



