2. 710000 西安,空军军医大学西京医院核医学科
2. Department of Nuclear Medicine, Xijing Hospital, Air Force Medical University (Fourth Military Medical University), Xi'an, Shaanxi Province, 710000, China
棕色脂肪组织与白色脂肪共同组成脂肪器官,主要功能是维持小型哺乳动物和新生儿的核心温度[1]。最初人们认为棕色脂肪组织只存在于新生儿体内,但是18F-FDG PET/CT证实棕色脂肪组织不仅存在于成人体内,并且代谢活跃[2]。最新研究发现棕色脂肪组织的功能状态与2型糖尿病、肥胖、动脉粥样硬化的发生密切相关[3-5],是治疗肥胖及糖尿病的新靶点[6]。棕色脂肪组织常规影像学检测包括超声和磁共振,功能成像包括红外时间分辨光谱、红外热成像、SPECT/CT、PET/CT等[7],其中18F-FDG PET/CT目前是棕色脂肪组织检测的“金标准”[8]。PET成像原理是放射核素发射出的正电子与负电子结合发生湮灭辐射产生两个能量相等方向相反的γ光子被探测器所接受。同样,当放射性核素发出的正电子在非真空透明的介质中穿行,其速度大于光速时发出电磁辐射被光学设备探测到,则形成了切伦科夫光学成像(Cerenkov luminescence imaging, CLI)。切伦科夫光学成像具有时间短、探针无毒、成本低等特点,在肿瘤检测及外科手术导航等方面拥有巨大的应用潜力,但CLI是否能够用于评估棕色脂肪组织代谢活性(受限于动物模型:正常小鼠寿命32个月,棕色脂肪组织活性减退缓慢、程度不一)目前尚未明确。
早衰症小鼠模型可以模拟人类早老症,主要由Lmna基因突变引起衰老,被广泛应用于衰老的研究中[9]。LmnaG609G/G609G小鼠是一种常用的早衰小鼠模型,据报道其多个器官例如皮肤、肝脏和肾脏均会出现提前衰老,但也有研究发现在microRNA-9作用下,早衰小鼠中枢神经系统并未出现认知功能的减退[10]。因此,早衰小鼠的衰老存在一定的器官差异性。早衰模型小鼠的棕色脂肪组织功能是否会出现早衰,棕色脂肪组织老化的时间节点是多少尚未明确。
针对以上两个问题,本实验以18F-FDG PET/CT为参照指标,使用切伦科夫光学成像动态监测早衰小鼠模型棕色脂肪组织代谢活性的变化,评估棕色脂肪组织的代谢活性,通过检测早衰小鼠棕色脂肪组织活性分子标志物(uncoupling protein 1,UCP1)评估棕色脂肪组织衰老情况,为棕色脂肪组织的研究提供理想的衰老模型以及新的可视化研究方法。
1 材料与方法 1.1 早衰小鼠的鉴定及小动物PET/CT成像由杂合子小鼠交配后可生出早衰小鼠,小鼠出生后经剪尾,提取DNA,PCR鉴定得到纯合子早衰小鼠。选取雄性早衰小鼠进行实验,实验遵守空军军医大学专业委员会动物保护与利用的相关规定。鉴于早衰小鼠4周龄时开始出现衰老,故从4周龄开始图像采集,每隔1周进行一次小动物PET/CT显像。小鼠禁食不禁水,冷刺激(4 ℃)4 h后,将200~300 μCi 18F-FDG(1 Ci=3.7×1010 Bq,150 μL生理盐水体系)经尾静脉注射到小鼠体内,继续冷刺激1 h,然后用小型动物PET/CT系统(Mediso,美国)进行扫描。异氟烷气体诱导麻醉后转移到检测床上,头部置于锥形面罩中,以1.5 L/min的流速输送异氟醚(2%)。在小鼠下方放置电热垫,利用小动物PET/CT系统提供的电热垫维持体温。小鼠先进行定位采集,随后进行600 s的PET数据采集。PET/CT图像采用Nucline nanoScan软件进行处理和分析。在每只小鼠的PET图像上,仔细绘制感兴趣的三维(3D)区域。示踪剂摄取的量化标准为最大摄入值(SUVmax),按公式计算SUVmax。
SUVmax=组织最大活度(Bq/mL)/注射剂量(Bq)×体质量(g)
1.2 小动物切伦科夫光学成像小鼠准备与PET/CT成像相同,冷刺激4 h后将500 μCi18F-FDG(150 μL生理盐水)经尾静脉注射到小鼠体内,小鼠在寒冷中再待1 h。CLI图像由体内成像系统(型号:IVIS Kinetic,Caliper Life Sciences,美国)采集获取,光学采集时间为180 s,将获得的图像与白光图像融合,在光学图像勾画感兴趣区域(region of interest, ROI),使用Living Image 3.2软件(IVIS dynamics,Caliper Life Sciences)计算Radiances值,计算方法与文献[11]一致。
1.3 棕色脂肪组织UCP1 mRNA及蛋白水平检测小鼠处死后,提取棕色脂肪组织总RNA,根据RNA KitⅠ试剂盒(Omega Bio-Tek,美国)说明书进行操作,以总RNA为模板使用Prime ScriptTM RT Master Mix (TaKaRa,中国)逆转录合成cDNA。PCR引物为TaKaRa公司合成,β-actin引物上游:5′-GTGACGTTGACATCCGTAAAGA-3′,下游:5′-GTAACAGTCCGCCTAGAAGCAC-3′;UCP-1引物上游:5′-ACAGTAAATGGCAGGGGACG-3′,下游:5′-CACGG- GGACCTACAATGCTT-3′。使用SYBR® Premix Ex Taq Ⅱ polymerase (TaKaRa)进行实时荧光PCR检测,反应条件如下:预热94 ℃(30 s),变性94 ℃(10 s), 退火60 ℃ (30 s)和伸长72 ℃ (20 s)共40个循环周期,以β-actin mRNA为参照进行分析。
小鼠处死后,取棕色脂肪组织,提取总蛋白,使用BCA定量法确定蛋白浓度,配制凝胶(碧云天),胶孔内加入蛋白(30~40 μg),随后电泳转NC膜,采用半干转膜法转膜(20 V,25 min),将NC膜放入封闭缓冲液封闭1.5~2 h,加入稀释后的UCP1(1 :1 000 Cell Signaling Technology, 美国)抗体,4 ℃封闭旋转振荡过夜。TBST清洗(3 min 5次),加入二抗,4 ℃ 2 h, 再次TBST清洗(3 min 5次),最后ECL发光。
1.4 棕色脂肪组织HE染色及UCP1组化分析10%福尔马林固定棕色脂肪组织,使用苏木精-伊红(hematoxylin eosin,HE)染色。取部分切片进行UCP1免疫组化检测:福尔马林固定石蜡包埋的组织块连续切成3 mm厚的切片,在二甲苯中脱蜡,乙醇溶液,PBS清洗3次后,在0.01 mol/L柠檬酸缓冲液中修复抗原。通过与正常牛血清预孵育30 min阻断非特异性结合位点。将切片在PBS中洗涤3次,每次5 min。将这些组织切片与抗-UCP1抗体(1 :50,Cell Signaling Technology)一起孵育,接着与含辣根过氧化物酶的抗兔IgG(1 :1 000,EarthOx)一起孵育。使用3, 3-二氨基联苯胺四盐酸盐(上海生工)显现阳性细胞,并用苏木精复染色。使用Image-Pro Plus 6.0软件进行免疫染色的定量分析。每个切片从阳性区域(400×物镜)中选择3个视野,并且检查来自不同动物的5个切片。测量每个视野和感兴趣区域(AOI)中所有阳性染色的积分光密度(IOD)。IOD用于评估阳性染色的面积和强度。以平均光密度(mean density,MD)代表每单位面积特定蛋白质的浓度。
MD=IOD/AOI
1.5 统计学分析采用GraphPad Prism 5软件进行统计学分析,数据以x±s表示,组内比较采用单因素方差分析,两两比较采用Student’s t检验,实验重复3次。P < 0.05表示差异有统计学意义。
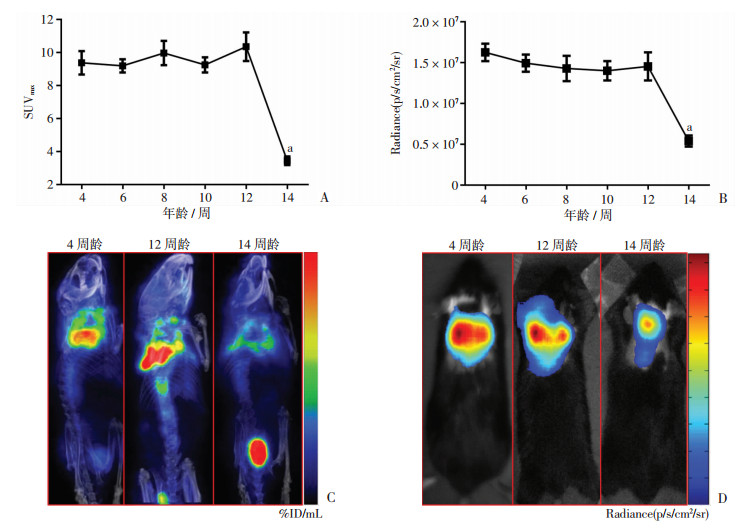
2 结果 2.1 小鼠棕色脂肪组织PET/CT成像及切伦科夫光学成像使用小动物PET/CT动态监测早衰小鼠棕色脂肪组织(图 1A、C)。4~12周龄时,早衰小鼠棕色脂肪组织SUVmax未发生变化(P>0.05),14周龄时早衰小鼠棕色脂肪组织SUVmax较12周龄显著降低(P < 0.01),说明衰老小鼠棕色脂肪组织代谢活性在14周龄时下降。同样,切伦科夫光学显像结果(图 1B、D)可见:早衰小鼠4~12周龄棕色脂肪组织切伦科夫光强度值未发生变化(P>0.05),而14周龄时切伦科夫光强度值较12周龄显著下降(P < 0.01),说明切伦科夫光学成像能够准确评估小鼠棕色脂肪组织代谢活性,并且与PET/CT显像结果一致。
|
|
A:早衰小鼠脂肪组织SUVmax动态变化 a:P < 0.01,与12周龄比较;B:早衰小鼠脂肪组织切伦科夫光学定量动态变化 a:P < 0.01,与12周龄比较;C:早衰小鼠小动物PET/CT显像;D:早衰小鼠棕色脂肪组织切伦科夫光学显像 图 1 不同周龄早衰小鼠小动物PET/CT显像、切伦科夫光学成像及定量分析 |
2.2 早衰小鼠棕色脂肪组织UCP1 mRNA和蛋白表达
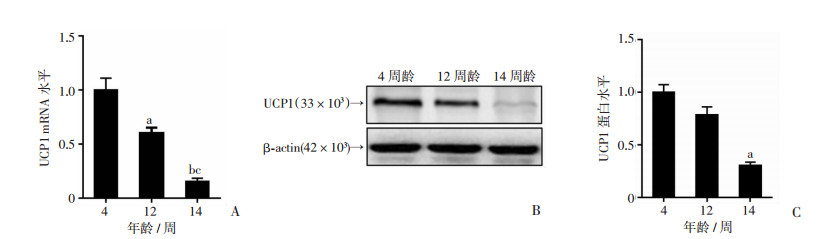
分别检测4、12、14周龄时棕色脂肪组织代谢活性分子标志物UCP1的mRNA和蛋白水平。结果发现,早衰小鼠棕色脂肪组织UCP1的mRNA水平在12周龄时较4周龄下降(P < 0.05),14周龄时较12周龄进一步下降(P < 0.01,图 2A);UCP1蛋白水平在12周龄时较4周龄有所下降,但差异无统计学意义(P>0.05),14周龄时较12周龄明显下降(P < 0.01,图 2B、C)。表明UCP1蛋白水平在14周龄下降,与棕色脂肪组织代谢活性显像结果一致,并且UCP1的转录水平先于蛋白水平下调。
|
| A:UCP1 mRNA水平检测 a:P < 0.05, b:P < 0.01,与4周龄比较;c:P < 0.05,与12周龄比较;B:UCP1蛋白水平Western blot检测;C:UCP1蛋白半定量分析 a:P < 0.01, 与12周龄比较 图 2 不同周龄早衰小鼠棕色脂肪组织UCP1 mRNA和蛋白水平 |
2.3 早衰小鼠棕色脂肪组织HE染色、UCP1免疫组化及体质量变化
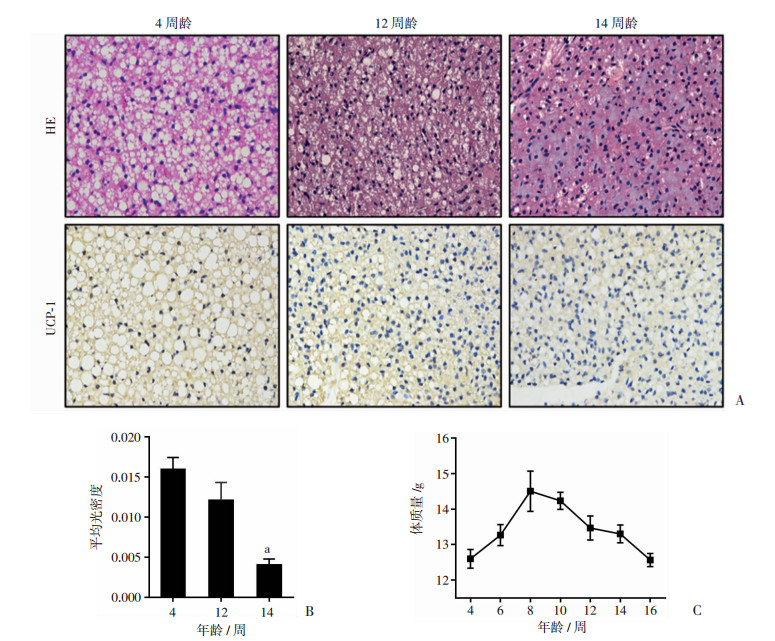
免疫组化检测结果发现,UCP1的蛋白水平12周龄时较4周龄时稍减少(P>0.05), 而14周龄时较12周龄明显下降(P < 0.05,图 3B), 与Western blot结果一致。HE染色结果(图 3A)显示,4周龄时小鼠棕色脂肪组织内脂滴较多,镜下视野内细胞数目较少,而12、14周龄时棕色脂肪组织内脂滴较4周时减少,视野下可见细胞数目增多。造成这种变化的主要原因是早衰小鼠随着年龄增长而体质量降低,体内脂肪减少。动态监测小鼠体质量变化见图 3C,自第8周开始小鼠体质量逐渐下降。
|
| A:HE及UCP1免疫组化染色观察早衰小鼠棕色脂肪组织(×400);B:棕色脂肪组织UCP1免疫组化半定量分析 a:P < 0.05, 与12周龄比较;C:小鼠体质量随着年龄增长的动态变化 图 3 不同周龄早衰小鼠棕色脂肪组织HE染色、UCP1免疫组化及体质量变化 |
3 讨论
本研究对早衰小鼠棕色脂肪组织进行了18F-FDG PET/CT显像与切伦科夫光学成像观察,并检测了棕色脂肪组织功能相关分子标志物UCP1的表达水平。研究发现:首先,早衰小鼠棕色脂肪组织中UCP1转录水平在12周龄开始下降,而UCP1的蛋白水平在14周龄时下降,说明早衰小鼠棕色脂肪组织14周龄时出现代谢活性的减退。其次,14周龄时早衰小鼠棕色脂肪组织UCP1表达水平下调、棕色脂肪组织代谢活性下降,导致脂肪组织18F-FDG代谢降低约2/3,继而切伦科夫光学成像光学定量值及PET/CT显像SUVmax值均下降,最终证实切伦科夫光学成像与PET/CT显像一样能够准确反应小鼠棕色脂肪组织代谢活性的变化。
本研究发现早衰小鼠在第14周时棕色脂肪组织出现功能减退。早衰小鼠衰老机制是Lmna基因的1 824位点发生点突变,导致在编码的蛋白质中胞嘧啶变为胸腺嘧啶。这种突变会造成异常剪接位点,产生截断蛋白(progerin),缺少607~656碱基的prelamin A截断蛋白仍保留c端CAAX盒。早衰蛋白不能脱离核膜,最终破坏核膜的结构和功能细胞核,使小鼠表现出了一个加速的衰老过程[12]。本研究通过蛋白水平检测证实早衰小鼠棕色脂肪代谢活性减退是由于分子标志物UCP1表达量减少,与正常小鼠棕色脂肪组织的衰老表现一致;此外,还发现早衰小鼠UCP1的mRNA水平于12周下降,先于UCP1蛋白水平。可能是因为UCP1的表达水平的调控主要在mRNA水平[13]。因此,早衰小鼠从机制上能够模拟正常小鼠棕色脂肪组织衰老;既往研究也证实progerin参与正常的衰老过程[14]。因此,我们认为早衰小鼠能够部分模拟正常小鼠棕色脂肪组织的衰老,以早衰小鼠为棕色脂肪组织衰老的研究模型可以克服正常小鼠衰老周期长(32个月),衰老程度不一致等困难。
本研究分别使用了PET/CT显像及切伦科夫光学成像检测早衰小鼠棕色脂肪组织的代谢活性,结果显示早衰小鼠14周龄时,由于棕色脂肪组织功能的减退,18F-FDG代谢降低,导致棕色脂肪组织的SUVmax下降以及切伦科夫光信号减弱。目前,18F-FDG PET/CT显像已经作为棕色脂肪组织活性评估的金标准,广泛应用于基础及临床研究[15-16]。本研究结果证实切伦科夫光学成像结果与PET成像结果一致,也可以用来评估棕色脂肪组织功能。PET和切伦科夫光学成像可以用于褐色脂肪功能的研究,两者具有各自的优点和缺点。显像前准备:由于切伦科夫光较弱,无法穿透黑色鼠毛,切伦科夫光学成像前小鼠通常需要备皮处理,而γ光子穿透能力强。因此,PET/CT显像前不需要特殊准备;显像效果方面:PET成像重建后的图像分辨率达到2 mm,比切伦科夫光学成像更加清晰,并且定量分析较切伦科夫光学成像精确,能够更加准确的反映棕色脂肪组织代谢活性;但在经济及显像速度方面切伦科夫光学成像有着显著的优势:切伦科夫成像速度较PET快、操作简单,采集时间只有180 s,而PET/CT采集时间需要20 min左右;切伦科夫光学成像系统设备价格(不到5万美金)远低于micro PET/CT(超100万美金),大多数科研单位均可负担起。综上所述,切伦科夫光学成像可作为micro PET/CT的替代,评估棕色脂肪组织的代谢活性,并能进行简单的定量分析。
18F-FDG PET/CT显像及切伦科夫光学成像对棕色脂肪组织代谢活性的评估主要基于UCP1的表达水平,然而影响棕色脂肪组织细胞摄取18F-FDG还有其他诸多因素。这也是本研究的局限性,早衰小鼠棕色脂肪组织功能的减退可能不是导致棕色脂肪组织18F-FDG摄取减少的唯一原因。早衰症引起的其他病理改变也可能影响棕色脂肪组织对18F-FDG的摄取。例如,progerin蛋白具有细胞毒性作用,可诱导线粒体损伤[17],以及早衰小鼠可能出现心率减慢和低血糖,这些变化均可能影响18F-FDG的摄取。
棕色脂肪组织是重要的能量代谢器官,为了全面评估棕色脂肪组织代谢活性,除了18F-FDG反映棕色脂肪组织糖代谢,可能需要更多的示踪剂,例如18F-FTHA是基于脂肪酸的示踪剂反映棕色脂肪组织的脂肪代谢[18],11C-Acetate则能够有效评估棕色脂肪组织的氧化代谢,这些显像剂都可以进行切伦科夫光学显像。早衰小鼠、切伦科夫光学显像为研究棕色脂肪组织提供了理想的衰老模型和检测方法。
| [1] |
GESTA S, TSENG Y H, KAHN C R. Developmental origin of fat: tracking obesity to its source[J]. Cell, 2007, 131(2): 242-256. DOI:10.1016/j.cell.2007.10.004 |
| [2] |
MARTINEZ-TELLEZ B, SANCHEZ-DELGADO G, BOON M R, et al. Distribution of brown adipose tissue radiodensity in young adults: implications for cold[18F]FDG-PET/CT analyses[J]. Mol Imaging Biol, 2019.[Epub ahead of print]. DOI: 10.1007/s11307-019-01381-y.
|
| [3] |
KOKSHAROVA E, USTYUZHANIN D, PHILIPPOV Y, et al. The relationship between brown adipose tissue content in supraclavicular fat depots and insulin sensitivity in patients with type 2 diabetes mellitus and prediabetes[J]. Diabetes Technol Ther, 2017, 19(2): 96-102. DOI:10.1089/dia.2016.0360 |
| [4] |
HOEKE G, KOOIJMAN S, BOON M R, et al. Role of brown fat in lipoprotein metabolism and atherosclerosis[J]. Circ Res, 2016, 118(1): 173-182. DOI:10.1161/CIRCRESAHA.115.306647 |
| [5] |
SUN J J, ZHANG L P, SUN R C, et al. Exploring the influence of resiliency on physician trust in patients: An empirical study of Chinese incidents[J]. PLoS ONE, 2018, 13(12): e0207394. DOI:10.1371/journal.pone.0207394 |
| [6] |
COHEN P, SPIEGELMAN B M. Cell biology of fatstorage[J]. Mol Biol Cell, 2016, 27(16): 2523-2527. DOI:10.1091/mbc.e15-10-0749 |
| [7] |
SUN L, YAN J, SUN L, et al. A synopsis of brown adipose tissue imaging modalities for clinical research[J]. Diabetes Metab, 2017, 43(5): 401-410. DOI:10.1016/j.diabet.2017.03.008 |
| [8] |
CRANDALL J P, JOO H O, GAJWANI P, et al. Measurement of brown adipose tissue activity using microwave radiometry and 18F-FDG PET/CT[J]. J Nucl Med, 2018, 59(8): 1243-1248. DOI:10.2967/jnumed.117.204339 |
| [9] |
ZHANG H Y, XIONG Z M, CAO K. Mechanisms controlling the smooth muscle cell death in progeria via down-regulation of poly(ADP-ribose) polymerase 1[J]. Proc Natl Acad Sci USA, 2014, 111(22): E2261-E2270. DOI:10.1073/pnas.1320843111 |
| [10] |
JUNG H J, COFFINIER C, CHOE Y, et al. Regulation of prelamin A but not lamin C by miR-9, a brain-specific microRNA[J]. Proc Natl Acad Sci USA, 2012, 109(7): E423-E431. DOI:10.1073/pnas.1111780109 |
| [11] |
GAO Y H, MA X W, KANG F, et al. Enhanced Cerenkov luminescence tomography analysis based on Y2O3: Eu3+ rare earth oxide nanoparticles[J]. Biomed Opt Express, 2018, 9(12): 6091-6102. DOI:10.1364/BOE.9.006091 |
| [12] |
LÓPEZ-OTÍN C, BLASCO M A, PARTRIDGE L, et al. The hallmarks of aging[J]. Cell, 2013, 153(6): 1194-1217. DOI:10.1016/j.cell.2013.05.039 |
| [13] |
KISSIG M, SHAPIRA S N, SEALE P. SnapShot: brown and beige adipose the rmogenesis[J]. Cell, 2016, 166(1): 258-258.e1. DOI:10.1016/j.cell.2016.06.038 |
| [14] |
SOLA-CARVAJAL A, REVÊCHON G, HELGADOTTIR H T, et al. Accumulation of progerin affects the symmetry of cell division and is associated with impaired Wnt signaling and the mislocalization of nuclear envelope proteins[J]. J Invest Dermatol, 2019.[Epub ahead of print]. DOI: 10.1016/j.jid.2019.05.005.
|
| [15] |
CYPESS A M, HAFT C R, LAUGHLIN M R, et al. Brown fat in humans: consensus points and experimental guidelines[J]. Cell Metab, 2014, 20(3): 408-415. DOI:10.1016/j.cmet.2014.07.025 |
| [16] |
KIM K, HUANG S, FLETCHER L A, et al. Whole body and regional quantification of active human brown adipose tissue using 18F-FDG PET/CT[J]. J Vis Exp, 2019(146): e58469. DOI:10.3791/58469 |
| [17] |
XIONG Z M, CHOI J Y, WANG K, et al. Methylene blue alleviates nuclear and mitochondrial abnormalities inprogeria[J]. Aging Cell, 2016, 15(2): 279-290. DOI:10.1111/acel.12434 |
| [18] |
ZHANG F, HAO G Y, SHAO M L, et al. An adipose tissue atlas: an image-guided identification of human-like BAT and beige depots in rodents[J]. Cell Metab, 2018, 27(1): 252-262.e3. DOI:10.1016/j.cmet.2017.12.004 |



