乳腺癌日益成为威胁女性健康的首位恶性肿瘤[1-2]。虽然早期乳腺癌的治疗取得很大的进展,不同分子分型下的乳腺癌治疗也取得不错的效果,但是乳腺癌的复发、耐药和转移仍然是目前医学界的难题,晚期乳腺癌目前尚无确切的有效治疗方法[3-5]。因此,有待进一步探索乳腺癌进展的机制。
近年来关于驱动蛋白家族在肿瘤中的研究越来越多[6-8]。微管驱动蛋白是一类具有水解ATPase活性的马达蛋白,在微管的动态变化和胞内物质运输中有着重要的作用,参与细胞的许多生物学功能,如纺锤体形成、染色体分离、细胞分裂、微管的聚合与解聚等。既往大多偏向于对驱动蛋白Eg5(KIF11)、MCAK(KIF2C)的研究[9]。驱动蛋白KIF18B是一种在细胞分裂过程中促进星体微管解聚的马达蛋白,属于kinesin-8家族中的一员。研究表明驱动蛋白KIF18B可能是一个促癌基因并促进宫颈癌的发展[10-11]。虽然也有少量其他驱动蛋白在乳腺癌中的研究[12-15],但驱动蛋白KIF18B在乳腺癌中的作用及其对乳腺癌患者的临床意义目前尚不清楚。因此,本研究检测驱动蛋白KIF18B在雌激素受体阳性(estrogen receptor positive, ER+)乳腺癌细胞和ER+乳腺癌组织中的表达,探讨其对乳腺癌细胞增殖、凋亡等生物学功能的影响及其对ER+乳腺癌患者预后的意义,希望能为ER+乳腺癌的治疗和研究提供新的方向。
1 材料与方法 1.1 材料 1.1.1 乳腺癌细胞株细胞株(MCF-7、MCF10A、T47D、YCCB1、ZR-75-1、SK-BR-3)由重庆医科大学附属第一医院分子肿瘤与表观遗传学重庆市重点实验室提供。
1.1.2 乳腺癌组织收集2016-2017年共20对配对的乳腺癌组织和癌旁组织,由重庆医科大学附属第一医院分子肿瘤与表观遗传学重庆市重点实验室组织标本库提供,乳腺癌组织均为ER+乳腺癌组织,病理分期为pT2或pT3,患者年龄45~60岁,临床标本的获取均得到患者及其家属的知情同意。
1.1.3 主要试剂及仪器胎牛血清和RPMI1640培养基购自美国Gibco公司;Lipofectamine 2000购自美国Invitrogen公司;蛋白抽提、定量、凝胶配制试剂盒和ECL化学发光试剂盒购自江苏碧云天生物技术研究所。siRNA由Origene公司提供合成干扰序列:5′-AGCUUUAUUGCUUAACUCUAUUGTA-3′;对照序列:5′-CACUAGCCAGUAGCACCUCT-3′。PCR引物由华大基因公司合成提供,多克隆KIF18B兔抗体(HPA027381)和β-actin兔单抗(SAB2701711)购自Sigma公司。
1.2 方法 1.2.1 RT-qPCR检测驱动蛋白KIF18B的mRNA水平分别提取各组细胞和组织总RNA,测定样本浓度,并采用逆转录试剂盒将2 μL RNA转录为20 μL cDNA,并作为后续PCR的模板。设计KIF18B、β-actin引物如下:KIF18B正义链5′- TGCAAGTAGTGGTACG-GGTG-3′,反义链:5′-ACACTGAGCAGTTGTAGCCC-3′;β-actin正义链5′-GCGGGAAATCGTGCGTGAC-3′,反义链:5′-CGTCATACTCCTGCTTGCTG-3′。按下述反应体系制备反应混合物:SYBR Green通用型qPCR Mix 10 μL,前后引物各2 μL,cDNA 1 μL,补双蒸水至总体积20 μL。按下列条件进行:预变性95 ℃,5 min;变性95 ℃,30 s;退火延伸60 ℃,1 min;40个循环重复。最后从RT-qPCR仪上直接读取Ct值, 按照2-ΔΔCt法进行相对定量分析。
1.2.2 Western blot检测siRNA转染后干扰效果分别提取各组细胞总蛋白,测定蛋白浓度,蛋白上样量为20 μg,然后进行电泳、转膜、封闭、一抗4 ℃孵育过夜、二抗孵育1 h, 最后用ECL发光试剂盒曝光显色。KIF18B、β-actin一抗稀释浓度为1 :1 000,二抗稀释浓度为1 :5 000。印迹条带用Image Lab软件进行灰度值分析。
1.2.3 siRNA转染细胞置于含10%胎牛血清的RPMI1640培养基中培养,细胞长满孔底面积70%左右用Lipfectamine 2000转染siRNA终浓度为30 nmol/L,对照组转染NC-siRNA,转染液混匀后放入CO2培养箱中孵育4~6 h, 然后换正常培养基培养48~72 h后进行后续的RNA、蛋白表达检测及其他功能实验。
1.2.4 CCK-8实验检测siRNA转染后乳腺癌细胞的增殖细胞转染前1 d按3×103个/孔在96孔板中铺板,每组设3~5个复孔,待细胞融合度达70%时分别转染siRNA(si-KIF18B组)和对照NC-siRNA(si-NC组),继续培养24、48、72 h,每孔加入100 μL用培养液稀释到10%的CCK-8显色,避光孵育30 min后用酶标仪测定波长450 nm处的光密度值[D(450)]。
1.2.5 流式细胞仪检测siRNA转染后乳腺癌细胞的凋亡细胞转染siRNA 72 h后收集细胞,采用FITC- Annexin V/PI双染法,流式细胞仪检测细胞凋亡。
1.3 统计学处理应用GraphPad Prism 5.0软件,数据以x±s表示, 两组间样本比较采用t检验,多组间比较采用方差分析。Kaplan-Meier生存分析按kmplot.com在线分析系统要求进行。检验水准:α=0.05。
2 结果 2.1 驱动蛋白KIF18B在ER+乳腺癌中的表达采用RT-qPCR检测各ER+乳腺癌细胞系驱动蛋白KIF18B表达情况,各ER+乳腺癌细胞系均高表达KIF18B mRNA,与MCF10A比较,差异有统计学意义(P < 0.05,图 1A)。并对ER+乳腺癌组织和癌旁组织KIF18B的表达水平进行检测,ER+乳腺癌组织mRNA表达显著高于癌旁组织(P < 0.01,图 1B)。
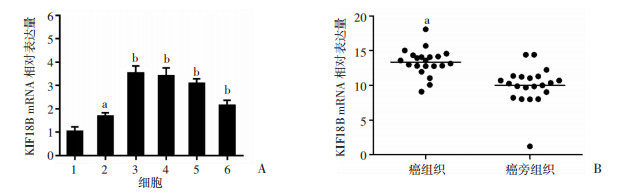
|
| A:RT-qPCR检测不同ER+人乳腺癌细胞系KIF18B mRNA水平 1: MCF10A; 2: MCF-7; 3: YCCB1; 4: T47D; 5: SK-BR-3; 6: ZR-75-1; a:P < 0.05,b: P < 0.01,与MCF10A比较;B:RT-qPCR检测各ER+人乳腺癌组织和癌旁组织KIF18B mRNA表达水平 a: P < 0.01,与癌旁组织比较 图 1 驱动蛋白KIF18B在ER+乳腺癌细胞及乳腺癌组织中的表达水平 |
2.2 siRNA干后对ER+乳腺癌细表达驱动蛋白KIF18B影响
RT-qPCR及Western blot检测结果显示,siRNA干扰后能显著降低KIF18B的RNA和蛋白表达(P < 0.05,图 2),说明干扰成功。
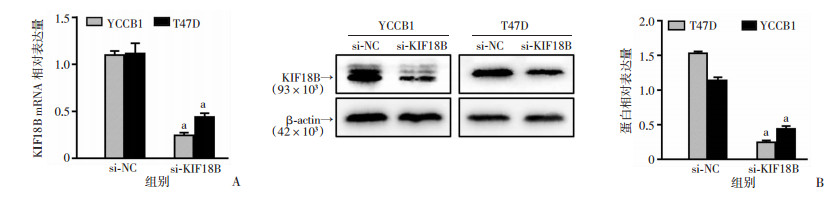
|
|
a: P < 0.001,与si-NC组比较 A:siRNA敲低驱动蛋白KIF18B后mRNA表达水平;B:Western blot检测siRNA敲低驱动蛋白KIF18B后蛋白表达及半定量分析 图 2 siRNA干扰驱动蛋白KIF18B后表达水平 |
2.3 siRNA干扰后对ER+乳腺癌细胞增殖和抗凋亡能力的影响
采用CCK-8法检测细胞增殖能力,结果显示siRNA敲低KIF18B后YCCB1、T47D乳腺癌细胞的增殖能力均降低,差异有统计学意义(P < 0.05,图 3)。采用流式细胞术检测siRNA干扰后细胞凋亡情况,结果显示敲低KIF18B后YCCB1、T47D乳腺癌细胞的凋亡增加,差异有统计学意义(P < 0.05,图 4)。
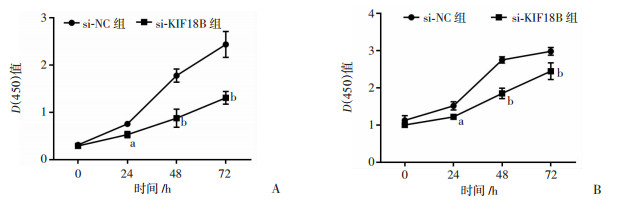
|
| a:P < 0.05,b:P < 0.01,与si-NC组比较; A:YCCB1细胞;B:T47D细胞 图 3 siRNA敲低驱动蛋白KIF18B后增殖能力变化 |
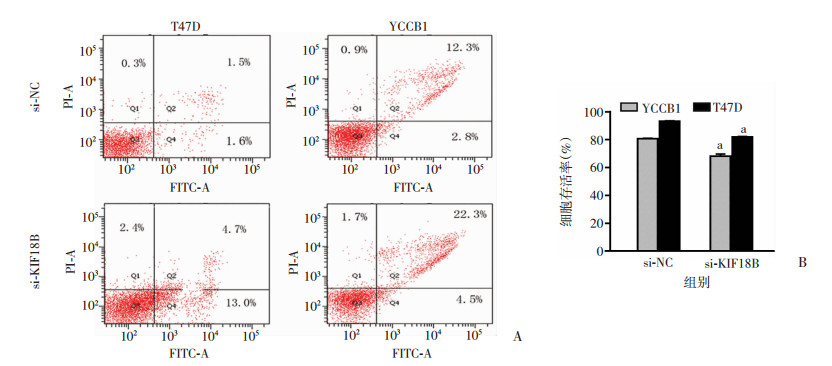
|
| A:流式细胞术检测结果;B:细胞存活率分析 a:P < 0.05, si-NC组比较 图 4 siRNA敲低驱动蛋白KIF18B后凋亡情况 |
2.4 驱动蛋白KIF18B的RNA水平对ER+乳腺癌患者生存预后的影响
Kaplan-Meier数据库在线分析结果显示,高表达KIF18B的ER+乳腺癌患者其总生存率(OS)、无复发生存率(RFS)较低水平组有明显降低,差异有统计学意义(P < 0.05,图 5A),而ER-乳腺癌患者KIF18B高低组之间OS、RFS差异无统计学意义(P>0.05,图 5B)。ER+并接受他莫昔芬治疗的乳腺癌患者中高表达KIF18B组较低水平组,其无远处转移生存率(DMFS)和RFS有明显的降低,差异有统计学意义(P < 0.05,图 5C)。
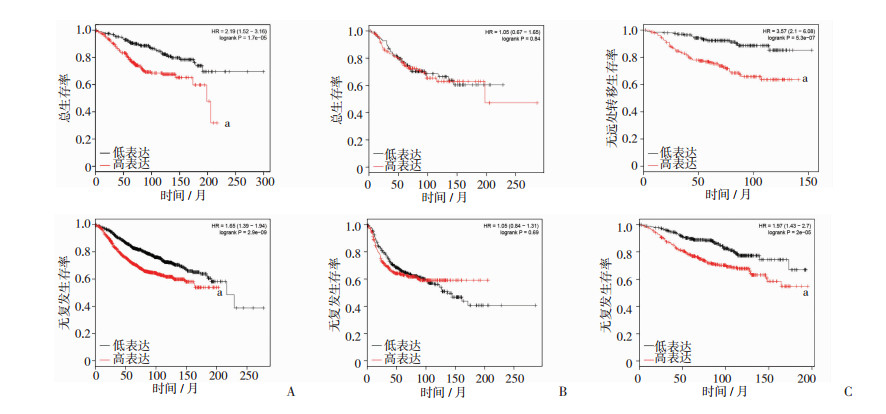
|
| a: P < 0.05,与低表达比较;A:ER+乳腺癌患者的OS和RFS;B:ER-乳腺癌患者的OS和RFS;C:接受他莫昔芬治疗的ER+乳腺癌患者的DMFS和RFS 图 5 Kaplan-Meier分析驱动蛋白KIF18B高低表达对乳腺癌患者的预后价值 |
3 讨论
微管驱动蛋白KIF18B属于微管驱动蛋白超家族成员之一,主要参与细胞分裂中后期微管的动态变化[16-18]。有研究表明驱动蛋白KIF18B在宫颈癌和肝癌的发展中有重要的作用[7, 11],并可能是一个多种肿瘤的驱动基因[10],但其在乳腺癌中的作用及临床意义目前尚不清楚。本研究结果显示,驱动蛋白KIF18B在ER+的乳腺癌中呈高表达,采用siRNA干扰KIF18B表达后观察其对乳腺癌细胞的增殖和凋亡的影响,结果显示敲低KIF18B的表达可以抑制乳腺癌细胞的增殖,并促进乳腺癌细胞的凋亡。这提示驱动蛋白KIF18B可能在ER+乳腺癌的发展过程中有着重要的作用。虽然其具体内在分子机制尚不明确,但有研究表明KIF18B可能通过Wnt/β-catenin信号通路促进宫颈癌细胞的生长[11]。Wnt/β-catenin信号通路在很多研究中都被证实具有促进肿瘤细胞增殖、抗凋亡、侵袭和转移的作用,β-catenin活化进入细胞核后与TCF和LEF组成转录复合体调控下游基因的表达[19-21]。在乳腺癌中是否影响这条通路还需进一步研究。驱动蛋白KIF18B主要定位于细胞核,通过STRING蛋白相互作用数据库[22]预测发现KIF18B和RACGAP1相互作用,RACGAP1同样一部分位于细胞核,RACGAP1在乳腺癌及其他肿瘤中被报道有促癌基因的作用[23-26]。因此,KIF18B也可能通过影响RACGAP1/Rho/ERK这条通路从而影响乳腺癌细胞的功能。
此外,本研究通过分析Kaplan-Meier数据库[27-28]中KIF18B不同RNA水平的乳腺癌患者OS和RFS情况,表明驱动蛋白KIF18B RNA水平较高的ER+乳腺癌患者OS和RFS明显低于RNA水平较低的患者,而在ER-的乳腺癌患者中KIF18B的RNA水平变化与患者生存预后无明显差异。进一步分析在ER+并接受他莫昔芬治疗的乳腺癌患者中,驱动蛋白KIF18B RNA高表达组DMFS和RFS明显低于低表达组。这表明驱动蛋白KIF18B的水平对ER+乳腺癌患者的预后有重要意义,进一步提示驱动蛋白KIF18B在ER+乳腺癌的进展过程中有着重要的作用,并可能促进接受他莫昔芬治疗患者的后期内分泌治疗耐受。内分泌治疗在ER+乳腺癌治疗中占有重要的地位,但其远期复发仍然是一个难题。
综上所述,驱动蛋白KIF18B在ER+乳腺癌中呈高表达,高表达驱动蛋白KIF18B的ER+乳腺癌患者的预后较低表达者差。敲低KIF18B的表达可以抑制ER+乳腺癌细胞的增殖并促进乳腺癌细胞的凋亡。本研究结果可能为乳腺癌,特别是ER+的乳腺癌的治疗和研究提供新的思路。
| [1] |
CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [2] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. DOI:10.3322/caac.21551 |
| [3] |
HARBECK N, GNANT M. Breast cancer[J]. Lancet, 2017, 389(10074): 1134-1150. DOI:10.1016/s0140-6736(16)31891-8 |
| [4] |
WAKS A G, WINER E P. Breast cancer treatment: A review[J]. JAMA, 2019, 321(3): 288-300. DOI:10.1001/jama.2018.19323 |
| [5] |
RICHMAN J, DOWSETT M. Beyond 5 years: enduring risk of recurrence in oestrogen receptor-positive breast cancer[J]. Nat Rev Clin Oncol, 2019, 16(5): 296-311. DOI:10.1038/s41571-018-0145-5 |
| [6] |
QIAO Y, CHEN J, MA C, et al. Increased KIF15 expression predicts a poor prognosis in patients with lung adenocarcinoma[J]. Cell Physiol Biochem, 2018, 51(1): 1-10. DOI:10.1159/000495155 |
| [7] |
HAN J, WANG F, LAN Y, et al. KIFC1 regulated by miR-532-3p promotes epithelial-to-mesenchymal transition and metastasis of hepatocellular carcinoma via gankyrin/AKT signaling[J]. Oncogene, 2019, 38(3): 406-420. DOI:10.1038/s41388-018-0440-8 |
| [8] |
HOU P F, JIANG T, CHEN F, et al. KIF4A facilitates cell proliferation via induction of p21-mediated cell cycle progression and promotes metastasis in colorectal cancer[J]. Cell Death Dis, 2018, 9(5): 477. DOI:10.1038/s41419-018-0550-9 |
| [9] |
WANG Y, WU X, DU M, et al. Eg5 inhibitor YL001 induces mitotic arrest and inhibits tumor proliferation[J]. Oncotarget, 2017, 8(26): 42510-42524. DOI:10.18632/oncotarget.17207 |
| [10] |
ITZEL T, SCHOLZ P, MAASS T, et al. Translating bio-informatics in oncology: guilt-by-profiling analysis and identification of KIF18B and CDCA3 as novel driver genes in carcinogenesis[J]. Bioinformatics, 2015, 31(2): 216-224. DOI:10.1093/bioinformatics/btu586 |
| [11] |
WU Y, WANG A, ZHU B, et al. KIF18B promotes tumor progression through activating the Wnt/β-catenin pathway in cervical cancer[J]. Oncotargets Ther, 2018, 11: 1707-1720. DOI:10.2147/OTT.S157440 |
| [12] |
KHONGKOW P, GOMES A R, GONG C, et al. Paclitaxel targets FOXM1 to regulate KIF20A in mitotic catastrophe and breast cancer paclitaxelresistance[J]. Oncogene, 2016, 35(8): 990-1002. DOI:10.1038/onc.2015.152 |
| [13] |
ALFARSI L H, ELANSARI R, TOSS M S, et al. Kinesin family member-18A (KIF18A) is a predictive biomarker of poor benefit from endocrine therapy in early ER+ breast cancer[J]. Breast Cancer Res Treat, 2019, 173(1): 93-102. DOI:10.1007/s10549-018-4978-5 |
| [14] |
XUE D, CHENG P, HAN M, et al. An integrated bioinformatical analysis to evaluate the role of KIF4A as a prognostic biomarker for breast cancer[J]. Oncotargets Ther, 2018, 11: 4755-4768. DOI:10.2147/OTT.S164730 |
| [15] |
WANG C, WANG C, WEI Z, et al. Suppression of motor protein KIF3C expression inhibits tumor growth and metastasis in breast cancer by inhibiting TGF-β signaling[J]. Cancer Lett, 2015, 368(1): 105-114. DOI:10.1016/j.canlet.2015.07.037 |
| [16] |
LEE Y M, KIM E, PARK M, et al. Cell cycle-regulated expression and subcellular localization of a kinesin-8 member human KIF18B[J]. Gene, 2010, 466(1/2): 16-25. DOI:10.1016/j.gene.2010.06.007 |
| [17] |
MIKI H, OKADA Y, HIROKAWA N. Analysis of the kinesin superfamily: insights into structure and function[J]. Trends Cell Biol, 2005, 15(9): 467-476. DOI:10.1016/j.tcb.2005.07.006 |
| [18] |
TANENBAUM M E, MACUREK L, VAN DER VAART B, et al. A complex of Kif18b and MCAK promotes microtubule depolymerization and is negatively regulated by Aurora kinases[J]. Curr Biol, 2011, 21(16): 1356-1365. DOI:10.1016/j.cub.2011.07.017 |
| [19] |
NUSSE R, CLEVERS H. Wnt/β-catenin signaling, disease, and emerging therapeutic modalities[J]. Cell, 2017, 169(6): 985-999. DOI:10.1016/j.cell.2017.05.016 |
| [20] |
MCCREA P D, GOTTARDI C J. Beyond β-catenin: prospects for a larger catenin network in the nucleus[J]. Nat Rev Mol Cell Biol, 2016, 17(1): 55-64. DOI:10.1038/nrm.2015.3 |
| [21] |
HUANG Y, YANG L, PEI Y Y, et al. Overexpressed ACBD3 has prognostic value in human breast cancer and promotes the self-renewal potential of breast cancer cells by activating the Wnt/beta-catenin signaling pathway[J]. Exp Cell Res, 2018, 363(1): 39-47. DOI:10.1016/j.yexcr.2018.01.003 |
| [22] |
SZKLARCZYK D, GABLE A L, LYON D, et al. STRING v11: protein-protein association networks with increased coverage, supporting functional discovery in genome-wide experimentaldatasets[J]. Nucleic Acids Res, 2019, 47(D1): D607-D613. DOI:10.1093/nar/gky1131 |
| [23] |
WANG C, WANG W, LIU Y, et al. Rac GTPase activating protein 1 promotes oncogenic progression of epithelial ovarian cancer[J]. Cancer Sci, 2018, 109(1): 84-93. DOI:10.1111/cas.13434 |
| [24] |
JACOBSEN A, BOSCH L J W, MARTENS-DE KEMP S R, et al. Aurora kinase A (AURKA) interaction with Wnt and Ras-MAPK signalling pathways in colorectal cancer[J]. Sci Rep, 2018, 8(1): 7522. DOI:10.1038/s41598-018-24982-z |
| [25] |
ŞAHIN S, IŞıK GÖNÜL İ, ÇAKıR A, et al. Clinicopathological significance of the proliferation markers Ki67, RacGAP1, and topoisomerase 2 alpha in breast cancer[J]. Int J Surg Pathol, 2016, 24(7): 607-613. DOI:10.1177/1066896916653211 |
| [26] |
LAWSON C D, FAN C, MITIN N, et al. Rho GTPase transcriptome analysis reveals oncogenic roles for rho GTPase-activating proteins in basal-like breast cancers[J]. Cancer Res, 2016, 76(13): 3826-3837. DOI:10.1158/0008-5472.CAN-15-2923 |
| [27] |
GYÖRFFY B, BENKE Z, LÁNCZKY A, et al. Recurrence Online: an online analysis tool to determine breast cancer recurrence and hormone receptor status using microarray data[J]. Breast Cancer Res Treat, 2012, 132(3): 1025-1034. DOI:10.1007/s10549-011-1676-y |
| [28] |
MIHÁLY Z, KORMOS M, LÁNCZKY A, et al. A meta-analysis of gene expression-based biomarkers predicting outcome after tamoxifen treatment in breast cancer[J]. Breast Cancer Res Treat, 2013, 140(2): 219-232. DOI:10.1007/s10549-013-2622-y |



