肝细胞癌(hepatocellular carcinoma,HCC)是威胁人类健康的常见恶性肿瘤之一,在全球癌症死亡率中居第3位[1]。HCC患者中肝炎病毒感染率明显高于一般人群,提示肝炎病毒感染与肝癌的发生密切相关。丙型肝炎病毒(hepatitis C virus,HCV)在全球广泛流行,据最新统计,全球约1.85亿人感染HCV,约占世界人口的2.8%,每年新发HCV感染病例300~400万[2]。丙型肝炎病毒主要引起慢性丙型肝炎感染, 慢性感染不可避免地会加重肝脏的损害。持续复制的丙肝病毒,不仅引发多种肝脏病变,还为肝癌的发生发展创造条件[3]。HCV的基因组可以裂解成10种不同的结构蛋白和非结构蛋白,其中HCV核心蛋白(core)、NS5a、NS3等会影响宿主细胞的功能并直接参与疾病的发展过程, 而核心蛋白作为HCV相关肝病的危险因子,在病毒与宿主细胞相互作用中扮演了非常重要的角色,其具有直接的致癌效应,诱导的细胞信号转导和转录因子调控异常导致了HCV相关肝癌的发生和转移[4]。
上皮间质转化(epithelial to mesenchymal transfor-mation,EMT)是非侵袭性的上皮细胞向具有侵袭能力的间质细胞转变的生物学过程,与肿瘤的发生进展密切相关,这一过程由多个信号通路及调控因子介导发生,常伴随多种分子标志物的变化,如上皮细胞标志物钙粘蛋白(E-cadherin)表达下调和间质细胞标志物波形蛋白(vimentin)表达增加等[5],而E-cadherin的表达下调在EMT过程中起主要作用。E-cadherin的表达受多种转录因子的调控,尤其是E-cadherin转录抑制因子(EcTRs)。迄今为止报道的EcTR主要包括E盒结合锌指蛋白家族(ZEB1和ZEB2),Snail1、Snail2(Slug),Twist1、Twist2和E12/E47。其中,ZEB1、ZEB2和Snail2可能具有最强的调节作用[6]。我们前期通过T7噬菌体展示技术发现HCV核心蛋白可与ZEB2相互结合[7],本研究进一步探讨HCV核心蛋白对ZEB2及其调控的E-cadherin表达的影响。
1 材料与方法 1.1 材料 1.1.1 质粒、细胞株和病毒质粒pcDNA3.1-3Flag、pCore-3Flag由本室构建并保存。荧光素酶报告质粒pGL3-Basic和pRL-TK购自Progema公司;shRNA-ZEB2慢病毒载体购自Santa Cruz公司;E-cadherin启动子质粒proE-cad178-Luc由日本Kumiko UiTei教授构建并提供(Addgene plasmid # 42081)。人细胞系HepG2细胞购自美国ATCC并由本室保存。
1.1.2 主要试剂SYBRgreen及其他荧光定量PCR试剂购自大连宝生物公司。细胞培养基DMEM及胎牛血清购自Gibco公司。脂质体Lipofectamine 2000购自Invitrogen公司。兔抗HCV核心蛋白多克隆IgG抗体(ab58713)购自Abcam公司,鼠抗ZEB2单克隆IgG抗体(sc-271984)购自Santa Cruz公司,兔抗E-cadherin单克隆IgG抗体(#3195)和鼠抗β-actin单克隆IgG抗体(3700S)购自CST公司。羊抗人二抗试剂购自武汉博士德公司。RNA提取试剂TRIzol购自Invitrogen公司。双荧光素酶活性检测试剂购自Progema公司。染色质免疫沉淀及蛋白印迹化学发光试剂购自上海碧云天公司。
1.2 方法 1.2.1 稳定细胞株的构建培养HepG2细胞,接种6孔板,按照试剂说明书用Lipofectamine 2000转染pCore-3Flag真核表达质粒,培养基中加入500 μg/mL的G418进行筛选培养,构建稳定表达HCV核心蛋白的细胞株,命名为HepG2-Core细胞。
1.2.2 Western blot检测接种HepG2细胞至6孔板,分别转染pCore-3Flag和对照质粒pcDNA3.1-3Flag,48 h后收集细胞提取总蛋白,经SDS-PAGE电泳,转膜后利用相应抗体检测ZEB2和E-cadherin的蛋白水平,用化学发光法进行显色;检测稳转细胞株时,培养HepG2-Core和HepG2细胞后,直接提取蛋白进行检测。
1.2.3 荧光定量RT-PCR常规培养细胞并分别转染pCore-3Flag和对照质粒pcDNA3.1-3Flag,48 h后利用TRIzol试剂提取细胞总RNA,用荧光定量RT-PCR方法测定RNA量,用β-actin作为内参照。E-cadherin的上下游引物为5′-TGCCCAGAAAATGAAAAAGG-3′和5′-GTGTATGTGGCAATGCGTTC-3′,ZEB2的上下游引物为5′-ATGGGGCCAGAAGCCACGAT-3′和5′-GTCGA-CTGCATGACCATCGC-3′,β-actin的上下游引物为5′-CTCTTCCAGCCTTCCTTCCT-3′和5′-AGCACTGTGTTGGCGTACAG-3′。
1.2.4 荧光素酶活性分析接种HepG2细胞至24孔板,利用Lipofectamine 2000共转染pCore-3Flag (0.5 μg)、proE-cad178-Luc(0.5 μg)和pRL-TK(0.1 μg),继续培养24 h后裂解细胞并用双荧光素酶分析系统检测荧光素酶活性,以海狗肾荧光酶活性为内参照计算相对活性,设置pCDNA3.1-3Flag对照。培养HepG2- Core细胞,感染shZEB2慢病毒后,共转染proE-cad178- Luc(0.5 μg)和pRL-TK(0.1 μg),继续培养24 h后裂解细胞检测荧光素酶活性。所有实验每次平行3孔,重复3次。
1.2.5 免疫共沉淀接种HepG2细胞于6孔板,利用Lipofectamine 2000转染pCore-3Flag,细胞转染48 h后,收集细胞,用预冷PBS液洗涤2次,离心弃上清,加入适量的RIPA Buffer,冰浴30 min,加入抗HCV核心蛋白的抗体包被的磁珠4 ℃孵育过夜,12 000 r/min离心后收集沉淀物,PBS充分洗涤,加入2×Tricine SDS PAGE上样缓冲液,煮沸5 min,12 000 r/min离心收集上清,Western blot分别检测ZEB2和HCV Core蛋白条带。实验设置转染pEGFP-N1质粒,以未转染组为对照。
1.2.6 染色质免疫共沉淀培养HepG2-Core和HepG2细胞,用终浓度为1%的甲醛溶液固定细胞,室温下放置10 min,甘氨酸溶液中止反应。用预冷的PBS洗涤细胞2次,离心去上清后加入1 mL预冷细胞裂解液裂解细胞。以35 V 10 s间隔30 s的条件超声处理细胞,12 000 r/min离心后保留上清,将超声处理后的溶液分成2份,分别加入磁珠包被的抗-ZEB2抗体和阴性对照抗体,4 ℃摇床孵育过夜,次日溶液中加入Protein A凝胶磁珠免疫沉淀复合物,短暂离心后去上清,加入预冷的ChIP缓冲液收集沉淀物,顺次用低盐、高盐、氯化锂和TE缓冲液清洗2遍,去上清,用洗脱缓冲液洗脱免疫沉淀物,用DNA纯化柱回收沉淀的DNA,以之为模板行PCR扩增,琼脂糖凝胶电泳并染料显色观察,比较HepG2-Core和HepG2细胞组扩增产物的浓度差别。实验中使用的引物为5′-TAGAGGGTCACCGCGTCTAT-3′和5′-TCACAGGTGCTTTGCAGTTC-3′, 扩增产物约为170 bp,该区段位于E-cadherin启动子-190~34 bp,包括了E-box的区段。实验以IgG做阴性对照。
1.3 统计学分析采用SPSS 15.0统计软件进行分析。数据以x±s表示。两组间差异比较采用独立样本t检验。多组间差异比较采用单因素方差分析。
2 结果 2.1 HCV核心蛋白下调E-cadherin的表达转染HCV核心蛋白真核表达质粒,在瞬时表达和稳定表达的细胞模型中,检测HCV核心蛋白对细胞E-cadherin表达水平的影响。结果显示,转染pCore-3Flag后,HepG2细胞内可检测出HCV核心蛋白条带,证明HCV核心蛋白有成功表达,同时细胞内E-cadherin表达量较空载体对照组明显下降(图 1A)。同样在稳定表达HCV核心蛋白的细胞系(HepG2-Core)中,E-cadherin表达水平显著低于HepG2对照组(图 1B)。荧光定量RT-PCR结果显示,转染HCV核心蛋白质粒的细胞比转染空载体质粒的细胞,E-cadherin的mRNA水平也明显降低(P < 0.001)。
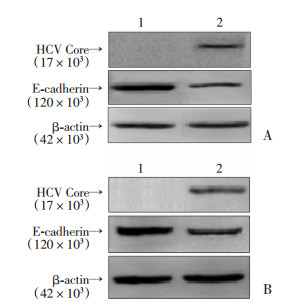
|
| A:瞬时表达细胞模型中E-cadherin的表达;1:HepG2p-3Flag组;2:HepG2pCore-3Flag组;B:稳定表达细胞模型中E-cadherin的表达; 1:HepG2组;2:HepG2-Core组 图 1 HCV核心蛋白下调E-cadherin的表达 |
2.2 HCV核心蛋白上调ZEB2的表达
在瞬时和稳定表达HCV核心蛋白的细胞中,ZEB2的蛋白和mRNA表达水平均较对照组明显增强(P < 0.05,图 2),而E-cadherin的表达则明显减弱(P < 0.01,图 2)。
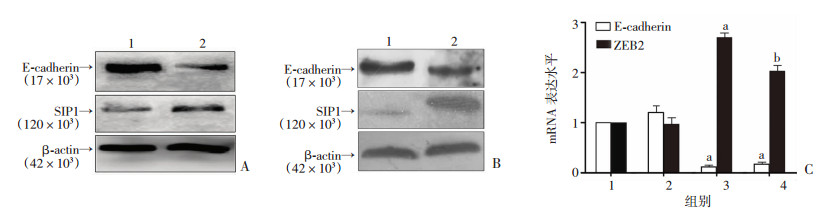
|
| A:瞬时表达细胞模型中ZEB2和E-cadherin的蛋白印迹分析; 1:HepG2p-3Flag组;2:HepG2pCore-3Flag组;B:稳定表达细胞模型中ZEB2和E-cadherin的蛋白印迹分析 1:HepG2组;2:HepG2-Core组;C:荧光定量RT-PCR检测E-cadherin和ZEB2 mRNA水平(n=3,x±s) 1:Mock组;2:HepG2组;3:HepG2-Core组;4:HepG2pCore-3Flag组;a:P < 0.01,b:P < 0.05,与Mock组比较 图 2 HCV核心蛋白上调ZEB2的表达 |
2.3 HCV核心蛋白抑制E-cadherin启动子的活性
proE-cad178-Luc转染HepG2细胞后,通过检测荧光素酶活性可判断E-cadherin启动子的转录活性。结果表明,转染HCV核心蛋白组荧光素酶活性较空载体对照组明显下降(P < 0.01, 图 3A)。当使用shRNA慢病毒敲减ZEB2后,HepG2及HepG2-Core细胞中,荧光素酶活性均明显增强,提示HCV核心蛋白可能通过ZEB2抑制了E-cadherin启动子的活性(HepG2组P < 0.01;HepG2-Core组P < 0.05,图 3B)。

|
| A:HCV核心蛋白抑制E-cadherin启动子介导的荧光素酶活性 1:Mock组;2:HepG2p-3Flag组;3:HepG2pCore-3Flag组; a:P < 0.01,与Mock组比较;B:shRNA慢病毒敲减ZEB2后E-cadherin启动子介导的荧光素酶活性 1:Mock组;2:cont shRNA组;3:shRNA-ZEB2组;a:P < 0.01,b:P < 0.05,与Mock组比较 图 3 HCV核心蛋白抑制E-cadherin启动子活性(n=3,x±s) |
2.4 HCV核心蛋白与ZEB2的相互作用
为了进一步验证HCV核心蛋白和ZEB2之间的相互作用,分别进行了免疫共沉淀和染色质免疫共沉淀实验。免疫共沉淀实验结果显示,用抗HCV核心蛋白的抗体抓取细胞裂解产物时,转染了HCV核心蛋白真核表达质粒的细胞可以检测出ZEB2的条带,而转染GFP对照及未转染者均检测不到相应条带,表明HCV核心蛋白可以与ZEB2相结合(图 4A)。用ZEB2抗体行染色质免疫共沉淀实验发现,HepG2-Core细胞中E-cadherin启动子扩增条带较HepG2细胞显著增高,表明HCV核心蛋白增强了ZEB2与E-cadherin启动子的结合能力(图 4B)。

|
| A:免疫共沉淀实验 1:Input组;2:Core组;3:GFP组;4:Mock组;B:染色质免疫共沉淀 M:标准;1、2:Input组;3:HepG2组;4:HepG2-Core组;5:IgG组 图 4 HCV核心蛋白与ZEB2的相互作用 |
3 讨论
肝细胞癌(HCC)的主要危险因素包括乙型肝炎、丙型肝炎、酒精和非酒精性肝炎等。近年来由于早期诊断和治疗的进展,HCC患者的预后虽然有所改善,但晚期HCC患者仍无法治愈,因此了解HCC的致癌机制,探索新的治疗靶点是很重要的。HCV可以通过病毒-宿主细胞相互作用影响细胞主要的信号通路,促使肝细胞发生恶性转化,其中HCV核心蛋白参与TGF-β、VEGF、WNT等多种信号通路与肝癌的发生过程密切相关[8]。而EMT作为致癌过程中的关键机制,已被证实参与了HCC的发生、发展过程,且恶性肝细胞的EMT与肿瘤恶性程度和预后相关[9]。研究发现,HCV感染可诱导原代肝细胞发生EMT[10],HCV核心蛋白或NS5a蛋白通过不同的途径诱导EMT的发生[11-12]。
上皮钙粘蛋白E-cadherin以Ca2+依赖的方式,参与细胞间、细胞与基质间的黏附过程, 是典型的跨膜蛋白,具有调控转录和抑制侵袭的功能,下调E-cadherin的表达会破坏细胞间的黏附连接,上皮细胞逐渐形成具有迁移能力的间充质细胞,故抑制E-cadherin的表达足以诱导癌细胞的发育与侵袭,这或许是导致HCC发生的关键机制[13]。而E-cadherin的表达变化也与多种恶性肿瘤细胞的EMT有关,其表达缺失被认为是EMT的主要标志。一些研究报道显示,与正常组织相比,肝炎病毒感染引起的肝细胞癌中,肿瘤抑制因子E-cadherin的表达降低,且肝细胞E-cadherin的缺失还会导致肝内胆道系统的损伤及炎症反应的加重[14]。
ZEB2是Zfh1家族的锌指/同源域蛋白,由一段可变序列和两端高度保守的锌指簇组成。研究证实ZEB2在HCC组织中过表达,它可通过与Smad蛋白相互作用,与TGF-β信号通路协同促进肿瘤细胞侵袭,在HCC中起癌基因的作用[15]。另外,ZEB2可与多种靶基因启动子中的E盒结合并抑制其转录,当ZEB2与E-cadherin的E盒结合后,可抑制E-cadherin表达,诱导EMT的发生,在人类恶性肿瘤的发生过程中发挥着重要的作用[16]。有研究表明,ZEB2在侵袭性肿瘤中表达显著增加,常伴有E-cadherin的表达下调[17],且ZEB2的敲除抑制胶质瘤细胞的增殖、迁移和侵袭,促进细胞凋亡[18]。然而,HCV核心蛋白能否直接与ZEB2相互作用,在转录水平上抑制E-cadherin的表达,还未见相关研究报道。
本研究显示,HCV核心蛋白可通过增强ZEB2的表达水平及与之相互作用,来抑制E-cadherin的表达。使用重组质粒转染人肝细胞株,在瞬时和稳定表达HCV核心蛋白的HepG2细胞中,HCV核心蛋白均显著下调了E-cadherin的表达水平,而ZEB2的表达则是明显增强,E-cadherin与ZEB2的表达水平呈负相关。我们通过荧光素酶活性检测证实了HCV核心蛋白能明显抑制E-cadherin基因启动子的转录活性,当以shRNA沉默ZEB2的表达后,HCV核心蛋白对E-cadherin启动子活性的抑制作用发生了逆转,提示HCV核心蛋白对E-cadherin表达的抑制作用与ZEB2密切相关。最后我们通过免疫共沉淀技术证实了HCV核心蛋白与ZEB2的物理相互作用,并利用染色质免疫共沉淀技术研究了ZEB2与E-cadherin启动子的结合,以及HCV核心蛋白对这种结合的影响,结果表明HCV核心蛋白可以促进ZEB2与E-cadherin启动子的结合,这可能与HCV核心蛋白增加ZEB2的表达水平并直接结合之,从而有效地稳定ZEB2在DNA上的结合有关。
综上所述,HCV核心蛋白可通过与ZEB2相互作用,抑制E-cadherin的表达,促进EMT的发生,这可能是HCV相关肝癌发生发展的机制之一。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
TAHERKHANI R, FARSHADPOUR F. Global elimination of hepatitis C virus infection: Progresses and the remaining challenges[J]. World J Hepatol, 2017, 9(33): 1239-1252. DOI:10.4254/wjh.v9.i33.1239 |
| [3] |
IRSHAD M, GUPTA P, IRSHAD K. Molecular basis of hepato- cellular carcinoma induced by hepatitis C virus infection[J]. World J Hepatol, 2017, 9(36): 1305-1314. DOI:10.4254/wjh.v9.i36.1305 |
| [4] |
SEDENO-MONGE V, VALLEJO-RUIZ V, SOSA-JURADO F, et al. Polymorphisms in the hepatitis C virus core and its association with development of hepatocellular carcinoma[J]. J Biosci, 2017, 42(3): 509-521. DOI:10.1007/s12038-017-9695-4 |
| [5] |
PRIETO-GARCÍA E, DÍAZ-GARCÍA C V, GARCÍA-RUIZ I, et al. Epithelial-to-mesenchymal transition in tumor progression[J]. Med Oncol, 2017, 34(7): 122. DOI:10.1007/s12032-017-0980-8 |
| [6] |
PEINADO H, OLMEDA D, CANO A. Snail, Zeb and bHLH factors in tumour progression: An alliance against the epithelial phenotype?[J]. Nat Rev Cancer, 2007, 7(6): 415-428. DOI:10.1038/nrc2131 |
| [7] |
黄英, 蔡雪飞, 张君, 等. 用T7噬菌体展示技术筛选HCV核心蛋白的相互作用蛋白[J]. 第三军医大学学报, 2007, 29(10): 876-878. HUANG Y, CAI X F, ZHANG J, et al. Screening of proteins interacting with hepatitis C virus core protein from T7-phage display library[J]. J Third Mil Med Univ, 2007, 29(10): 876-878. DOI:10.3321/j.issn:1000-5404.2007.10.006 |
| [8] |
MAHMOUDVAND S, SHOKRI S, TAHERKHANI R, et al. Hepatitis C virus core protein modulates several signaling pathways involved in hepatocellular carcinoma[J]. World J Gastroenterol, 2019, 25(1): 42-58. DOI:10.3748/wjg.v25.i1.42 |
| [9] |
GIANNELLI G, KOUDELKOVA P, DITURI F, et al. Role of epithelial to mesenchymal transition in hepatocellular carcinoma[J]. J Hepatol, 2016, 65(4): 798-808. DOI:10.1016/j.jhep.2016.05.007 |
| [10] |
BOSE S K, MEYER K, DI BISCEGLIE A M, et al. Hepatitis C virus induces epithelial-mesenchymal transition in primary human hepatocytes[J]. J Virol, 2012, 86(24): 13621-13628. DOI:10.1128/JVI.02016-12 |
| [11] |
TIWARI I, YOON M H, PARK B J, et al. Hepatitis C virus core protein induces epithelial-mesenchymal transition in human hepatocytes by upregulating E12/E47 levels[J]. Cancer Lett, 2015, 362(1): 131-138. DOI:10.1016/j.canlet.2015.03.032 |
| [12] |
AKKARI L, GRÉGOIRE D, FLOC'H N, et al. Hepatitis C viral protein NS5A induces EMT and participates in oncogenic transformation of primary hepatocyte precursors[J]. J Hepatol, 2012, 57(5): 1021-1028. DOI:10.1016/j.jhep.2012.06.027 |
| [13] |
WONG S H M, FANG C M, CHUAH L H, et al. E-cadherin: Its dysregulation in carcinogenesis and clinical implications[J]. Crit Rev Oncol Hematol, 2018, 121: 11-22. DOI:10.1016/j.critrevonc.2017.11.010 |
| [14] |
MAEDA S, NAKAGAWA H. Roles of E-cadherin in hepatocarcinogenesis[M]//MAEDA S, NAKAGAWA H, ed. Innovative Medicine. Tokyo: Springer Japan, 2015: 71-77. DOI: 10.1007/978-4-431-55651-0_6.
|
| [15] |
JIANG G B, WEN L, DENG W P, et al. Regulatory role of miR-211-5p in hepatocellular carcinoma metastasis by targeting ZEB2[J]. Biomed Pharmacother, 2017, 90: 806-812. DOI:10.1016/j.biopha.2017.03.081 |
| [16] |
WONG T S, GAO W, CHAN J Y. Transcription regulation of E-cadherin by zinc finger E-box binding homeobox proteins in solid tumors[J]. Biomed Res Int, 2014, 2014: 921564. DOI:10.1155/2014/921564 |
| [17] |
FARDI M, ALIVAND M, BARADARAN B, et al. The crucial role of ZEB2: From development to epithelial-to-mesenchymal transition and cancer complexity[J]. J Cell Physiol, 2019, 234(9): 14783-14799. DOI:10.1002/jcp.28277 |
| [18] |
QI S T, SONG Y, PENG Y P, et al. ZEB2 mediates multiple pathways regulating cell proliferation, migration, invasion, and apoptosis in glioma[J]. PLoS ONE, 2012, 7(6): 38842. DOI:10.1371/journal.pone.0038842 |



