肾细胞癌约占成人恶性肿瘤的2%,其中肾透明细胞癌占所有肾细胞癌的80%~85%,且近几十年来其发病率不断上升[1-2]。在最初的诊断中,20%~30%的肾细胞癌患者有转移,转移仍是肾细胞癌相关死亡的主要原因。目前,手术是治疗肾细胞癌的首选方式,但术后复发率约为30%[3]。此外,肾细胞癌对化疗/放疗和靶向治疗方案均不敏感[4]。因此,迫切需要探索新的基因以揭示肾透明细胞癌的分子机制,为诊断和治疗提供新的线索和策略。
三结构域蛋白2(tripartite motif-containing protein 2,TRIM2)属于TRIM家族的一种蛋白,是一种环指E3泛素连接酶。TRIM2的高表达与癫痫的神经活动相关,并与肌球蛋白V一起参与神经细胞机制的调节[5]。TRIM2的缺乏可降低神经丝蛋白轻链多肽(neurofilament light subunit,NF-L)的泛素化降解,从而引起神经退行性变[6]。TRIM2通过介导p42/p44 MAPK信号通路从而泛素化降解Bim(Bcl-2-interacting mediator of cell death),已被证实为快速缺血耐受诱导的神经保护的调节机制[7]。然而,在肾透明细胞癌中,TRIM2如何对肾透明细胞癌产生影响和具体机制还不明确。本研究观察TRIM2对肾透明细胞癌增殖、迁移和干性的影响,并对其相关作用机制进行初步探讨,期望为肾透明细胞癌发生的分子机制、诊断和治疗提供理论依据。
1 材料与方法 1.1 材料与试剂肾透明细胞癌细胞株(786-O、769-P、OSRC-2、CAKI-1)购自ATCC细胞库,RPMI1640培养基、opti-MEM培养基,McCoy’s 5A培养基、0.25%胰蛋白酶、PBS、B27和胎牛血清购自美国Gibco公司,TRIM2过表达质粒由上海生工工程有限公司合成,CCK-8试剂盒购自美国MedChemExpress公司,划痕插件购自德国Ibidi公司,低黏附24孔板购自美国康宁公司, TRIzol购自日本TaKaRa公司,TRIM2一抗购自美国Proteintech公司,C-MYC、0CT-4、NANOG一抗购自美国Abcam公司,Lipofectamine 3000转染试剂盒购自美国Invitrogen公司, GAPDH一抗、BCA法蛋白浓度测定试剂盒购自上海碧云天公司,表皮生长因子(EGF)、碱性成纤维生长因子(bFGF)购自美国Sigma公司,二抗山羊抗小鼠IgG抗体和山羊抗兔IgG抗体购自北京中杉金桥生物技术有限公司。
1.2 TRIM2高表达和低表达肾透明细胞癌患者生存曲线分析登录THE HUMAN PROTEIN ATLAS数据库(www.proteinatlas.org),输入TRIM2,即可显示TRIM2高表达和低表达肾透明细胞癌患者生存曲线分析结果。
1.3 免疫组化检测肾透明细胞癌和癌旁组织TRIM2的表达取2017-2018年本科临床诊断为肾透明细胞癌的患者并行手术切除的肾癌及其癌旁组织(距癌组织约3 cm),石蜡包埋组织后将石蜡包块切成4 μm的小切片,然后脱蜡和水化,PBS中洗涤充分,用柠檬酸抗原修复液进行热抗原修复,PBS充分洗涤。3%双氧水避光室温孵育20 min灭活内源性过氧化物酶活性,3%BSA室温下封闭20 min,加TRIM2一抗,将切片平放于湿盒中在4 ℃冰箱中孵育过夜。次日,取出湿盒,切片用PBS洗3次,每次3 min,再滴加二抗覆盖组织,室温下孵育30 min。玻片PBS洗涤3次,每次3 min。稍甩干后滴加DAB显色液,显微镜下5 min,棕黄色为阳性,即可用自来水冲洗切片终止显色,用自来水冲洗,然后苏木精分化液分化3 s,自来水冲洗3 min,用苏木精返蓝液返蓝,然后自来水冲洗。脱水,将切片晾干,滴加适量中性树胶封片,显微镜下拍照。
1.4 细胞培养及过表达质粒转染786-O、769-P、OSRC-2均用90% RPMI1640培养基+10%FBS+1%双抗配制成的细胞培养基培养;CAKI-1用90% McCoy’s 5A培养基+10%FBS+1%双抗配制成的细胞培养基培养。用6 cm培养皿进行转染,待细胞生长至70%~80%最佳。转染前1 d,用4 mL相应培养基(10%FBS,无双抗)换液。将6 cm培养皿中的培养基吸出,用无血清的opti-MEM培养基清洗2次,再加入3 mL无血清的opti-MEM培养基后,放置于培养箱中。配置溶液A和溶液B,溶液A:取2个1.5 mL EP管,分别加入0.5 mL opti-MEM培养基(一个为目的,另一个为对照),再分别加入5 μL Lipofectamine 3000,轻轻混匀;溶液B:取2个1.5 mL EP管,分别加入0.5 mL opti-MEM培养基(一个为目的质粒,另一个为对照空载体质粒),分别加入5 μL P3000,再向一个EP管中加入5 μg目的质粒,另一个加入5 μg空载体质粒,室温孵育5 min。将溶液A逐渐加入到溶液B中,室温孵育20 min。直接将A+B复合物加入到相应6 cm培养皿中,8 h后观察细胞,更换为相应含10%FBS的完全培养基。
1.5 Western blot检测收集培养好的细胞,加入300 μL RIPA细胞裂解液(含1/1 000的PMSF), 用细胞刮刮下细胞,并收集细胞裂解液于1.5 mL EP管中,放于冰上裂解30 min。12 000 r/min,4 ℃离心15 min,取上清液至新的1.5 mL EP管中,放于冰上,用BCA法测蛋白浓度。用SDS-PAGE蛋白上样缓冲液(5×)稀释样品蛋白,蛋白溶液与缓冲液(5×)体积比为4 :1,再将样品蛋白置于95 ℃金属浴仪上加热10 min变性。配置浓缩胶与分离胶,上样进行SDS-PAGE电泳,根据目的蛋白分子量大小恒流230 mA转膜60~90 min。于5%脱脂奶粉中,室温水平摇床上封闭2 h。封闭完成后,用TBST清洗3次,每次5 min。并分别转移至相应稀释好的一抗中,然后4 ℃孵育过夜。第2天将条带置于TBST中清洗3次,每次5 min。用5%脱脂奶粉稀释好二抗(比例为1 :5 000),将膜置相应二抗中,室温孵育2 h,用TBST洗3次,每次5 min。在凝胶成像系统中进行曝光,保存图片。
1.6 q-PCR实验收集培养好的细胞,用TRIzol法提取细胞中的RNA,测量RNA浓度后,用q-PCR逆转录试剂盒将RNA逆转录为cDNA,配制好反应液,瞬时离心后置于PCR仪中,反应条件:37 ℃ 15 min,85 ℃ 5 s,然后置于冰上或4 ℃。逆转录完成后,将cDNA于-20 ℃保存。将cDNA稀释10倍,用于实时定量PCR反应。引物均稀释至10 μmol/L,4 ℃储存备用。q-PCR引物序列如下:GAPDH上游5′ -CCATGGAGAAGGCTGGGG-3′, 下游5′-CAAAGTTGTCATGGATGACC-3′;C-MYC上游5′ -CCCTCCACTCGGAAGGACTA-3′, 下游5′-GCTGG-TGCATTTTCGGTTGT-3′;NANOG上游5′ -TCTGGACACTGGCTGAATCC-3′, 下游5′-TGACTGGATGGGC-ATCATGG-3′;OCT4上游5′ -TATTCAGCCAAACGAC-CATCT-3′, 下游5′-TCAGCTTCCTCCACCCACTT-3′。加入SYBR Green Real time PCR Master Mix 10.0 μL,上下引物各1.0 μL,cDNA 2.0 μL,ddH2O 6.0 μL。用Step One Plus实时荧光定量PCR仪进行反应扩增,反应参数设定为:变性95 ℃ 1 min;退火60 ℃ 15 s;延伸72 ℃ 45 s;30个循环。绘制溶解曲线。基因的表达量用2-△△Ct方法进行分析。
1.7 CCK-8实验将上一步转染的两株细胞进行细胞增殖实验,实验分2组:TRIM2过表达组转染过表达TRIM2质粒,对照组转染空载体质粒。消化离心后重悬细胞,用相应的完全培养基稀释细胞,细胞玻璃计数板进行计数,再将细胞稀释至20 000/mL。取96孔板,每孔加入20 000/mL的细胞悬液100 μL,每组5个复孔,观测5个时间点共5对结果。置于5% CO2、37 ℃培养箱中孵育过夜,等待细胞贴壁。次日,取出96孔板,在第1对5个复孔的培养基中加入10 μL CCK-8溶液。放入37 ℃培养箱孵育2 h。立即放入酶标仪测定波长450 nm处的光密度值[D(450)]。第3、4、5、6天,在同一时间点,重复上述步骤。共测得5个时间点的D(450)值,绘制细胞增殖曲线。
1.8 划痕实验将TRIM2过表达组和对照组的细胞消化重悬后并计数。将酒精消毒后的划痕实验插件小心放入12孔板内(每组3个复孔),使划痕实验插件紧贴于12孔板底部。用完全培养基将细胞稀释至500/μL,并吸取70 μL加入左右各孔中,置于37 ℃,5%CO2的培养箱培养24 h,待细胞完全贴壁。24 h后,小心取出划痕实验插件,用PBS轻柔洗涤细胞2次,然后加入1 mL 1%FBS的相应培养基。分别于0、12、24 h在显微镜下观察并拍照,测量并统计细胞间的宽度。
1.9 细胞成球实验用含20 ng/mL的EGF、20 ng/mL bFGF和B27的DMEM/F12培养基进行细胞成球实验。将TRIM2过表达组和对照组的细胞消化重悬后并计数,在低黏附24孔板中加入1 mL上述培养基,再加入200个细胞,每隔1 d加入100 μL上述培养基,2周后显微镜下拍照,测量并统计细胞成球的直径。
1.10 生物信息学分析为有助于理解与TRIM2有关基因之间的相互作用。从COEXPEDIA数据库中构建一个在肾脏中与TRIM2相关的基因共表达网络(http://www.coexpedia.org/)。同时,在THE HUMAN PROTEIN ATLAS数据库(www.proteinatlas.org)中,分析与TRIM2有关基因的高低表达对肾透明细胞癌患者生存曲线分析的影响。
1.11 统计学分析采用SPSS 16.0统计软件,数据以x±s表示,两组比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,检验水准:α=0.05。
2 结果 2.1 TRIM2在肾透明细胞癌组织和癌旁组织的表达在THE HUMAN PROTEIN ATLAS数据库中,发现TRIM2高表达的肾透明细胞癌患者生存时间明显比TRIM2低表达患者长(P < 0.001, 图 1A),说明TRIM2高表达肾癌患者的预后较好。在临床手术切除的肾透明细胞癌患者的肿瘤及相应癌旁肾组织标本中,免疫组化染色结果显示,与癌旁组织比较,TRIM2在肾透明细胞癌组织中明显低表达(图 1B)。
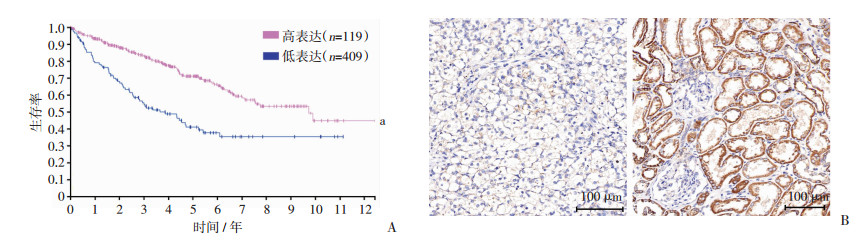
|
| A:TRIM2高表达和低表达的肾透明细胞癌患者生存曲线分析 a:P < 0.001,与低表达组比较; B:免疫组化观察TRIM2在肾透明细胞癌(左)和癌旁组织(右)中的表达 图 1 TRIM2高低表达患者的生存分析和TRIM2在肾癌及癌旁组织中的表达 |
2.2 TRIM2相对低表达的肾透明细胞癌细胞株筛选和TRIM2质粒转染
Western blot和q-PCR检测结果均证实TRIM2在786-O和769-P细胞中相对低表达, 在OSRC-2和CAKI-1细胞中相对高表达(图 2),故选择786-O和769-P两个细胞株进行TRIM2质粒转染过表达实验。Western blot检测发现,在786-O和769-P细胞中TRIM2过表达组HA标签蛋白表达明显,而对照组HA标签蛋白没有表达(图 2C),说明TRIM2质粒成功转染到786-O和769-P细胞中。荧光显微镜观察显示,与对照组比较,TRIM2过表达组荧光明显增强(图 2E),也证实TRIM2质粒成功转染到786-O和769-P细胞中。
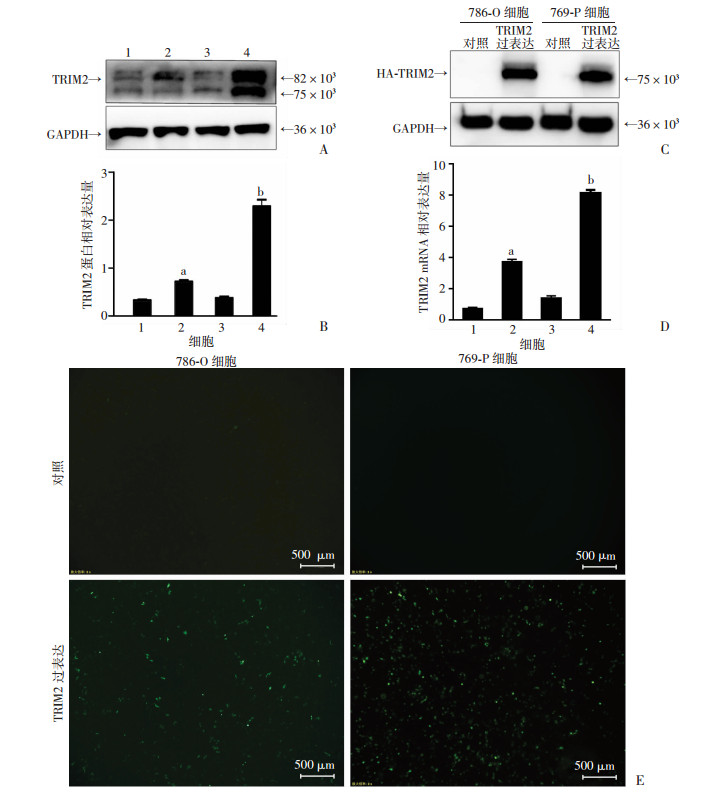
|
|
1: 786-O细胞;2:CAKI-1细胞:3:769-P细胞;4:OSRC-2细胞;a:P < 0.05,b:P < 0.01,与786-O细胞比较 A、B: Western blot检测TRIM2蛋白表达及半定量分析;C:Western blot检测786-O和769-P细胞转染空载体和TRIM2质粒HA标签的表达;D:q-PCR检测不同肾透明细胞癌细胞中TRIM2 mRNA的表达;E:荧光显微镜观察786-O和769-P细胞荧光强度 图 2 TRIM2低表达细胞株的筛选以及TRIM2过表达的情况 |
2.3 过表达TRIM2对肾透明细胞癌增殖和迁移的影响
在786-O和769-P细胞中,CCK-8实验显示,TRIM2过表达组较对照组细胞增殖均明显减慢(图 3),表明TRIM2过表达后细胞的增殖能力受到抑制。划痕实验显示在24 h时,TRIM2过表达组较对照组细胞迁移能力明显减弱(图 4),表明TRIM2过表达以后细胞的迁移能力受到抑制。
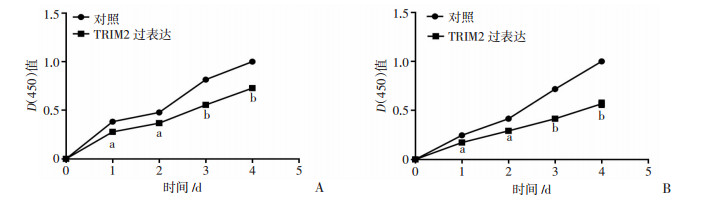
|
| a: P < 0.05, b: P < 0.01, 与对照组比较;A:786-O细胞;B:769-P细胞 图 3 CCK-8实验检测过表达TRIM2后对786-O和769-P细胞增殖能力的影响 |

|
| 图 4 划痕实验检测过表达TRIM2后对786-O和769-P细胞迁移能力的影响 |
2.4 过表达TRIM2对肾透明细胞癌成球能力和干性的影响
786-O和769-P细胞中,肿瘤干细胞成球实验显示,TRIM2过表达组较对照组细胞成球直径小(图 5),表明TRIM2过表达以后肿瘤干细胞的成球能力受到抑制。q-PCR和Western blot实验显示,TRIM2过表达组细胞较对照组细胞干性基因(C-MYC、NANOG、OCT4)mRNA和蛋白水平明显下调(P < 0.01, 图 6),表明TRIM2过表达以后细胞的干性受到抑制。
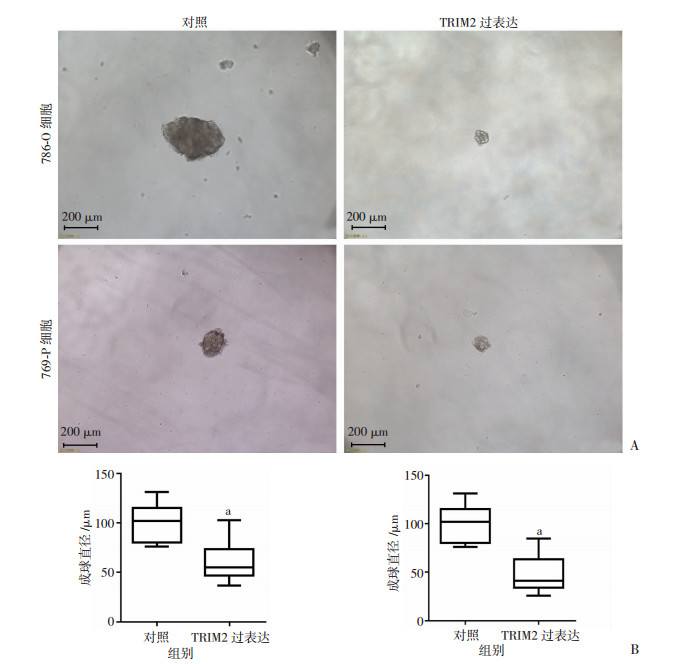
|
|
A:细胞成球实验观察786-O和769-P细胞成球情况;B: 786-O(左)和769-P(右)细胞两组成球直径分析 a: P < 0.01,与对照组比较 图 5 过表达TRIM2对肾透明细胞癌786-O和769-P干细胞成球能力的影响 |
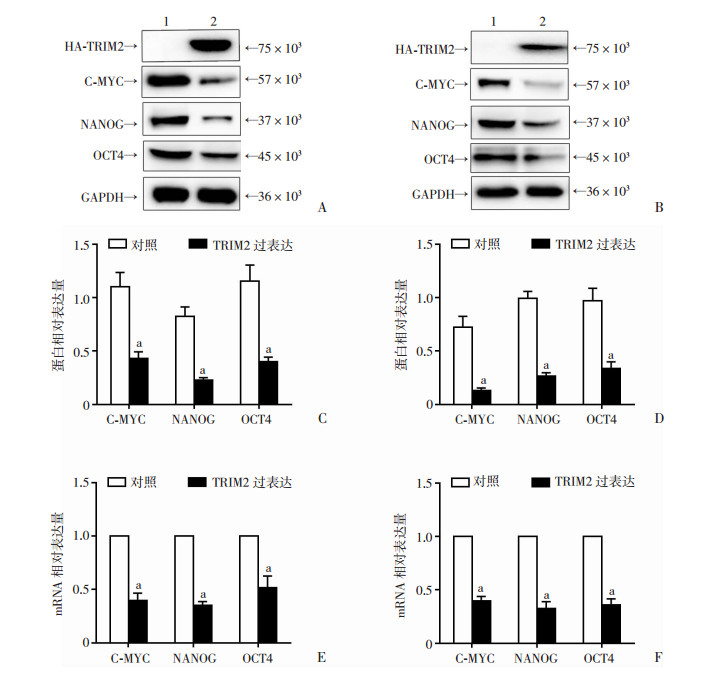
|
| 1:对照;2:TRIM2过表达;A、C:Western blot检测786-O细胞干性基因(C-MYC、NANOG、OCT4)的影响及半定量分析;B、D: Western blot检测769-P细胞干性基因(C-MYC、NANOG、OCT4)的影响及半定量分析;E:q-PCR检测786-O细胞干性基因(C-MYC、NANOG、OCT4)的影响;F: q-PCR检测769-P细胞干性基因(C-MYC、NANOG、OCT4)的影响 a:P < 0.01,与对照组比较 图 6 过表达TRIM2对肾透明细胞癌786-O和769-P干性基因的影响 |
2.5 TRIM2相关基因共表达网络及TRIM2相关基因的生存分析
从COEXPEDIA数据库中,构造了一个在肾癌中与TRIM2相关的基因共表达网络,与TRIM2相关程度较高的基因可能与肾透明细胞癌的关系较为密切。在这些基因中,排在前4位的基因分别为NR3C2(nuclear receptor subfamily 3 group C member 2)、ESRRG(estrogen related receptor gamma)、COL4A3(collagen type Ⅳ alpha 3 chain)和CTDSPL(CTD small phosphatase like)(图 7)。同时,在THE HUMAN PROTEIN ATLAS数据库(www.proteinatlas.org)中, 分析NR3C2、ESRRG、COL4A3和CTDSPL对肾透明细胞癌患者生存分析的影响(图 8),结果发现NR3C2、ESRRG、COL4A3和CTDSPL高表达肾透明细胞癌患者的预后均比低表达的患者好。

|
| 图 7 TRIM2在肾癌中与邻近基因的基因共表达网络 |
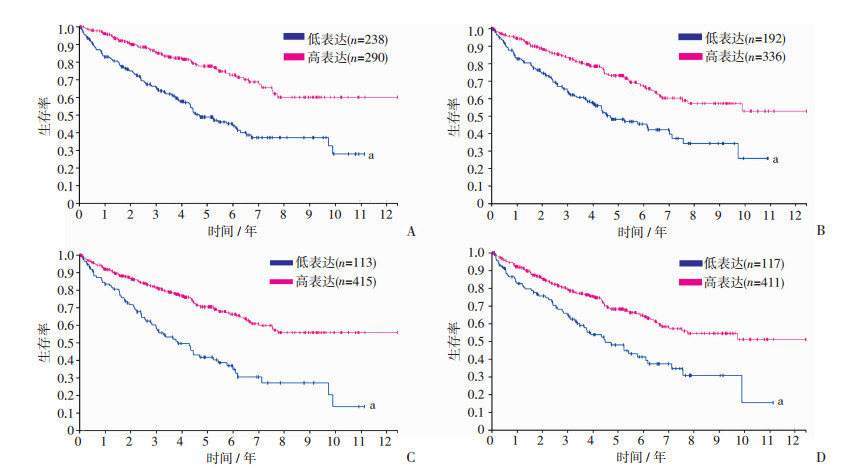
|
| A: NR3C2;B:ESRRG;C:CTDSPL;D: COL4A3;a: P < 0.001,与对应高表达比较 图 8 TRIM2相关基因的高低表达在肾透明细胞癌患者中的生存分析 |
3 讨论
肾细胞癌全球每年有40万新诊患者,并导致14万人死亡[8],肾细胞癌约占成人恶性肿瘤的2%,其中肾透明细胞癌约占所有肾细胞癌的75%[9-10]。目前,由于肾透明细胞癌对各种放化疗和靶向药物不敏感,手术切除仍是肾透明细胞癌的主要治疗方法[11-12]。然而,在行肾切除术后,仍有30%的患者发生远处转移[13]。因此,研究肾透明细胞癌发生、发展的分子机制尤其重要,了解某些分子对肾透明细胞癌的增殖、迁移和干性的影响对开发肾透明细胞癌的早期诊断和新的治疗方法具有重要意义。
泛素化在几乎所有生命活动的调控中都发挥着重要作用,其中泛素化在各种肿瘤的发生、发展中也起到重要作用。VHL(von hippel-lindau)在多种肿瘤中发现为肿瘤抑制基因[14],是一种E3泛素连接酶,可与缺氧诱导因子-1α和-2α(hypoxia inducible fators alpha,HIF-1α和HIF-2α)结合导致HIF-α降解[15],从而抑制肿瘤细胞的增殖[16]。然而,在大多数肾透明细胞癌患者中,VHL发生突变或失活,导致肾癌患者预后较差[17-18]。同样,TRIM2也是一种E3泛素连接酶,且有研究预测TRIM2可能通过降解HIF-α从而抑制肾癌的增殖和转移[19]。肿瘤干细胞在肿瘤里其实只占一小部分,只要放化疗没有杀死所有的肿瘤干细胞,就会有抗药性或是复发的风险出现,TRIM2可以明显抑制肾透明细胞的干性及肿瘤干细胞成球能力,可能为肾透明细胞癌的治疗提供一个新的靶点。TRIM2在卵巢癌、宫颈癌、滤泡癌和骨肉瘤等不同肿瘤中均有差异表达[20-23]。在卵巢癌和滤泡癌的研究中,检测到TRIM2的表达为下调,与本研究的结果一致。然而,在宫颈癌和骨肉瘤中,研究显示了相反的结果,TRIM2表达上调,且在直肠癌中TRIM2通过上皮-间质转化促进直肠癌细胞的转移[24]。虽然TRIM2的潜在机制可能复杂多样,但仍是参与肿瘤发生、发展的重要基因。本研究显示,TRIM2在肾透明细胞癌组织中的表达低于癌旁组织,且TRIM2高表达的患者具有更好的预后,过表达TRIM2抑制肾透明细胞癌细胞的增殖、迁移和干性,表明TRIM2功能障碍可能是肾透明细胞癌进展的因素之一。
为进一步探索TRIM2在肾透明细胞癌发生、发展中的作用机制, 我们从COEXPEDIA数据库构建了一个在肾癌中与TRIM2相关的基因共表达网络,与TRIM2相关程度较高的基因(NR3C2、ESRRG、COL4A3和CTDSPL)可能与肾透明细胞癌的关系较为密切,且NR3C2、ESRRG、COL4A3和CTDSPL四个基因高表达肾透明细胞癌患者的预后均比低表达的患者好。NR3C2在多种肿瘤中扮演抑癌基因的角色,且在肾癌中NR3C2能明显抑制肾癌细胞的增殖、迁移[25]。ESRRG能抑制肾癌细胞的迁移、侵袭[26]。目前未见COL4A3在肾癌中的报道,但在卵巢癌、肺癌中,高表达COL4A3的患者预后均比较好[27-28]。在多种肿瘤中,CTDSPL扮演抑癌基因的角色,且参与细胞周期的调控[29-30]。在与TRIM2相关程度较高的4个基因(NR3C2、ESRRG、COL4A3和CTDSPL)中,TRIM2可能直接或者间接影响了4个基因(NR3C2、ESRRG、COL4A3和CTDSPL)的表达,或4个基因影响了TRIM2的表达,从而共同影响了肾透明细胞癌的增殖、迁移和侵袭。它们均可能作为肾透明细胞癌患者早期诊断及预后的指标。
本研究显示,TRIM2在肾透明细胞癌进展中发挥重要作用,过表达TRIM2抑制肾透明细胞癌细胞的增殖、迁移和干性。与TRIM2相关程度较高的基因(NR3C2、ESRRG、COL4A3和CTDSPL)可能参与肾透明细胞癌的发生、发展。故TRIM2可能作为肾透明细胞癌早期诊断及预后的指标,且可能是治疗肾透明细胞癌的潜在靶点。
| [1] |
刘鑫, 刘小兵, 刘骞, 等. 钙激活核苷酸酶1敲低对肾透明细胞癌769-P细胞增殖和迁移的影响[J]. 第三军医大学学报, 2018, 40(6): 473-478. LIU X, LIU X B, LIU Q, et al. Silencing calcium-activated nucleotidase 1 inhibits proliferation and migration of clear cell renal cell carcinoma 769-P cells[J]. J Third Mil Med Univ, 2018, 40(6): 473-478. DOI:10.16016/j.1000-5404.201711057 |
| [2] |
ARORA H C, FASCELLI M, ZHANG J H, et al. Kidney, ureteral, and bladder cancer: A primer for the internist[J]. Med Clin North Am, 2018, 102(2): 231-249. DOI:10.1016/j.mcna.2017.10.002 |
| [3] |
HAKIMI A A, VOSS M H, KUO F S, et al. Transcriptomic profiling of the tumor microenvironment reveals distinct subgroups of clear cell renal cell cancer: data from a randomized phase Ⅲ trial[J]. Cancer Discov, 2019, 9(4): 510-525. DOI:10.1158/2159-8290.CD-18-0957 |
| [4] |
LIN T C, YEH Y M, FAN W L, et al. Ghrelin upregulates oncogenic aurora A to promote renal cell carcinoma invasion[J]. Cancers (Basel), 2019, 11(3): E303. DOI:10.3390/cancers11030303 |
| [5] |
OHKAWA N, KOKURA K, MATSU-URA T, et al. Molecular cloning and characterization of neural activity-related RING finger protein (NARF): a new member of the RBCC family is a candidate for the partner of myosin V[J]. J Neurochem, 2001, 78(1): 75-87. DOI:10.1046/j.1471-4159.2001.00373.x |
| [6] |
BALASTIK M, FERRAGUTI F, PIRES-DA SILVA A, et al. Deficiency in ubiquitin ligase TRIM2 causes accumulation of neurofilament light chain and neurodegeneration[J]. Proc Natl Acad Sci USA, 2008, 105(33): 12016-12021. DOI:10.1073/pnas.0802261105 |
| [7] |
THOMPSON S, PEARSON A N, ASHLEY M D, et al. Identification of a novel Bcl-2-interacting mediator of cell death (Bim) E3 ligase, tripartite motif-containing protein 2 (TRIM2), and its role in rapid ischemic tolerance-induced neuroprotection[J]. J Biol Chem, 2011, 286(22): 19331-19339. DOI:10.1074/jbc.M110.197707 |
| [8] |
Global Burden of Disease Cancer Collaboration, FITZMAURICE C, ALLEN C, et al. Global, regional, and national cancer incidence, mortality, years of life lost, years lived with disability, and disability-adjusted life-years for 32 cancer groups, 1990 to 2015: A systematic analysis for the global burden of disease study[J]. JAMA Oncol, 2017, 3(4): 524-548. DOI:10.1001/jamaoncol.2016.5688 |
| [9] |
LIU N, HUANG D, CHENG X, et al. Percutaneous radio-frequency ablation for renal cell carcinoma vs. partial nephrectomy: Comparison of long-term oncologic outcomes in both clear cell and non-clear cell of the most common subtype[J]. Urol Oncol, 2017, 35(8): 530.e1-530.e6. DOI:10.1016/j.urolonc.2017.03.014 |
| [10] |
LIU X, HAO Y, YU W, et al. Long non-coding RNA emergence during renal cell carcinoma tumorigenesis[J]. Cell Physiol Biochem, 2018, 47(2): 735-746. DOI:10.1159/000490026 |
| [11] |
JI S Q, SU X L, CHENG W L, et al. Down-regulation of CD74 inhibits growth and invasion in clear cell renal cell carcinoma through HIF-1α pathway[J]. Urol Oncol, 2014, 32(2): 153-161. DOI:10.1016/j.urolonc.2012.09.013 |
| [12] |
ZHANG P, MA X, SONG E, et al. Tubulin cofactor A functions as a novel positive regulator of ccRCC progression, invasion and metastasis[J]. Int J Cancer, 2013, 133(12): 2801-2811. DOI:10.1002/ijc.28306 |
| [13] |
AUDENET F, YATES D R, CANCEL-TASSIN G, et al. Genetic pathways involved in carcinogenesis of clear cell renal cell carcinoma: genomics towards personalized medicine[J]. BJU Int, 2012, 109(12): 1864-1870. DOI:10.1111/j.1464-410X.2011.10661.x |
| [14] |
YANG L, ZHAO Z, ZHAO S, et al. The clinicopathological significance of epigenetic silencing of VHL promoter and renal cell carcinoma: A meta-analysis[J]. Cell Physiol Biochem, 2016, 40(6): 1465-1472. DOI:10.1159/000453198 |
| [15] |
KEITH B, JOHNSON R S, SIMON M C. HIF1α and HIF2α: sibling rivalry in hypoxic tumour growth and progression[J]. Nat Rev Cancer, 2011, 12(1): 9-22. DOI:10.1038/nrc3183 |
| [16] |
FROST J, GALDEANO C, SOARES P, et al. Potent and selective chemical probe of hypoxic signalling downstream of HIF-α hydroxylation via VHL inhibition[J]. Nat Commun, 2016, 7: 13312. DOI:10.1038/ncomms13312 |
| [17] |
ZHAO Z, CHEN C, LIN J, et al. Synergy between von Hippel-Lindau and P53 contributes to chemosensitivity of clear cell renal cell carcinoma[J]. Mol Med Rep, 2016, 14(3): 2785-2790. DOI:10.3892/mmr.2016.5561 |
| [18] |
MARTÍNEZ-SÁEZ O, GAJATE BORAU P, ALONSO-GORDOA T, et al. Targeting HIF-2 α in clear cell renal cell carcinoma: A promising therapeutic strategy[J]. Crit Rev Oncol Hematol, 2017, 111: 117-123. DOI:10.1016/j.critrevonc.2017.01.013 |
| [19] |
XIAO W, WANG X, WANG T, et al. TRIM2 downregulation in clear cell renal cell carcinoma affects cell proliferation, migration, and invasion and predicts poor patients' survival[J]. Cancer Manag Res, 2018, 10: 5951-5964. DOI:10.2147/CMAR.S185270 |
| [20] |
CHEN X, DONG C, LAW P T, et al. MicroRNA-145 targets TRIM2 and exerts tumor-suppressing functions in epithelial ovarian cancer[J]. Gynecol Oncol, 2015, 139(3): 513-519. DOI:10.1016/j.ygyno.2015.10.008 |
| [21] |
WILLIAMS M D, ZHANG L, ELLIOTT D D, et al. Differential gene expression profiling of aggressive and nonaggressive follicular carcinomas[J]. Hum Pathol, 2011, 42(9): 1213-1220. DOI:10.1016/j.humpath.2010.12.006 |
| [22] |
MIYATAKE T, UEDA Y, NAKASHIMA R, et al. Down-regulation of insulin-like growth factor binding protein-5 (IGFBP-5): novel marker for cervical carcinogenesis[J]. Int J Cancer, 2007, 120(10): 2068-2077. DOI:10.1002/ijc.22264 |
| [23] |
QIN Y, YE J, ZHAO F, et al. TRIM2 regulates the development and metastasis of tumorous cells of osteosarcoma[J]. Int J Oncol, 2018, 53(4): 1643-1656. DOI:10.3892/ijo.2018.4494 |
| [24] |
CAO H, FANG Y, LIANG Q W, et al. TRIM2 is a novel promoter of human colorectal cancer[J]. Scand J Gastroenterol, 2019, 54(2): 210-218. DOI:10.1080/00365521.2019.1575463 |
| [25] |
ZHAO Z, ZHANG M, DUAN X, et al. Low NR3C2 levels correlate with aggressive features and poor prognosis in non-distant metastatic clear-cell renal cell carcinoma[J]. J Cell Physiol, 2018, 233(10): 6825-6838. DOI:10.1002/jcp.26550 |
| [26] |
NAM H Y, CHANDRASHEKAR D S, KUNDU A, et al. Integrative epigenetic and gene expression analysis of renal tumor progression to metastasis[J]. Mol Cancer Res, 2019, 17(1): 84-96. DOI:10.1158/1541-7786.MCR-17-0636 |
| [27] |
SIAMAKPOUR-REIHANI S, OWZAR K, JIANG C, et al. Prognostic significance of differential expression of angiogenic genes in women with high-grade serous ovarian carcinoma[J]. Gynecol Oncol, 2015, 139(1): 23-29. DOI:10.1016/j.ygyno.2015.08.001 |
| [28] |
DENG B, MOLINA J, AUBRY M C, et al. Clinical bio-markers of pulmonary carcinoid tumors in never smokers via profiling miRNA and target mRNA[J]. Cell Biosci, 2014, 4: 35. DOI:10.1186/2045-3701-4-35 |
| [29] |
DONG P, XIONG Y, YU J, et al. Control of PD-L1 expression by miR-140/142/340/383 and oncogenic activation of the OCT4-miR-18a pathway in cervical cancer[J]. Oncogene, 2018, 37(39): 5257-5268. DOI:10.1038/s41388-018-0347-4 |
| [30] |
ZHANG L, HE X, LI F, et al. The miR-181 family promotes cell cycle by targeting CTDSPL, a phosphatase-like tumor suppressor in uveal melanoma[J]. J Exp Clin Cancer Res, 2018, 37(1): 15. DOI:10.1186/s13046-018-0679-5 |



