军事训练中长期、反复的骨骼肌肉运动常导致肌腱的急、慢性损伤。肌腱损伤修复术作为肌腱伤的主要治疗方法在临床中广泛应用,但损伤修复术后的肌腱粘连仍然难以解决。屈指肌腱损伤术后发生的粘连常对军事训练造成严重影响,成为非战争减员的重要因素。因此,如何减少术后肌腱粘连情况的发生,促进肌腱的愈合是军事医学中亟待解决的问题[1]。常用的减少肌腱粘连的方法包括改进手术缝合方式、使用生物物理学屏障、局部应用药物和术后物理治疗等[2]。术后早期康复锻炼作为主要的物理治疗方式,其疗效已获得临床认可,但其具体的机制尚没有得到充分的认识[3]。目前研究已确认转化生长因子-β1(transforming growth factor-β1,TGF-β1)在肌腱愈合中发挥重要作用,而TGF-β3作为TGF-β1的同分异构体,在肌腱愈合中的作用却少有报道[4]。另一方面,环磷酸腺苷应答元件结合蛋白(cAMP response element binding protein, CREB)作为转录因子参与TGF-β3的调节,在组织纤维化调控和瘢痕形成等方面同样发挥重要作用。因此本研究拟通过对大鼠的损伤屈趾深肌腱施加被动周期性机械牵伸,研究周期机械牵伸下TGF-β1、TGF-β3和CREB等相关分子的变化,以期为肌腱愈合及肌腱粘连的机制研究提供新思路。
1 材料与方法 1.1 实验材料 1.1.1 动物健康雄性SD大鼠(由陆军军医大学大坪医院实验动物中心提供)18只,体质量200~250 g,单笼饲养。
1.1.2 主要器械及试剂高速冷冻离心机(美国科俊仪器公司),NanoDrop紫外分光光度计(Thermo Fisher美国),荧光定量PCR仪(PALL, 65421),石蜡轮转切片机(Leica德国),组织RNA提取试剂盒(上海奕杉生物科技有限公司,RN002plus),快速逆转录试剂盒(上海奕杉生物科技有限公司,RT001),qPCR反应Mix(上海奕杉生物科技有限公司,QP002),S-P试剂盒(北京中杉金桥生物技术有限公司,SP-9001),DAB显色试剂盒(北京中杉金桥生物技术有限公司,ZLI-9018),DNA合成引物(上海生工),TGF-β1单克隆抗体(Abcam公司),TGF-β3单克隆抗体(Abcam公司),CREB单克隆抗体(Abcam公司)。
1.2 实验方法 1.2.1 动物模型建立SD大鼠腹腔注射麻醉后,取双侧后肢第2~5趾,局部消毒后于掌趾关节与近节趾间关节间行Bruner切口,切开皮肤、皮下组织后将皮瓣向两侧牵开,暴露屈肌腱鞘及屈趾肌腱。在切口中点处横行切开腱鞘,游离出屈趾深肌腱,并在趾半屈曲位时用锐刀将其从掌侧横形做完全切断。用6-0无创缝线做改良Kessler法缝合修复肌腱、并做肌腱周边缝合,最后用5-0缝线间断缝合关闭切口(建模方法见图 1)。手术趾因肌腱断端缝合产生的张力自然固定于半屈位后,同等条件下分笼饲养。
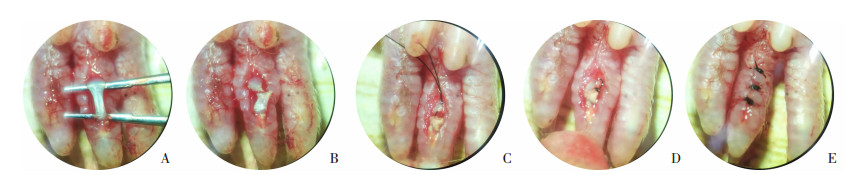
|
| A:分离暴露屈趾肌腱;B:横断屈趾肌腱;C、D:6-0无创缝线改良Kessler法缝合;E:5-0缝线间断缝合皮下组织及皮肤 图 1 屈趾肌腱损伤修复动物模型的建立 |
1.2.2 动物分组与实验干预
实验动物采用随机数表法分为牵伸组、损伤组、假手术组,每组6只,每只8趾。牵伸组按屈趾肌腱损伤修复模型进行动物建模,从术后第72小时开始对手术趾进行被动机械牵伸,牵伸频率为1次/8 h的被动肌腱牵伸运动,每次各趾牵伸范围为45°~135°,每次牵伸次数为100次,牵伸至术后1周。损伤组按上述方法建模后不予施加被动牵伸,允许动物自由活动,但手术趾因肌腱断端的张力作用维持在半屈曲位。假手术组按上述方法切开皮肤后不分离及横断屈趾肌腱,随即缝合皮肤切口,术后允许动物自由活动。
1.2.3 实验标本的获取各组动物肌腱损伤修复模型建立后,按照分组干预措施进行为期1周的干预,并在术后第1、2、4、8周分别对各组实验动物双侧后肢第2、3、4、5趾进行手术取材,各时间点各组取得肌腱标本12趾。方法为麻醉动物后沿原有手术切口切开皮肤及皮下组织,游离愈合的肌腱,快速并完整切下缝合处近、远端各0.2 cm范围的组织标本。缝合手术皮肤伤口后继续正常饲养。
1.3 观察指标 1.3.1 解剖学观察在各取材时间点获取实验标本时,利用光学显微镜对暴露的肌腱进行镜下观察并拍照记录。分别对各肌腱标本的愈合情况进行分级。Ⅰ级:肌腱与腱周组织无粘连;Ⅱ级:肌腱缝合处少量局限性、薄膜状粘连,肉芽组织存在;Ⅲ级:小块带状疏松粘连,与肌腱表面易分离,肌腱滑动受限;Ⅳ级:中等致密粘连,有一定移动性,肌腱滑动明显受限;Ⅴ级:严重广泛的粘连,移动性差,肌腱与腱周组织无分界。比较肌腱愈合情况并分析。
1.3.2 组织学观测各取材时间点的肌腱组织完成解剖学观察后,取缝合处肌腱组织,充分固定后修整为大小约0.2 cm×0.2 cm×0.2 cm组织块,包埋并切成厚度4 μm石蜡切片。苏木精-伊红染色并在显微镜下观察愈合肌腱组织中成纤维细胞的形态、数目以及胶原纤维排布情况。随机选取6个视野,在40倍光镜下拍照,Image Pro Plus 6.0图像软件计算各视野成纤维细胞数目,统计并分析组间差异。
1.3.3 实时荧光定量PCR检测各取材时间点获取的左后趾肌腱组织标本充分裂解,利用试剂盒提取总RNA并测定浓度,逆转录后对合成的cDNA进行质量确定。根据GenBank查找TGF-β1、TGF-β3和CREB的DNA引物,GAPDH为内参引物。SYBR法进行PCR反应。利用相对定量方法确定牵伸组与损伤组在各取材时间点TGF-β1、TGF-β3和CREB mRNA的表达情况,2-ΔΔCt法计算两组样本差异性,并分别与假手术组各基因的水平进行相对表达量的计算。
1.3.4 免疫组织化学法检测用于组织学观察包埋的石蜡组织,在进行HE染色的同时每个组织切取3张切片进行免疫组织化学染色。方法为:烤片后脱蜡至水,微波法抗原修复,S-P试剂盒封闭,TGF-β1、TGF-β3和CREB对应一抗4 ℃孵育过夜。孵育后先后滴加生物素标记的山羊抗兔IgG和辣根酶标记链霉卵白素工作液,DAB显色液显色,苏木精染液复染。每张切片随机选取6个染色良好的视野,100倍光镜下拍照并对TGF-β1、TGF-β3、CREB表达情况进行定位和定性分析。
1.4 统计学分析采用SPSS 20.0统计软件。显微镜下观察的肌腱愈合情况分级采用K-W秩和检验,HE染色下的成纤维细胞数量组间比较采用单因素方差分析,两两比较采用LSD法,PCR相对定量TGF-β1、TGF-β3和CREB的mRNA相对表达情况采用t检验。检验水准:α=0.05。
2 结果手术完成后实验动物各手术趾愈合良好,无局部感染。术后牵伸组1趾,损伤组2趾出现缝合处肌腱断裂,以上样本不参与后续的结果分析。
2.1 大体观察肌腱粘连情况各时间点各组12趾肌腱组织,排除术后断裂的标本后所有参加统计的肌腱断端均得到愈合。镜下观察可见牵伸组肌腱组织与周围组织界限明显,肌腱滑动性较好,肌腱表面可见滑液附着,具有较好的光泽度。损伤组肌腱组织与周围组织粘连广泛,分离暴露较为困难,肌腱表面可见明显的肉芽组织增生,相较于牵伸组标本滑动性和光泽度欠佳。随着愈合时间的延长,牵伸组肌腱在术后2个月时依然与周围组织保持较好的分离度,损伤组肌腱与腱周组织粘连情况更加明显,肌腱的滑动性逐渐变差(图 2)。对牵伸组和损伤组标本的肌腱愈合情况按照表 1进行分级,统计结果表明牵伸组肌腱组织相较损伤组在愈合过程的各个时间点均表现出更好的愈合效果,瘢痕粘连更轻,肌腱滑动性更好,差异有统计学意义(P < 0.05,表 1)。
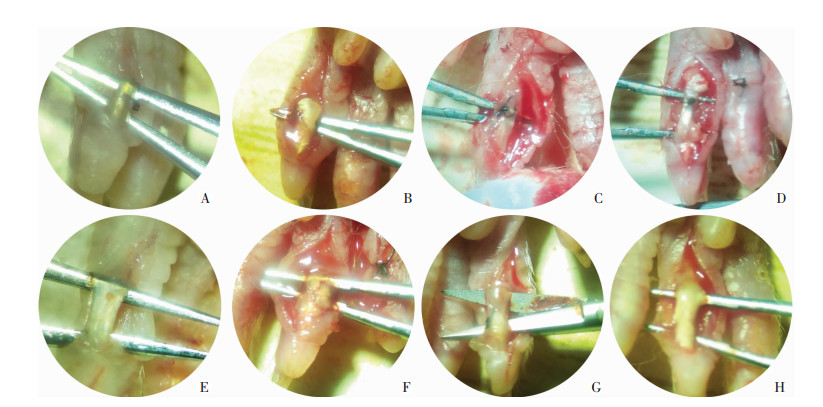
|
| A~D:牵伸组第1、2、4、8周肌腱组织粘连情况;E~H:损伤组第1、2、4、8周肌腱组织粘连情况 图 2 各个观察时间点牵伸组与损伤组肌腱瘢痕粘连情况 |
| 时间 | 组别 | n | 肌腱粘连分级 | 检验统计量 | P值 | ||||
| Ⅰ级 | Ⅱ级 | Ⅲ级 | Ⅳ级 | Ⅴ级 | |||||
| 1周 | 牵伸组 | 11 | 2 | 5 | 3 | 1 | 0 | 25.963 | < 0.001 |
| 损伤组 | 11 | 0 | 1 | 3 | 4 | 3 | |||
| 2周 | 牵伸组 | 12 | 1 | 3 | 4 | 3 | 1 | 9.118 | 0.003 |
| 损伤组 | 12 | 0 | 0 | 4 | 5 | 3 | |||
| 4周 | 牵伸组 | 12 | 0 | 3 | 5 | 3 | 1 | 6.991 | 0.008 |
| 损伤组 | 11 | 0 | 0 | 4 | 5 | 2 | |||
| 8周 | 牵伸组 | 12 | 0 | 3 | 6 | 2 | 1 | 11.299 | 0.001 |
| 损伤组 | 12 | 0 | 0 | 4 | 6 | 2 | |||
2.2 HE染色观察组织胶原纤维排布及成纤维细胞数
术后各取材时间点标本HE染色可见,术后1周牵伸组肌腱的胶原纤维排布呈规则束状分布,成纤维细胞散在分布,可见新生毛细血管。2周时胶原纤维排布更加致密,成纤维细胞数量减少,毛细血管改建。术后4周成纤维细胞细胞核染色加深,胞质细长,逐渐演化为肌腱细胞,形态接近正常肌腱组织形态。损伤组肌腱术后1周时可见大量成纤维细胞聚集分布,毛细血管垂直创面分布且数目较多,胶原排布杂乱不规则,2周时仍可见炎性细胞,术后4周成纤维细胞数目减少,胶原排布形态逐渐规则(图 3)。细胞计数结果显示,牵伸组肌腱中的成纤维细胞数目在术后早期呈现逐渐增多的趋势,在2周时达到峰值后开始逐渐减少;损伤组肌腱的成纤维细胞数目在术后1周即达到峰值,之后逐渐降低。与损伤组相比,牵伸组肌腱组织在术后早期成纤维细胞数目减少,差异具有统计学意义(P < 0.05),4周后两组肌腱成纤维细胞数目差异无统计学意义(表 2)。
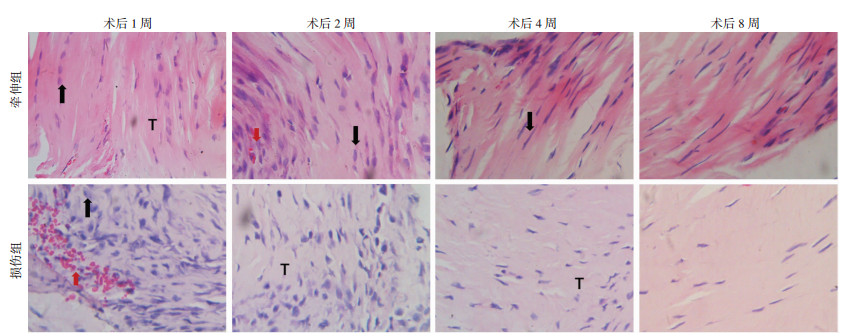
|
| 黑色箭头示成纤维细胞; 红色箭头示毛细血管; T:胶原纤维 图 3 各个观察时间点牵伸组与损伤组肌腱的组织学观察(HE ×40) |
| 时间 | n | 牵伸组 | 损伤组 | 假手术组 |
| 1周 | 12 | 98.34±19.30abc | 378.33±27.09c | 49.87±4.45 |
| 2周 | 12 | 193.40±21.90ab | 299.50±28.23 | 54.32±6.39 |
| 4周 | 12 | 124.09±12.66b | 135.83±19.78c | 49.02±5.20 |
| 8周 | 12 | 89.20±9.28b | 111.67±18.30 | 57.34±4.63 |
| a: P < 0.05,与损伤组比较;b: P < 0.05,与假手术组比较; c: n=11 | ||||
2.3 qRT-PCR相对定量结果
术后各时间点PCR相对定量结果显示,牵伸组与损伤组肌腱TGF-β1的mRNA水平相较假手术组均有高表达,术后1周时牵伸组TGF-β1 mRNA水平低于损伤组,差异有统计学意义(P < 0.05,表 3),2周后两组无明显差异。术后各时间点牵伸组与损伤组TGF-β3 mRNA的表达水平均高于假手术组,但牵伸组的相对表达量在各阶段均高于损伤组(P < 0.05),其在术后2周时达到最高水平,术后8周仍有高水平维持,损伤组TGF-β3 mRNA表达水平在术后各阶段基本相同。牵伸组与损伤组CREB mRNA相对表达量在术后早期均有高表达,随时间延长表达水平递减,其中牵伸组CREB mRNA的水平较损伤组明显上调(P < 0.05),其增量在第2周表现最为明显(图 4)。
| 时间 | n | TGF-β1 | TGF-β3 | CREB | |||||
| 牵伸组 | 损伤组 | 牵伸组 | 损伤组 | 牵伸组 | 损伤组 | ||||
| 1周 | 11 | 0.68±0.02a | 1.15±0.04 | 1.80±0.04a | 1.22±0.01 | 7.21±0.02a | 6.12±0.11 | ||
| 2周 | 12 | 1.99±0.01 | 2.12±0.01 | 3.52±0.05a | 1.25±0.02 | 5.20±0.02a | 1.95±0.07 | ||
| 4周 | 12 | 1.56±0.03 | 1.59±0.01b | 3.42±0.04a | 1.46±0.02b | 1.54±0.02a | 0.57±0.03b | ||
| 8周 | 12 | 1.06±0.07 | 1.05±0.04 | 1.96±0.05a | 1.25±0.01 | 2.28±0.04a | 1.79±0.02 | ||
| a: P < 0.05,与损伤组比较; b: n=11 | |||||||||

|
| a: P < 0.05,与损伤组比较 图 4 qRT-PCR检测各时间点牵伸组与损伤组TGF-β1(A)、TGF-β3(B)与CREB(C) mRNA相对表达量 |
2.4 免疫组化抗原阳性表达结果
术后1周对比可见牵伸组肌腱TGF-β1阳性表达较损伤组有所降低,2周后两组阳性表达无明显差异。牵伸组肌腱在术后各时间点均可见链状排列的TGF-β3阳性表达,损伤组肌腱胞质同样可见明显的TGF-β3阳性表达,但表达强度低于牵伸组。牵伸组术后各阶段均可见CREB的阳性表达,损伤组CREB阳性表达明显低于牵伸组(图 5)。
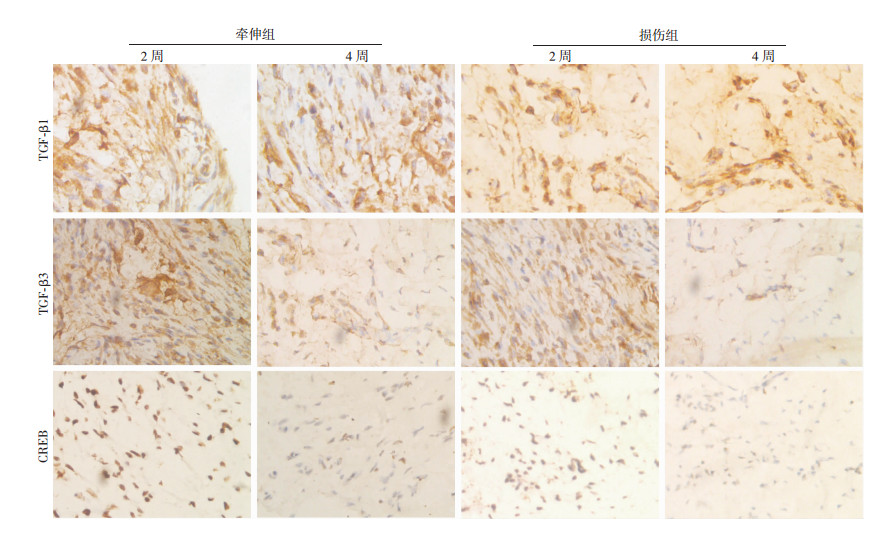
|
| 图 5 免疫组织化学法观察牵伸组与损伤组TGF-β1、TGF-β3与CREB阳性表达(S-P×100) |
3 讨论
周期性被动机械牵伸作为肌腱损伤术后的主要康复方式,其减少肌腱粘连、恢复肌腱功能的效果已得到广泛认可。既往认为牵伸的压力作用促进肌腱周围滑液生成并改善滑液循环,从而为肌腱提供更多营养因子, 同时使新生胶原纤维按力学方向生长,形成致密有序的纤维结构,增加肌腱强度[5]。在本研究中,我们通过对屈趾肌腱损伤修复模型进行术后时长1周的被动机械牵伸,模拟临床早期功能锻炼,以研究周期牵伸减少肌腱粘连的机制。解剖学观察结果显示,经过早期机械牵伸的肌腱在术后早期,肌腱组织与周围的软组织分离明显,肌腱轮廓清晰并且具有较好的滑动性;未经被动牵伸活动的肌腱组织与周围软组织粘连明显,难以分离。术后2个月时实验组肌腱标本相较损伤组仍具有明显的光泽度和良好的滑动性。结果表明机械牵伸在促肌腱愈合过程中发挥着重要的作用。
外源性和内源性两种愈合方式同时存在于肌腱修复的过程中,但愈合早期以外源性愈合为主[6],这也是造成纤维瘢痕形成、肌腱滑动性丧失和肌腱功能障碍的主要原因。被动牵伸可以抑制腱周组织的成纤维细胞向肌腱断端迁移,从而抑制外源性愈合,同时促进肌腱断端成肌腱细胞的分化增殖,促进内源性愈合[7]。在本研究中,经早期被动牵伸的大鼠在肌腱愈合过程中瘢痕粘连较损伤组明显减少。组织学观察发现,损伤组肌腱组织在术后1周成纤维细胞聚集,肉芽组织形成,这是外源性愈合在术后早期发挥作用的表现,该期是组织炎症反应和瘢痕形成的高峰期[8]。牵伸组术后早期肉芽组织较少,说明被动牵伸限制了外源性愈合在伤后早期的作用。牵伸组成纤维细胞的增殖高峰出现在术后2周,这种现象符合内源性愈合的延迟效应[9],我们由此预测机械牵伸通过特定方式促进内源性愈合,诱导肌腱内的成腱细胞增殖完成肌腱的修复。
目前研究已证实TGF-β1是肌腱愈合过程中的关键分子,同时TGF-β1诱导成纤维细胞过度增殖造成肌腱瘢痕愈合[10-12]。我们早期的研究通过体外实验发现核心蛋白聚糖可隔离腱鞘TGF-β1对成纤维细胞的作用,减少Ⅰ型胶原纤维的生成以促进肌腱内源性愈合[13-14]。XIA等[15]在损伤肌腱局部应用TGF-β1中和抗体,发现受损组织瘢痕粘连减少, 愈合强度增加。作为TGF-β1的同分异构体,TGF-β3的增加可以下调TGF-β1,达到抑制瘢痕形成的作用。人胎儿皮肤损伤修复处的愈合以无瘢痕愈合的形式出现,其中TGF-β3高表达,而TGF-β1表达偏低[16]。绵羊和鸡胚胎的相关实验中均有类似的现象出现[17]。JIANG等[18]研究证实负载TGF-β3的壳聚糖缓释滑膜鞘可以通过外源性TGF-β3减少粘连,促进屈趾肌腱的无瘢痕愈合。这些研究都从一定程度上证明了TGF-β3对于肌腱愈合的重要作用。
CREB是调控组织纤维化和瘢痕形成的重要因子,启动TGF-β3的转录使其表达增加[19]。国内外研究发现CREB在对抗肝脏和心肌纤维化中发挥了重要作用[20-21],证实CREB可以通过TGF-β信号通路影响纤维化过程[22-23]。本研究实时荧光定量结果表明,对比假手术组,牵伸组和损伤组在术后TGF-β3和CREB的转录水平均有上调,这种表现在牵伸组更加明显,高峰持续时间也更长。而TGF-β1在术后早期的表达较损伤组显著降低,提示被动牵伸促进TGF-β3的表达从而抑制TGF-β1的产生,通过平衡TGF-β1和TGF-β3的比例减少细胞外基质堆积和瘢痕组织形成。免疫组化结果与上述结果相符,牵伸组在术后早期TGF-β1阳性表达表达相对较低,同时可见链状TGF-β3和颗粒状CREB的阳性表达增加,提示被动牵伸在肌腱愈合早期限制TGF-β1的外源性愈合并通过促进TGF-β3、CREB表达诱导内源性愈合的可能。
本研究发现经周期性机械牵伸的肌腱在术后愈合过程中相较未施加干预的损伤肌腱存在TGF-β3和CREB的高表达,并在术后早期出现TGF-β1的表达降低,同时可见牵伸肌腱在愈合过程中瘢痕粘连减少和肌腱滑动性增加。这些结果提示周期性被动牵伸促进肌腱组织愈合减少瘢痕形成的作用与TGF-β1、TGF-β3和CREB表达水平的变化密切相关,但其具体机制尚不清楚,或与TGF-β3/CREB通路的启动和TGF-β1的早期抑制有关。TGF-β3与CREB如何相互影响并反馈调节,TGF-β3如何平衡TGF-β1发挥抑制肌腱纤维化、促进肌腱内源性愈合的作用需要深入研究。未来将进一步探讨肌腱细胞力学-生物信号转导机制,为增强手术治疗的靶向作用、提高军事训练伤疗效提供新的研究思路。
| [1] |
KHANNA A, FRIEL M, GOUGOULIAS N, et al. Prevention of adhesions in surgery of the flexor tendons of the hand: what is the evidence?[J]. Br Med Bull, 2009, 90: 85-109. DOI:10.1093/bmb/ldp013 |
| [2] |
LOISELLE A E, KELLY M, HAMMERT W C. Biological augmentation of flexor tendon repair: A challenging cellular landscape[J]. J Hand Surg Am, 2016, 41(1): 144-149. DOI:10.1016/j.jhsa.2015.07.002 |
| [3] |
KJAER M, LANGBERG H, HEINEMEIER K, et al. From mechanical loading to collagen synthesis, structural changes and function in human tendon[J]. Scand J Med Sci Sports, 2009, 19(4): 500-510. DOI:10.1111/j.1600-0838.2009.00986.x |
| [4] |
JIANG C Y, SHAO L, WANG Q J, et al. Repetitive mechanical stretching modulates transforming growth factor-β induced collagen synthesis and apoptosis in human patellar tendon fibroblasts[J]. Biochem Cell Biol, 2012, 90(5): 667-674. DOI:10.1139/o2012-024 |
| [5] |
TESTA S, COSTANTINI M, FORNETTI E, et al. Combination of biochemical and mechanical cues for tendon tissue engineering[J]. J Cell Mol Med, 2017, 21(11): 2711-2719. DOI:10.1111/jcmm.13186 |
| [6] |
汤锦波. 手屈指肌腱损伤的临床修复效果[J]. 中华创伤骨科杂志, 2006, 8(1): 8-12. TANG J B. Current repairs of flexor tendon injuries in the hand[J]. Chin J Orthop Trauma, 2006, 8(1): 8-12. DOI:10.3760/cma.j.issn.1671-7600.2006.01.003 |
| [7] |
KILLIAN M L, CAVINATTO L, GALATZ L M, et al. The role of mechanobiology in tendon healing[J]. J Shoulder Elbow Surg, 2012, 21(2): 228-237. DOI:10.1016/j.jse.2011.11.002 |
| [8] |
陈亮, 尹良军, 梁凯路, 等. 大鼠跟腱损伤修复局部生长因子内源性表达变化的研究[J]. 重庆医学, 2012, 41(15): 1476-1478. CHEN L, YIN L J, LIANG K L, et al. Study on change of endogenous expression of local growth factor in repair of rat achilles tendon injury[J]. Chongqing Med, 2012, 41(15): 1476-1478. DOI:10.3969/j.issn.1671-8348.2012.15.008 |
| [9] |
KLIFTO C S, CAPO J T, SAPIENZA A, et al. Flexor tendon injuries[J]. J Am Acad Orthop Surg, 2018, 26(2): e26-e35. DOI:10.5435/jaaos-d-16-00316 |
| [10] |
窦永峰, 房清敏, 王志刚, 等. TGF-β1抗体复合生物蛋白胶预防鞘管区屈肌腱粘连的组织学观察[J]. 中国矫形外科杂志, 2012, 20(16): 1489-1492. DOU Y F, FANG Q M, WANG Z G, et al. The preventing effect of the compound of transforming growth factor-β1 antibody with fibrin glue (TGFβ1 Ab +FG) on postoperative adhesions in the chicken's flexor tendon in zone Ⅱ (no man's land)[J]. Orthop J China, 2012, 20(16): 1489-1492. DOI:10.3977/j.issn.1005-8478.2012.16.14 |
| [11] |
MAJEWSKI M, HEISTERBACH P, JAQUIÉRY C, et al. Improved tendon healing using bFGF, BMP-12 and TGFβ1 in a rat model[J]. Eur Cell Mater, 2018, 35: 318-334. DOI:10.22203/eCM.v035a22 |
| [12] |
姜士超, 刘珅, 范存义. 肌腱粘连机制及预防的研究进展[J]. 中国修复重建外科杂志, 2013, 27(5): 633-636. JIANG S C, LIU S, FAN C Y. Research progress of mechanism and prevention of peritendinous adhesions[J]. Chin J Repar Reconstr Surg, 2013, 27(5): 633-636. DOI:10.7507/1002-1892.20130139 |
| [13] |
熊雁, 张正治, 傅晓岚, 等. 核心蛋白聚糖对兔肌腱细胞增殖及细胞周期的影响[J]. 第三军医大学学报, 2006, 28(17): 1761-1764. XIONG Y, ZHANG Z Z, FU X L, et al. Effect of decorin on proliferation and cell cycle of rabbit tendon cells in vitro[J]. J Third Mil Med Univ, 2006, 28(17): 1761-1764. DOI:10.3321/j.issn:1000-5404.2006.17.009 |
| [14] |
熊雁, 张正治, 可金星, 等. 核心蛋白聚糖对兔屈趾肌腱损伤位点胶原纤维形成以及成纤维细胞增殖的延迟效应[J]. 中国临床康复, 2005, 9(30): 101-103. XIONG Y, ZHANG Z Z, KE J X, et al. Delayed effects of decorin on the formation of collagen fibers and the proliferation of fibroblasts at the injured site of the flexor tendon of toes in rabbits[J]. Chin J Clin Rehabil, 2005, 9(30): 101-103. DOI:10.3321/j.issn:1673-8225.2005.30.032 |
| [15] |
XIA C S, YANG X Y, WANG Y Z, et al. Tendon healing in vivo and in vitro: neutralizing antibody to TGF-β improves range of motion after flexor tendon repair[J]. Orthopedics, 2010, 33(11): 809. DOI:10.3928/01477447-20100924-06 |
| [16] |
FINNSON K W, MCLEAN S, DI GUGLIELMO G M, et al. Dynamics of transforming growth factor beta signaling in wound healing and scarring[J]. Adv Wound Care, 2013, 2(5): 195-214. DOI:10.1089/wound.2013.0429 |
| [17] |
KUO C K, PETERSEN B C, TUAN R S. Spatiotemporal protein distribution of TGF-betas, their receptors, and extracellular matrix molecules during embryonic tendon development[J]. Dev Dyn, 2008, 237(5): 1477-1489. DOI:10.1002/dvdy.21547 |
| [18] |
JIANG K, WANG Z M, DU Q Y, et al. A new TGF-β3 controlled-released chitosan scaffold for tissue engineering synovial sheath[J]. J Biomed Mater Res A, 2014, 102(3): 801-807. DOI:10.1002/jbm.a.34742 |
| [19] |
MALLANO T, PALUMBO-ZERR K, ZERR P, et al. Activating transcription factor 3 regulates canonical TGFβ signalling in systemic sclerosis[J]. Ann Rheum Dis, 2016, 75(3): 586-592. DOI:10.1136/annrheumdis-2014-206214 |
| [20] |
DENG L, LI Y, HUANG J M, et al. Effects of p-CREB-1 on transforming growth factor-β3 auto-regulation in hepatic stellate cells[J]. J Cell Biochem, 2011, 112(4): 1046-1054. DOI:10.1002/jcb.23017 |
| [21] |
CHAN E C, DUSTING G J, GUO N, et al. Prostacyclin receptor suppresses cardiac fibrosis: role of CREB phosphorylation[J]. J Mol Cell Cardiol, 2010, 49(2): 176-185. DOI:10.1016/j.yjmcc.2010.04.006 |
| [22] |
DENG X L, DENG L, WANG P, et al. Post-translational modification of CREB-1 decreases collagen Ⅰ expression by inhibiting the TGF-β1 signaling pathway in rat hepatic stellate cells[J]. Mol Med Rep, 2016, 14(6): 5751-5759. DOI:10.3892/mmr.2016.5926 |
| [23] |
SCHILLER M, DENNLER S, ANDEREGG U, et al. Increased cAMP levels modulate transforming growth factor-beta/Smad-induced expression of extracellular matrix components and other key fibroblast effector functions[J]. J Biol Chem, 2010, 285(1): 409-421. DOI:10.1074/jbc.M109.038620 |



