2. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院:放射科
2. Department of Radiology, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
重度抑郁障碍(major depressive disorder,MDD)是一种高发病率、高复发率、高致残率、高自杀率、严重损害人类身心健康的精神疾病,主要表现为情绪低落或快感缺失。研究发现,MDD患者存在大脑灰质、脑白质体积和静息态默认网络改变[1-3],初步揭示了大脑灰质、白质体积改变和默认网络功能的异常与认知-情绪有关[4-6],但关于MDD脑白质神经环路改变的认识尚不清楚。脑白质神经环路是信息传递的载体,正是因为脑白质神经环路的信息传递,才能保证脑灰质结构之间及时进行信息沟通,从而维持大脑正常工作,如果脑白质神经环路受损或者异常,可能会导致大脑功能障碍。近年来,许多研究利用弥散张量成像技术(diffusion tensor imaging, DTI)对MDD患者脑白质神经环路进行探索性研究,但结果并不完全一致,如:BLOOD等[7]发现,与对照组相比,MDD组腹侧被盖区/黑质(VTA/SN)区域的各向异性分数(fractional anisotropy, FA)较高,而BRACHT等[8]却发现在VTA区域,MDD组FA值降低;WANG等[9]研究发现,MDD组左侧上纵束FA值较对照组升高,而XIA等[10]研究发现MDD组左侧上纵束FA值出现降低。上述研究结果不一致可能是由于MDD组年龄层次、分析方法以及病程等差异所致。有研究发现,成长期随着年龄增加,脑白质会发生变化,脑白质FA值增加[11],提示如果研究选择的样本年龄跨度大,可能会影响研究结果。从以往发表相关文献来看,许多研究倾向于研究整个青年期(15~35岁)及成年中晚期的变化[10, 12-14],研究所选年龄段跨度大且鲜有对青年中期人群(18~25岁)[15]进行研究。而青年中期人群正值步入社会、寻找工作、确定职业方向、婚恋等个人生活和事业启动最重要的时期,必然面临多种多样的应激压力,使得青年中期人群罹患MDD的风险相比其他年龄段更高[16]。本研究针对青年中期MDD进行研究,探索青年中期MDD脑白质神经环路的改变,从而为临床早期识别、预防和干预青年中期MDD提供参考。
1 资料与方法 1.1 研究对象选取2018年6-12月于本院医学心理科就诊的青年中期人群首发MDD患者23例为抑郁症组,其中男性5例,女性18例,年龄18~25(19.43±1.97)岁。入组标准:①美国国立精神卫生研究所编制流调中心用抑郁量表(center for epidemiological studies depression scale, CES-D)>20分;②符合美国精神障碍诊断与统计手册第4版(diagnostic and statistical manual of mental disorders Ⅳ, DSM-Ⅳ);③抑郁程度评分达到美国精神障碍诊断与统计手册第5版推荐的9条患者健康问卷(the 9-item Patient Health Questionnaire, PHQ-9) 15分及以上;④年龄18~25岁;⑤中国汉族人群;⑥首次抑郁发作;⑦右利手。排除标准:①抑郁发作继发于脑器质性精神障碍、精神活性物质使用、严重躯体疾病及其他精神障碍;②患有神经系统疾病或心、肝、肾、血液、内分泌等其他重大躯体疾病;③患有其他精神疾病;④核磁禁忌症和幽闭恐惧症;⑤入组前曾经或正在接受药物或其他治疗干预。
选取性别、年龄和教育程度匹配的正常志愿者25例作为对照组,其中男性5例,女性20例,年龄18~23(19.48±1.29)岁。入组标准:①CES-D < 15分;②年龄18~25岁; ③中国汉族人群; ④右利手; ⑤身心健康。排除标准:①患有精神疾病、神经系统疾病或其他躯体疾病;②既往精神疾病和重大躯体疾病史;③核磁禁忌症和幽闭恐惧症。
入组受试者均先通过CES-D量表筛查,经过筛查后的抑郁症受试者,由2名高年资精神科医师根据MDD诊断标准进行评判,排除共病,评判结果一致后,符合MDD诊断且PHQ-9≥15分纳入抑郁症组。本研究经本院伦理委员会批准(KY201857),受试者均签署知情同意书。
1.2 DTI检测使用Siemens 3.0 T Trio MR扫描仪及头部8通道标准头线圈采集DTI数据,检查前告知受试者检查过程,消除受试者紧张情绪,嘱受试者保持清醒安静状态。扫描时使用软垫垫于受试者头下,让受试者感觉舒适,同时佩戴防噪音耳塞和耳机,降低噪音干扰。DTI采用平面回波序列,扫描参数:TR=10 000 ms,TE=92 ms,视野(FOV)=230 mm×230 mm,矩阵(matrix)=128×128,b值=1 000 s/mm2,64个扩散梯度方向,无间距75层轴面图像,层厚=2.0 mm。
1.3 数据处理分析采用FMRIB Software Library v5.09(https://fsl.fmrib.ox.ac.uk/fsl/fslwiki)软件。DTI数据预处理步骤:①使用Eddy current correction进行头动和涡流校正;②进行梯度方向校正;③获取b0图像并利用BET工具将b0图像的脑外图像去除,获得mask;④利用dtifit功能对校正后的图像进行张量计算,得到各向异性分数(fractional anisotropy, FA)、径向扩散系数(radial diffusivity, RD)、平均扩散系数(mean diffusion, MD)以及轴向扩散系数(axial diffusivity, AD)等指标。基于纤维束示踪的空间统计(tract-based spatial statistics,TBSS)分析步骤:①利用非线性配准将个体FA配准到标准空间(FMRIB58_FA模板);②基于所有配准到标准空间的FA图像构建平均FA图及白质骨架;③为平均FA图取阈值0.2,保留阈值以上纤维束;④在进行完FA分析后,将其他指标(MD、AD和RD)通过FA的非线性配准到标准空间,并得所有配准后的MD、AD和RD图对应骨架。
1.4 统计学分析对两组中的FA、MD、RD值图像和AD值图像,利用FSL软件中Randomise进行置换检验(次数为5 000次),使用无阈值簇群增强(Threshold-Free Cluster Enhancement, TFCE)方法进行多重比较校正,P < 0.05为差异有统计学意义。采用SPSS 20.0统计软件,年龄、教育程度、病程、CES-D分数和PHQ-9分数采用独立样本t检验,数据以x±s表示,性别采用χ2检验,提取差异有统计学意义的抑郁症组FA值和RD值与PHQ-9评分和病程进行皮尔森(Pearson)相关分析,P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料抑郁症组和对照组比较,年龄、性别和教育程度差异无统计学意义;两组CES-D分数、PHQ-9分数和病程差异有统计学意义(P < 0.05,表 1)。
| 组别 | n | 年龄/岁 | 性别(男/女) | 教育程度/年 | CES-D评分 | PHQ-9评分 | 病程/周 |
| 抑郁症组 | 23 | 19.43±1.97 | 5/18 | 13.82±1.30 | 41.34±6.00 | 19.04±4.51 | 11.64±5.24 |
| 对照组 | 25 | 19.48±1.29 | 5/20 | 14.12±0.73 | 8.32±5.75 | 2.44±2.22 | 0.00±0.00 |
| P值 | 0.925 | 1.000 | 0.347 | < 0.001 | < 0.001 | < 0.001 |
2.2 TBSS分析
与对照组比较,抑郁症组左侧上纵束、右侧丘脑前辐射以及双侧皮质脊髓束FA值低于对照组(TFCE, P < 0.05,表 2、图 1)。抑郁症组左侧上纵束RD值高于对照组(TFCE, P < 0.05,表 2、图 2)。两组MD值和AD值差异无统计学意义(TFCE, P>0.05)。纤维素区域参照“JHU White-Matter Tractography Atlas”进行划分。
| 指标 | 峰值区域 | Voxel (体素) |
MNI峰值坐标/mm | TFCE校正P值 | ||
| X | Y | Z | ||||
| FA值 | 左侧上纵束 | 14 | -33 | -41 | 43 | 0.049 |
| 右侧丘脑前辐射 | 118 | 25 | -40 | 26 | 0.041 | |
| 右侧皮质脊髓束 | 122 | 19 | -20 | 51 | 0.046 | |
| 左侧皮质脊髓束 | 4 980 | -25 | -14 | 11 | 0.007 | |
| RD值 | 左侧上纵束 | 34 790 | -20 | -11 | 3 | 0.002 |
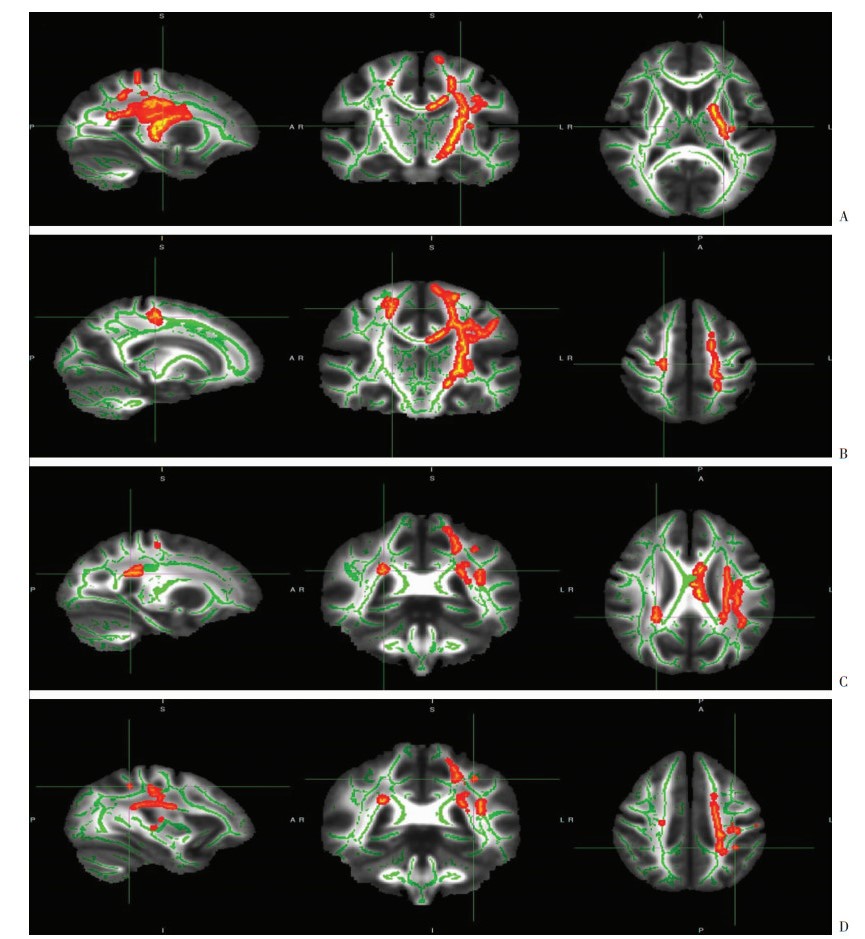
|
| A:左侧皮质脊髓束,十字交叉线MNI峰值坐标(mm)为X=-25、Y=-14、Z=11;B:右侧皮质脊髓束,十字交叉线MNI峰值坐标(mm)为X=19、Y=-20、Z=51;C:右侧前丘脑辐射,十字交叉线MNI峰值坐标(mm)为X=25、Y=-40、Z=26;D:左侧上纵束,十字交叉线MN峰值I坐标(mm)为X=-33、Y=-41、Z=43;由左向右分别为矢状位、冠状位和轴位图像;绿色体素部分显示FA白质骨架,红黄色体素部分显示抑郁症组相对于对照组FA值降低区域 图 1 抑郁症组和对照组FA值降低区域图像 |
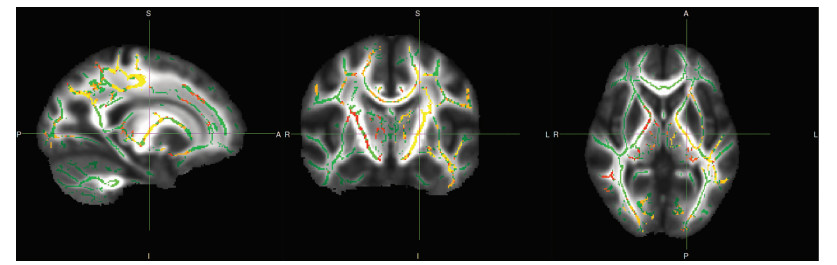
|
| 左侧上纵束,十字交叉线MNI峰值坐标(mm)为X=-20,Y=-11,Z=3;由左向右分别为矢状位、冠状位和轴位图像;绿色体素部分显示FA白质骨架,红黄色体素部分显示抑郁症相对于对照组RD值增加区域 图 2 抑郁症组和对照组RD值增加区域图像 |
2.3 FA值和RD值与PHQ-9评分和病程相关分析
提取上述两组差异有统计学意义的纤维束FA值和RD值,与PHQ-9评分和病程进行Pearson相关分析,其中病程与左侧皮质脊髓束FA值呈现负相关(r=- 0.659,P < 0.05),与左侧上纵束RD值呈现正相关(r=0.534,P < 0.05),其余指标未显示出有明显相关性(表 3)。
| 量表类型 | 统计值 | FA值 | RD值 | ||||
| 左侧上纵束 | 右侧丘脑前辐射 | 右侧皮质脊髓束 | 左侧皮质脊髓束 | 左侧上纵束 | |||
| PHQ-9 | r值 | 0.229 | -0.345 | -0.005 | 0.002 | 0.111 | |
| P值 | 0.293 | 0.107 | 0.983 | 0.991 | 0.615 | ||
| 病程 | r值 | -0.021 | -0.198 | -0.091 | -0.659 | 0.534 | |
| P值 | 0.924 | 0.365 | 0.680 | 0.001 | 0.009 | ||
3 讨论
本研究利用DTI技术探索青年中期人群首发MDD脑白质神经环路结构差异以及脑白质神经环路结构的改变与抑郁程度和病程之间的关系,为了避免抗抑郁药物和MDD复发对探索MDD神经病理机制的影响,在青年中期人群中选择首发MDD以及未治疗的患者作为研究对象,选择年龄、性别和教育程度相匹配的健康人群作对照组。结果显示:青年中期人群MDD组[(19.43±1.97)岁]左侧上纵束FA值低于对照组,与LAI等[17]对成年早期人群[MDD:(36.91±5.31)岁]、OTA等[18]对成年中期人群[MDD:(42.3±10.0)岁]和DALBY等[19]对成年中晚期人群[MDD:(57.4±4.6)岁]的研究结果类似,说明青年中期MDD患者可能与其他年龄段MDD患者类似,都存在左侧上纵束细微结构的损伤。本研究中,MDD组左上纵束RD值高于对照组,RD值与MDD病程呈现正相关,提示可能随着病程延长,左侧上纵束髓鞘结构的损害增加,进而影响了纤维束的完整性。上纵束存在大脑两侧,连接着额叶、枕叶、顶叶和颞叶,在执行控制、认知过程和情绪调节中起着关键作用,广泛参与工作记忆、体感反应、空间注意力、语言和运动行为[20-22]。由此可见,左侧上纵束神经微结构的改变可能对青年中期MDD患者认知过程和情绪调节产生影响,并参与疾病的发展过程。
本研究还发现,与对照组比较,青年中期人群MDD组右侧丘脑前辐射FA值降低,该结果与BESSETTE等[23]报道的青年早期人群[MDD:(17.10± 1.88)岁]和JIANG等[24]报道的成年早期人群[MDD:(29.54±8.57)岁]的研究结果一致。丘脑前辐射是额叶-皮质下回路组成之一[25],该回路通过纹状体、苍白球、黑质亚纹状体和丘脑回到额叶皮质,从而连接额叶皮质特定区域(运动区、辅助运动区、背外侧前额皮质、前扣带回皮质和眶额叶皮质)[26],广泛参与大脑认知、执行功能和情绪表达[27-28]。丘脑前辐射微结构的异常可能使MDD患者认知受损以及情绪不稳定[29],提示该纤维束的损伤可能参与MDD神经病理机制[30]。本研究发现青年中期人群MDD右丘脑前辐射细微结构出现改变,提示该细微结构的改变也可能与青年中期人群MDD的神经病理机制有关。
此外,本研究结果显示青年中期人群MDD组较对照组双侧皮质脊髓束FA值降低,与BESSETTE等[23]报道的青年早期人群、LIU等[25]报道的成年中期人群[MDD:(41.8±11.0)岁]和KAKEDA等[31]报道的成年中晚期人群[MDD:(47.1±15.2)岁]研究结果相同,但与SACCHET等[32]报道的青年中晚期人群[MDD:(35.6±8.4)岁]结果不一致。其可能原因在于SACCHET等未采用本研究使用的TBSS技术,而是采用自动纤维定向技术(AFQ)和最大路径密度程序技术(MDP),发现MDD组双侧皮质脊髓束FA值较对照组高。其次,本研究发现左侧皮质脊髓束FA值与MDD病程显现负相关,提示随着病程延长,左侧皮质脊髓束细微结构改变逐渐增加。皮质脊髓束的纤维束来自初级运动皮层、辅助运动区、运动前皮层、体感皮层、顶叶和扣带回[33],将神经信号由大脑皮质传递到脊髓。相对于认知-情感环路的纤维束而言,皮质脊髓束对于MDD的意义尚不是很明确,相关报道相对较少,有研究推测皮质脊髓束可能与MDD精神动力缺乏有关,其原因可能是连接脑干和皮质灰质运动区白质微结构的改变所致[34]。本研究也显示青年中期人群出现双侧皮质脊髓束细微结构的改变,特别是左侧皮质脊髓束与病程相关,揭示皮质脊髓束可能参与青年中期MDD患者的病理机制中,但是皮质脊髓束是如何影响MDD症状的,还需要进一步研究才能揭示。
有研究显示MDD患者左侧上纵束、右侧丘脑前辐射FA值与抑郁严重程度呈现负相关[17, 35],而本研究未能发现左侧上纵束FA值和RD值、右侧丘脑前辐射FA值以及双侧皮质脊髓束FA值和抑郁严重程度相关,可能原因是:①使用的量表不一致,既往文献都采取他评量表汉密尔顿抑郁量表(HAMD)[17]来评价抑郁严重程度,而本研究使用的是根据DSM-V诊断标准制定的自评量表PHQ-9,该量表由美国精神病学会(APA)推荐,即可以评估抑郁程度,也可以进行科研研究。该量表以10分为判断点时,其特异度和敏感度为80%[36],许多研究使用PHQ-9作为抑郁严重程度评价指标[37-38],可能是由于量表之间的差异性,量表评估的方法和内容不一致,本研究未能发现相关性。②选择的年龄段不同,本研究选择的是青年中期,而LAI等[17]和CULLEN等[35]分别选择成年早期人群和青年早期人群,可能是由于年龄段选择不一致,脑白质细微结构有差别,导致未能发现相关性。③可能是本研究样本量较少,未能发现更多的脑白质细微结构的差异,从而未能够揭示脑白质纤维束微结构的改变与抑郁症状的相关关系。
综上所述,本研究发现青年中期人群MDD组相对于正常对照组,在左上纵束、右侧丘脑前辐射以及双侧皮质脊髓束均出现细微结构改变,该结果与其他年龄段神经病理改变是一致的。另外,左上纵束和左侧皮质脊髓束与病程相关,提示其可能参与青年中期MDD症状发展过程。相对于既往发表文献,本研究针对青年中期人群探索MDD神经病理机制,为研究MDD神经病理机制提供了新的年龄阶段的补充和证据。但本研究也存在一些不足:首先,样本量较少,对于揭示更加细微的脑白质神经环路改变的检验效能不够;其次,所采用的TBSS分析技术,不能很好解决纤维交叉问题,对于有纤维交叉的区域不能准确区分;最后,本研究是横向研究,不能确定青年中期MDD患者脑白质神经环路结构改变和症状之间的因果关系。本研究将在今后的研究中扩大样本量,采用多种分析技术,更加全面地探索青年中期人群MDD的神经病理机制。
| [1] |
WANG L, HERMENS D F, HICKIE I B, et al. A systematic review of resting-state functional-MRI studies in major depression[J]. J Affect Disord, 2012, 142(1/2/3): 6-12. DOI:10.1016/j.jad.2012.04.013 |
| [2] |
DU M Y, LIU J, CHEN Z Q, et al. Brain grey matter volume alterations in late-life depression[J]. J Psychiatry Neurosci, 2014, 39(6): 397-406. DOI:10.1503/jpn.130275 |
| [3] |
ZENG L L, LIU L, LIU Y D, et al. Antidepressant treatment normalizes white matter volume in patients with major depression[J]. PLoS ONE, 2012, 7(8): e44248. DOI:10.1371/journal.pone.0044248 |
| [4] |
MACMASTER F P, MIRZA Y, SZESZKO P R, et al. Amygdala and hippocampal volumes in familial early onset major depressive disorder[J]. Biol Psychiatry, 2008, 63(4): 385-390. DOI:10.1016/j.biopsych.2007.05.005 |
| [5] |
ZHONG X, PU W D, YAO S Q. Functional alterations of fronto-limbic circuit and default mode network systems in first-episode, drug-naïve patients with major depressive disorder: A meta-analysis of resting-state fMRI data[J]. J Affect Disord, 2016, 206: 280-286. DOI:10.1016/j.jad.2016.09.005 |
| [6] |
CARCELLER-SINDREU M, SERRA-BLASCO M, DE DIEGO-ADELIÑO J, et al. Altered white matter volumes in first-episode depression: Evidence from cross-sectional and longitudinal voxel-based analyses[J]. J Affect Disord, 2019, 245: 971-977. DOI:10.1016/j.jad.2018.11.085 |
| [7] |
BLOOD A J, IOSIFESCU D V, MAKRIS N, et al. Microstructural abnormalities in subcortical reward circuitry of subjects with major depressive disorder[J]. PLoS ONE, 2010, 5(11): e13945. DOI:10.1371/journal.pone.0013945 |
| [8] |
BRACHT T, HORN H, STRIK W, et al. White matter microstructure alterations of the medial forebrain bundle in melancholic depression[J]. J Affect Disord, 2014, 155: 186-193. DOI:10.1016/j.jad.2013.10.048 |
| [9] |
WANG Y F, XU C, ZHANG A X, et al. White matter abnormalities in medication-naïve adult patients with major depressive disorder: tract-based spatial statistical analysis[J]. Neuro Endocrinol Lett, 2014, 35(8): 697-702. |
| [10] |
XIA W P, ZHOU R B, ZHAO G Q, et al. Abnormal white matter integrity in Chinese young adults with first-episode medication-free anxious depression: A possible neurological biomarker of subtype major depressive disorder[J]. Neuropsychiatr Dis Treat, 2018, 14: 2017-2026. DOI:10.2147/NDT.S169583 |
| [11] |
GIORGIO A, WATKINS K E, CHADWICK M, et al. Longitudinal changes in grey and white matter during adolescence[J]. Neuroimage, 2010, 49(1): 94-103. DOI:10.1016/j.neuroimage.2009.08.003 |
| [12] |
GUO W B, LIU F, XUE Z M, et al. Altered white matter integrity in young adults with first-episode, treatment-naive, and treatment-responsive depression[J]. Neurosci Lett, 2012, 522(2): 139-144. DOI:10.1016/j.neulet.2012.06.027 |
| [13] |
LI L J, MA N, LI Z X, et al. Prefrontal white matter abnormalities in young adult with major depressive disorder: A diffusion tensor imaging study[J]. Brain Res, 2007, 1168: 124-128. DOI:10.1016/j.brainres.2007.06.094 |
| [14] |
ZOU K, HUANG X Q, LI T, et al. Alterations of white matter integrity in adults with major depressive disorder: A magnetic resonance imaging study[J]. J Psychiatry Neurosci, 2008, 33(6): 525-530. |
| [15] |
林崇德. 发展心理学[M]. 2版. 北京: 人民教育出版社, 2008: 370-372. LIN C D. Developmental psychology[M]. 2nd ed. Beijing: People Education Press, 2008: 370-372. |
| [16] |
BREEDVELT J J F, KANDOLA A, KOUSOULIS A A, et al. What are the effects of preventative interventions on major depressive disorder (MDD) in young adults? A systematic review and meta-analysis of randomized controlled trials[J]. J Affect Disord, 2018, 239: 18-29. DOI:10.1016/j.jad.2018.05.010 |
| [17] |
LAI C H, WU Y T. Alterations in white matter micro-integrity of the superior longitudinal fasciculus and anterior thalamic radiation of young adult patients with depression[J]. Psychol Med, 2014, 44(13): 2825-2832. DOI:10.1017/S0033291714000440 |
| [18] |
OTA M, NODA T, SATO N, et al. White matter abnormalities in major depressive disorder with melancholic and atypical features: A diffusion tensor imaging study[J]. Psychiatry Clin Neurosci, 2015, 69(6): 360-368. DOI:10.1111/pcn.12255 |
| [19] |
DALBY R B, FRANDSEN J, CHAKRAVARTY M M, et al. Depression severity is correlated to the integrity of white matter fiber tracts in late-onset major depression[J]. Psychiatr Res, 2010, 184(1): 38-48. DOI:10.1016/j.pscychresns.2010.06.008 |
| [20] |
WANG X H, PATHAK S, STEFANEANU L, et al. Subcomponents and connectivity of the superior longitudinal fasciculus in the human brain[J]. Brain Struct Funct, 2016, 221(4): 2075-2092. DOI:10.1007/s00429-015-1028-5 |
| [21] |
JIANG J, ZHAO Y J, HU X Y, et al. Microstructural brain abnormalities in medication-free patients with major depressive disorder: A systematic review and meta-analysis of diffusion tensor imaging[J]. J Psychiatry Neurosci, 2017, 42(3): 150-163. DOI:10.1503/jpn.150341 |
| [22] |
SEXTON C E, MACKAY C E, EBMEIER K P. A systematic review of diffusion tensor imaging studies in affective disorders[J]. Biol Psychiatr, 2009, 66(9): 814-823. DOI:10.1016/j.biopsych.2009.05.024 |
| [23] |
BESSETTE K L, NAVE A M, CAPRIHAN A, et al. White matter abnormalities in adolescents with major depressive disorder[J]. Brain Imaging Behav, 2014, 8(4): 531-541. DOI:10.1007/s11682-013-9274-8 |
| [24] |
JIANG W Y, GONG G L, WU F, et al. The papez circuit in first-episode, treatment-naive adults with major depressive disorder: combined atlas-based tract-specific quantification analysis and voxel-based analysis[J]. PLoS ONE, 2015, 10(5): e0126673. DOI:10.1371/journal.pone.0126673 |
| [25] |
LIU X D, WATANABE K, KAKEDA S, et al. Relationship between white matter integrity and serum cortisol levels in drug-naive patients with major depressive disorder: diffusion tensor imaging study using tract-based spatial statistics[J]. Br J Psychiatr, 2016, 208(6): 585-590. DOI:10.1192/bjp.bp.114.155689 |
| [26] |
TEKIN S, CUMMINGS J L. Frontal-subcortical neuronal circuits and clinical neuropsychiatry: An update[J]. J Psychosom Res, 2002, 53(2): 647-654. DOI:10.1016/S0022-3999(02)00428-2 |
| [27] |
BIESBROEK J M, KUIJF H J, VAN DER GRAAF Y, et al. Association between subcortical vascular lesion location and cognition: A voxel-based and tract-based lesion-symptom mapping study[J]. PLoS ONE, 2013, 8(4): e60541. DOI:10.1371/journal.pone.0060541 |
| [28] |
SPALLETTA G, FAGIOLI S, CALTAGIRONE C, et al. Brain microstructure of subclinical apathy phenomenology in healthy individuals[J]. Hum Brain Mapp, 2013, 34(12): 3193-3203. DOI:10.1002/hbm.22137 |
| [29] |
COENEN V A, PANKSEPP J, HURWITZ T A, et al. Human medial forebrain bundle (MFB) and anterior thalamic radiation (ATR): imaging of two major subcortical pathways and the dynamic balance of opposite affects in understanding depression[J]. J Neuropsychiatr Clin Neurosci, 2012, 24(2): 223-236. DOI:10.1176/appi.neuropsych.11080180 |
| [30] |
SEXTON C E, MACKAY C E, EBMEIER K P. A systematic review of diffusion tensor imaging studies in affective disorders[J]. Biol Psychiatry, 2009, 66(9): 814-823. DOI:10.1016/j.biopsych.2009.05.024 |
| [31] |
KAKEDA S, WATANABE K, KATSUKI A, et al. Genetic effects on white matter integrity in drug-naive patients with major depressive disorder: A diffusion tensor imaging study of 17 genetic loci associated with depressive symptoms[J]. Neuropsychiatr Dis Treat, 2019, 15: 375-383. DOI:10.2147/NDT.S190268 |
| [32] |
SACCHET M D, PRASAD G, FOLAND-ROSS L C, et al. Structural abnormality of the corticospinal tract in major depressive disorder[J]. Biol Mood Anxiety Disord, 2014, 4: 8. DOI:10.1186/2045-5380-4-8 |
| [33] |
HALL A C G, JOHN E. Textbook of medical physiology[M]. 11th ed.Philadelphia: W.B. Saunders, 2005: 687-690.
|
| [34] |
GALEA M P, DARIAN-SMITH I. Multiple corticospinal neuron populations in the macaque monkey are specified by their unique cortical origins, spinal terminations, and connections[J]. Cereb Cortex, 1994, 4(2): 166-194. DOI:10.1093/cercor/4.2.166 |
| [35] |
CULLEN K R, BROWN R, SCHREINER M W, et al. White matter microstructure relates to lassitude but not diagnosis in adolescents with depression[J]. Brain Imaging Behav, 2019.[Epub ahead of print]. DOI: 10.1007/s11682-019-00078-8.
|
| [36] |
KROENKE K, SPITZER R L. The PHQ-9: A new depression diagnostic and severity measure[J]. Psychiatric Annals, 2002, 32(9): 509-515. DOI:10.3928/0048-5713-20020901-06 |
| [37] |
BERGAMINO M, KUPLICKI R, VICTOR T A, et al. Comparison of two different analysis approaches for DTI free-water corrected and uncorrected maps in the study of white matter microstructural integrity in individuals with depression[J]. Hum Brain Mapp, 2017, 38(9): 4690-4702. DOI:10.1002/hbm.23694 |
| [38] |
KIM S H, KWAK K, HYUN J W, et al. Diffusion tensor imaging of normal-appearing white matter in patients with neuromyelitis optica spectrum disorder and multiple sclerosis[J]. Eur J Neurol, 2017, 24(7): 966-973. DOI:10.1111/ene.13321 |



