2. 400038 重庆,陆军军医大学(第三军医大学) 第一附属医院:干细胞与再生医学科;
3. 400038 重庆,陆军军医大学(第三军医大学) 第一附属医院:肿瘤科
2. Department of Stem Cell and Regenerative Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China;
3. Department of Oncology, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
胰腺癌是致死率极高的恶性肿瘤之一,其中80%~ 90%为胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)。转移是导致胰腺癌患者死亡重要的原因之一[1],虽然在放疗、化疗和免疫治疗等领域取得了一系列进展,仍有约90%的胰腺导管腺癌患者死于早期转移[1],其5年生存率仅为7%[2]。
与非肿瘤患者相比,胰腺癌患者的呼出气体中,12种挥发性有机物的含量有显著差别。其中,醛类物质变化最为明显,且对胰腺癌的检出有一定的提示作用[3]。乙醛脱氢酶(aldehyde dehydrogenase,ALDH)家族是细胞内最重要的醛代谢酶系统,在醛类物质转化为醇类或者对应的羧酸类物质过程中起着关键的催化作用[4-6],有意思的是,胰腺癌患者血清中ALDH的酶活性较高[7]。此外,ALDH的催化活性可作为鉴定和分离正常干细胞及肿瘤干细胞的标志物,参与调节肿瘤发生、发展及化疗抵抗等多种恶性生物学行为,且与多种肿瘤患者预后相关[5, 8-11]。其中乙醛脱氢酶家族1成员A3(Aldehyde dehydrogenase1 family member A3,ALDH1A3)是ALDH家族中重要的成员之一,可将全反式视黄醛氧化为维甲酸,通过调节维甲酸的合成在脊椎动物的发育过程中扮演重要角色[12]。此外,在NAD(P)+存在的条件下,ALDH1A3可将乙醛氧化为乙酸,从而参与醛类物质的解毒过程[13]。更为重要的是,ALDH1A3在多种肿瘤组织中的表达水平较高[4, 14],可作为乳腺癌[15]、非小细胞肺癌[16]等肿瘤干细胞的标志物,与肿瘤转移密切相关。然而,ALDH1A3在胰腺癌中的作用及其与胰腺癌转移之间的关系并不清楚。因此,本研究观察ALDH1A3在胰腺癌及正常胰腺组织中的表达情况,并探讨其对胰腺癌侵袭的调控及可能的机制。
1 材料与方法 1.1 主要材料与试剂人胰腺癌CAPAN1细胞系购自武汉普诺赛生命科技有限公司,DMEM细胞培养基、胎牛血清、双抗(青霉素+链霉素)、胰蛋白酶均购自美国Gibco公司,细胞裂解液购自美国Thermo Scientific公司,蛋白酶抑制剂购自美国Sigma公司,BCA法蛋白浓度检测试剂盒购自美国Pierce公司,PBS缓冲粉剂购自中杉金桥公司,PVDF膜购自美国Bio-Rad公司,蛋白Marker、Western blot显色液购自美国Thermo Scientific公司,Tween-20购自中国Beyotime Biotechnology公司,GAPDH多克隆抗体(兔抗人)、STAT3单克隆抗体(兔抗人)、磷酸化-STAT3单克隆抗体(兔抗人)购自美国Cell Signaling Technology公司,ALDH1A3单克隆抗体(鼠抗人)购自美国Sigma公司,组蛋白H2A多克隆抗体(兔抗人)购自美国Proteintech公司,细胞核蛋白与细胞浆蛋白抽提试剂盒购自碧云天公司,Transwell小室购自美国Millipore公司,Matrigel胶购自美国BD公司,结晶紫染色液购自碧云天公司。
1.2 数据库分析ALDH各亚型在胰腺癌中的表达通过基因表达谱数据交互分析(Gene Expression Profilling Interactive Analysis,GEPIA)网站(http://gepia.cancer-pku.cn/),对癌症和肿瘤基因图谱(the Cancer Genome Atlas,TCGA)数据库中胰腺癌患者数据集和基因组织表达项目(Genotype-Tissue Expression Project,GTEx)中正常胰腺组织基因表达谱数据进行分析,比较ALDH各亚型在癌组织与癌旁组织中的表达情况。下载肿瘤细胞系百科全书(Cancer Cell Line Encyclopedia,CCLE)数据库中胰腺癌细胞系的基因表达谱矩阵,比较ALDHs家族各亚型在胰腺癌细胞系中的表达水平。
1.3 细胞培养人胰腺癌细胞系CAPAN1购自武汉普诺赛生命科技有限公司,用DMEM完全培养基(含10%胎牛血清),置于37 ℃、5% CO2、95%湿度的恒温培养箱中培养,待细胞融合度为80%~90%或2~3 d后传代。
1.4 构建干扰ALDH1A3的胰腺癌细胞系设计并合成ALDH1A3干扰序列,序列1:正向5′-GATCCGCTGTATTAGAACCCTCAGATCTCCGGGATCC-AAGAGATCTGAGGGTTCTAATACAGCTTTTTTG-3′,反向5′-AATTCAAAAAAGCTGTATTAGAACCCTCAGATC-TCTTGGATCCCGGAGATCTGA-3′;序列2:正向5′-GA-TCCGCCGAATACACAGAAGTG AAACTCCGGGATCCAA- GAGTTTCACTTCTGTGTATTCGGCTTTTTTG-3′,反向5′-AATTCAAAAAAGCCGAATACACAGAAGTGAAACT- CTTGGATCCCGGAGTTTCACTTCTGTGTATTCGGCG-3′。经退火、酶切、连接、转化等一系列步骤将其连接于pLV-shRNA-eGFP载体上。采用慢病毒感染的方法,建立稳定敲低ALDH1A3表达的CAPAN1细胞系。实验分为3组,对照组:转染pLV-shRNA-eGFP空载体(sh-NC组);敲低组:分别转染ALDH1A3干扰序列1、2(sh-1组和sh-2组)。
1.5 Western blot实验按照M-PERTM Mammalian Protein Extraction Reagent(Thermo Scientific公司,美国)说明书进行细胞总蛋白提取处理,取少量上清液用于BCA蛋白浓度测定。按蛋白上清液:5× SDS-PAGE蛋白Loading缓冲液=4 :1的比例混匀后,置于100 ℃金属浴中,加热10 min使蛋白变性。设置电泳参数(两块SDS-PAGE胶):80 V,30 min后调整为120 V,据目的蛋白分子量大小调整电泳时间。按照“海绵-滤纸-胶-PVDF膜-滤纸-海绵”的顺序将其放置于转膜夹内,浸泡于转膜液中,PVDF膜侧为正极。设置转膜参数:300 mA,120 min。封闭:待转膜结束后取出PVDF膜,于左上角剪小缺口,将膜置于抗原封闭液中,室温下于水平摇床摇晃封闭1 h。一抗孵育:将PVDF膜置于抗体孵育盒内,滴加用PBST稀释的一抗工作液(依说明书选择合适的稀释比例),4 ℃摇床孵育过夜。结合二抗:根据目的蛋白的一抗来源,选择对应的HRP偶联的二抗(用PBST按1 :5 000比例稀释),室温下水平摇床震荡2 h。按照A液:B液=1 :1配置化学发光显影液,均匀滴加至PVDF膜上,将膜置于Bio-Rad凝胶成像仪内进行光成像。
1.6 分离细胞核蛋白与细胞浆蛋白用PBS清洗后,用细胞刮刮下并收集细胞。1 000 r/min离心,弃去上清,留下细胞沉淀备用。按照20 μL细胞沉淀:200 μL的细胞浆蛋白抽提试剂A的比例进行裂解(已添加1 mmol/L PMSF)。最高速剧烈涡旋5 s,使细胞沉淀完全悬浮并分散开。冰浴10~15 min,加入细胞浆蛋白抽提试剂B 10 μL。最高速剧烈涡旋5 s,冰浴1 min。最高速剧烈涡旋5 s,4 ℃,12 000~16 000×g离心5 min。将上清移至预冷的Ep管中,即为细胞浆蛋白。对于沉淀,完全吸尽残余的上清后,加入50 μL添加了PMSF的细胞核蛋白抽提试剂。最高速剧烈涡旋15~30 s,使细胞沉淀完全悬浮并分散开。然后放回冰浴中。每隔1~2 min再高速剧烈涡旋15~30 s,共30 min。4 ℃,12 000~16 000×g离心10 min,将上清移至预冷的Ep管中,即为细胞核蛋白。
1.7 Transwell实验检测细胞侵袭能力的变化用无菌镊将Transwell小室置于24孔板内,按照培养基:Matrigel胶=3 :1的比例混合,并以10 μL/孔的量将其均匀铺在Transwell小室的内表面,置于37 ℃培养箱内放置30 min。收集对数生长期的胰腺癌细胞,进行细胞计数,用无血清培养基调整细胞数至1×105/mL,依照实验分组每孔加入200 μL细胞悬液,下室添加含20%血清的培养基600 μL,于37 ℃、5% CO2培养箱中孵育培养。细胞接种48 h后弃去原有培养基,用PBS清洗3次后,置于4%多聚甲醛中固定15 min。用PBS清洗3次后,使用结晶紫染色液进行染色,于显微镜下观察拍照。
1.8 基因富集分析(gene set enrichment analysis, GSEA)以ALDH1A3表达水平的中位数为临界值,将TCGA数据集中包含的胰腺癌患者,分为ALDH1A3高表达与低表达两组,并行GSEA富集分析,观察各通路的富集情况。
1.9 统计学分析采用GraphPad Prism 5.0软件进行数据分析与处理,数据以x±s表示。采用独立样本t检验对两组均数进行比较。P < 0.05表示差异具有统计学意义。
2 结果 2.1 ALDH1A3在胰腺癌中表达较高采用GEPIA对TCGA数据库中胰腺癌患者数据集和GTEx项目中正常胰腺组织基因表达谱数据进行分析,ALDH各亚型在癌组织与正常胰腺组织中的表达情况见图 1A。其中,ALDH1A3、ALDH1B1、ALDH2、ALDH3A1、ALDH3B1、ALDH4A1、ALDH7A1和ALDH9A1在胰腺癌组织中的表达均高于正常胰腺组织。此外,利用CCLE数据库中的信息,比较ALDHs家族各亚型在胰腺癌细胞系中的基因表达水平,发现ALDH1A3在多种胰腺癌细胞系中的表达高于其他亚型(图 1B)。
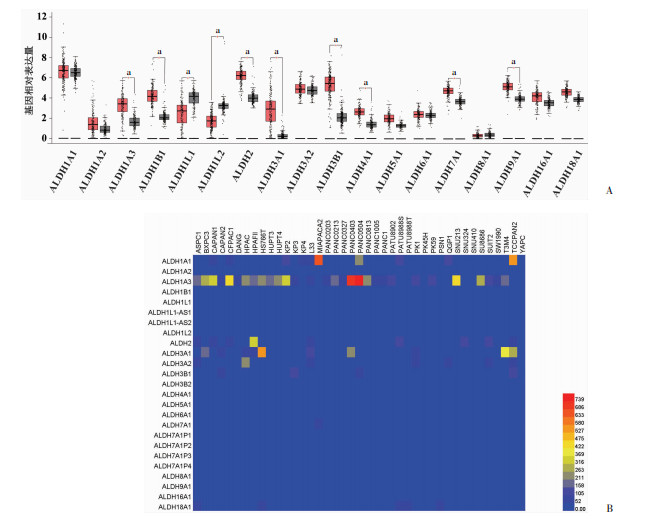
|
| A:TCGA数据库中胰腺癌患者数据集和GTEx项目中正常胰腺组织基因表达谱中ALDHs家族各亚型的表达红色:胰腺癌组织共179例,灰色:正常胰腺组织共171例;a:P < 0.05,与正常胰腺组织比较;B:CCLE数据库分析不同胰腺癌细胞系中ALDHs家族各亚型的表达 图 1 ALDH各亚型在胰腺癌组织中的表达 |
2.2 敲低ALDH1A3显著减弱胰腺癌细胞系CAPAN1的侵袭能力
采用慢病毒感染的方法构建敲低ALDH1A3表达的胰腺癌细胞系,CAPAN1细胞系中ALDH1A3的表达降低(图 2A),敲低ALDH1A3能显著减弱细胞的侵袭能力(P < 0.01,n=4,图 2B、C)。
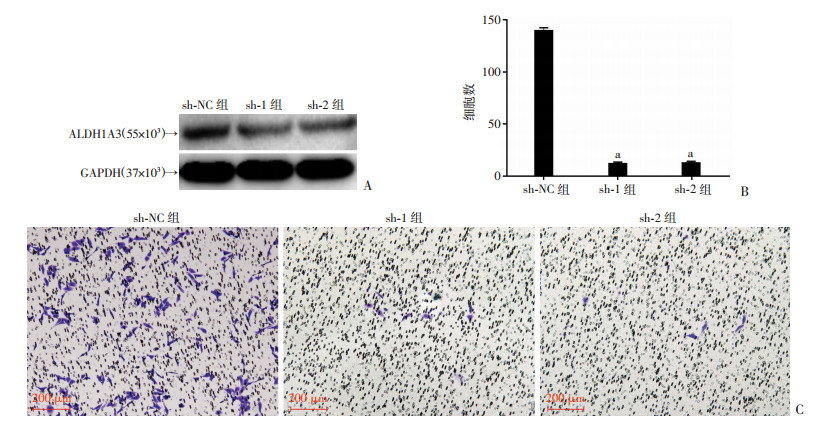
|
| A:Western blot检测ALDH1A3的表达;B:各组侵袭细胞数量分析a:P < 0.01,与sh-NC组比较;C:Transwell实验检测敲低ALDH1A3对胰腺癌细胞系侵袭能力的影响 图 2 验证ALDH1A3敲低效率并观察敲低ALDH1A3后对胰腺癌细胞侵袭能力的影响 |
2.3 IL6/JAK/STAT3通路在ALDH1A3高表达胰腺癌患者中显著富集
对TCGA数据集进行GSEA基因集富集分析,结果提示:高表达ALDH1A3的胰腺癌患者中,基因集HALLMARK_IL6_JAK_STAT3_SIGNALING显著富集。在TCGA数据集中匹配出86个基因,其中43个基因存在显著富集:标准化富集积分值=1.875,错误发现率q值= 0.014,名义P值= 0.002(图 3)。
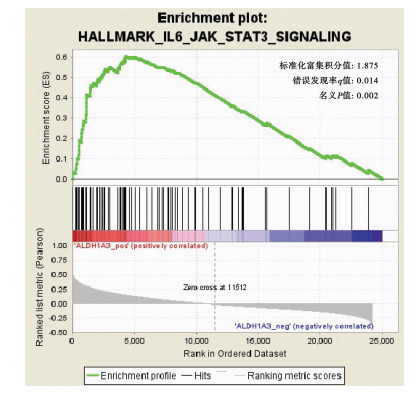
|
| 图 3 基于ALDH1A3表达差异的GSEA分析 |
2.4 ALDH1A3可影响STAT3的磷酸化
下调ALDH1A3后,信号转导与转录激活因子3(signal transducers and activators of transcription 3,STAT3)的蛋白表达量差异无统计学意义,但磷酸化STAT3的水平降低(图 4A)。其中,细胞核内磷酸化STAT3的水平下降显著(图 4B)。
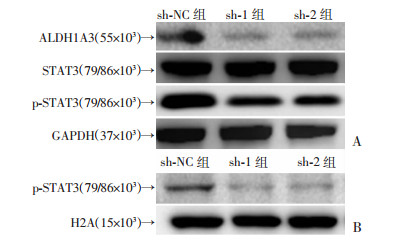
|
| A:Western blot检测下调ALDH1A3后各组细胞中STAT3及磷酸化STAT3的表达;B:Western blot检测下调ALDH1A3后各组细胞细胞核内磷酸化STAT3的表达 图 4 下调ALDH1A3可减少磷酸化STAT3的表达 |
3 讨论
肿瘤细胞能够通过代谢重编程来克服微环境中缺氧、能量耗竭、氧化应激以及炎症反应等诸多不利因素的影响[17-18]。近期多项研究显示:相较于其他实体瘤,胰腺癌细胞的代谢重编程更为广泛,主要表现在由原癌基因介导的多条信号通路的激活、独特的肿瘤微环境等[19]。因此,针对胰腺癌肿瘤细胞特殊的代谢状态,寻找合适的治疗靶点,将有助于为胰腺癌早期干预提供新的策略[18]。
呼出气体中醛类物质变化的检测,对胰腺癌的诊断有一定的提示作用[3]。此外,在乳腺癌[20]、肺癌[21]、结直肠癌[22]患者的呼出物中也可以检测到醛类物质的改变。由此可以猜测:如此广泛而又普遍的变化,很可能是由调节这类物质代谢的酶的变化所致。而本研究结果也为这种推测提供了初步的证据:主导机体醛类代谢的重要酶蛋白ALDH1A3,在胰腺癌中高表达且参与侵袭转移表型的调控。
ALDH超家族是细胞内最重要的醛代谢酶系统,属于NAD(P)+依赖酶。人类ALDH超家族包含11个家族共19个成员,它们在物质代谢、胚胎形成、生长发育、细胞增殖、分化等过程中扮演重要角色[5-6]。ALDH家族中多种亚型的活性与肿瘤干细胞的数量以及肿瘤细胞的药物抵抗特性呈正相关[6, 23-24]。高表达ALDH的肿瘤细胞可通过降低细胞内活性氧及醛类物质的水平,减少细胞凋亡[25]。本研究通过分析ALDH家族各成员在胰腺癌中的表达分布情况,结果发现:虽然多种亚型在胰腺癌组织中的表达显著高于癌旁组织,但ALDH1A3在不同胰腺癌细胞系中的表达高于其他亚型。因此,本研究对ALDH1A3在胰腺癌中的作用进行了探讨。
本研究利用慢病毒感染的方法干预ALDH1A3在胰腺癌细胞系中的表达后,发现其侵袭能力显著减弱。这与既往的研究结果一致:ALDH的活性与卵巢癌[11]、乳腺癌[26]、前列腺癌[10]、肺癌[27]等多种肿瘤细胞的侵袭能力相关。通过对58种人源性细胞系进行检测发现:ALDH1A3是ALDH活性最重要的亚型,与结直肠癌细胞的侵袭能力呈正相关[28]。此外,ALDH1A3可作为间质型胶质瘤的标志物之一[29],其表达与胶质瘤细胞的侵袭能力及高级别胶质瘤的死亡率呈正相关[30]。KONG等[14]的研究结果表明:ALDH1A3高表达的胰腺癌患者预后较差,其表达与胰腺癌患者的淋巴结转移率呈正相关;ALDH1A3高表达的胰腺癌患者淋巴结转移率为95%(20例/21例),远高于ALDH1A3阴性表达的胰腺癌患者58.6%(17例/29例)。然而,ALDH1A3是如何参与调节胰腺癌细胞的侵袭、迁移并未明确。
为了进一步探索ALDH1A3在胰腺癌中发挥的作用,本研究通过数据库基因集富集分析发现:ALDH1A3高表达的胰腺癌患者,其基因表达谱在JAK/STAT3通路显著富集。已有研究表明:STAT3通路参与了多种肿瘤的侵袭转移表型的调控,STAT3可通过调节ALDH1A3的表达影响非小细胞肺癌肿瘤干细胞的特性[16];STAT3可与MLK-1协同作用增加Vimentin的表达促进乳腺癌MCF7细胞EMT进程,进而促进侵袭、迁移的发展[31];IL-6R/STAT3/miR-34a可促进结直肠癌EMT介导的侵袭和转移[32];JAK2/STAT3可诱导肿瘤血管生成而促进头颈部鳞癌的生长及转移[33]。进一步体外细胞学实验证实:干扰ALDH1A3后,细胞内STAT3蛋白表达保持不变,但磷酸化STAT3的水平,尤其是细胞核内磷酸化STAT3的水平显著减少。这与文献[34]报道的“在ALDH+的胰腺癌干细胞内,磷酸化STAT3的水平升高”相互印证。然而,ALDH1A3如何影响STAT3磷酸化,以及磷酸化的STAT3如何调控胰腺癌细胞的侵袭,仍需进一步研究。
综上所述,本研究发现ALDH1A3在胰腺癌组织中高表达;下调ALDH1A3可降低胰腺癌细胞的侵袭能力;影响STAT3的磷酸化可能是ALDH1A3调控胰腺癌细胞侵袭能力的机制。为深入理解胰腺癌的转移机制提供了新的实验依据,ALDH1A3也可望成为抗胰腺癌转移治疗的候选靶点。
| [1] |
MAKOHON-MOORE A, IACOBUZIO-DONAHUE C A. Pancreatic cancer biology and genetics from an evolutionary perspective[J]. Nat Rev Cancer, 2016, 16(9): 553-565. DOI:10.1038/nrc.2016.66 |
| [2] |
MILLER K D, SIEGEL R L, LIN C C, et al. Cancer treatment and survivorship statistics, 2016[J]. CA: A Cancer J Clin, 2016, 66(4): 271-289. DOI:10.3322/caac.21349 |
| [3] |
MARKAR S R, BRODIE B, CHIN S T, et al. Profile of exhaled-breath volatile organic compounds to diagnose pancreatic cancer[J]. Br J Surg, 2018, 105(11): 1493-1500. DOI:10.1002/bjs.10909 |
| [4] |
DUAN J J, CAI J, GUO Y F, et al. ALDH1A3, a metabolic target for cancer diagnosis and therapy[J]. Int J Cancer, 2016, 139(5): 965-975. DOI:10.1002/ijc.30091 |
| [5] |
MA I, ALLAN A L. The role of human aldehyde dehydrogenase in normal and cancer stem cells[J]. Stem Cell Rev, 2011, 7(2): 292-306. DOI:10.1007/s12015-010-9208-4 |
| [6] |
MARCATO P, DEAN C A, GIACOMANTONIO C A, et al. Aldehyde dehydrogenase: its role as a cancer stem cell marker comes down to the specific isoform[J]. Cell Cycle, 2011, 10(9): 1378-1384. DOI:10.4161/cc.10.9.15486 |
| [7] |
JELSKI W, KUTYLOWSKA E, LANIEWSKA-DUNAJ M, et al. Alcohol dehydrogenase (ADH) and aldehyde dehydrogenase (ALDH) as candidates for tumor markers in patients with pancreatic cancer[J]. J Gastrointestin Liver Dis, 2011, 20(3): 255-259. |
| [8] |
LI G, LI Y, LIU X, et al. Aldh1a3 induces mesenchymal differentiation and serves as a predictor for survival in glioblastoma[J]. Cell Death Dis, 2018, 9(12): 1190. DOI:10.1038/s41419-018-1232-3 |
| [9] |
CHANG P M, CHEN C H, YEH C C, et al. Transcriptome analysis and prognosis of ALDH isoforms in human cancer[J]. Sci Rep, 2018, 8(1): 2713. DOI:10.1038/s41598-018-21123-4 |
| [10] |
COJOC M, PEITZSCH C, KURTH I, et al. Aldehyde dehydrogenase is regulated by β-Catenin/TCF and promotes radioresistance in prostate cancer progenitor cells[J]. Cancer Res, 2015, 75(7): 1482-1494. DOI:10.1158/0008-5472.CAN-14-1924 |
| [11] |
LI Y Y, CHEN T, ZHU J, et al. High ALDH activity defines ovarian cancer stem-like cells with enhanced invasiveness and EMT progress which are responsible for tumor invasion[J]. Biochem Biophys Res Commun, 2018, 495(1): 1081-1088. DOI:10.1016/j.bbrc.2017.11.117 |
| [12] |
KOENIG U, AMATSCHEK S, MILDNER M, et al. Aldehyde dehydrogenase 1A3 is transcriptionally activated by all-trans-retinoic acid in human epidermal keratinocytes[J]. Biochem Biophys Res Commun, 2010, 400(2): 207-211. DOI:10.1016/j.bbrc.2010.08.035 |
| [13] |
MORETTI A, LI J, DONINI S, et al. Crystal structure of human aldehyde dehydrogenase 1A3 complexed with NAD(+) and retinoic acid[J]. Sci Rep, 2016, 6(35710): 35710. DOI:10.1038/srep35710 |
| [14] |
KONG B, WU W W, CHENG T, et al. A subset of metastatic pancreatic ductal adenocarcinomas depends quantitatively on oncogenic Kras/Mek/Erk-induced hyperactive mTOR signalling[J]. Gut, 2016, 65(4): 647-657. DOI:10.1136/gutjnl-2014-307616 |
| [15] |
MARCATO P, DEAN C A, PAN D, et al. Aldehyde dehydrogenase activity of breast cancer stem cells is primarily due to isoform ALDH1A3 and its expression is predictive of metastasis[J]. Stem Cells, 2011, 29(1): 32-45. DOI:10.1002/stem.563 |
| [16] |
SHAO C, SULLIVAN J P, GIRARD L, et al. Essential role of aldehyde dehydrogenase 1A3 for the maintenance of non-small cell lung cancer stem cells is associated with the STAT3 pathway[J]. Clin Cancer Res, 2014, 20(15): 4154-4166. DOI:10.1158/1078-0432.CCR-13-3292 |
| [17] |
HANAHAN D, WEINBERG R A. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5): 646-674. DOI:10.1016/j.cell.2011.02.013 |
| [18] |
VANDER HEIDEN M G. Targeting cancer metabolism: A therapeutic window opens[J]. Nat Rev Drug Discov, 2011, 10(9): 671-684. DOI:10.1038/nrd3504 |
| [19] |
HALBROOK C J, LYSSIOTIS C A. Employing metabolism to improve the diagnosis and treatment of pancreatic cancer[J]. Cancer Cell, 2017, 31(1): 5-19. DOI:10.1016/j.ccell.2016.12.006 |
| [20] |
CHEN J, XU H, ZOU X, et al. Snail recruits ring1b to mediate transcriptional repression and cell migration in pancreatic cancer cells[J]. Cancer Res, 2014, 74(16): 4353-4363. DOI:10.1158/0008-5472.CAN-14-0181 |
| [21] |
SHIELDS M A, EBINE K, SAHAI V, et al. Snail cooperates with KrasG12D to promote pancreatic fibrosis[J]. Mol Cancer Res, 2013, 11(9): 1078-1087. DOI:10.1158/1541-7786.MCR-12-0637 |
| [22] |
HOTZ B, ARNDT M, DULLAT S, et al. Epithelial to mesenchymal transition: expression of the regulators snail, slug, and twist in pancreatic cancer[J]. Clin Cancer Res, 2007, 13(16): 4769-4776. DOI:10.1158/1078-0432.CCR-06-2926 |
| [23] |
RAGHAVAN S, MEHTA P, WARD M R, et al. Personalized medicine-based approach to model patterns of chemoresistance and tumor recurrence using ovarian cancer stem cell spheroids[J]. Clin Cancer Res, 2017, 23(22): 6934-6945. DOI:10.1158/1078-0432.CCR-17-0133 |
| [24] |
XIAO Z J, LIU J, WANG S Q, et al. NFATc2 enhances tumor-initiating phenotypes through the NFATc2/SOX2/ALDH axis in lung adenocarcinoma[J]. eLife, 2017, 6. DOI:10.7554/elife.26733 |
| [25] |
RAHA D, WILSON T R, PENG J, et al. The cancer stem cell marker aldehyde dehydrogenase is required to maintain a drug-tolerant tumor cell subpopulation[J]. Cancer Res, 2014, 74(13): 3579-3590. DOI:10.1158/0008-5472.CAN-13-3456 |
| [26] |
PAL D, KOLLURU V, CHANDRASEKARAN B, et al. Targeting aberrant expression of Notch-1 in ALDH+ cancer stem cells in breast cancer[J]. Mol Carcinog, 2017, 56(3): 1127-1136. DOI:10.1002/mc.22579 |
| [27] |
KIM I G, KIM S Y, CHOI S I, et al. Fibulin-3-mediated inhibition of epithelial-to-mesenchymal transition and self-renewal of ALDH+ lung cancer stem cells through IGF1R signaling[J]. Oncogene, 2014, 33(30): 3908-3917. DOI:10.1038/onc.2013.373 |
| [28] |
FENG H L, LIU Y Y, BIAN X C, et al. ALDH1A3 affects colon cancer in vitro proliferation and invasion depending on CXCR4 status[J]. Br J Cancer, 2018, 118(2): 224-232. DOI:10.1038/bjc.2017.363 |
| [29] |
MAO P, JOSHI K, LI J F, et al. Mesenchymal glioma stem cells are maintained by activated glycolytic metabolism involving aldehyde dehydrogenase 1A3[J]. Proc Natl Acad Sci USA, 2013, 110(21): 8644-8649. DOI:10.1073/pnas.1221478110 |
| [30] |
ZHANG W, LIU Y, HU H, et al. ALDH1A3: A marker of mesenchymal phenotype in gliomas associated with cell invasion[J]. PLoS ONE, 2015, 10(11): e0142856. DOI:10.1371/journal.pone.0142856 |
| [31] |
XIANG Y, LIAO X H, YU C X, et al. MiR-93-5p inhibits the EMT of breast cancer cells via targeting MKL-1 and STAT3[J]. Exp Cell Res, 2017, 357(1): 135-144. DOI:10.1016/j.yexcr.2017.05.007 |
| [32] |
ROKAVEC M, ÖNER M G, LI H, et al. IL-6R/STAT3/miR-34a feedback loop promotes EMT-mediated colorectal cancer invasion and metastasis[J]. J Clin Invest, 2014, 124(4): 1853-1867. DOI:10.1172/jci73531 |
| [33] |
LIU J F, DENG W W, CHEN L, et al. Inhibition of JAK2/STAT3 reduces tumor-induced angiogenesis and myeloid-derived suppressor cells in head and neck cancer[J]. Mol Carcinog, 2018, 57(3): 429-439. DOI:10.1002/mc.22767 |
| [34] |
LIN L, JOU D, WANG Y, et al. STAT3 as a potential therapeutic target in ALDH+ and CD44+/CD24+ stem cell-like pancreatic cancer cells[J]. Int J Oncol, 2016, 49(6): 2265-2274. DOI:10.3892/ijo.2016.3728 |



