2. 400038 重庆,陆军军医大学(第三军医大学):生物医学工程与影像医学系数字医学教研室;
3. 400037 重庆,陆军军医大学(第三军医大学)第二附属医院全军肿瘤诊治研究所
2. Department of Digital Medicine, Faculty of Biomedical Engineering and Imaging Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Cancer Institute, Second Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400037, China
肝细胞肝癌(hepatocellular carcinoma,HCC)是最常见的恶性肿瘤。除了手术和介入治疗外,化疗是治疗HCC的一种重要方式。近年来,一些新的分子靶向药物在HCC的化疗过程中发挥着越来越重要的作用,但是在化疗过程中产生的耐药以及化疗效果不理想等问题严重制约HCC患者的化疗效果[1]。所以, 增强化疗效果以及寻找新的有效的药物联用策略与措施具有重要价值。
索拉非尼是用于肝癌的新型分子靶向治疗药物,同时对肿瘤细胞的增殖和血管形成具有明显的抑制作用,对延长患者疾病的进展时间以及生存期也具有明显效果。但临床研究也发现:索拉非尼用于晚期HCC治疗的客观反应率只有41.1%,且患者的存活获益有限(约3个月),主要与HCC细胞对索拉非尼的耐受有关[2-3]。因此,寻找肝癌细胞对索拉非尼的耐受机制以及增强索拉非尼杀伤肝癌细胞效果的措施或寻求新的药物联用方案具有重要的临床意义。研究表明索拉非尼的耐药与肿瘤细胞周围缺氧的微环境密切相关,而二氯乙酸盐(dichloroacetate,DCA)是丙酮酸脱氢酶(pyruvate dehydrogenase,PDH)激酶的抑制剂,是一种重要的代谢性药物。研究表明DCA可较好地抑制肿瘤的恶性增殖并能显著增敏多类化疗药物杀伤肿瘤的效果[4-7]。DCA通过抑制肿瘤细胞糖酵解、恢复肿瘤细胞线粒体膜电位而促进肿瘤细胞凋亡、抑制肿瘤细胞生长。由于DCA具有逆转肿瘤糖酵解的作用从而改变肿瘤细胞周围的酸性微环境使其成为很有吸引力的肿瘤化疗增敏剂。目前,DCA对索拉非尼的增敏作用尚不清楚。因此,本研究探讨DCA在HCC细胞中对索拉非尼增敏效果及可能机制,以期为临床上提升索拉非尼对肝癌的疗效提供实验依据。
1 材料与方法 1.1 材料人肝癌细胞株Hep3B由陆军军医大学基础医学院生物化学与分子生物学教研室保存。高糖DMEM培养基购自美国HyClone公司;胎牛血清、0.25%胰酶购自Gibco公司;CCK-8试剂、蛋白定量试剂盒、RIPA裂解液(强)、PMSF、活性氧检测试剂盒均购自江苏碧云天公司;DCA、N-Acetylcysteine amide (NAC)、SP600125均购自美国Selleck公司;索拉非尼购自美国Sigma公司;p-JNK抗体购自美国Santa公司;PARP、JNK抗体购自Proteintech公司;GAPDH抗体、山羊抗兔的二抗购自美国Bioworld technology公司;PVDF膜,ECL发光液购自美国Bio-Rad公司。
1.2 细胞培养与加药处理Hep3B细胞在10%胎牛血清的DMEM培养基中,5%CO2、37 ℃的细胞培养箱中静置培养,换液时PBS洗3次后加入新鲜培养基,传代时PBS洗3次后加入适量胰酶消化并用含10%血清的培养基重悬细胞,使其重新铺板并贴壁生长,当细胞进入到对数生长期时,就可以进行加药处理,药物作用时间24 h后,收集细胞进行下一步实验。
1.3 流式细胞仪检测细胞凋亡率Hep3B细胞铺于6孔板种,加药处理24 h后,收集漂浮的细胞以及培养板中的细胞,1 000 r/min离心5 min,PBS漂洗1遍,用含Annexin V和PI的缓冲液重悬细胞,避光15 min,采用Beckman流式细胞仪进行检测,Annexin V单阳为早期凋亡细胞,Annexin V和PI双阳为晚期凋亡细胞。以各组的早期凋亡细胞和晚期凋亡细胞的总和作为总的细胞凋亡率统计并作图,数据重复3次。
1.4 CCK-8检测细胞增殖Hep3B细胞生长到对数生长期,消化并重悬细胞,用血球计数板计数后以每孔约3 000个细胞接种在96孔板中,过夜后第2天早上加药。实验分成4个组:对照组(DMSO)、索拉非尼处理组(10 μmol/L)[8]、DCA处理组(5 mmol/L)[9]、联合处理组(10 μmol/L索拉非尼与5 mmol/L DCA联合处理),每组设5个复孔。药物处理24 h后,弃去每孔的培养基,每孔加入100 μL含10% CCK-8的DMEM培养基,在细胞培养箱中放置1 h后在450 nm波长下测定每孔的光密度值[D(450)],计算每组细胞存活率,分析不同处理因素对细胞增殖的影响。
1.5 总蛋白的提取6孔板中处于对数生长期的Hep3B细胞分别加药处理24 h后,收集漂浮的细胞以及培养板中的细胞,1 000 r/min离心5 min,PBS漂洗1遍,再次1 000 r/min离心5 min,每个处理组加入100 μL含1 mmol/L PMSF的RIPA裂解液,然后用枪反复吹打细胞裂解液,并于涡旋振荡器上涡旋,置于冰上裂解20 min。然后4 ℃、14 000×g离心10 min,吸取上清液于新EP管中,用BCA法测定蛋白浓度并将不同组蛋白浓度标定为相同浓度。
1.6 Western blot检测将定量后蛋白样品加入适量体积的5×loading buffer,100 ℃煮样5 min,每孔上样20 μg,根据目的蛋白的相对分子质量选择特定浓度的丙烯酰胺凝胶并进行电泳分离,浓缩胶80 V,20 min,分离胶120 V,60 min。电泳结束后,用半干转法选择特定的电压和时间将凝胶中蛋白转移至PVDF膜上,用0.1% Tween-20的PBST配制5%的脱脂奶粉,于37 ℃封闭2 h,用含0.1% Tween-20的PBST洗膜1次,用一抗稀释液按1 :1 000比例稀释抗体并4 ℃摇床孵育过夜,第2天用含0.1% Tween-20的PBST洗膜3次,然后用PBST按1 :5 000稀释的山羊抗兔的二抗在室温条件下孵育1 h,用PBST洗膜3次后,每次10 min,然后在化学发光仪中进行显影曝光。
1.7 活性氧的检测6孔板中处于对数生长期的Hep3B细胞分别加药处理24 h后,吸去上清,用PBS洗3遍,每孔加入1 mL终浓度为10 μmol/L DCFH-DA荧光探针的无血清培养基,37 ℃细胞培养箱中孵育20 min,每隔3~5 min颠倒混匀一下,使探针和细胞充分接触。弃上清,用无血清培养基洗3遍,用胰酶消化细胞,培养基重悬,PBS漂洗1遍,用缓冲液重悬,采用Beckman流式细胞仪在FITC通道进行检测。
1.8 统计学分析采用SPSS 13.0统计软件,数据以x±s表示,两组间比较采用独立样本t检验。检验水准:α=0.05。
2 结果 2.1 DCA联合索拉非尼能显著抑制Hep3B的增殖并影响细胞形态和生长状态结晶紫染色后在显微镜下观察(图 1),DCA单独处理24 h基本不影响Hep3B细胞的生长状态,索拉非尼单独处理24 h在一定程度上可影响Hep3B的生长状态,细胞形态发生改变,贴壁能力降低,细胞数量减少,而DCA和索拉非尼联合处理24 h则会导致细胞形态严重受损,细胞数量明显减少,只剩下极少部分存活的贴壁细胞。CCK-8实验结果同样表明:DCA或者索拉非尼单独处理24 h对Hep3B细胞的增殖有一定影响,但是DCA和索拉非尼联合处理24 h后显著抑制Hep3B的增殖(P < 0.05,图 2)。
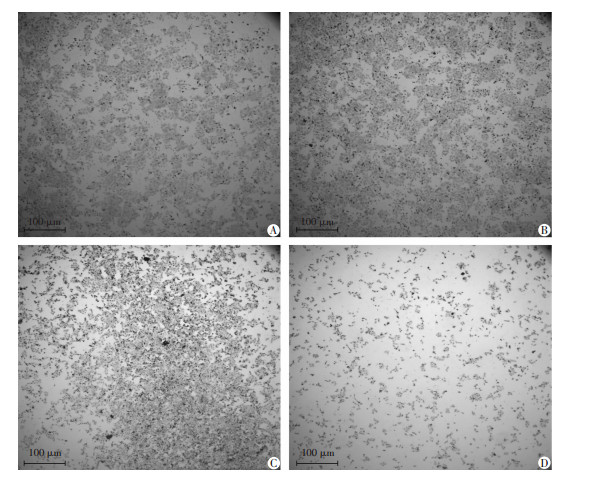
|
| A:对照组;B:DCA处理组;C:索拉非尼处理组;D:联合处理组 图 1 显微镜下观察各组处理后Hep3B细胞的形态 (结晶紫染色) |
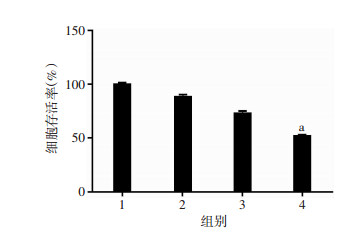
|
| 1:对照组;2:DCA处理组;3:索拉非尼处理组;4:联合处理组;a:P < 0.05,与索拉非尼处理组比较 图 2 CCK-8检测各组细胞存活率 |
2.2 DCA和索拉非尼联用明显诱导Hep3B的凋亡
流式细胞仪分析结果显示(图 3):各组细胞处理24 h后,与对照组和单独用药组比较,联合处理组Annexin V阳性细胞比率明显升高(P < 0.05),同时凋亡相关分子PARP剪切明显增强(P < 0.05,图 4),表明两药联合可显著增加细胞的凋亡。

|
| A:各组细胞凋亡水平;B:统计分析 1:对照组;2:DCA处理组;3:索拉非尼处理组;4:联合处理组;a:P < 0.05,与索拉非尼处理组比较 图 3 流式细胞仪检测不同处理方式对Hep3B细胞凋亡的影响 |

|
| A:Western blot检测;B:半定量分析 1:对照组;2:DCA处理组;3:索拉非尼处理组;4:联合处理组;a:P < 0.05,与索拉非尼处理组比较 图 4 Western blot检测DCA促进索拉非尼诱导的肝癌细胞凋亡 |
2.3 DCA联合索拉非尼能够明显升高Hep3B细胞内的ROS水平
进一步探究联合用药诱导肝癌细胞凋亡及抑制细胞增殖可能存在的机制,分析各组ROS的变化。结果发现:与索拉非尼处理组比较,联合处理组胞内ROS水平显著升高(P < 0.05,图 5)。
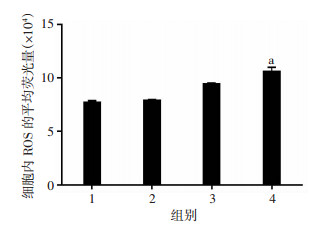
|
| 1:对照组;2:DCA处理组;3:索拉非尼处理组;4:联合处理组;a:P < 0.05,与索拉非尼处理组比较 图 5 流式细胞仪检测各组Hep3B细胞内ROS水平 |
2.4 DCA联合索拉非尼显著增强JNK的磷酸化水平
ROS升高后导致的JNK过度激活是诱导细胞凋亡的重要途径,为明确这一途径在DCA和索拉非尼发挥杀伤细胞和抑制增殖过程中的作用,进一步检测索拉非尼和DCA联合处理对JNK磷酸化的影响。结果表明:DCA单独或索拉非尼单独处理均对JNK的磷酸化水平无明显影响,而两药联合使用后p-JNK水平明显升高(P < 0.05,图 6),说明JNK被活化。
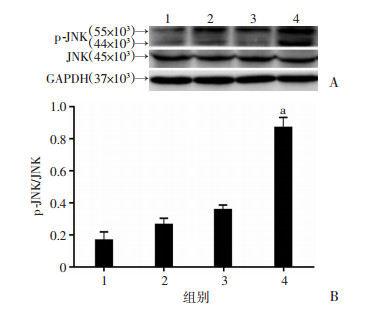
|
| A:Western blot检测;B:半定量分析 1:对照组;2:DCA处理组;3:索拉非尼处理组;4:联合处理组;a:P < 0.05,与索拉非尼处理组比较 图 6 Western blot检测DCA联合索拉非尼对JNK活化水平的影响 |
2.5 DCA联合索拉非尼升高ROS水平从而激活JNK途径
为了明确ROS的升高和JNK的活化之间的联系,在DCA和索拉非尼联用的同时加入抗氧化剂NAC(5 mmol/L)联合处理细胞,用JNK激酶的抑制剂SP600125作为对照,结果显示(图 7):NAC或者SP600125联合处理均可明显降低DCA和索拉非尼联用所升高的p-JNK水平,说明联合用药对JNK通路的激活是由ROS的升高所介导的。
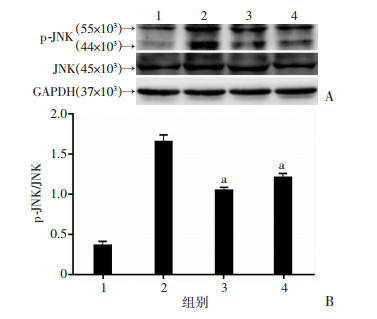
|
| A:Western blot检测;B:半定量分析 1:对照组;2:DCA、索拉非尼联合处理组;3:DCA、索拉非尼、NAC联合处理组;4:DCA、索拉非尼、SP600125联合处理组;a:P < 0.05,与DCA、索拉非尼联合处理组比较 图 7 Western blot检测DCA联合索拉非尼所引起的JNK的活化增强依赖于ROS的升高 |
2.6 DCA联合索拉非尼诱导的凋亡通过升高ROS导致的JNK活化所介导
为证明ROS升高和JNK的活化在DCA联合索拉非尼诱导凋亡中的作用,使用抗氧化剂NAC(5 mmol/L)联合处理细胞,同时以JNK抑制剂SP600125联合索拉非尼,结果显示(图 8):NAC和SP600125联合处理均可降低DCA和索拉非尼联合用药所诱导的细胞凋亡,说明联合用药对Hep3B的促凋亡作用依赖于细胞内ROS水平的升高和JNK通路的激活。
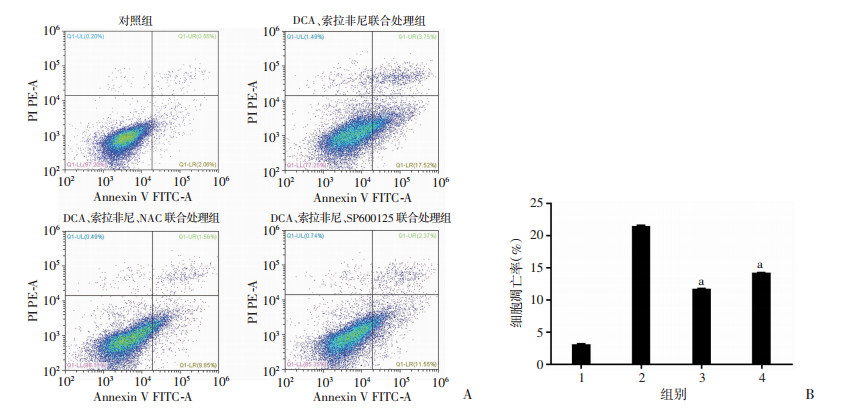
|
| A:各组细胞凋亡水平;B:统计分析 1:对照组;2:DCA、索拉非尼联合处理组;3:DCA、索拉非尼、NAC联合处理组;4:DCA、索拉非尼、SP600125联合处理组;a:P < 0.05,与DCA、索拉非尼联合处理组比较 图 8 流式细胞仪检测DCA、索拉非尼同时联合SP600125、NAC对各组细胞凋亡的影响 |
3 讨论
近年来,我国HCC的发病率不断增加,而手术前和手术后等一系列问题严重限制了HCC的治疗效果。索拉非尼是目前临床上治疗肝癌唯一可用的分子靶向药物[10],但是索拉非尼在使用过程中会产生严重的抵抗作用[11]。因此,探讨肝癌对索拉非尼的耐药机制及逆转和增敏方法是提高肝癌系统治疗的关键。而在大多数实体瘤中, 肿瘤缺氧微环境与肿瘤的发展、预后和转移,以及治疗效果密切相关。研究表明:索拉非尼在持续作用过程中,会诱导缺氧环境的产生[12-14]。而这个环境的产生是作为一种肿瘤细胞保护适应性反应从而诱导索拉非尼耐药,限制了索拉非尼的效力。研究表明缺氧可以促进肝癌对索拉非尼的耐药[15]。糖酵解表型在大多数的肿瘤细胞中普遍存在并与肿瘤细胞的凋亡抵抗息息相关,缺氧微环境与肿瘤细胞的耐药性密切相关。
DCA是丙酮酸脱氢酶激酶的特异性抑制剂,能够抑制线粒体钾离子通道轴,引起癌细胞凋亡,抑制肿瘤生长,是一种调节代谢从而发挥抗肿瘤作用的小分子化合物,同时DCA是一种安全性较高的药物,没有心脏、肺部、肾脏或骨髓毒性,其在抗肿瘤等方面的潜力正在不断被发现。研究表明DCA能够抑制多种肿瘤细胞的生长,经DCA处理后,癌细胞中的ROS水平升高,MMP去极化,在体内外都能够增加凋亡[16]。在索拉非尼处理过程中,肝癌细胞产生极度缺氧的微环境,此时细胞以糖酵解为主,大部分线粒体功能异常,线粒体膜电位处于超极化状态[17]。而DCA作为丙酮酸脱氢酶激酶的特异性抑制剂,能够将细胞代谢从糖酵解转换为葡萄糖有氧氧化,明显降低线粒体膜电位,促进线粒体转运孔的开放,使线粒体功能恢复,增强线粒体途径的凋亡,对肿瘤的增殖起到抑制作用[18]。ROS是细胞代谢产生的一系列活性氧簇,少量的ROS能够影响多种途径的信号转导,机体内的ROS通过和自由基相互影响来调控和维持机体内细胞的平衡和稳态。ROS的变化不仅能够引起细胞凋亡、坏死,而且低浓度ROS能够激活转录因子并促进细胞的增殖和分化,然而ROS浓度升高可以通过使细胞发生氧化应激反应从而诱导细胞凋亡甚至发生坏死[19-20]。因此,ROS可双向调控某些肿瘤细胞的凋亡和增殖。调节并维持活性氧平衡成为治疗肝癌的一个重要策略。在ROS诱导的信号通路中,JNK是激活细胞凋亡的重要下游分子,ROS能够诱导JNK的活化,而活化的JNK能诱导肿瘤细胞中促凋亡蛋白的表达和介导线粒体途径的细胞凋亡从而诱导凋亡的发生。而JNK是丝裂原活化蛋白激酶家族成员之一,能够磷酸化并激活c-Jun,是哺乳动物细胞内普遍存在的一种丝氨酸/苏氨酸蛋白激酶。其中JNK被激活后参与细胞增殖、细胞分化、细胞衰亡和应激反应等一系列的细胞调控,通过使转录因子复合物激活蛋白-1活性增强进一步促进P53、BAX、FasL和肿瘤坏死因子等促凋亡蛋白的表达[21-23]。本研究证实DCA能够逆转肝癌细胞在索拉非尼作用过程中产生的抗药性,联合使用能够更明显杀伤肝癌细胞,增敏索拉非尼的疗效,DCA和索拉非尼联合应用会导致ROS的大量产生和JNK的活化,而ROS的大量产生和JNK的活化正是DCA和索拉非尼联合杀伤作用的关键。我们进一步推测JNK的激活可通过一些转录因子促进一些凋亡蛋白的表达,大量表达的促凋亡蛋白会作用于线粒体,从而使细胞色素C释放到胞浆,使Caspase-3活化,从而诱导凋亡。
综上所述,DCA联合索拉非尼可以显著抑制Hep3B的增殖,增敏索拉非尼,促进细胞的死亡,而该途径主要是由ROS的升高和JNK通路的激活介导的。在索拉非尼处理过程中,肝癌细胞的瓦伯格(Warburg)效应明显增强,同时加入DCA处理,通过抑制丙酮酸脱氢酶激酶,使丙酮酸脱氢酶的活性升高从而促进有氧代谢,使肿瘤细胞糖酵解为主的途径转向有氧代谢的途径,同时明显促进ROS生成,增强线粒体膜电位,抑制了肝癌细胞的糖酵解,ROS的升高使JNK的活化增强,共同诱导了线粒体途径的细胞凋亡。本研究为索拉非尼更好地应用于肝细胞癌的治疗以及解决肝癌患者化疗抵抗等临床问题提供了理论与实验依据。
| [1] |
LI J, WU P W, ZHOU Y, et al. Rage induces hepatocellular carcinoma proliferation and sorafenib resistance by modulating autophagy[J]. Cell Death Dis, 2018, 9(2): 225. DOI:10.1038/s41419-018-0329-z |
| [2] |
朱虹, 陈孝平, 罗顺峰, 等. 缺氧诱导因子1α依赖性缺氧诱导人肝癌细胞多药耐药相关基因的表达及意义[J]. 中华外科杂志, 2005, 43(5): 277-281. ZHU H, CHEN X P, LUO S F, et al. Hypoxia-inducible factor-1α dependent expression and significance of the related multidrug resistance genes induced by hypoxia in human hepatocarcinoma cell[J]. Chin J Surg, 2005, 43(5): 277-281. DOI:10.3760/j:issn:0529-5815.2005.05.003 |
| [3] |
CORIAT R, NICCO C, CHÉREAU C, et al. Sorafenib-induced hepatocellular carcinoma cell death depends on reactive oxygen species production in vitro and in vivo[J]. Mol Cancer Ther, 2012, 11(10): 2284-2293. DOI:10.1158/1535-7163.MCT-12-0093 |
| [4] |
DAI Y H, XIONG X P, HUANG G, et al. Dichloroacetate enhances adriamycin-induced hepatoma cell toxicity in vitro and in vivo by increasing reactive oxygen species levels[J]. PLoS ONE, 2014, 9(4): e92962. DOI:10.1371/journal.pone.0092962 |
| [5] |
LU X, ZHOU D, HOU B, et al. Dichloroacetate enhances the antitumor efficacy of chemotherapeutic agents via inhibiting autophagy in non-small-cell lung cancer[J]. Cancer Manag Res, 2018, 10: 1231-1241. DOI:10.2147/CMAR.S156530 |
| [6] |
WOO S H, SEO S K, PARK Y, et al. Dichloroacetate potentiates tamoxifen-induced cell death in breast cancer cells via downregulation of the epidermal growth factor receptor[J]. Oncotarget, 2016, 7(37): 59809-59819. DOI:10.18632/oncotarget.10999 |
| [7] |
HARTING T, STUBBENDORFF M, WILLENBROCK S, et al. The effect of dichloroacetate in canine prostate adenocarcinomas and transitional cell carcinomas in vitro[J]. Int J Oncol, 2016, 49(6): 2341-2350. DOI:10.3892/ijo.2016.3720 |
| [8] |
BRAGGIO D, KOLLER D, JIN F, et al. Autophagy inhibition overcomes sorafenib resistance in S45F-mutated desmoid tumors[J]. Cancer, 2019. DOI: 10.1002/cncr.32120.[Epubaheadofprint]
|
| [9] |
SUN R C, BOARD P G, BLACKBURN A C. Targeting metabolism with arsenic trioxide and dichloroacetate in breast cancer cells[J]. Mol Cancer, 2011, 10: 142. DOI:10.1186/1476-4598-10-142 |
| [10] |
SHEN J Y, LIU J Y, LI C, et al. The impact of tumor differentiation on the prognosis of HBV-associated solitary hepatocellular carcinoma following hepatectomy: a propensity score matching analysis[J]. Dig Dis Sci, 2018, 63(7): 1962-1969. DOI:10.1007/s10620-018-5077-5 |
| [11] |
SHENG J Y, QIN H J, ZHANG K, et al. Targeting autophagy in chemotherapy-resistant of hepatocellular carcinoma[J]. Am J Cancer Res, 2018, 8(3): 354-365. |
| [12] |
SEMENZA G L. HIF-1 and mechanisms of hypoxia sensing[J]. Curr Opin Cell Biol, 2001, 13(2): 167-171. DOI:10.1016/S0955-0674(00)00194-0 |
| [13] |
ZHAI B, SUN X Y. Mechanisms of resistance to sorafenib and the corresponding strategies in hepatocellular carcinoma[J]. World J Hepatol, 2013, 5(7): 345-352. DOI:10.4254/wjh.v5.i7.345 |
| [14] |
CHANG Y S, ADNANE J, TRAIL P A, et al. Sorafenib (BAY 43-9006) inhibits tumor growth and vascularization and induces tumor apoptosis and hypoxia in RCC xenograft models[J]. Cancer Chemother Pharmacol, 2007, 59(5): 561-574. DOI:10.1007/s00280-006-0393-4 |
| [15] |
LIANG Y J, ZHENG T S, SONG R P, et al. Hypoxia-mediated sorafenib resistance can be overcome by EF24 through Von Hippel-Lindau tumor suppressor-dependent HIF-1α inhibition in hepatocellular carcinoma[J]. Hepatology, 2013, 57(5): 1847-1857. DOI:10.1002/hep.26224 |
| [16] |
SUN R C, BOARD P G, BLACKBURN A C. Targeting metabolism with arsenic trioxide and dichloroacetate in breast cancer cells[J]. Mol Cancer, 2011, 10: 142. DOI:10.1186/1476-4598-10-142 |
| [17] |
REISCHER D, HEYFETS A, SHIMONY S, et al. Effects of natural and novel synthetic jasmonates in experimental metastatic melanoma[J]. Br J Pharmacol, 2007, 150(6): 738-749. DOI:10.1038/sj.bjp.0707146 |
| [18] |
BRAMHALL S R, HALLISSEY M T, WHITING J, et al. Marimastat as maintenance therapy for patients with advanced gastric cancer: A randomised trial[J]. Br J Cancer, 2002, 86(12): 1864-1870. DOI:10.1038/sj.bjc.6600310 |
| [19] |
KIM J, SHIM M. COX-2 inhibitor NS-398 suppresses doxorubicin-induced p53 accumulation through inhibition of ROS-mediated Jnk activation[J]. Mol Carcinog, 2016, 55(12): 2156-2167. DOI:10.1002/mc.22458 |
| [20] |
WU H, LIU S P, GONG J, et al. VCPA, a novel synthetic derivative of α-tocopheryl succinate, sensitizes human gastric cancer to doxorubicin-induced apoptosis via ROS-dependent mitochondrial dysfunction[J]. Cancer Lett, 2017, 393: 22-32. DOI:10.1016/j.canlet.2017.02.007 |
| [21] |
LI H Y, ZHANG J, SUN L L, et al. Celastrol induces apoptosis and autophagy via the ROS/JNK signaling pathway in human osteosarcoma cells: An in vitro and in vivo study[J]. Cell Death Dis, 2015, 6: e1604. DOI:10.1038/cddis.2014.543 |
| [22] |
LIANG T, ZHANG X J, XUE W H, et al. Curcumin induced human gastric cancer BGC-823 cells apoptosis by ROS-mediated ASK1-MKK4-JNK stress signaling pathway[J]. Int J Mol Sci, 2014, 15(9): 15754-15765. DOI:10.3390/ijms150915754 |
| [23] |
ZHANG L, ZHOU M, WANG Y J, et al. MiR-92a inhibits vascular smooth muscle cell apoptosis: role of the MKK4-JNK pathway[J]. Apoptosis, 2014, 19(6): 975-983. DOI:10.1007/s10495-014-0987-y |



