脑缺血再灌注损伤(cerebral ischemia reperfusion injury)是指闭塞的脑血管开通、脑细胞恢复血液再灌注后,其缺血性损伤反而进一步加重的现象。有研究表明线粒体功能障碍、细胞凋亡、氧自由基激活及炎症反应与脑缺血再灌注损伤的发生密切相关[1]。坏死和凋亡是脑缺血再灌注损伤后神经元死亡的两种形式,而细胞凋亡是脑缺血再灌注损伤的关键环节[2]。此外,炎症反应在脑缺血再灌注损伤中也起着重要作用。然而,目前尚缺乏有效的治疗手段。脂肪间充质干细胞(adipose-derived mesenchymal stem cells,ADMSCs)是一种具有自我更新和多向分化潜能的成体干细胞,具有促进血管生成和抗凋亡的作用[3],在治疗缺血性脑卒中方面有很好的前景[4]。已有研究表明经颈静脉移植ADMSCs可通过抑制细胞凋亡和氧化应激反应减轻脑缺血再灌注损伤[5]。外泌体(exosomes)是一种活细胞,在生理和病理状态下均可分泌具有双层脂质分子层的囊泡样结构,直径30~100 nm,介导细胞间信息传递[6]。由ADMSCs分泌到胞外的外泌体称为ADMSCs来源外泌体,在心肌梗死[7]、肝纤维化[8]和创伤愈合[9]等研究中显示出有益的作用,并且在阿尔茨海默症[10]和脊髓侧索硬化[11]等研究中也具有显著的治疗效果。此外,HUANG等[12]研究也发现色素上皮衍生因子预处理的ADMSCs来源外泌体对脑缺血再灌注大鼠有神经保护作用。因此,本研究探讨ADMSCs来源外泌体对脑缺血再灌注损伤的作用,希望为未来脑梗死的治疗提供一种更好的选择。
1 材料与方法 1.1 实验动物及分组清洁级健康雄性8周龄SD大鼠70只,体质量270~300 g。由湖南斯莱克景达实验动物有限公司提供,许可证号:SCXK(湘)2016-0002。其中10只用于ADMSCs的提取,60只采用随机数字表法等分为5组(n=12):假手术组、缺血再灌注组、PBS组、低氧外泌体组、常氧外泌体组。
1.2 主要试剂DMEM/F12培养基、胰酶消化液购自美国HyClone公司,胎牛血清购自上海GIBCO公司,青-链霉素购自上海碧云天公司,FITC-CD31流式抗体购自上海ab33858公司,PE-CD90流式抗体(551401)购自美国BD公司,CD105抗体购自上海ab156756公司,油红O工作液、苏木精、伊红、DAPI均购自广州Wellbio公司,96孔培养板购自苏州Corning公司、CCK-8购自日本同仁公司,Tris、APS、SDS、TEMED、Tween-20、丙烯酰胺、甘氨酸、甲叉双丙烯酰胺、丽春红、Ⅰ型胶原酶、DNaseI、BSA、水合氯醛、中性树胶均购自美国Sigma公司,HRP goat anti-mouse IgG购自美国Proteintech公司,RIPA裂解液购自北京普利莱公司,蛋白酶抑制剂购自德国Merck公司,蛋白磷酸酶抑制剂购自瑞士Roche公司,SuperECL Plus超敏发光液购自美国Thermo pierce公司,显影液、定影液购自长沙WellBiology公司,Exo-Clear cell Growth Medium、EXOTC50A-1购自上海SBI公司,TTC染料购自上海BIOFROXX公司,Tunel试剂盒(KGA7053)购自南京凯基生物公司,二步法试剂盒、DAB试剂盒购自北京中杉金桥公司。
1.3 方法 1.3.1 ADMSCs培养和鉴定SD大鼠经麻醉处死后,在无菌条件下取附睾旁脂肪,经胶原酶消化、过滤、红细胞裂解液重悬等步骤后再加入DMEM/F12培养基重悬(含10% FBS、1 00 U/mL青霉素、0.1 mg/mL链霉素),悬浮细胞后接种至培养瓶,于37 ℃、5%CO2培养箱培养,每天观察拍照,第3天首次换液,以后每2~3天换液1次。细胞达80%~90%融合时传代培养,倒置相差显微镜下观察。取第3代ADMSCs用流式细胞仪检测细胞表面抗原CD90、CD105、CD31,鉴定所培养细胞来源。同时取第3代ADMSCs,成骨诱导后行茜素红染色,成脂诱导后行油红O染色,鉴定ADMSCs分化能力。
1.3.2 常氧和低氧下培养ADMSCs的生长曲线取第3代细胞,胰酶消化制备细胞悬液,按照每孔接种5×103 /100 μL于96孔板中,待细胞贴壁后,分别在常氧(21%)和低氧(1%)环境下培养0、1、2、3、4、5、6、7 d,每个时间点设置3个重复。培养相应时间后,更换完全培养基200 μL,每孔加入CCK-8溶液20 μL,37 ℃、5%CO2培养箱中继续孵育4 h,酶标仪测定在450 nm处的光密度值D(450),分别绘制细胞生长曲线,并在显微镜下观察低氧和常氧下培养24 h后的细胞形态。
1.3.3 ADMSCs的常氧和低氧处理及外泌体的提取和鉴定取第3代细胞,每个大皿接种5×106细胞,培养过夜后,弃培养液,PBS洗2次,换用Exo-Clear cell Growth Medium培养基培养,常氧组正常培养24 h后收集细胞上清,低氧组在含1% O2环境下培养24 h后收集细胞上清。每组各收集4~5个大皿的培养上清,3 000×g离心15 min,弃去细胞和细胞碎片。转移到新的离心管中,按细胞上清:ExoQuick TC(体积比)为4 :1比例加入外泌体提取试剂,混匀,4 ℃静置过夜。1 500×g离心30 min,弃上清,再1 500×g离心5 min,小心吸弃上清,沉淀即为外泌体。电镜保存液保存待测样本,送检。采用透射电镜观察浓缩后的外泌体并拍照,Western blot法检测其抗原表达。
1.3.4 脑缺血再灌注损伤模型的建立、干预及神经功能缺损评分假手术组大鼠只分离右侧颈总动脉及颈内外动脉,不插线,其余4组采用LONGA等[13]的改良线栓法制备脑缺血再灌注损伤模型。大鼠脑缺血2 h(从线栓插线成功开始算)再灌注时,用普通的镊子去除线栓。缺血再灌注组仅进行造模,PBS组拔出线栓5 min内经尾静脉注射PBS 2 mL,低氧外泌体组和常氧外泌体组分别同时给予等量低氧外泌体和常氧外泌体100 μg。待大鼠苏醒后对每只行造模手术的大鼠进行Longa评分[13],神经功能缺损评分在1~3分为模型成功,0分和4分及出现癫痫发作、取材时发现脑出血者均剔除出组并随机补充,保证每组有6只大鼠。以上评分由3位参加实验的人员分别以单盲法进行打分和记录.然后将3组记分结果平均后的得分进行统计分析。
1.3.5 TTC法测定脑梗死体积百分比脑缺血再灌注24 h后将大鼠麻醉,快速断头,取出脑组织。去除嗅球、小脑和低位脑干,去除血迹,置于-20 ℃ 20 min。以2 mm的厚度为标准制作冠状切片。冠状切4刀分为5段脑片,第l刀在脑前极与视交叉连线中点处,第2刀在视交叉部位,第3刀在漏斗柄处,第4刀在漏斗柄与叶尾极之间。将制备好的切片浸入1% TTC溶液中,37 ℃恒温避光孵育20 min染色。取出脑片置于4%多聚甲醛中固定10 min,用滤纸吸干液体,观察,拍照,应用Image Pro Plus 6.0软件[14]进行分析。所有脑片的梗死面积之和即为总梗死面积,乘以脑片的厚度即是梗死体积。为了排除脑水肿的影响,计算如下:校正的梗死体积=健侧半球体积-(患侧半球体积-患侧半球梗死体积),水肿校正后,梗死体积百分比=(校正的梗死体积/健侧半球体积)×100%。
1.3.6 组织切片制备和HE染色每组其余6只大鼠,脑缺血再灌注24 h后,麻醉,断头取脑,去除嗅球、小脑和低位脑干,脑组织置于4%多聚甲醛磷酸缓冲液固定1~2 h,再放入30%蔗糖溶液浸泡沉底;病理切片机冠状连续切片,片厚5 μm,分别用于HE染色、免疫组织化学染色及凋亡细胞的检测。HE染色后光镜下观察组织病理学变化。
1.3.7 TUNEL染色严格按照TUNEL试剂盒(KGA7053)说明书进行操作,再用DAPI工作液37 ℃染核10 min,PBS冲洗5 min×3次,封片固定,荧光显微镜检测凋亡。图像用Image-Pro Plus 6.0软件[14]进行图像分析,并采用盲法计算凋亡指数。于高倍镜(400倍)视野下在每张切片随机取5个视野,分别计数TUNEL阳性细胞数和总细胞数,凋亡指数=TUNEL阳性细胞数/总细胞数×100%,5个视野的细胞凋亡指数平均值代表每只大鼠的神经元凋亡指数。
1.3.8 免疫组化法检测CytC和IL-1β表达60 ℃烤片12 h;切片脱蜡至水:先将切片置于二甲苯中20 min,3次。然后依次在100%、95%、85%和75%乙醇,每级放置5 min。再用蒸馏水浸洗5 min;热修复抗原:将切片浸入0.01 mol/L枸橼酸盐缓冲液(pH=6.0),电炉或微波炉加热至沸腾后断电,连续煮20 min后,冷却20 min拿出,冷却至室温;加入3%H2O2,室温15 min以灭活内源性酶;孵育一抗:分别滴加适当稀释的一抗CytC和IL-1β,4 ℃过夜;孵育二抗:滴加50~100 μL抗-兔和抗-小鼠-IgG抗体-HRP多聚体37 ℃孵育30 min;DAB显色:滴加预制好的显色剂DAB工作液50~100 μL,室温孵育1~5 min,镜下控制反应时间,蒸馏水洗涤;苏木精复染5~10 min,蒸馏水冲洗,PBS返蓝;各级酒精(60%~100%)脱水,每级5 min。取出后置于二甲苯10 min,2次,中性树胶封片、显微镜观察。以上3~6步骤均用0.01 mol/L PBS洗3 min×5次,阴性对照用0.01 mol/L PBS代替一抗。每只大鼠取3张不连续切片,光镜下观察,然后随机选取每张切片脑梗死灶周围3个不重叠视野(400倍),拍照,应用Image Pro Plus 6.0软件[9]进行图像分析,统计CytC免疫反应产物在每个视野中的光密度值。注意选择相同光源和光学条件完成每组标本的检测。
1.4 统计学分析采用SPSS 23.0统计软件。计量资料以x±s表示,多组计量资料之间的比较采用单因素方差分析,进一步两两比较采用LSD-t法。P < 0.05为差异具有统计学意义。
2 结果 2.1 ADMSCs具有成脂和成骨分化潜能光镜下观察,原代培养的ADMSCs在接种24 h后,细胞贴壁增生,2~5 d时逐渐伸展,体积增大,为多角形或梭形,单核,核仁清晰,部分细胞有较长、较多的突起,且互相连接,类似成纤维细胞(图 1A)。应用流式细胞仪检测ADMSCs表面抗原,细胞高表达黏附分子CD31,而CD90和CD105的表达为阴性(图 1B)。第3代ADMSCs经成骨诱导培养后,茜素红染色可见钙结节染上鲜红色,蓝色为细胞核。经成脂诱导培养后,油红O染色后可见脂滴染上鲜红色,蓝色为细胞核(图 1C)。
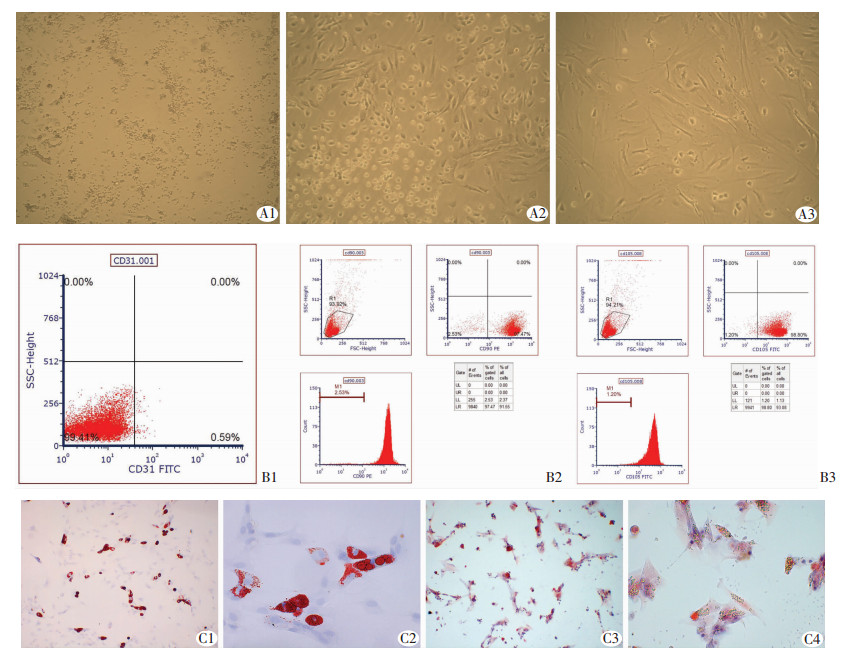
|
| A1~A3:大鼠脂肪间充质干细胞培养1、2、5 d(×100);B1~B3:流式细胞仪检测CD90、CD105、CD31表达;C1:油红O染色(×100);C2:油红O染色(×400);C3:茜素红染色(×100);C4:茜素红染色(×400) 图 1 ADMSCs原代培养和鉴定 |
2.2 常氧和低氧条件下ADMSCs形态和生长曲线
光镜下观察,第3代ADMSCs分别在常氧(21%)和低氧(1%)条件下培养24 h后,细胞体积增大,为多角形或梭形,有较长、较多的突起。低氧状态下培养的ADMSCs数目更多,核更大,有清晰的核仁(图 2)。常氧(21%)条件下培养第3代ADMSCs,细胞活性逐渐增高,在培养7 d时达到高峰;而低氧(1%)条件下培养第3代ADMSCs,细胞活性先增高,后降低,在培养1 d时达到高峰(图 3)。
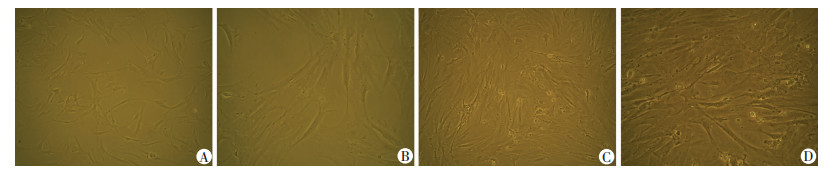
|
| A:常氧状态下培养的ADMSCs(×100);B:常氧状态下培养的ADMSCs(×200);C:低氧状态下培养的ADMSCs(×100);D:低氧状态下培养的ADMSCs(×200) 图 2 常氧和低氧状态下培养ADMSCs的形态 |
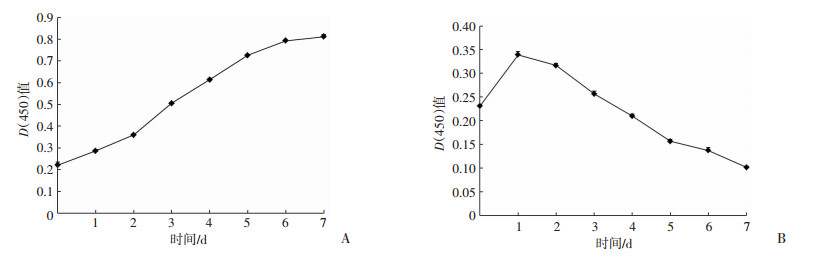
|
| 图 3 ADMSCs常氧(A)和低氧(B)条件下的生长活性 |
2.3 外泌体的生物学特征
透射电子显微镜下,常氧(21%)和低氧(1%)条件下培养的ADMSCs来源外泌体均为直径30 ~100 nm的封闭小囊泡状(图 4A、B),Western blot可检测到其标志蛋白TSG101和HSP70均为阳性(图 4C)。

|
| A:电镜下观察常氧条件下培养的ADMSCs来源外泌体;B :电镜下观察低氧状态下培养的ADMSCs来源外泌体;C: Western blot检测ADMSCs来源外泌体表面蛋白表达 1:Exosomes,为外泌体;2:Cell Lysate,为细胞裂解产物,即阳性对照 图 4 ADMSCs来源外泌体的形态和表面蛋白表达 |
2.4 外泌体改善神经功能缺损评分
假手术组未出现神经功能缺损症状,其余4组均表现不同程度神经功能损伤;与PBS组比较,低氧外泌体组、常氧外泌体组神经功能损害评分显著降低(P < 0.05);低氧外泌体组较常氧外泌体组降低更加显著(P < 0.05,表 1)。
| 组别 | 神经功能缺损评分 | 脑梗死体积百分比(%) | 凋亡指数 | CytC表达 | IL-1β表达 |
| 假手术组 | 0 | 0 | 8.7±0.7 | 0.21±0.02 | 0 |
| 缺血再灌注组 | 2.0±0.0 | 79.9±7.1 | 54.9±1.4 | 0.71±0.01 | 0.36±0.02 |
| PBS组 | 2.3±0.6ab | 81.2±5.1ab | 52.3±2.7ab | 0.69±0.03ab | 0.36±0.01ab |
| 低氧外泌体组 | 1.0±0.0b | 58.8±1.4b | 21.7±1.2b | 0.41±0.04b | 0.02±0.00b |
| 常氧外泌体组 | 1.3±0.6 | 62.2 ±5.9 | 34.6±3.0 | 0.52±0.02 | 0.06±0.01 |
| a:P < 0.05,与低氧外泌体组比较;b:P < 0.05,与常氧外泌体组比较 | |||||
2.5 外泌体减轻脑梗死体积
脑缺血再灌注损伤24 h后,假手术组大鼠脑组织TTC染色后均为玫瑰红色;其余4组均可见白色的梗死灶(图 5),表明模型建立成功。与PBS组相比,低氧外泌体组和常氧外泌体组脑梗死体积明显减小(P < 0.05),且低氧外泌体组较常氧外泌体组显著减少(P < 0.05,表 1)。
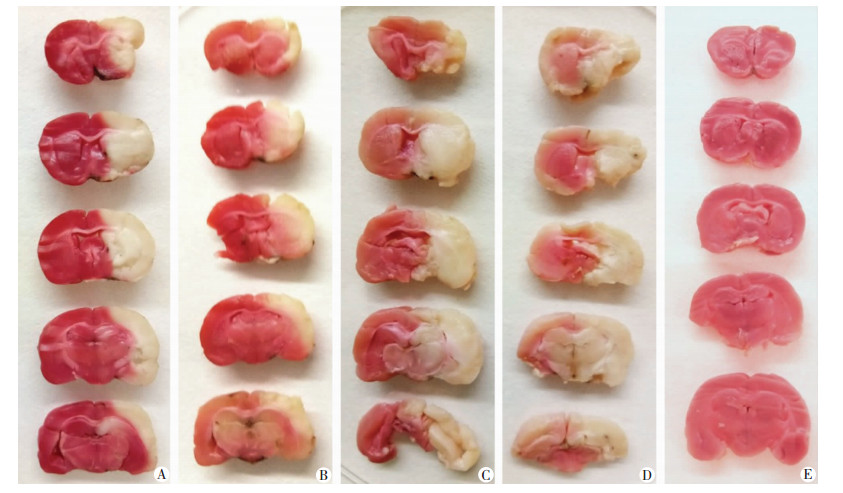
|
| A:常氧外泌体组;B:低氧外泌体组;C:缺血再灌注组;D: PBS组;E:假手术组每一组均列出同一样本的5个切面 图 5 各组大鼠脑组织TTC染色及脑梗死体积比较 |
2.6 外泌体减轻脑组织病理损伤
常氧组和低氧组与PBS组和缺血再灌注组相比,细胞损伤明显减轻,细胞间结合紧密,凋亡细胞减少,空泡变性较少,组织结构较完整(图 6A、B);假手术组未见明显病理改变,神经细胞数目较多、形态一致且排列整齐(图 6C);PBS组和缺血再灌注组,镜下可见大片坏死的神经细胞,多数细胞可见核碎片,细胞质水肿或形成空泡,凋亡细胞内可见核固缩,有大量空腔形成(图 6D、E);低氧组(图 6B)脑组织坏死区域较常氧组(图 6A)缩小,结构更加完整。
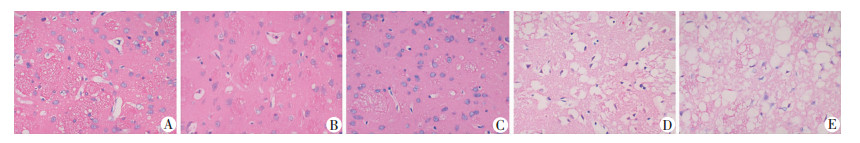
|
| A:常氧外泌体组;B:低氧外泌体组;C:假手术组;D:缺血再灌注组;E:PBS组 图 6 各组大鼠脑组织HE染色观察(×400) |
2.7 外泌体抑制神经元凋亡
在荧光显微镜下观察,TUNEL阳性信号为绿色荧光,蓝色为核染信号,凋亡的神经元细胞核形态不规则(图 7)。假手术组正常脑组织区可见少量TUNEL阳性细胞表达,而缺血-再灌注组、PBS组、低氧外泌体组,常氧外泌体组等缺血半暗带区凋亡指数明显升高,同时,与PBS组相比,低氧外泌体组和常氧外泌体组凋亡指数明显降低(P < 0.05),且低氧外泌体组较常氧外泌体组降低更加显著(P < 0.05,表 1)。
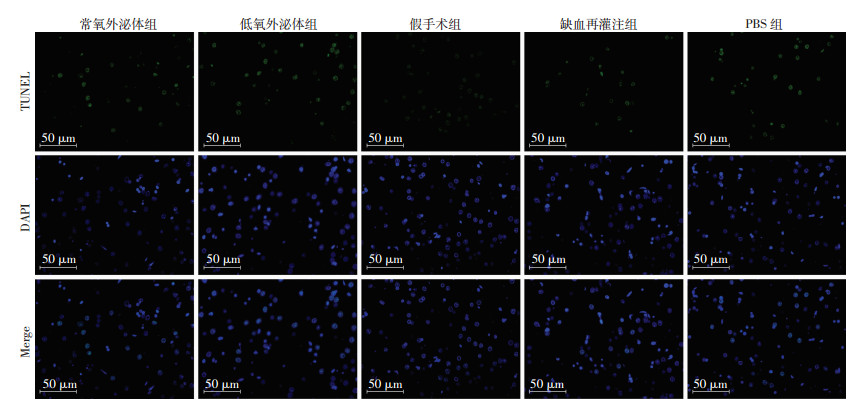
|
| 图 7 各组大鼠脑组织TUNEL染色观察 |
2.8 外泌体减少Cyt C和IL-1β表达
Cyt C免疫组化染色阳性表现为细胞质内有黄色或褐色颗粒,而IL-1β阳性染色则位于胞核内或细胞核周围,其颜色深浅用光密度值测定。Cyt C和IL-1β在各组中均有阳性染色,在缺血再灌注组和PBS组,染色程度较重;在假手术组和外泌体治疗组中染色程度较轻(图 8)。从光密度值分析结果看,假手术组中Cyt C和IL-1β免疫染色强度最弱,光密度值最小;PBS组和缺血再灌注组光密度值明显高于常氧外泌体组和低氧外泌体组(P < 0.05);且低氧组光密度值显著低于常氧组(P < 0.05,表 1)。
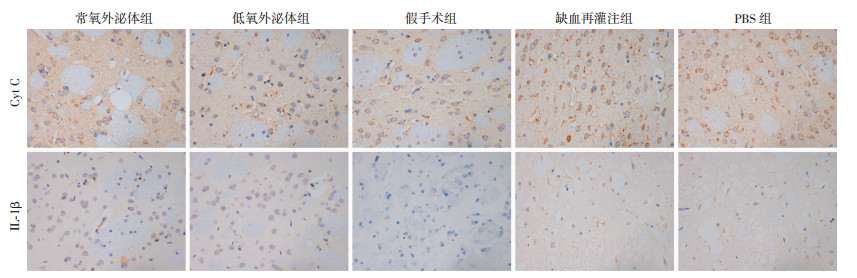
|
| 图 8 免疫组化染色观察各组大鼠脑组织CytC和IL-1β表达(S-P ×400) |
3 讨论
ADMSCs来源外泌体具有以下优势:①它是一种非细胞治疗,没有伦理的限制;②外泌体像药物一样具有半衰期,与干细胞治疗相比,外泌体的用量和使用起止时间,都更容易控制;③外泌体治疗目前没有发现明显的致瘤作用;④对于脑血管疾病的研究来说,血脑屏障一直是一个令人困扰的问题,而外泌体是纳米级的脂质结构,研究已经证实,可以在病变处很好地通过血脑屏障,使其治疗效果得到保证[4]。
本研究选用MCAO大鼠模型,给予低氧和常氧条件下培养的ADMSCs来源外泌体进行干预,结果显示:与假手术组比,PBS组CytC和IL-1β表达及神经元凋亡指数均明显增加,外泌体干预可明显减少CytC和IL-1β表达及神经元凋亡指数,提示ADMSCs来源外泌体可通过抑制神经元凋亡及炎症反应来发挥神经保护作用。
本实验在常氧(21%)和低氧(1%)状态下用外泌体培养基培养第3代ADMSCs,从培养基中提取的外泌体在电镜下观察均为直径30~100 nm的圆形囊泡,这与以往报道的外泌体特征一致[15],结合外泌体表型蛋白的检测,可确定我们的提取物为ADMSCs来源外泌体。低氧组和常氧组分别接受100 μg[16]低氧外泌体和常氧外泌体治疗后,神经系统功能缺损评分和脑梗死体积百分比均较PBS组和缺血-再灌注组明显改善,表明ADMSCs来源外泌体在脑缺血再灌注损伤中具有神经保护功能。
以往研究发现外泌体中包含脂质、蛋白质、细胞因子、RNA、microRNAs等多种成分,可通过自分泌或旁分泌的方式在细胞内或细胞间进行信息传递[17]。研究表明外泌体可通过多种方式参与卒中后神经修复,是神经损伤活动中重要的细胞间介质[18]。例如,内皮细胞来源外泌体不仅可以直接向内皮细胞提供促血管生成相关的miRNA,如miR-126和miR-296,从而促进血管生成;还能下调脑血管内皮细胞miRNA-15a,促进缺血周边区的血管新生[19]。此外,神经元来源外泌体中包含α-氨基羟甲基恶唑丙酸受体,该受体激活后能调节神经元突触的可塑性,进而改善脑卒中后运动功能缺损症状[20]。神经髓鞘的形成对神经修复是至关重要的,而神经胶质细胞来源外泌体有助于神经髓鞘的形成[21]。不仅如此,外泌体内容物也因其来源细胞所处生理病理状态的不同而有差异[22]。脑缺血缺氧可诱导MicroRNA-210(miR-210)在外泌体中表达,进而调节线粒体代谢和发挥抗凋亡作用[23]。
脑缺血引起细胞凋亡主要有两条途径:内源性通路是线粒体受刺激后释放出细胞色素C从而激活caspase-3引起的,又称为线粒体介导细胞凋亡;外源性通路则是由于细胞表面死亡受体的激活,启动caspase-8级联反应,最终发生细胞凋亡[24]。研究发现线粒体介导的细胞凋亡是脑缺血后神经元凋亡的主要通路[25-26]。CytC是线粒体中一种可溶性促凋亡蛋白,生理情况下稳定地结合在线粒体内膜中,不能通过细胞外膜;但在脑缺血时,由于神经元中线粒体膜功能障碍,CytC可从线粒体外膜释放到细胞质。在ATP/dATP的参与下,CytC在胞质中与Apaf-1(凋亡蛋白激活因子-l)结合,再通过其氨基端和caspase-9前体(冬氨酸特异性半胱氨酸蛋白酶-9前体)的功能前区相互作用,后激活caspase-3,从而诱导caspase依赖性细胞凋亡[27]。因此,CytC从线粒体释放到细胞质是多种细胞凋亡的共同表现,CytC在线粒体介导的细胞凋亡途径中起着关键作用。而且,也有研究表明抑制CytC释放可对脑缺血再灌注损伤后神经元凋亡起到抑制作用[28]。因此,抑制CytC漏出到胞质内应该可以阻滞线粒体介导的细胞凋亡通路。HOEHN等[29]研究证实了这一点。
本研究HE染色显示:外泌体治疗组较缺血再灌注组和PBS组的坏死区域减小,损伤程度减轻。与假手术组相比,其余4组缺血再灌注损伤模型中神经元细胞质中CytC含量均显著升高,可能是脑缺血再灌注损伤破坏了线粒体结构,使CytC向线粒体外转移所造成的。外泌体治疗组较缺血再灌注组和PBS组相比,细胞质中CytC的表达显著减少,而且低氧组较常氧组减少更加显著。在TUNEL荧光染色的凋亡指数分析中,显示出了与CytC表达量一致。因此,推断外泌体可能减少了CytC向线粒体外的转移,从而减轻了神经元凋亡。
本研究还发现外泌体治疗可减少脑缺血再灌注损伤后大鼠神经元中IL-1β表达量。IL-1有IL-1α和IL-1β两种亚型。IL-1β主要由单核细胞、巨噬细胞和树突状细胞分泌产生,在B淋巴细胞和自然杀伤细胞中也有少量表达,其主要功能是参与体内的一系列炎症反应,是一种关键的炎症因子。生理情况下,脑组织中可表达少量IL-1β,主要对中枢神经系统发育起到重要作用,也能保护神经元免遭兴奋性氨基酸毒性的损伤。脑缺血使少突胶质细胞、小胶质细胞、星形胶质细胞及浸润的巨噬细胞活化,进而分泌更多的IL-1β。持续表达的IL-1β,可促进T细胞和B细胞的活化,还诱导TNF-α、IL-6等炎症因子的产生,激活炎症级联反应,引起脑水肿和神经元坏死[30]。此外,过量的IL-1β还可以诱导黏附分子表达,促进内皮细胞和白细胞黏附,导致脑血流速度降低[31],从而进一步加重脑梗死。
IL-1β也是一种促凋亡的因子,IL-1β可通过线粒体途径促进人退行性髓核细胞凋亡[32],小鼠的矽肺模型细胞凋亡由IL-1β通过NO途径来介导[33]。在大鼠脑缺血再灌注损伤模型中,应用IL-1β转换酶抑制剂脑室注射,可以降低损伤组织中的IL-1β水平,减轻细胞凋亡,减少梗死面积,改善神经功能评分[34]。本研究中,脑缺血再灌注损伤24 h时IL-1β表达显著升高,这与AL DERA[35]的研究结果一致。经过ADMSCs来源外泌体处理后,缺血脑组织中IL-1β表达显著降低,脑梗死体积缩小,神经功能评分明显改善,神经元凋亡显著减少。推测外泌体可能通过降低IL-1β的表达,从而抑制脑缺血再灌注损伤后炎症级联反应和细胞凋亡,进而发挥神经保护作用。
综上所述,本研究证实了ADMSCs来源外泌体能减少大鼠脑缺血再灌注损伤后CytC和IL-1β的表达量,减少神经元凋亡和梗死面积,改善神经功能评分,具有神经保护作用。但是,其作用机制仍需进一步研究探索。
| [1] |
ELTZSCHIG H K, ECKLE T. Ischemia and reperfusion: from mechanism to translation[J]. Nat Med, 2011, 17(11): 1391-1401. DOI:10.1038/nm.2507 |
| [2] |
丁新生, 冯美江. 缺血性卒中的病理生理学机制与细胞凋亡[J]. 国际脑血管病杂志, 2006, 14(1): 5-10. DING X S, FENG M J. Pathophysiology and apoptosis in ischemic stroke[J]. Int J Cerebrovasc Dis, 2006, 14(1): 5-10. DOI:10.3760/cma.j.issn.1673-4165.2006.01.004 |
| [3] |
SADAT S, GEHMERT S, SONG Y H, et al. The cardioprotective effect of mesenchymal stem cells is mediated by IGF-Ⅰ and VEGF[J]. Biochem Biophys Res Commun, 2007, 363(3): 674-679. DOI:10.1016/j.bbrc.2007.09.058 |
| [4] |
CHUNG T N, KIM J H, CHOI B Y, et al. Adipose-derived mesenchymal stem cells reduce neuronal death after transient global cerebral ischemia through prevention of blood-brain barrier disruption and endothelial damage[J]. Stem Cells Transl Med, 2015, 4(2): 178-185. DOI:10.5966/sctm.2014-0103 |
| [5] |
LI D H, FANG Y, WANG P, et al. Autologous transplantation of adipose-derived mesenchymal stem cells attenuates cerebral ischemia and reperfusion injury through suppressing apoptosis and inducible nitric oxide synthase[J]. Int J Mol Med, 2012, 29(5): 848-854. DOI:10.3892/ijmm.2012.909 |
| [6] |
THÉRY C, ZITVOGEL L, AMIGORENA S. Exosomes: composition, biogenesis and function[J]. Nat Rev Immunol, 2002, 2(8): 569-579. DOI:10.1038/nri855 |
| [7] |
LUO Q C, GUO D F, LIU G R, et al. Exosomes from MiR-126-overexpressing adscs are therapeutic in relieving acute myocardial ischaemic injury[J]. Cell Physiol Biochem, 2017, 44(6): 2105-2116. DOI:10.1159/000485949 |
| [8] |
QU Y, ZHANG Q D, CAI X B, et al. Exosomes derived from miR-181-5p-modified adipose-derived mesenchymal stem cells prevent liver fibrosis via autophagy activation[J]. J Cell Mol Med, 2017, 21(10): 2491-2502. DOI:10.1111/jcmm.13170 |
| [9] |
BAI Y, HAN Y D, YAN X L, et al. Adipose mesenchymal stem cell-derived exosomes stimulated by hydrogen peroxide enhanced skin flap recovery in ischemia-reperfusion injury[J]. Biochem Biophys Res Commun, 2018, 500(2): 310-317. DOI:10.1016/j.bbrc.2018.04.065 |
| [10] |
LEE M, BAN J J, YANG S, et al. The exosome of adipose-derived stem cells reduces β-amyloid pathology and apoptosis of neuronal cells derived from the transgenic mouse model of Alzheimer's disease[J]. Brain Res, 2018, 1691: 87-93. DOI:10.1016/j.brainres.2018.03.034 |
| [11] |
LEE M, BAN J J, KIM K Y, et al. Adipose-derived stem cell exosomes alleviate pathology of amyotrophic lateral sclerosis in vitro[J]. Biochem Biophys Res Commun, 2016, 479(3): 434-439. DOI:10.1016/j.bbrc.2016.09.069 |
| [12] |
HUANG X, DING J, LI Y F, et al. Exosomes derived from PEDF modified adipose-derived mesenchymal stem cells ameliorate cerebral ischemia-reperfusion injury by regulation of autophagy and apoptosis[J]. Exp Cell Res, 2018, 371(1): 269-277. DOI:10.1016/j.yexcr.2018.08.021 |
| [13] |
LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91. DOI:10.1161/01.STR.20.1.84 |
| [14] |
WEXLER E J, PETERS E E, GONZALES A, et al. An objective procedure for ischemic area evaluation of the stroke intraluminal thread model in the mouse and rat[J]. J Neurosci Methods, 2002, 113(1): 51-58. |
| [15] |
SKOG J, WVRDINGER T, VAN RIJN S, et al. Glioblastoma microvesicles transport RNA and proteins that promote tumour growth and provide diagnostic biomarkers[J]. Nat Cell Biol, 2008, 10(12): 1470-1476. DOI:10.1038/ncb1800 |
| [16] |
CHEN K H, CHEN C H, WALLACE C G, et al. Intravenous administration of xenogenic adipose-derived mesenchymal stem cells(ADMSC) and ADMSC-derived exosomes markedly reduced brain infarct volume and preserved neurological function in rat after acute ischemic stroke[J]. Oncotarget, 2016, 7(46): 74537-74556. DOI:10.18632/oncotarget.12902 |
| [17] |
EL ANDALOUSSI S, MÄGER I, BREAKEFIELD X O, et al. Extracellular vesicles: biology and emerging therapeutic opportunities[J]. Nat Rev Drug Discov, 2013, 12(5): 347-357. DOI:10.1038/nrd3978 |
| [18] |
UENO Y, CHOPP M, ZHANG L, et al. Axonal outgrowth and dendritic plasticity in the cortical peri-infarct area after experimental stroke[J]. Stroke, 2012, 43(8): 2221-2228. DOI:10.1161/STROKEAHA.111.646224 |
| [19] |
YIN K J, HAMBLIN M, CHEN Y E. Angiogenesis-regulating microRNAs and ischemic stroke[J]. Curr Vasc Pharmacol, 2015, 13(3): 352-365. DOI:10.2174/15701611113119990016 |
| [20] |
CLARKSON A N, OVERMAN J J, ZHONG S, et al. AMPA receptor-induced local brain-derived neurotrophic factor signaling mediates motor recovery after stroke[J]. J Neurosci, 2011, 31(10): 3766-3775. DOI:10.1523/JNEUROSCI.5780-10.2011 |
| [21] |
FRVHBEIS C, FRÖHLICH D, KUO W P, et al. Extracellular vesicles as mediators of neuron-Glia communication[J]. Front Cell Neurosci, 2013, 7: 182. DOI:10.3389/fncel.2013.00182 |
| [22] |
ZHANG Y, YU M, TIAN W D. Physiological and pathological impact of exosomes of adipose tissue[J]. Cell Prolif, 2016, 49(1): 3-13. DOI:10.1111/cpr.12233 |
| [23] |
CHAN S Y, ZHANG Y Y, HEMANN C, et al. MicroRNA-210 controls mitochondrial metabolism during hypoxia by repressing the iron-sulfur cluster assembly proteins ISCU1/2[J]. Cell Metab, 2009, 10(4): 273-284. DOI:10.1016/j.cmet.2009.08.015 |
| [24] |
BROUGHTON B R S, REUTENS D C, SOBEY C G. Apoptotic mechanisms after cerebral ischemia[J]. Stroke, 2009, 40(5): e331-e339. DOI:10.1161/strokeaha.108.531632 |
| [25] |
MARTINOU J C, YOULE R J. Mitochondria in apoptosis: Bcl-2 family members and mitochondrial dynamics[J]. Dev Cell, 2011, 21(1): 92-101. DOI:10.1016/j.devcel.2011.06.017 |
| [26] |
SMITH D J, NG H, KLUCK R M, et al. The mitochondrial gateway to cell death[J]. IUBMB Life, 2008, 60(6): 383-389. DOI:10.1002/iub.44 |
| [27] |
HUANG X P, TAN H, CHEN B Y, et al. Astragalus extract alleviates nerve injury after cerebral ischemia by improving energy metabolism and inhibiting apoptosis[J]. Biol Pharm Bull, 2012, 35(4): 449-454. DOI:10.1248/bpb.35.449 |
| [28] |
秦华平, 杨常春, 张一, 等. 深低温对全脑缺血大鼠海马线粒体细胞色素C释放及细胞凋亡影响[J]. 中华神经医学杂志, 2012, 11(2): 138-140. QIN H P, YANG C C, ZHANG Y, et al. Effect of profound hypothermia on cytochrome C release and cell apoptosis in the Hippocampus after global ischemia in rats[J]. Chin J Neuromed, 2012, 11(2): 138-140. DOI:10.3760/cma.j.issn.1671-8925.2012.02.007 |
| [29] |
HOEHN B, YENARI M A, SAPOLSKY R M, et al. Glutathione peroxidase overexpression inhibits cytochrome C release and proapoptotic mediators to protect neurons from experimental stroke[J]. Stroke, 2003, 34(10): 2489-2494. DOI:10.1161/01.STR.0000091268.25816.19 |
| [30] |
CASO J R, MORO M A, LORENZO P, et al. Involvement of IL-1beta in acute stress-induced worsening of cerebral ischaemia in rats[J]. Eur Neuropsychopharmacol, 2007, 17(9): 600-607. DOI:10.1016/j.euroneuro.2007.02.009 |
| [31] |
CLARK W M, RINKER L G, LESSOV N S, et al. Lack of interleukin-6 expression is not protective against focal central nervous system ischemia[J]. Stroke, 2000, 31(7): 1715-1720. DOI:10.1161/01.STR.31.7.1715 |
| [32] |
SHEN J L, XU S X, ZHOU H, et al. IL-1β induces apoptosis and autophagy via mitochondria pathway in human degenerative nucleus pulposus cells[J]. Sci Rep, 2017, 7: 41067. DOI:10.1038/srep41067 |
| [33] |
SRIVASTAVA K, ROM W, JAGIRDAR J, et al. Crucial role of interleukin-1 β and nitric oxide synthase in silica-induced inflammation and apoptosis in mice[J]. Am J Respir Crit Care Med, 2002, 165(4): 527-533. DOI:10.1164/ajrccm.165.4.2106009 |
| [34] |
HARA H, FRIEDLANDER R M, GAGLIARDINI V, et al. Inhibition of interleukin 1 converting enzyme family proteases reduces ischemic and excitotoxic neuronal damage[J]. Proc Natl Acad Sci U S A, 1997, 94(5): 2007-2012. DOI:10.1073/pnas.94.5.2007 |
| [35] |
AL DERA H. Neuroprotective effect of resveratrol against late cerebral ischemia reperfusion induced oxidative stress damage involves upregulation of osteopontin and inhibition of interleukin-1beta[J]. J Physiol Pharmacol, 2017, 68(1): 47-56. |



