2. 409099 重庆 黔江,重庆市黔江中心医院消化内科
2. Department of Gastroenterology, Chongqing Qianjiang Central Hospital, Chongqing, 409099, China
我国是消化道肿瘤高发国家,超过90%的食管癌患者确诊时已进展为中晚期[1]。据相关文献报道,目前我国早期胃癌的诊治率不足10%,远低于韩国50%和日本70%[2]。所以《上消化道癌筛查及早诊早治技术方案》提出在自然人群中推行上消化道早癌筛查和对高危人群进行内镜精查策略,是改变我国食管癌、胃癌诊治严峻形势可行且高效的方法。普通白光内镜(white light endoscopy,WLE)是临床上最常用的能够判断病灶特点的检查方法;WLE筛查可提前发现癌前病变和早期癌以及潜在的浸润癌患者,为早发现和早治疗提高疗效提供了机会[3]。但一些荟萃研究结果[4-5]显示:WLE难以与炎症性病变相鉴别。新技术的不断应用,内镜理念日益更新,目前在上消化道早癌精查常用的技术手段有蓝激光成像放大内镜结合技术(magnifying endoscopy combined with blue laser imaging,BLI-ME)、窄带成像放大内镜技术(magnifying endoscopy combined with narrowband imaging,NBI-ME)、自发荧光内镜(autofluorescence imaging,AFI)、共聚焦激光显微内镜(confocal laser endomicroscopy,CLE)等。NBI-ME是通过观察黏膜上皮内毛细血管袢形态变化来判断病变性质,通过窄带滤光器代替传统的宽带滤光器,仅留下605 nm、540 nm和415 nm的红、绿、蓝色窄带光波,利用不同波段光穿透胃肠道黏膜的深度差异显示黏膜和黏膜下血管;BLI-ME是近年来内镜检查中的一项新技术,采用激光光源代替传统的卤素灯和氙气灯光源,通过波长为410 nm的激光显示黏膜表面的血管,具有明亮的图像、更高的分辨率。本研究采用BLI-ME和NBI-ME对可疑上消化道早癌患者进行检查,比较二者对上消化道早癌的诊断价值。
1 资料与方法 1.1 研究对象收集2017年12月至2018年6月在重庆医科大学附属第二医院消化内镜中心进行无痛胃镜检查的患者。纳入标准:①年龄≥ 45岁;②有上消化道症状;③有食管癌、胃癌家族史;④患有食管或胃癌前疾病或癌前病变者;⑤有幽门螺旋杆菌感染。经WLE初筛发现可疑上消化道早癌患者466例,共计病灶472处,年龄45~78岁,平均65.2岁。入选患者均签署相关知情同意书。
1.2 仪器和方法 1.2.1 仪器及设备NBI-ME使用的Olympus公司CV- 260 SL主机及GIF-H 260 Z镜子;BLI-ME使用FUJIFILM公司蓝激光内镜系统LASEREO及LL- 4450激光光源,VP- 4450 HD图像处理装置。
1.2.2 检查方法将纳入研究的466例患者分成2组,一组230例,行NBI-ME精查,对可疑病灶实时诊断并靶向活检;另一组236例,行BLI-ME精查,对病灶采用蓝激光联动成像功能(linked coler imaging,LCI)、蓝激光成像(blue laser imaging,BLI)、高亮模式(BLI-bright) 3种检查模式,即:远距离LCI进行筛查发现病灶,中远距离用BLI-bright模式去观察整体病灶,接近的时候用BLI-ME精查,实现从筛查到精查的全面诊断并靶向活检。精查前内镜先端都安装黑色橡胶帽,以上内镜操作均由同一名有丰富经验的内镜医师完成。发现可疑局灶病变,记录每一处病灶位置、轮廓、内镜下分型,食管、胃病变内镜下分型均依照2002年巴黎分型标准和2005年巴黎分型标准更新版[6-8]。病检证实及内镜下高度怀疑早癌的患者均行内镜黏膜下剥离术(endoscopic submucosal dissection,ESD),最终以ESD术后病理诊断为金标准。
1.3 诊断标准 1.3.1 内镜诊断标准NBI-ME可清楚显示食管上皮乳头内毛细血管袢(intrapapillary capillary loops,IPCL)的形态变化[9-10]。最常用的IPCL分型为井上晴洋分型(Inoue分型)和日本内镜学会AB分型诊断标准。YAO等[11]基于腺管结构和微血管结构的双重改变,提出VS(vessel plus surface)分型,在该分型中把微血管(MV)和腺管结构(MS)分成规则、不规则和消失3种类型,VS分型系统诊断(胃)癌与非癌的诊断标准:①不规则的MV构造和分界线(DL);②不规则的MS构造和分界线DL。存在①和(或)②时可以诊断癌,不符合①和②时考虑为非癌病变[12]。Inoue分型、AB分型和VS分型系统作为本研究的内镜诊断标准。
1.3.2 病理诊断标准病理切片由一名经验丰富的胃肠道病理学专家进行诊断,详情参见《中国消化内镜活组织检查与病理学检查规范专家共识(草案)》。了解病变范围、浸润深度及病理类型,根据不同内镜和病理诊断,选择不同的临床处理方式[13-14]。
1.4 治疗原则参照《中国早期食管癌筛查及内镜诊治专家共识意见(2014年,北京)》、《中国早期胃癌筛查及内镜诊治共识意见(2014年,长沙)》、《早期胃癌内镜下规范化切除的专家共识意见(2018年,北京)》执行。
1.5 统计学分析采用SPSS 16.0统计软件,计数资料以例数或率(%)表示。依据病理学诊断结果金标准,采用Kappa一致性检验评价BLI-ME、NBI-ME两种镜下诊断与病理诊断的一致性;采用McNemar配对卡方检验比较BLI-ME、NBI-ME诊断的效果。P < 0.05为差异有统计学意义。
2 结果 2.1 内镜检查结果WLE筛查出的472处可疑上消化道早癌病变,其中食管病灶112处(23.7%),胃病灶360处(76.3%)。内镜下表现为隆起型(Ⅰ型)24处、平坦型(Ⅱ型) 354处、凹陷型(Ⅲ型)94处。BLI-ME诊断炎症117处,萎缩及肠化生72处,低级别上皮内瘤变10处,早癌31处;NBI-ME诊断炎症121处,萎缩及肠化生69处,低级别上皮内瘤变16处,早癌36处。
2.2 病检结果活检病理证实炎症269处,萎缩或肠化生127处,低级别上皮内瘤变(low-grade intraepithelial neoplasia,LGIN) 20处,早癌56处,存在食管多中心癌。其中对活检病理证实为消化道早癌的患者均行ESD,对活检提示的3处LGIN,因存在高危因素(病灶>2 cm及表面发红的凹陷),行内镜下诊断性切除,术后2处提示高级别上皮内瘤变(high-grade intraepithelial neoplasia,HGIN),1处提示黏膜内癌、原位癌。最终以ESD术后病理为最高诊断,ESD术后病理修正LGIN 17处,早癌59处。
2.3 不同内镜诊断与病理结果的一致性评价BLI-ME、NBI-ME与病理诊断一致的病例分别为85.2%(196/230)和85.1%(206/242),Kappa值分别为:0.756和0.759。可见,BLI-ME、NBI-ME诊断与病理诊断一致性较好(Kappa>0.7),差异无统计学意义(P>0.05)。不同内镜下的具体定性诊断结果见表 1。
| 方法 | 病灶数 | 病理学诊断结果 | |||
| 炎性反应 | 萎缩肠化 | LGIN | HGIN或早期食管/胃癌 | ||
| BLI-ME | |||||
| 炎性反应 | 117 | 109 | 8 | 0 | 0 |
| 萎缩肠化 | 72 | 13 | 57 | 1 | 1 |
| LGIN | 10 | 3 | 0 | 5 | 2 |
| HGIN或早期食管/胃癌 | 31 | 5 | 0 | 1 | 25 |
| NBI-ME | |||||
| 炎性反应 | 121 | 115 | 5 | 0 | 1 |
| 萎缩肠化 | 69 | 14 | 55 | 0 | 0 |
| LGIN | 16 | 4 | 2 | 8 | 2 |
| HGIN或早期食管/胃癌 | 36 | 6 | 0 | 2 | 28 |
| 内镜检查方法 | 例数 | 病理诊断 | 敏感度 (%) |
特异度 (%) |
一致性 (%) |
Kappa值 | |
| 癌性病变 (n=59) |
非癌性病变 (n=413) |
||||||
| BLI-ME | |||||||
| 癌性病变 | 31 | 25 | 6 | 89.3 | 97.0 | 96.1 | 0.810 |
| 非癌性病变 | 199 | 3 | 196 | ||||
| NBI-ME | |||||||
| 癌性病变 | 36 | 28 | 8 | 90.3 | 96.2 | 95.5 | 0.825 |
| 非癌性病变 | 206 | 3 | 203 | ||||
2.4 各种内镜诊断上消化道早癌的准确性比较
BLI-ME、NBI-ME对诊断上消化道早癌的检出率分别为12.2%(28/230)、12.8%(31/242);敏感度分别为89.3%(25/28)、90.3%(28/31);特异度分别为97.0%(196/202)、96.2%(203/211);一致性分别为96.1%(221/230)和95.5%(231/242),Kappa值分别为:0.810和0.825。说明BLI-ME、NBI-ME两种方法在上消化道早癌诊断结果方面一致性较好。详细结果见表 2。
2.5 治疗将56例上消化道早癌及3例LGIN患者共59例纳入ESD适应证行内镜下治疗,1例术后病理提示脉管可疑侵犯,1例食管早癌,行ESD术中注入CO2后胃黏膜习惯性撕裂,不宜行ESD转外科手术治疗。上消化道早癌筛查典型病例见图 1、2。
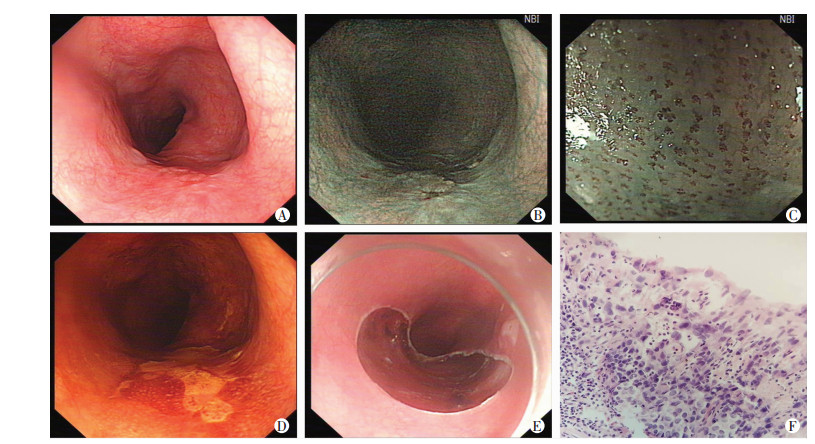
|
| A:白光表现 食管中段黏膜发红、粗糙、糜烂,大小约2.0 cm×2.0 cm;B:内镜示病变区域呈茶色改变,边界清晰;C:IPCL井上分型Ⅴ1-Ⅴ2型;D:复方碘染色观察 可见病变区不着色,粉红色征(+);E:ESD治疗;F:术后标本病理学观察(HE ×100) 0-Ⅱb型黏膜内鳞癌;Ly0,V0;pHM0,pVM0 图 1 食管早癌(NBI-ME)内镜及病理学观察 |
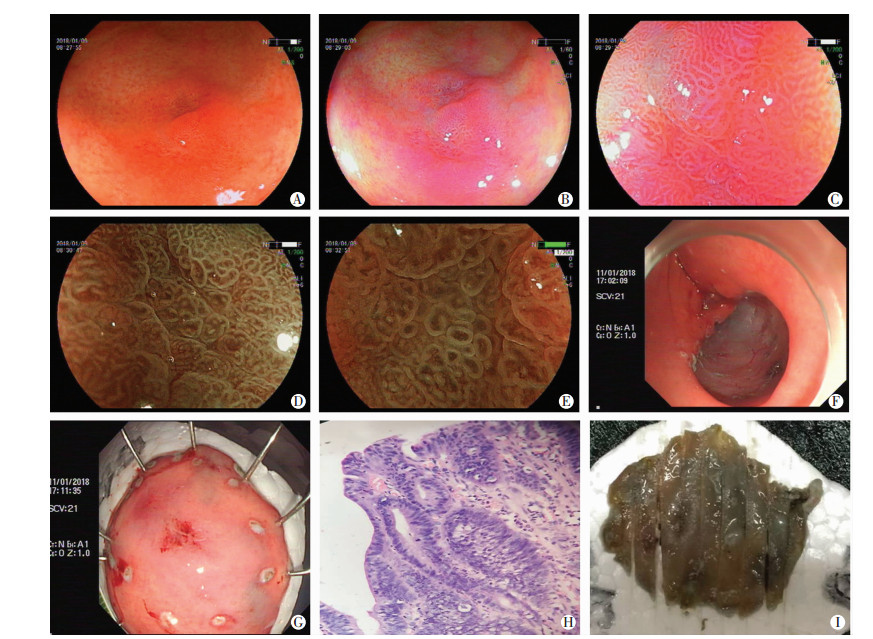
|
| A:白光表现 胃窦Ⅱa+Ⅱc型病变大小约1.2 cm×1.0 cm;B:LCI放大观察(远景);C:LCI放大观察(近景) 可见微血管排列不规则,内径不均一;D:内镜示病变区MV及MS均不规则,VEC(+);E:内镜示病变呈褐色改变,病变边界清晰; F:ESD治疗;G:术后标本;H:术后标本病理学观察(HE ×100);I:标本复原 图 2 胃窦早癌(BLI-ME)内镜及病理学观察 |
3 讨论
上消化道早癌起病隐匿,临床上无特异性症状,WLE初筛是最基本的手段,但对于微小、凹陷或扁平隆起病灶容易漏诊,以至于大多数病变发现时已处于中晚期。目前采用放大染色内镜进行消化道早癌精查已达成共识,操作中发现NBI能够强调血管和黏膜表面的细微改变,但NBI用于观察胃腔时,由于胃容积大、血管丰富,窄带光易被充分吸收,导致整体图像过于晦暗、细微结构不能精确显示[15];BLI采用LASEREO系统,图像能够清晰显示表面血管,支持更广范围的观察。三种观察模式,可根据临床需求随意切换达到诊断效果[16],其中LCI是搭载激光内窥镜系统的另一种图像处理功能,对发红部位可起到重点强调的作用,对于较远距离显像更明亮、强烈和有层次感[17-18]。
本研究结果显示,内镜检查发现Ⅰ型24处(5.1%)、Ⅱ型354处(75.0%)、Ⅲ型94处(19.9%)。据国内文献统计,早期胃癌内镜下分型以Ⅱ型最为常见,其中以Ⅱc型为主。有学者认为,早期胃癌的大体类型与预后相关。也有学者认为Ⅰ型和Ⅱa型病灶是早期胃癌复发的保护性因素[19]。
陈巍峰曾报道WLE与病理诊断一致的病例占72.8%,本研究显示:BLI-ME、NBI-ME与病理诊断一致的病例分别为85.2%和85.1%,Kappa值分别为:0.756和0.759。可见,普通白光一致性不强;BLI-ME、NBI-ME诊断与病理诊断一致性较好(Kappa>0.7),两者之间的差异无统计学意义(P>0.05)。研究显示在良恶性病变的鉴别上,NBI-ME的诊断正确率优于WLE[(62.6±21.7)% vs (49.8±28.7)%,P=0.005][20];对比白光模式,LCI能够清晰观察黏膜弥漫性发红,明显提高HP感染相关性胃炎的诊断率,更好地观察判断粘膜萎缩的边界,在诊断肠上皮化生时,LCI观察与WLE、BLI观察相比,最大限度地提高了病变的识别性[21],具有较好的临床使用价值。BLI-bright模式有从远景获取高分辨率对比图像的能力,因此可用于对病灶的远景观察,有助于在内镜筛查中发现早癌病灶[22]。
本研究显示:BLI-ME、NBI-ME对诊断上消化道早癌的检出率分别为12.2%、12.8%;敏感度分别为89.3%、90.3%;特异度分别为97.0%、96.2%;一致性分别为96.1%和95.5%,Kappa值分别为:0.810和0.825。说明BLI-ME、NBI-ME两种方法在上消化道早癌诊断结果方面一致性较好。日本学者采用NBI-ME对1 097例患者进行了前瞻性研究,采用VS分型,结果显示NBI-ME诊断胃癌的准确性高达98.1%,提示NBI-ME是诊断早期胃癌可靠的影像技术[23]。另一项研究评价了BLI-ME对早期胃癌的诊断价值,发现其特异性、敏感性和准确性分别为91.6%、93.8%和92.1%[24]。采用上述分型,BLI-ME对于诊断早期胃癌明显高于WLE,与NBI-ME相似,在细致上更有优势[25]。
研究发现,胃非浸润性肿瘤存在术前病理过低诊断,即术前活检病理常低估了病灶的组织学类型[26]。内镜下活检病理提示LGIN 3例,但镜下高度怀疑消化道早癌的患者均予以诊断性ESD治疗,术后确诊为上消化道早癌。术前活检为LGIN的患者的Meta分析显示,EMR切除术后,16.7%的患者病理提示HGIN,6.9%的患者病理提示早期胃癌[27]。在术前病理为高级别上皮内瘤变患者中亦发现,ESD术后66.5%的患者病理分级升高[28]。可见ESD整块切除对于确诊的重要性,最终以ESD术后病理为最高诊断。在日本,胃ESD已被公认为一种疗效确切且广泛开展的微创治疗手段。研究表明,ESD与外科治疗疗效、预后均相当,但是具有创伤小、恢复快、并发症少、费用低等优点。
综上所述,BLI-ME、NBI-ME诊断与病理诊断一致性较好,两者之间差异无统计学意义(P>0.05),且明显优于WLE,两种方法在上消化道早癌的检出率,诊断的敏感度、特异度方面一致性较好,对上消化道早癌的诊断价值较高。
| [1] |
马丹, 杨帆, 廖专, 等. 中国早期食管癌筛查及内镜诊治专家共识意见(2014年, 北京)[J]. 中国实用内科杂志, 2015, 35(4): 320-337. MA D, YANG F, LIAO Z, et al. Chinese expert consensus on screening and endoscopic management of early esophageal cancer(Beijing, 2014)[J]. Chin J Pract Intern Med, 2015, 35(4): 320-337. |
| [2] |
中华医学会消化内镜学分会. 中国早期胃癌筛查及内镜诊治共识意见(2014年, 长沙)[J]. 胃肠病学, 2014, 34(7): 433-448. Digestive Endoscopy Branch of Chinese Medical Association. Consensus on early gastric cancer screening and endoscopic diagnosis and treatment in China (Changsha, 2014)[J]. J Gastroenterol, 2014, 34(7): 433-448. |
| [3] |
LU Y F, LIU Z C, LI Z H, et al. Esophageal/gastric cancer screening in high-risk populations in Henan Province, China[J]. Asian Pac J Cancer Prev, 2014, 15(3): 1419-1422. DOI:10.7314/apjcp.2014.15.3.1419 |
| [4] |
姜舒馨, 宫爱霞, 葛林梅, 等. 放大内镜联合窄带成像技术对早期胃癌的诊断价值比较[J]. 中国医师进修杂志, 2017, 40(1): 80-82. JIANG S X, GONG A X, GE L M, et al. Diagnostic value of magnifying endoscopy combined with narrow-band imaging in early gastric cancer[J]. Chin J Postgrad Med, 2017, 40(1): 80-82. DOI:10.3760/cma.j.jssn.1673-4904.2017.01.022 |
| [5] |
杨珍明, 沈磊. 蓝激光成像结合放大内镜对早期胃癌及癌前病变的诊断价值[J]. 中华消化内镜杂志, 2017, 34(1): 24-29. YANG Z M, SHEN L. Diagnostic value of blue laser imaging combined with magnifying endoscopy for precancerous lesions and early gastric cancers[J]. Chin J Digest Endosc, 2017, 34(1): 24-29. DOI:10.3760/cma.j.issn.1007-5232.2017.01.005 |
| [6] |
The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002[J]. Gastrointest Endosc, 2003, 58(6 Suppl): S3-S43.
|
| [7] |
Endoscopic Classification Review Group. Update on the Paris classification of superficial neoplastic lesions in the digestive tract[J]. Endoscopy, 2005, 37(6): 570-578. DOI:10.1055/s-2005-861352 |
| [8] |
ENDOSCOPIC CLASSIFICATION REVIEW GROUP. Update on the Paris classification of superficial neoplastic lesions in the digestive tract[J]. Endoscopy, 2005, 37(6): 570-578. DOI:10.1055/s-2005-861352 |
| [9] |
张月明, 贺舜, 郝长青, 等. 窄带成像技术诊断早期食管癌及其癌前病变的临床应用价值[J]. 中华消化内镜杂志, 2007, 24(6): 410-414. ZHANG Y M, HE S, HAO C Q, et al. Evaluation of narrow-banding imaging endoscopy in the diagnosis of early squamous esophageal cancer and precancerous lesions[J]. Chin J Digest Endosc, 2007, 24(6): 410-414. DOI:10.3760/cma.j.issn.1007-5232.2007.06.003 |
| [10] |
余强, 井上晴洋, 工藤進英. 上皮乳头内毛细血管袢形态在食管表浅型病变诊治中的应用[J]. 中华消化内镜杂志, 2013, 30(3): 145-149. YU Q, INOUE H, KUDOU S. IPCL in diagnosis of esophageal superficial lesions[J]. Chin J Digest Endosc, 2013, 30(3): 145-149. DOI:10.3760/cma.j.issn.1007-5232.2013.03.007 |
| [11] |
YAO K, ANAGNOSTOPOULOS G K, RAGUNATH K. Magnifying endoscopy for diagnosing and delineating early gastric cancer[J]. Endoscopy, 2009, 41(5): 462-467. DOI:10.1055/s-0029-1214594 |
| [12] |
八尾建史.放大胃镜[M].杨爱明, 姚方, 译.北京: 人民卫生出版社, 2015. YAO K. Zoom gastroscopy[M]. YANG A M, YAO F, Translator. Beijing: People's Health Publishing House, 2015. |
| [13] |
SCHLEMPER R J. The Vienna classification of gastrointestinal epithelial neoplasia[J]. Gut, 2000, 47(2): 251-255. DOI:10.1136/gut.47.2.251 |
| [14] |
DIXON M F. Gastrointestinal epithelial neoplasia: Vienna revisited[J]. Gut, 2002, 51(1): 130-131. DOI:10.1136/gut.51.1.130 |
| [15] |
朱凌音, 李晓波. 内镜窄带成像技术在早期消化道肿瘤中的应用进展[J]. 中华消化内镜杂志, 2014, 31(7): 381-383. ZHU L Y, LI X B. Application of narrow-band endoscopic imaging in early gastrointestinal tumors[J]. Chin J Digest Endosc, 2014, 31(7): 381-383. DOI:10.3760/cma.j.issn.1007-5232.2014.07.003 |
| [16] |
王曼彤, 陶丽莹. 蓝激光内镜在消化道早癌精准诊断中的进展[J]. 中国内镜杂志, 2018, 24(6): 88-92. WANG M T, TAO L Y. Advances in the accurate diagnosis of early carcinoma of digestive tract in blue laser endoscopy[J]. China J Endosc, 2018, 24(6): 88-92. DOI:10.3969/j.issn.1007-1989.2018.06.016 |
| [17] |
OSAWA H, YAMAMOTO H. Present and future status of flexible spectral imaging color enhancement and blue laser imaging technology[J]. Digest Endosc, 2014, 26(Suppl 1): 105-115. DOI:10.1111/den.12205 |
| [18] |
OSAWA H, YAMAMOTO H, MIURA Y, et al. Blue laser imaging provides excellent endoscopic images of upper gastrointestinal lesions[J]. Vide J Encyclopedia GI Endosc, 2014, 1(3/4): 607-610. |
| [19] |
邹文斌, 杨帆, 李兆申. 中国胃癌诊治关键在于提高早期诊断率[J]. 浙江大学学报(医学版), 2015, 44(1): 9-14, 53. ZOU W B, YANG F, LI Z S. How to improve the diagnosis rate of early gastric cancer in China[J]. J Zhejiang Univ Med Sci, 2015, 44(1): 9-14, 53. DOI:10.3785/j.issn.1008-9292.2015.01.002 |
| [20] |
闫红林, 管蕾, 吕文浩, 等. 窄带成像结合放大内镜对胃黏膜病变的定性诊断意义[J]. 中华消化内镜杂志, 2016, 33(9): 609-612. YAN H L, GUAN L, LYU W H, et al. Diagnostic efficacy of magnifying endoscopy with narrow band imaging for gastric mucosal lesions[J]. Chin J Digest Endosc, 2016, 33(9): 609-612. DOI:10.3760/cma.j.issn.1007-5232.2016.09.008 |
| [21] |
八木一芳, 味冈洋一.放大胃镜诊断图谱[M].吴永友, 李锐, 译. 2版.沈阳: 辽宁科学技术出版社, 2017. YAGI Y, AJIOKA Y. Magnifying gastroscopy diagnostic atlas[M]. WU Y Y, LI R, Translator. 2nd Ed. Shenyang: Liaoning Science and Technology Publishing House, 2017. |
| [22] |
KANEKO K, OONO Y, YANO T, et al. Effect of novel bright image enhanced endoscopy using blue laser imaging (BLI)[J]. Endosc Int Open, 2014, 2(4): E212-E219. DOI:10.1055/s-0034-1390707 |
| [23] |
YAO K S, DOYAMA H, GOTODA T, et al. Diagnostic performance and limitations of magnifying narrow-band imaging in screening endoscopy of early gastric cancer: a prospective multicenter feasibility study[J]. Gastric Cancer, 2014, 17(4): 669-679. DOI:10.1007/s10120-013-0332-0 |
| [24] |
何振, 李鹏, 张澍田. 2016年消化道早癌内镜诊治进展[J]. 中华医学信息导报, 2017, 32(8): 10-11. HE Z, LI P, ZHANG S T. Progress in endoscopic diagnosis and treatment of early gastrointestinal cancer in 2016[J]. Chin Med Inform Rep, 2017, 32(8): 10-11. DOI:10.3760/cma.j.issn.1000-8039.2017.08.006 |
| [25] |
DOHI O, YAGI N, MAJIMA A, et al. Diagnostic ability of magnifying endoscopy with blue laser imaging for early gastric cancer: a prospective study[J]. Gastric Cancer, 2017, 20(2): 297-303. DOI:10.1007/s10120-016-0620-6 |
| [26] |
国家消化系统疾病临床医学研究中心, 中华医学会消化内镜学分会, 中国医师协会消化医师分会. 胃内镜黏膜下剥离术围手术期指南[J]. 中华消化内镜杂志, 2017, 34(12): 837-851. National Clinical Research Center for Digestive Diseases, Chinese Digestive Endoscopy Society, Chinese Digestive Doctor Association. Clinical guidelines for gastric endoscopic submucosal dissection during the perioperative period[J]. Chin J Digest Endosc, 2017, 34(12): 837-851. DOI:10.3760/cma.j.issn.1007-5232.2017.12.001 |
| [27] |
北京市科委重大项目《早期胃癌治疗规范研究》专家组, 柴宁莉, 翟亚奇, 等. 早期胃癌内镜下规范化切除的专家共识意见(2018, 北京)[J]. 中华胃肠内镜电子杂志, 2018, 5(2): 49-60. Experts Group of the Subject"Study of the Standard Treatment of Early Gastric Cancer" of Beijing Science And Technology Program, CHAI N L, ZHAI Y Q, et al. Expert consensus of standardized endoscopic resection for early gastric cancer(2018, Beijing)[J]. Chin J Gastrointest Endosc (Electron Ed), 2018, 5(2): 49-60. |
| [28] |
RYU D G, CHOI C W, KANG D H, et al. Clinical outcomes of endoscopic submucosa dissection for high-grade dysplasia from endoscopic forceps biopsy[J]. Gastric Cancer, 2017, 20(4): 671-678. DOI:10.1007/s10120-016-0665-6 |



