脑出血(intracerebral hemorrhage, ICH)是一种发病率高、致残率高及致死率高的疾病,在脑卒中发病中占10%~15%。脑出血发生后出现的脑水肿、氧化应激等继发性脑损伤会导致神经元与皮质脊髓束的损害,对患者的神经功能恢复造成严重的影响。近来有研究证实:虽然神经元在死亡后几乎无法再生,但其受损的轴突却可以表现出一定的再生与修复能力,这对脑出血后患者神经功能的恢复有极大的帮助作用[1]。
白藜芦醇(resveratrol,RES)是一种多酚类化合物,存在于葡萄、浆果和花生等植物中,具有抗氧化、抗炎症以及抗凋亡等功效[2]。既往研究证明:白藜芦醇在多种神经系统缺血性损伤中有显著保护作用[3];同时,白藜芦醇被发现能够通过抑制氧化应激反应,减轻神经元细胞的凋亡[4]。但是,白藜芦醇对于促进脑出血后神经系统功能的恢复作用尤其是促进轴突再生方面的作用目前国内外尚无相关的研究。白藜芦醇对PI3K/Akt通路有活化作用[5],有研究证实PI3K/Akt通路对下游产物腺苷酸活化蛋白激酶(AMP-activated protein kinase, AMPK)有调控作用[6]。AMPK分别有AMPKα、AMPKβ和AMPKγ 3种亚单位,在脑组织神经元中主要存在的是AMPKα,表达于胞核[7]。糖原合酶激酶-3β(glycogen synthase kinase 3 beta,GSK-3β)在中枢神经系统表达于神经元,对细胞骨架与轴突生长有抑制作用[8]。文献[9-10]报道GSK-3β在心脏与肾脏可受AMPK的活性调节,而在中枢神经系统,AMPKα对GSK-3β的调控机制尚无明确研究。白藜芦醇是否能通过PI3K/Akt通路调控AMPKα磷酸化水平,降低GSK-3β的活性以促进脑出血后轴突再生,发挥神经系统保护作用,尚不清楚。本研究通过自体血注射法建立大鼠ICH模型,观察白藜芦醇是否能促进脑出血后大鼠轴突再生进而促进神经功能的恢复,并对可能的机制进行探讨,旨在为脑出血的临床治疗寻找新的靶点和治疗方法。
1 材料与方法 1.1 实验动物与材料无特定病原体级(SPF)成年雄性SD大鼠126只,体质量220~250 g,由重庆医科大学实验动物中心提供。操作过程及处死方式遵循国际通用实验动物使用指南。GAP43抗体、MBP抗体、Akt抗体、p-Akt抗体、AMPKα抗体、p-AMPKα抗体、GSK-3β抗体、p-GSK-3β抗体购自英国Abcam公司,NF200抗体、MAP-2抗体、GAPDH抗体购自中国博奥森(Bioss)公司,二甲亚砜(DMSO)、白藜芦醇、Akt抑制剂LY294002购自美国Sigma公司,总蛋白提取试剂盒、BCA蛋白浓度测定试剂盒购自中国碧云天生物技术有限公司。
1.2 实验方法与步骤 1.2.1 动物模型建立与分组将SD大鼠按随机数字表法分为4组:假手术组(Sham,n=30)、脑出血组(ICH,n=30)、20 mg/kg白藜芦醇组(小剂量组,n=30)、40 mg/kg白藜芦醇组(大剂量组,n=30)。使用戊巴比妥(40 mg/kg)腹腔注射麻醉大鼠,将其固定于立体定向仪上。对头顶皮肤进行剪毛、消毒处理后,沿头皮正中矢状线作8 mm切口,剥离骨膜,使用骨钻于前囟后0.2 mm,左侧旁开2.9 mm处钻孔,作为进针处。用1 mL微量注射器取大鼠尾静脉自体血150 μL,将微量注射器固定于立体定向仪,沿进针点缓慢进针,深度6 mm,以15 μL/min的速度将自体血缓慢匀速注入基底节区。完成后将微量注射器留置10 min,然后缓慢退出。进针点钻孔用骨蜡封闭,缝合皮肤,待大鼠苏醒后放回饲养笼,完成脑出血组模型建立。小剂量组和大剂量组使用相同方法建立脑出血后,于术前连续7 d分别给小剂量组腹腔注射白藜芦醇(20 mg/kg)[4]、大剂量组腹腔注射白藜芦醇(40 mg/kg)[4],1次/d,脑出血组于术前相同时间腹腔注射等体积DMSO溶液。假手术组仅作头皮切开,不注射自体血,缝合皮肤后放回饲养笼。为进一步验证白藜芦醇是经PI3K/Akt途径对AMPKα通路进行调控从而促进了脑出血后的轴突再生,我们应用LY294002(PI3K/Akt通路抑制剂),按随机数字表法选取220~250 g雄性SD大鼠6只,建模前行头皮切开术,经侧脑室注射LY294002(10 μL,10 mmol/L),按上述方法建立大鼠脑出血模型,术前连续7 d腹腔注射白藜芦醇(40 mg/kg),1次/d。
1.2.2 神经行为学评分对各组大鼠分别于建模后1 h,1、3、7、14 d进行神经功能评分,采用改良神经功能缺损评分标准(modified neurological severity scores,mNSS)进行评分。评分由2名经过培训的实验员在不知道分组的情况下进行,大鼠所得分数越高神经功能受损越重(0~18分)。
1.2.3 HE染色对各组大鼠分别于建模后1 h,1、3、7、14 d采用4%多聚甲醛心脏灌注,取脑组织固定24 h后做石蜡切片。二甲苯、梯度酒精常规脱蜡、透明后HE染色。光学显微镜下每张切片在脑血肿周围(基底节区)组织随机选取5个视野进行观察,计算变性细胞计数和总细胞计数,采用变性细胞指数(denatured cell indexs,DCIs)显示神经细胞的损伤程度[11],变性细胞指数=变性细胞计数/总细胞计数。
1.2.4 氧化应激检测按照ELISA检测试剂盒说明书,将建模后14 d各组大鼠脑血肿周围(基底节区)组织匀浆,检测丙二醛(malondialdehyde,MDA)、过氧化氢酶(catalase,CAT)和超氧歧化酶(superoxide dismutase,SOD)的表达。
1.2.5 Western blot检测建模后14 d提取大鼠脑血肿周围(基底节区)组织总蛋白并测定浓度。按30 μg/孔上样,进行电泳、转膜。所得条带用5%BSA封闭1 h,一抗4 ℃过夜孵育。TBST洗3次,二抗室温孵育1 h,TBST清洗3次,滴加ECL显色液曝光显色。Image Lab 5.2软件分析各组NF200、MAP-2、MBP、GAP43、p-Akt、p-AMPKα和p-GSK-3β等蛋白的表达。
1.2.6 免疫组化观察建模后14 d对大鼠进行4%多聚甲醛心脏灌注,取脑组织固定24 h后做石蜡切片。60 ℃烘烤1 h,二甲苯、梯度酒精常规脱蜡,95 ℃枸橼酸钠溶液抗原修复20 min,晾至室温。内源性过氧化物酶孵育10 min,一抗4 ℃孵育过夜(NF200、MAP-2)。PBS洗3次,二抗室温孵育20 min,苏木精返蓝2 min,DAB显色。光学显微镜下每张切片在脑血肿周围(基底节区)组织随机选取5个视野进行观察。使用Image Pro Plus 6.0软件分析视野内阳性区域的平均光密度值。
1.2.7 免疫荧光观察对建模后14 d大鼠行4%多聚甲醛心脏灌注,取脑组织固定24 h后做冰冻切片。Triton孵育10 min,加山羊血清室温封闭1 h,滴加一抗4 ℃孵育过夜(MBP、NF200/p-AMPKα、GAP43/p-AMPKα)。PBS洗3次,滴加荧光二抗室温避光孵育1 h,DAPI染色10 min,封片。显微镜下随机选取5个视野进行观察。使用Image Pro Plus 6.0软件检测视野内阳性区域的阳性蛋白表达率。
1.3 统计学分析采用SPSS 18.0统计软件,组间比较使用单因素方差分析,组内不同时间点比较采用重复测量方差分析,计量资料以x±s表示。两组之间的比较应用独立样本t检验。检验水准:α=0.05。
2 结果 2.1 白藜芦醇改善脑出血后大鼠神经功能mNSS评分结果显示:建模后1 h,脑出血组、小剂量组、大剂量组脑神经功能缺损差异无统计学意义;建模后1、3、7、14 d,脑出血组大鼠神经功能缺损均显著高于Sham组,腹腔注射白藜芦醇后神经功能评分降低,且大剂量组效果明显优于小剂量组(P < 0.05,表 1)。提示白藜芦醇改善了脑出血后大鼠的神经功能。
| 组别 | 1 h | 1 d | 3 d | 7 d | 14 d |
| 假手术组 | 1 | 1 | 1 | 1 | 1 |
| 脑出血组 | 9.8±0.9a | 11.7±1.6a | 16.4±2.1a | 15.2±1.7a | 14.5±1.5a |
| 小剂量组 | 10.3±0.9a | 10.9±1.2ab | 15.5±1.8ab | 14.3±1.3ab | 13.6±1.2ab |
| 大剂量组 | 9.5±0.8a | 6.2±0.7abc | 8.9±1.1abc | 7.8±0.9abc | 6.5±0.7abc |
| a: P < 0.05,与假手术组比较;b:P < 0.05,与脑出血组比较;c:P < 0.05,与小剂量组比较 | |||||
2.2 白藜芦醇改善脑组织病理损伤及氧化应激水平
脑组织切片HE染色结果显示:在各时间点,假手术组大鼠脑组织形态、细胞间隙正常,神经细胞排列有序,胞核的形状均匀规则;1 d时的脑出血组大鼠脑组织病理损伤最严重,可见明显水肿,神经细胞排列紊乱,间隙增加,细胞胞体皱缩,胞浆嗜酸性减弱,细胞核固缩(图 1);DCIs结果显示:各时间点小剂量组相较于脑出血组的病理损伤改善不明显,差异无统计学意义(图 2)。大剂量组在1、3、7、14 d时均能减轻脑出血造成的脑组织病理损伤,其中14 d时病理损伤程度最低(P < 0.05,图 2),表明大剂量白藜芦醇对脑出血后大鼠起神经保护作用。为观察白藜芦醇对脑出血后轴突再生的促进作用,结合mNSS评分结果,将后续实验主要观察时间点定为脑出血后14 d。
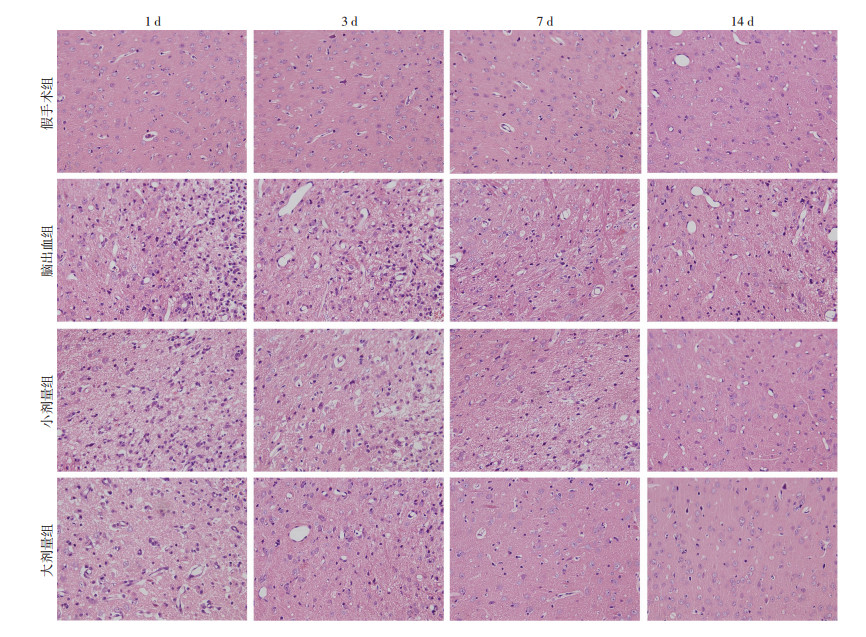
|
| 图 1 HE染色观察建模后不同时间各组大鼠脑组织病理学变化(×400) |
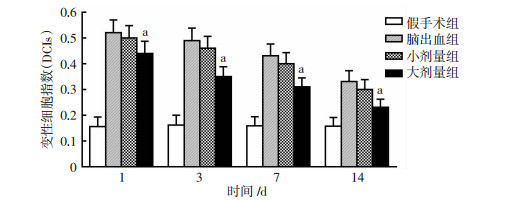
|
| a:P < 0.05,与脑出血组比较 图 2 建模后不同时间各组大鼠变性细胞指数(DCIs)变化 |
术后14 d检测各组大鼠氧化应激产物水平。与假手术组比较,脑出血组MDA、CAT、SOD产物水平均升高;相比于脑出血组,各剂量白藜芦醇组可降低MDA,升高CAT与SOD的水平,且大剂量组效果明显优于小剂量组(P < 0.05,图 3)。提示白藜芦醇降低了脑出血后大鼠脑组织氧化应激产物的水平。
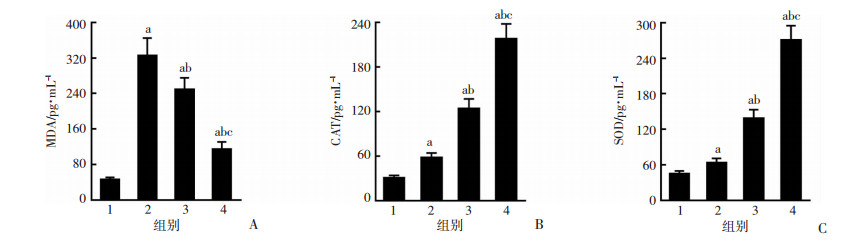
|
| A: MDA水平的改变;B:CAT水平的改变;C:SOD水平的改变1:假手术组;2:脑出血组;3:小剂量组;4:大剂量组;a: P < 0.05,与假手术组比较;b:P < 0.05,与脑出血组比较;c:P < 0.05,与小剂量组比较 图 3 术后14 d各组大鼠脑出血区域氧化应激产物水平的改变 |
2.3 白藜芦醇促进脑出血后大鼠轴突的再生 2.3.1 轴突标记蛋白NF200和MAP-2蛋白的表达
Western blot结果显示:脑出血后14 d,与脑出血组比较,各剂量白藜芦醇能够使NF200和MAP-2蛋白表达升高,其中,大剂量组的效果明显高于小剂量组(P < 0.05,图 4A~C)。免疫组化结果显示:各组蛋白变化趋势与Western blot结果一致(P < 0.05,图 4D~F)。
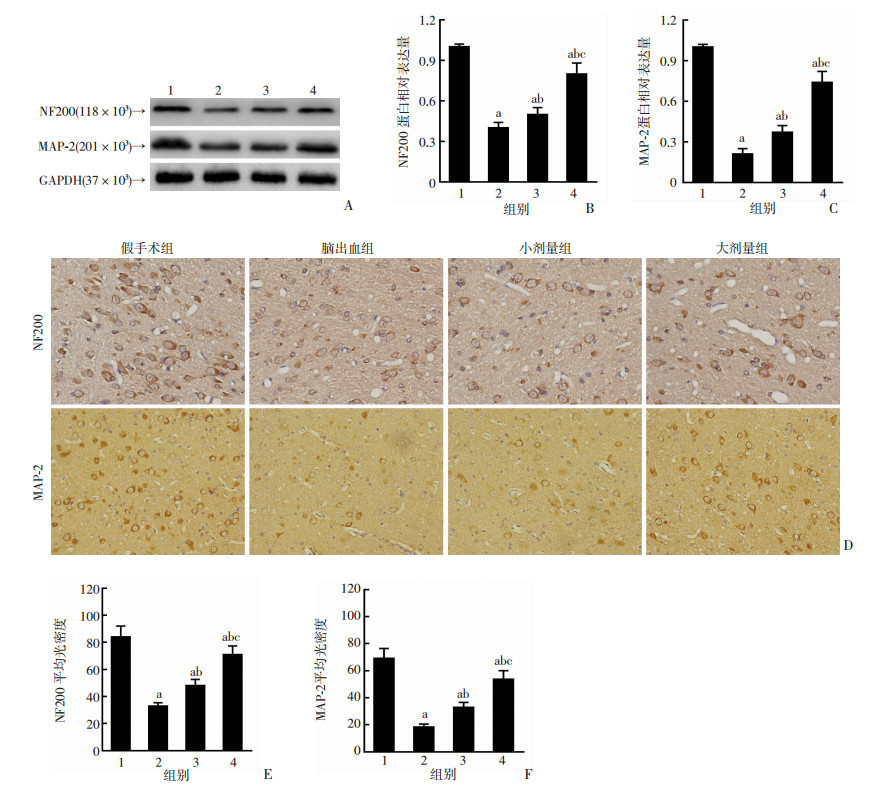
|
| A: Western blot检测各组大鼠NF200和MAP-2的蛋白表达;B、C:各组大鼠NF200和MAP-2蛋白半定量分析;D:免疫组化检测各组大鼠NF200和MAP-2的蛋白表达(S-P×400);E、F:NF200和MAP-2蛋白平均光密度1:假手术组;2:脑出血组;3:小剂量组;4:大剂量组;a: P < 0.05,与假手术组比较;b:P < 0.05,与脑出血组比较;c:P < 0.05,与小剂量组比较 图 4 Western blot和免疫组化检测术后14 d各组大鼠脑出血区域NF200和MAP-2的蛋白表达 |
2.3.2 髓鞘碱性蛋白MBP的表达
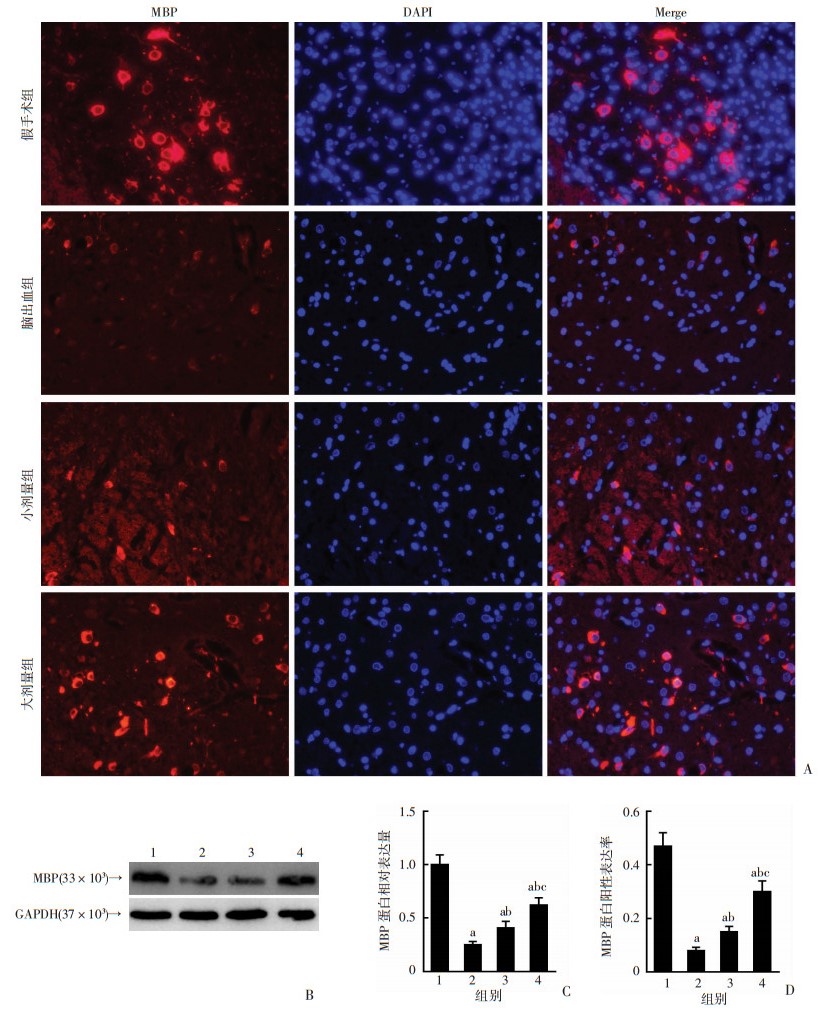
Western blot结果显示:脑出血后14 d,与脑出血组比较,各剂量白藜芦醇能够显著提高MBP的蛋白表达水平,其中,大剂量组的效果明显高于小剂量组(P < 0.05,图 5A)。免疫荧光结果显示,各组蛋白变化趋势与Western blot检测结果一致(P < 0.05,图 5B)。提示白藜芦醇能够促进脑出血后大鼠轴突的再生,并减轻髓鞘的损伤程度。
|
| A:免疫荧光检测各组大鼠MBP的蛋白表达(×400);B:Western blot检测各组大鼠MBP的蛋白表达;C:各组大鼠MBP蛋白半定量分析;D:各组大鼠MBP蛋白阳性表达率1:假手术组;2:脑出血组;3:小剂量组;4:大剂量组;a: P < 0.05,与假手术组比较;b:P < 0.05,与脑出血组比较;c:P < 0.05,与小剂量组比较 图 5 Western blot和免疫荧光检测术后14 d各组大鼠脑出血区域MBP的蛋白表达 |
2.4 白藜芦醇经PI3K/Akt途径抑制AMPKα活性促进脑出血后大鼠的轴突再生
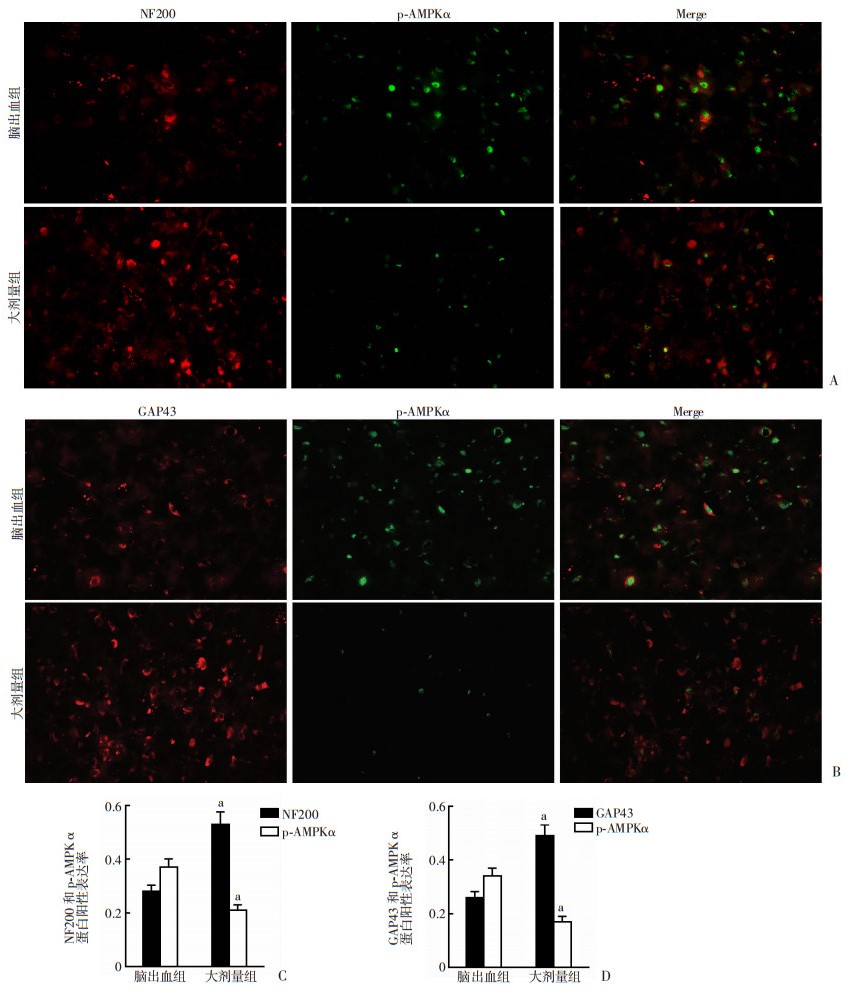
为观察白藜芦醇是否经抑制AMPKα活性促进了大鼠脑出血后轴突的再生,采用免疫荧光检测术后14 d各组大鼠脑组织NF200、GAP43和p-AMPKα的蛋白表达。免疫荧光结果显示:p-AMPKα(绿光)与轴突标记物NF200(红光)基本表达于同一胞体上(图 6A),p-AMPKα(绿光)与轴突标记物GAP43(红光)也基本表达于同一胞体上(图 6B),部分细胞两种阳性表达不共存,可能是由于脑出血导致部分神经元轴突受损,轴突标记蛋白无法成功染色所致。与脑出血组比较,白藜芦醇大剂量组NF200和GAP43的蛋白表达升高,p-AMPKα表达降低(P < 0.05,图 6C、D)。提示AMPK通路可直接作用于神经元对轴突生长起调控作用。
|
| A:免疫荧光定位检测NF200、p-AMPKα的表达(×400);B:免疫荧光定位检测GAP43、p-AMPKα的表达(×400);C、D:NF200、p-AMPKα、GAP43、p-AMPKα蛋白阳性表达率a:P < 0.05,与脑出血组比较 图 6 免疫荧光与Western blot检测术后14 d各组大鼠脑出血区域NF200、GAP43和AMPKα通路蛋白表达 |
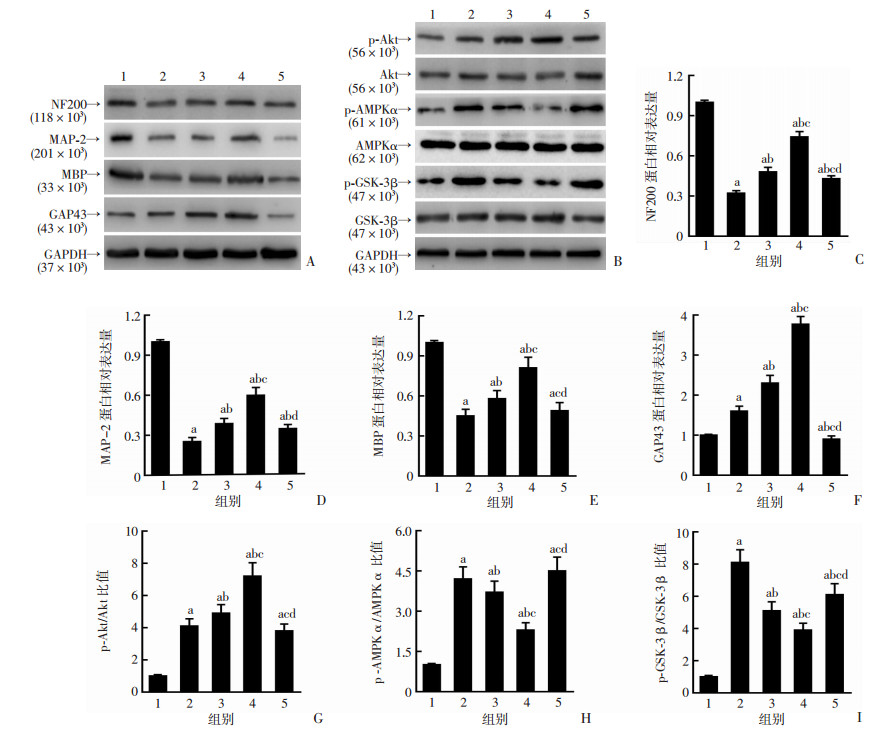
为进一步探讨白藜芦醇对AMPK的抑制是否与PI3K/Akt途径有关,使用Akt阻滞剂LY294002对Akt通路进行阻断,采用Western blot检测术后14 d各组大鼠脑组织NF200、MAP-2、MBP、GAP43、p-Akt、p-AMPKα和p-GSK-3β等蛋白的表达。与脑出血组比较,各剂量白藜芦醇可升高NF200、MAP-2、MBP、GAP43和p-Akt的表达,降低p-AMPKα和p-GSK-3β的表达,其中大剂量组效果明显优于小剂量组(P < 0.05,图 7);与大剂量组比较,大剂量白藜芦醇联用Akt抑制剂LY294002后(抑制剂组)降低了NF200、MAP-2、MBP、GAP43和p-Akt的蛋白表达,升高了p-AMPKα和p-GSK-3β的表达(P < 0.05,图 7)。提示白藜芦醇可经PI3K/Akt途径抑制AMPKα活性促进脑出血后大鼠的轴突再生。
|
| A:Western blot检测各组大鼠脑出血NF200、MAP-2、MBP、GAP43蛋白表达;B:Western blot检测各组大鼠p-Akt、p-AMPKα和p-GSK-3β蛋白表达;C~I:各组蛋白半定量分析1:假手术组;2:脑出血组;3:小剂量组;4:大剂量组;5:抑制剂组;a:P < 0.05,与假手术组比较;b:P < 0.05,与脑出血组比较;c:P < 0.05,与小剂量组比较;d:P < 0.05,与大剂量组比较 图 7 Western blot检测术后14 d各组大鼠脑出血区域NF200、MAP-2、MBP、GAP43和Akt、AMPKα、GSK-3β通路蛋白表达 |
3 讨论
脑出血后发生的脑水肿等继发性损伤可对神经细胞及纤维造成机械性损害。成年人大脑神经元几乎无再生能力,但正常脑组织与受损处脑组织的轴突可建立结构重建[12]。轴突的再生与修复在一定程度上可以使脑出血患者的神经功能得到恢复[13]。
白藜芦醇是一种具有抗氧化、抗炎症以及抗凋亡等功效的多酚化合物。前期有研究证实白藜芦醇可缓解帕金森病时多巴胺能神经元丢失,促进纹状体中的多巴胺神经元存活[14];另外;白藜芦醇可通过调节线粒体的能量代谢减轻脑缺血期间引起的脑损伤[15-16]。但目前白藜芦醇对脑出血后的神经保护及其对轴突再生修复的促进作用,国内外报道较少。神经丝蛋白NF200特异性表达于神经元轴突中,可以作为神经元轴突标记物,反映轴突的生长情况[17]。微管相关蛋白MAP-2位于轴突微管结构中,参与细胞骨架形成并涉及轴突发生与树突分支[18],也可作为轴突标记物。髓鞘是包绕在轴突外面的一层外膜,对轴突有支持作用,并通过其绝缘作用保护轴突内神经电冲动的传导。髓鞘碱性蛋白MBP在髓鞘上高度表达,其表达量与髓鞘厚度呈正相关[19],对髓鞘的功能与结构具有重要作用,可作为髓鞘损伤程度的指标,并从侧面反映轴突的损伤程度[20]。本研究建立大鼠脑出血模型,通过给予白藜芦醇对脑出血大鼠进行干预,观察神经功能、HE染色观察脑组织病理损伤程度,发现白藜芦醇可以缓解脑出血后大鼠的神经功能障碍,降低氧化应激产物水平,并于脑出血后第14天将脑组织病理损伤降至最低。为观察白藜芦醇对脑出血后轴突再生的促进作用,我们将脑出血后第14天作为后续主要观察时间,运用Western blot、免疫组化和免疫荧光检测脑出血区域神经丝蛋白NF200、微管相关蛋白MAP-2和髓鞘相关蛋白MBP的表达,发现白藜芦醇对脑出血大鼠神经元轴突的再生有促进作用,且大剂量白藜芦醇的效果优于小剂量。
神经元受损后轴突的再生修复对神经功能具有重要保护作用。研究发现白藜芦醇能够通过PI3K/Akt通路减轻脑动脉闭塞引起的缺血性脑损伤[21],同时PI3K/Akt的下游产物AMPK对轴突再生相关蛋白GAP43等也具有调节作用[22]。AMPK是调节生物能量代谢的关键分子,其中AMPKα亚基在脑神经元中有较高表达,参与脑细胞的各种代谢活动[7]。GSK-3β在轴突再生的调节中具有重要作用,有研究证实,神经元胞体中GSK-3β的活性降低可调控细胞骨架,促进微管稳定性,增加轴突的再生[23]。近年来,生长相关蛋白43(growth associated protein 43, GAP43)成为轴突再生相关研究的焦点。GAP43主要表达于神经元轴突的生长锥末端,通过诱导轴突出芽、延伸等作用,促进轴突的再生[24-25]。此外,神经元细胞中GAP43蛋白的过度表达还可以引发丝状伪足的形成,提高轴突分支的生长能力,引导其沿正确途径生长并到达靶细胞区域,重建轴突结构联系[26]。因此,我们假设白藜芦醇可以通过PI3K/Akt途径调控AMPK通路,抑制神经元胞体GSK-3β的活性,促进大鼠脑出血后轴突再生。在本研究中增加了Akt通路抑制剂LY294002与大剂量白藜芦醇联用,运用Western blot与免疫荧光等方法对通路相关蛋白进行了检测,结果证实:大剂量白藜芦醇可显著增加Akt的磷酸化水平,并降低神经元细胞AMPKα的磷酸化水平,从而抑制了GSK-3β的活性,增加轴突生长相关蛋白GAP43以及NF200、MAP-2、MBP的表达。对于大剂量白藜芦醇联用PI3K/Akt抑制剂LY294002后,PI3K/Akt的磷酸化水平明显下降,并上调AMPK通路的磷酸化水平,GSK-3β活性升高,NF200、MAP-2、MBP和GAP43的蛋白表达随之下降。上述实验结果初步证明了我们的假设,即白藜芦醇可能通过PI3K/Akt途径降低AMPKα的磷酸化水平,抑制了神经元胞体GSK-3β的活性,以促进脑出血后轴突再生。
综上所述,本研究在大鼠脑出血模型中初步揭示了白藜芦醇在脑出血后的神经保护作用,探讨了其对脑出血后轴突再生和修复的促进作用及可能的机制。对于其可能降低脑损伤的其他机制如保护血脑屏障或促进血管再生等还需要做更深入的研究,为临床治疗脑出血提供新手段。
| [1] |
CRAMER S C. Repairing the human brain after stroke. Ⅱ. Restorative therapies[J]. Ann Neurol, 2008, 63(5): 549-560. DOI:10.1002/ana.21412 |
| [2] |
JARDIM F R, DE ROSSI F T, NASCIMENTO M X, et al. Resveratrol and brain mitochondria: A review[J]. Mol Neurobiol, 2018, 55(3): 2085-2101. DOI:10.1007/s12035-017-0448-z |
| [3] |
XU H E, HUA Y, ZHONG J, et al. Resveratrol delivery by albumin nanoparticles improved neurological function and neuronal damage in transient middle cerebral artery occlusion rats[J]. Front Pharmacol, 2018, 9: 1403. DOI:10.3389/fphar.2018.01403 |
| [4] |
GAO Y, FU R R, WANG J, et al. Resveratrol mitigates the oxidative stress mediated by hypoxic-ischemic brain injury in neonatal rats via Nrf2/HO-1 pathway[J]. Pharm Biol, 2018, 56(1): 440-449. DOI:10.1080/13880209.2018.1502326 |
| [5] |
XU X L, LIU X D, YANG Y C, et al. Resveratrol inhibits the development of obesity-related osteoarthritis via the TLR4 and PI3K/Akt signaling pathways[J]. Connect Tissue Res, 2019, 1-12. DOI:10.1080/03008207.2019.1601187 |
| [6] |
TAO K, MATSUKI N, KOYAMA R. AMP-activated protein kinase mediates activity-dependent axon branching by recruiting mitochondria to axon[J]. Dev Neurobiol, 2014, 74(6): 557-573. DOI:10.1002/dneu.22149 |
| [7] |
SINNETT S E, BRENMAN J E. Past strategies and future directions for identifying AMP-activated protein kinase (AMPK) modulators[J]. Pharmacol Ther, 2014, 143(1): 111-118. DOI:10.1016/j.pharmthera.2014.02.008 |
| [8] |
SEIRA O, DEL RÍO J A. Glycogen synthase kinase 3 beta (GSK3β) at the tip of neuronal development and regeneration[J]. Mol Neurobiol, 2014, 49(2): 931-944. DOI:10.1007/s12035-013-8571-y |
| [9] |
AL-DAMRY N T, ATTIA H A, AL-RASHEED N M, et al. Sitagliptin attenuates myocardial apoptosis via activating LKB-1/AMPK/Akt pathway and suppressing the activity of GSK-3β and p38α/MAPK in a rat model of diabetic cardiom-yopathy[J]. Biomed Pharmacother, 2018, 107: 347-358. DOI:10.1016/j.biopha.2018.07.126 |
| [10] |
LIU C M, YANG H X, MA J Q, et al. Role of AMPK pathway in lead-induced endoplasmic reticulum stress in kidney and in paeonol-induced protection in mice[J]. Food Chem Toxicol, 2018, 122: 87-94. DOI:10.1016/j.fct.2018.10.024 |
| [11] |
PEI H T, JIANG T, LIU G F, et al. The effect of minimally invasive hematoma aspiration on the JNK signal transduction pathway after experimental intracerebral hemorrhage in rats[J]. Int J Mol Sci, 2016, 17(5): E710. DOI:10.3390/ijms17050710 |
| [12] |
刘畅, 王冠宇, 周昌龙, 等. 黄体酮促进脑出血后轴突再生及其相关机制[J]. 第三军医大学学报, 2019, 41(13): 1222-1231. LIU C, WANG G Y, ZHOU C L, et al. Progesterone promotes axonal regeneration after cerebral hemorrhage and related mechanisms in rats[J]. J Third Mil Med Univ, 2019, 41(13): 1222-1231. DOI:10.16016/j.1000-5404.201812150 |
| [13] |
DANCAUSE N, BARBAY S, FROST S B, et al. Extensive cortical rewiring after brain injury[J]. J Neurosci, 2005, 25(44): 10167-10179. DOI:10.1523/JNEUROSCI.3256-05.2005 |
| [14] |
LIU Q Q, ZHU D S, JIANG P E, et al. Resveratrol synergizes with low doses of L-DOPA to improve MPTP-induced Parkinson disease in mice[J]. Behav Brain Res, 2019, 367: 10-18. DOI:10.1016/j.bbr.2019.03.043 |
| [15] |
KHOURY N, XU J, STEGELMANN S D, et al. Resveratrol preconditioning induces genomic and metabolic adaptations within the long-term window of cerebral ischemic tolerance leading to bioenergetic efficiency[J]. Mol Neurobiol, 2018.[Epub ahead of print]. DOI: 10.1007/s12035-018-1380-6.
|
| [16] |
LIN K L, LIN K J, WANG P W, et al. Resveratrol provides neuroprotective effects through modulation of mitochondrial dynamics and ERK1/2 regulated autophagy[J]. Free Radic Res, 2018, 52(11/12): 1371-1386. DOI:10.1080/10715762.2018.1489128 |
| [17] |
LISCHKA K, LADEL S, LUKSCH H, et al. Expression patterns of ion channels and structural proteins in a multimodal cell type of the avian optic tectum[J]. J Comp Neurol, 2018, 526(3): 412-424. DOI:10.1002/cne.24340 |
| [18] |
MERCERÓN-MARTÍNEZ D, ALMAGUER-MELIAN W, ALBERTI-AMADOR E, et al. Amygdala stimulation promotes recovery of behavioral performance in a spatial memory task and increases GAP-43 and MAP-2 in the hippocampus and prefrontal cortex of male rats[J]. Brain Res Bull, 2018, 142: 8-17. DOI:10.1016/j.brainresbull.2018.06.008 |
| [19] |
OZGEN H, SCHRIMPF W, HENDRIX J, et al. The lateral membrane organization and dynamics of myelin proteins PLP and MBP are dictated by distinct galactolipids and the extracellular matrix[J]. PLoS ONE, 2014, 9(7): e101834. DOI:10.1371/journal.pone.0101834 |
| [20] |
SHI X H, CHEN Y H, NADEEM L, et al. Beneficial effect of TNF-α inhibition on diabetic peripheral neuropathy[J]. J Neuroinflamm, 2013, 10: 69. DOI:10.1186/1742-2094-10-69 |
| [21] |
LEI J R, CHEN Q X. Resveratrol attenuates brain damage in permanent focal cerebral ischemia via activation of PI3K/Akt signaling pathway in rats[J]. Neurol Res, 2018, 40(12): 1014-1020. DOI:10.1080/01616412.2018.1509826 |
| [22] |
DINDA B, DINDA M, KULSI G, et al. Therapeutic potentials of plant iridoids in Alzheimer's and Parkinson's diseases: A review[J]. Eur J Med Chem, 2019, 169: 185-199. DOI:10.1016/j.ejmech.2019.03.009 |
| [23] |
JIANG J J, LIU C M, ZHANG B Y, et al. MicroRNA-26a supports mammalian axon regeneration in vivo by suppressing GSK3β expression[J]. Cell Death Dis, 2015, 6: e1865. DOI:10.1038/cddis.2015.239 |
| [24] |
TESIC V, PEROVIC M, ZALETEL I, et al. A single high dose of dexamethasone increases GAP-43 and synaptophysin in the hippocampus of aged rats[J]. Exp Gerontol, 2017, 98: 62-69. DOI:10.1016/j.exger.2017.08.010 |
| [25] |
HOLAHAN M R. A shift from a pivotal to supporting role for the growth-associated protein (GAP-43) in the coordination of axonal structural and functional plasticity[J]. Front Cell Neurosci, 2017, 11: 266. DOI:10.3389/fncel.2017.00266 |
| [26] |
GRASSELLI G, STRATA P. Structural plasticity of climbing fibers and the growth-associated protein GAP-43[J]. Front Neural Circuits, 2013, 7: 25. DOI:10.3389/fncir.2013.00025 |



