2. 400016 重庆,重庆医科大学:中医药学院
2. College of Traditional Chinese Medicine, Chongqing Medical University, Chongqing, 400016, China
人们几乎每天都在接触日光,日光中的紫外线是导致皮肤光老化的重要因素。据报道,90%的皮肤老化由紫外线导致的光老化引起[1];到达地表的紫外线主要分为长波紫外线(ultraviolet radiation A, UVA)和中波紫外线(ultraviolet radiation B, UVB),其中UVB光损伤作用是同剂量UVA的800~1 000倍[2-3],可直接导致DNA损伤,同时也可诱发氧化应激,是引起皮肤光老化的主要诱发因素[4]。人角质形成细胞位于皮肤的表层,是UVB辐射的主要靶细胞。使用UVB照射皮肤角质形成细胞(HaCaT细胞)是构建光老化细胞模型的常用方法,但是目前该模型的构建方法仍缺乏统一性。
尹颂超等[5]采用不同剂量UVB辐照HaCaT细胞,通过检测细胞氧化相关物质(MDA、SOD、LDH)的含量,指出30~40 mJ/cm2的UVB辐照剂量可诱发HaCaT细胞氧化损伤导致细胞衰老,为本研究提供了参考。衰老的评价指标不仅包括氧化相关物质、细胞增殖活性,还包括细胞周期阻滞[6]、细胞衰老β-半乳糖苷酶(SA-β-gal)染色[7]、端粒和端粒酶[8]、衰老相关的分泌表[9],以及常见老化通路p53/p21[10]及p16通路[11]等。
本研究选取30 mJ/cm2的UVB辐照HaCaT细胞,通过检测SA-β-gal活性观察细胞衰老情况,流式细胞仪分析细胞周期分布,以及检测常见老化通路如p53/p21和p16相关通路的表达情况,以期更全面地验证HaCaT细胞光老化模型的可行性,初步探索其可能涉及的老化相关信号转导途径,为皮肤光老化的研究提供实验依据。
1 材料与方法 1.1 材料 1.1.1 细胞及细胞培养HaCaT细胞即永生化人角化细胞细胞系,经多次传代后仍保持正常分化能力,用于研究人角质形成细胞功能,来源于上海中乔新舟生物科技有限公司,细胞均在高糖DMEM培养基(含10%胎牛血清、1%青-链霉素),5%CO2、37 ℃培养箱中培养。
1.1.2 主要试剂及仪器胎牛血清购自德国PAN公司,高糖DMEM培养基购自美国Corning公司,青-链霉素购自美国HyClone公司,0.25%胰酶、SA-β-gal染色试剂盒、BCA蛋白浓度测定试剂盒(增强型)购自上海碧云天生物技术研究所,RNAiso Plus、Prime ScriptTM RT reagent Kit、SYBR® Premix Ex TaqTM Ⅱ、引物购自北京宝日医生物技术有限公司,Cell Counting Kit-8(CCK-8)购自日本株式会社同仁化学研究所,p53兔多克隆抗体购自沈阳万类生物科技有限公司,p21小鼠单克隆抗体购于美国Abcam抗体公司,p16兔单克隆抗体购自美国Cell Signaling Technology,β-actin小鼠单克隆抗体购自武汉博士德生物公司,辣根过氧化物酶标记的羊抗鼠IgG和辣根过氧化物酶标记的羊抗兔IgG均购自杭州联科生物公司,UVB Philips PL-S 9W/01购自荷兰Philips公司,UV-B297型紫外辐照计购自北京师范大学光电仪器厂。
1.2 方法 1.2.1 UVB辐照当细胞融合度约60%时,PBS缓冲液清洗2次,加入薄薄的1层PBS缓冲液覆盖HaCaT细胞,置于UVB光源正下方10 cm处进行辐照(辐照强度:0.1 mW/cm2,辐照时间:5 min,累计辐照剂量:30 mJ/cm2[12])。辐照结束后,弃废液,加入高糖DMEM完全培养基置于细胞孵育箱进行培养。
1.2.2 CCK-8检测HaCaT细胞增殖活性将1 000个细胞接种到96孔板中培养24 h,将细胞暴露于UVB(30 mJ/cm2)并在标准条件下继续培养12、24、48 h,对照组细胞给予虚假照射,每孔中加入10 μL试剂,于37 ℃继续孵育2 h。使用酶联免疫检测仪测定每孔在450 nm处的光密度[D(450)]值,计算细胞增殖率=[实验组D(450)值-空白组D(450)值]/[对照组D(450)值-空白组D(450)值]×100%。
1.2.3 流式细胞仪分析细胞周期收集细胞,用PBS洗涤2次,调整细胞密度为1×106 /mL,每组加入70%冷乙醇1 mL重悬固定,-20 ℃过夜,PI/Triton X-100染色细胞,用流式细胞仪检测细胞周期。
1.2.4 SA-β-gal染色分析各组阳性细胞百分比分别于30 mJ/cm2 UVB辐照后12、24、48 h进行实验,按照SA-β-gal染色试剂盒说明书对各组细胞进行染色,倒置显微镜下观察,老化细胞胞质呈蓝色,阴性细胞未着色,每皿至少计数600个细胞,最终取染色阳性细胞百分比的平均值为各组细胞的SA-β-gal染色阳性率。
1.2.5 Western blot测定HaCaT细胞中p53、p21和p16的蛋白表达收集细胞,按试剂说明书提取总蛋白后保存于-80 ℃,使用BCA蛋白质测定试剂盒测量蛋白质浓度。每组蛋白上样量30~50 μg,经12%SDS-PAGE凝胶电泳,然后转移到PVDF膜上,5%脱脂奶粉封闭2 h,特异性抗体4 ℃孵育过夜:p53兔多克隆抗体(1 :500),p21小鼠单克隆抗体(1 :500),p16兔单克隆抗体(1 :1 000),β-actin小鼠单克隆抗体(1 :500)。次日,PBS漂洗3次,二抗37 ℃孵育1 h[辣根过氧化物酶标记的羊抗鼠IgG和辣根过氧化物酶标记的羊抗兔IgG(1 :5 000)]。PBS漂洗3次后ECL显影,采用Fusion软件分析。
1.2.6 qRT-PCR检测p53、p21和p16的mRNA表达使用RNAiso Plus Total RNA提取试剂盒提取总mRNA,并使用PrimeScriptTM RT试剂盒逆转录成互补DNA,使用TB GreenTM Premix Ex TaqTM Ⅱ聚合酶进行qRT-PCR扩增,程序均按试剂说明书进行。通过qRT-PCR估计总mRNA水平,使用2-△△Ct方法计算基因的相对表达量。以下引物对用于扩增TP53、p21、p16和内参(GAPDH):TP53-F/R(5′-3′),TGCGTGTTTGTGCCTGTCCT/AGTGCTCGCTTAGTGCTCCCT;p21-F/R(5′-3′),TGCCCAAGCTCTACCTTCC/CAGGTCCACATGGTCTTCCT;p16-F/R(5′-3′), TCGGGTAGAGGAGGTGCG/ATC-GGGGATGTCTGAGGG;GAPDH-F/R(5′-3′), CAGGAGGCATTGCTGATGAT/GAAGGCTGGGGCTCATTT。
1.2.7 细胞免疫荧光检测p21胞内定位将细胞接种到盖玻片上,30 mJ/cm2 UVB照射并在不同时间点收获细胞,4%甲醛溶液在室温下固定15 min,细胞膜用1%Triton X-100渗透10 min,用5%山羊血清在37 ℃下封闭1 h,然后在4 ℃下用p21小鼠单克隆抗体(稀释比1 :100)孵育过夜。PBS洗涤3次后,在37 ℃下与荧光二抗孵育1 h,PBS洗涤3次后,使用DAPI在黑暗中染色5 min,进行核标记,激光共聚焦显微镜下观察样品。
1.3 统计学分析采用GraphPad Prism 5软件绘制统计图,SPSS 20.0软件进行分析,实验重复3次,所得数值以x±s表示。两组间数据比较采用独立样本t检验;多组间数据比较采用单因素方差分析。检验水准α=0.05。
2 结果 2.1 30 mJ/cm2 UVB辐照导致HaCaT细胞增殖活性降低将无处理的HaCaT细胞设为对照组,将30 mJ/cm2 UVB辐照的HaCaT细胞设为实验组,通过CCK-8测定来评估细胞的增殖活性。实验组辐照后12、24、48 h增殖率均较对照组降低(F=159.011,P < 0.01),两两比较结果显示:辐照后12、24、48 h 3组间差异无统计学意义(图 1)。
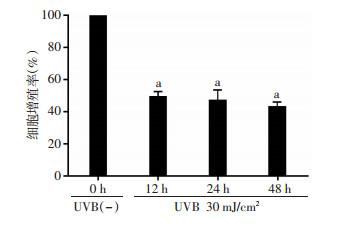
|
| a:P < 0.01,与对照组比较 图 1 CCK-8检测HaCaT细胞的增殖活性(n=3) |
2.2 30 mJ/cm2 UVB辐照导致HaCaT细胞G2期周期停滞
实验组辐照后12、24、48 h,G2期细胞比例较对照组显著增加(P < 0.01,图 2)。
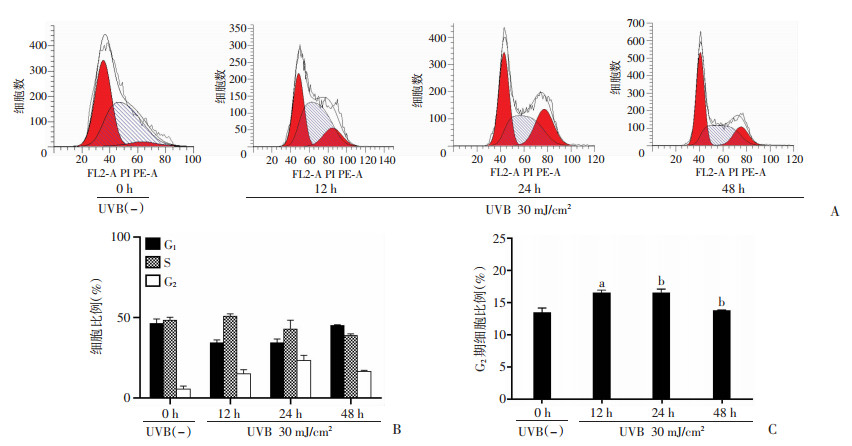
|
| A:流式细胞仪检测;B:各组G1、S、G2期细胞比例分析(n=3);C:各组G2期细胞比例分析(n=3) a:P < 0.05,b:P < 0.01,与对照组比较 图 2 流式细胞仪检测30 mJ/cm2 UVB对HaCaT细胞周期的影响 |
2.3 30 mJ/cm2 UVB辐照导致HaCaT细胞SA-β-gal染色阳性
实验组辐照后12、24、48 h,SA-β-gal染色阳性率较对照组明显增加(F=576.408,P < 0.01),两两比较结果显示:辐照后12、24、48 h 3组间差异无统计学意义(图 3),表明30 mJ/cm2的UVB辐照剂量可以诱导HaCaT细胞发生衰老。
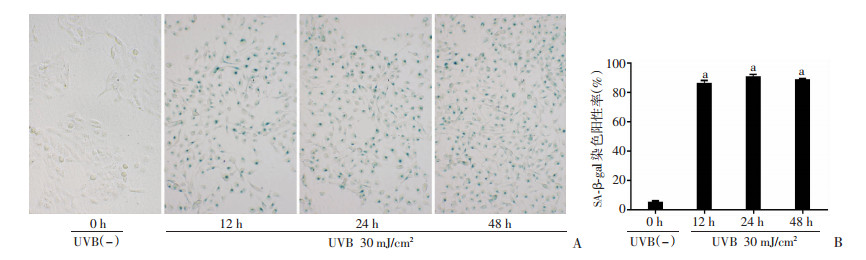
|
| A:SA-β-gal染色观察(×100);B:SA-β-gal染色阳性率分析(n=3) a:P < 0.01,与对照组比较 图 3 各组细胞SA-β-gal染色分析 |
2.4 30 mJ/cm2 UVB辐照对HaCaT细胞中p53/p21及p16相关信号通路的影响
Western blot检测结果(图 4A、B)显示:经30 mJ/cm2 UVB照射后24 h,p53、p16蛋白表达明显升高,但p21蛋白表达明显下降。qRT-PCR检测结果(图 4C)显示:与对照组比较,p53 mRNA表达量在UVB辐照后升高至(2.475±0.443)倍(P=0.028 8),p21 mRNA表达量在UVB辐照后降低至(0.532±0.097)倍(P=0.014 1),p16 mRNA表达量在UVB辐照后升高(3.310±0.172)倍(P=0.001 9)。

|
| A:Western blot检测;B:蛋白表达半定量分析(n=3);C:qRT-PCR检测半定量分析(n=3) a:P < 0.05,b:P < 0.01,与对照组比较 图 4 Western blot和qRT-PCR检测p53、p21和p16的表达 |
2.5 30 mJ/cm2 UVB辐照导致p21发生核移位
无UVB辐照时,p21均匀分布于细胞质及细胞核中,但给予30 mJ/cm2 UVB辐照后,p21发生了明显的核定位(图 5)。
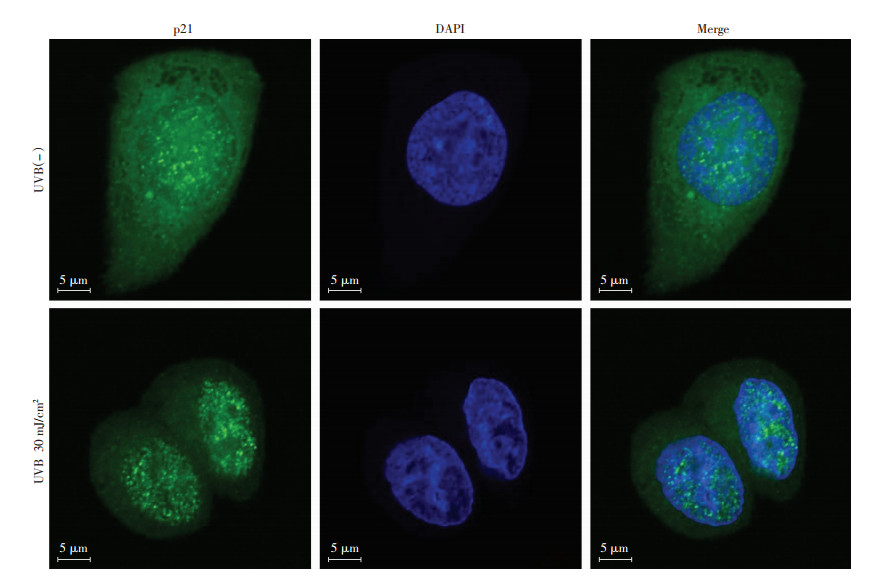
|
| p21蛋白呈绿色荧光,核呈蓝色荧光 图 5 免疫荧光观察p21的胞内定位(激光共聚焦显微镜) |
3 讨论
长期反复的紫外线暴露不仅导致皮肤光老化[13-14],同时还可在曝光部位出现日光相关性皮肤病,人皮肤角质形成细胞在皮肤屏障保护功能中扮演着重要的角色,它的衰老也越来越受到人们的重视。HaCaT细胞的生长能力强,可快速完成细胞的培养及模型的构建,避免了如原代细胞培养困难、耗时等情况的发生,可作为皮肤光老化体外研究的基石,为后续的实验提供支持,所以HaCaT细胞光老化模型的成功构建尤为重要。
细胞衰老是细胞发展的必然过程,随着时间的延长,细胞增殖和分化能力缓慢衰退,并伴有多种生理功能的低下。几种常见的细胞衰老检测指标中,细胞周期阻滞及增殖活性的抑制是发生衰老的必要条件[6],同时SA-β-gal是细胞溶酶体中的一种水解酶,也被认为是衰老检测的金标准[7]。尹颂超等[5]仅检测了HaCaT细胞的增殖活性及常见的氧化损伤指标,并未对细胞周期、SA-β-gal及常见衰老通路的表达进行验证,而我们的实验对以上缺失部分进行补充,更全面地验证HaCaT细胞的衰老情况;另外尹颂超等[5]均于UVB辐照后24 h进行检测,而本研究设计了不同的时间点(12、24 h和48 h),进一步验证收获衰老HaCaT细胞的最佳时间点。
本研究选取30 mJ/cm2的UVB剂量辐照HaCaT细胞,分别在UVB辐照后12、24、48 h收获细胞,并对SA-β-gal、细胞增殖活性及细胞周期进行检测,发现UVB辐照后12、24、48 h均有高达80%以上的细胞发生衰老,增殖活性明显下降,同时伴有明显的G2期阻滞,而在UVB辐照后24 h,G2期阻滞达到高峰。提示给予30 mJ/cm2 UVB辐照并于辐照后24 h收获细胞进行后续实验可作为光老化HaCaT细胞模型的推荐方法。
目前研究表明:衰老的发生与肿瘤抑制基因和蛋白p53/p21有关[15-16]。EL-DEIRY等[17]指出应激损伤后细胞可产生野生型p53蛋白,从而激活p21的转录活性,p21蛋白的产生及其向细胞核的转运导致细胞G1期停滞,从而诱导衰老的发生。然而,在由UVB照射引起光老化的HaCaT细胞中并未观察到这一现象,在光老化的HaCaT细胞中,p53基因和蛋白的表达均较对照组升高,然而p21基因和蛋白的表达均下降。众所周知,HaCaT细胞是永生化人角质形成细胞,其p53基因含有两个点突变[18]。因此,我们推测突变的p53基因未能激活p21基因的转录活性,在光老化的HaCaT细胞中并不能通过经典的p53/p21信号通路调节衰老,p53蛋白或基因的表达并不能作为HaCaT细胞衰老的检测指标。
针对p21蛋白,虽然突变的p53并不能激活p21的转录[19],但是目前已有大量研究表示其周期抑制作用与胞内定位密切相关[20-21]。本研究亦对p21的胞内定位进行检测,发现对照组细胞的p21蛋白分布于胞质和胞核中,而在光老化的HaCaT细胞中可见p21蛋白发生明显的核移位,我们认为虽然p21蛋白在光老化的HaCaT细胞中表达下降,但是并不影响p21蛋白向细胞核的转运,仍具有导致细胞周期停滞诱导衰老的能力。提示p21蛋白的核内定位可作为验证HaCaT细胞光老化的辅助指标。
p16是一种细胞周期蛋白依赖性激酶抑制因子[22]。目前已有大量研究指出p16的表达与衰老呈正相关,提出p16可能是细胞、小鼠甚至人类组织中较为可信的衰老标志物[23-25]。本研究发现p16在光老化的HaCaT细胞中表达明显升高,提示HaCaT细胞通过p16通路调控衰老。
本研究发现30 mJ/cm2的UVB辐照可成功构建光老化HaCaT细胞模型,其机制可能是通过调控p21核定位及p16通路诱导了细胞衰老的进程。尽管本研究尚存在一些不足,如老化机制未进一步延伸等,但通过对HaCaT细胞周期停滞、增殖活性、SA-β-gal染色、老化相关通路标志蛋白等几个方面进行评价,验证了皮肤光老化HaCaT细胞模型的成功建立,为之后的机制研究及临床治疗奠定了基础。
| [1] |
GILCHREST B A. Skin aging and photoaging[J]. Dermatol Nurs, 1990, 2(2): 79-82. |
| [2] |
MOAN J, POROJNICU A C, DAHLBACK A. Ultraviolet radiation and malignant melanoma[J]. Clin Dermatol, 2008, 624(1): 67-104. DOI:10.1007/978-0-387-77574-6_9 |
| [3] |
SYED D N, KHAN M I, SHABBIR M, et al. MicroRNAs in skin response to UV radiation[J]. Curr Drug Targets, 2013, 14(10): 1128-1134. DOI:10.2174/13894501113149990184 |
| [4] |
李建民, 徐艳明, 陈巧云, 等. 杜仲抗UVB致HaCaT细胞光老化活性部位的初步筛选[J]. 中医药信息, 2011, 28(1): 24-26. LI J M, XU Y M, CHEN Q Y, et al. Screening on activity part of eucommia for resistance photoaging from UVB induced damage[J]. Information Tradit Chin Med, 2011, 28(1): 24-26. DOI:10.3969/j.issn.1002-2406.2011.01.010 |
| [5] |
尹颂超, 张云青, 薛晓杨, 等. 不同剂量中波紫外线照射对角质形成细胞的氧化损伤作用[J]. 中国美容医学, 2016, 25(5): 57-59. YIN S C, ZHANG Y Q, XUE X Y, et al. The oxidative damage on keratinocytes from UVB at different doses[J]. Chin J Aesth Med, 2016, 25(5): 57-59. DOI:10.15909/j.cnki.cn61-1347/r.001151 |
| [6] |
MICHALOGLOU C, VREDEVELD L C W, SOENGAS M S, et al. BRAFE600-associated senescence-like cell cycle arrest of human naevi[J]. Nature, 2005, 436(7051): 720-724. DOI:10.1038/nature03890 |
| [7] |
COLLADO M, SERRANO M. The power and the promise of oncogene-induced senescence markers[J]. Nat Rev Cancer, 2006, 6(6): 472-476. DOI:10.1038/nrc1884 |
| [8] |
DUMONT P. Increasing the complexity of respiratory syncytial virus infection: Reactive oxygen species, DNA damage, and premature senescence[J]. Virulence, 2016, 7(4): 372-375. DOI:10.1080/21505594.2016.1162370 |
| [9] |
KENNEDY A L, MCBRYAN T, ENDERS G H, et al. Senescent mouse cells fail to overtly regulate the HIRA histone chaperone and do not form robust senescence associated Heterochromatin Foci[J]. Cell Div, 2010, 5: 16. DOI:10.1186/1747-1028-5-16 |
| [10] |
LEE S H, UM S J, KIM E J. CBX8 antagonizes the effect of Sirtinol on premature senescence through the AKT-RB-E2F1 pathway in K562 leukemia cells[J]. Biochem Biophys Res Commun, 2016, 469(4): 884-890. DOI:10.1016/j.bbrc.2015.12.070 |
| [11] |
BAKER D J, WIJSHAKE T, TCHKONIA T, et al. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders[J]. Nature, 2011, 479(7372): 232-236. DOI:10.1038/nature10600 |
| [12] |
ZHOU F, HUANG X, PAN Y, et al. Resveratrol protects HaCaT cells from ultraviolet B-induced photoaging via upregulation of HSP27 and modulation of mitochondrial caspase-dependent apoptotic pathway[J]. Biochem Biophys Res Commun, 2018, 499(3): 662-668. DOI:10.1016/j.bbrc.2018.03.207 |
| [13] |
REDDY K K, GILCHREST B A. The molecular basis of cutaneous aging[J]. Expert Rev Dermatol, 2011, 6(5): 525-536. DOI:10.1586/edm.11.48 |
| [14] |
GILCHREST B A. Photoaging[J]. J Invest Dermatol, 2013, 133: E2-E6. DOI:10.1038/skinbio.2013.176 |
| [15] |
MOH M C, ZHANG T, LEE L H, et al. Expression of hepaCAM is downregulated in cancers and induces senescence-like growth arrest via a P53/p21-dependent pathway in human breast cancer cells[J]. Carcinogenesis, 2008, 29(12): 2298-2305. DOI:10.1093/carcin/bgn226 |
| [16] |
KANG J Y, KIM J J, JANG S Y, et al. The p53-p21(Cip1/WAF1) pathway is necessary for cellular senescence induced by the inhibition of protein kinase CKⅡ in human colon cancer cells[J]. Mol Cells, 2009, 28(5): 489-494. DOI:10.1007/s10059-009-0141-9 |
| [17] |
EL-DEIRY W S, HARPER J W, O'CONNOR P M, et al. WAF1/CIP1 is induced in p53-mediated G1 arrest and apoptosis[J]. Cancer Res, 1994, 54(5): 1169-1174. |
| [18] |
LEHMAN T A, MODALI R, BOUKAMP P, et al. P53 mutations in human immortalized epithelial cell lines[J]. Carcinogenesis, 1993, 14(5): 833-839. DOI:10.1093/carcin/14.5.833 |
| [19] |
DATTO M B, LI Y, PANUS J F, et al. Transforming growth factor beta induces the cyclin-dependent kinase inhibitor p21 through a p53-independent mechanism[J]. Proc Natl Acad Sci USA, 1995, 92(12): 5545-5549. DOI:10.1073/pnas.92.12.5545 |
| [20] |
CMIELOVÁ J, REZÁČOVÁ M. P21Cip1/Waf1 protein and its function based on a subcellular localization[corrected][J]. J Cell Biochem, 2011, 112(12): 3502-3506. DOI:10.1002/jcb.23296 |
| [21] |
ZHOU B P, LIAO Y, XIA W, et al. Cytoplasmic localization of P21Cip1/WAF1 by Akt-induced phosphorylation in HER-2/neu-overexpressing cells[J]. Nat Cell Biol, 2001, 3(3): 245-252. DOI:10.1038/35060032 |
| [22] |
PARRY D, BATES S, MANN D J, et al. Lack of cyclin D-Cdk complexes in Rb-negative cells correlates with high levels of P16INK4/MTS1 tumour suppressor gene product[J]. EMBO J, 1995, 14(3): 503-511. |
| [23] |
BURD C E, SORRENTINO J A, CLARK K S, et al. Monitoring tumorigenesis and senescence in vivo with a P16INK4a-luciferase model[J]. Cell, 2013, 152(1/2): 340-351. DOI:10.1016/j.cell.2012.12.010 |
| [24] |
WESTHOFF J H, HILGERS K F, STEINBACH M P, et al. Hypertension induces somatic cellular senescence in rats and humans by induction of cell cycle inhibitor P16INK4a[J]. Hypertension, 2008, 52(1): 123-129. DOI:10.1161/HYPERTENSIONAHA.107.099432 |
| [25] |
RAYESS H, WANG M B, SRIVATSAN E S. Cellular senescence and tumor suppressor gene p16[J]. Int J Cancer, 2012, 130(8): 1715-1725. DOI:10.1002/ijc.27316 |



