肝硬化是肝细胞癌最常见原因,约90%的肝细胞癌来源于肝硬化组织[1]。细胞外基质(extra celluar matrix,ECM)生物支架成分改变及结构失衡与疾病发生息息相关,当胶原蛋白在组织大量沉积时导致组织硬度增加,进而促进组织纤维化[2]。目前肝硬化的发病机制尚不完全明了,肝硬化的治疗也缺乏相应的药物,当患者罹患肝硬化后,病情往往持续进展至终末期肝病,预后不佳[3]。深入了解肝硬化发病机制,对于肝硬化的治疗具有积极意义。
ECM是利用理化的方法去除组织原有细胞,仅保留细胞外基质成分及支架结构[4]。已有研究表明,ECM参与了细胞分化、生长、发育等一系列过程,其成分与含量的变化与疾病发生、发展密切相关[5-6]。近年来,已有研究小组利用正常或疾病状态下的ECM进行细胞培养,了解细胞在表型的变化,加深对疾病发病机理的认识。
本研究通过理化方法制备人源性肝硬化组织ECM,并评估人原代肝细胞(primary human hepatocytes,PHH)在肝硬化支架上的生长情况。研究尝试利用疾病状态下的生物支架对细胞进行立体培养,对了解疾病的发生发展过程具有一定积极意义。
1 材料与方法 1.1 材料重庆医科大学附属儿童医院肝移植受者移除的硬化肝脏,通过医院伦理委员会审核通过[2019伦审(研)第22号],与患者及家属签署知情同意书,术中硬化肝组织离体后,立即予以12.5 U/mL肝素生理盐水灌洗肝脏2~3次,直至灌洗液清亮,去除脉管中的血细胞及血凝块,后经磷酸缓冲盐溶液清洗后,切割成为(5~8)mm×(5~8)mm×(5~8)mm大小的组织块,-80 ℃长期保存。
1.2 生物支架去细胞将组织块融化后,置于超纯水中30 min,再将其置于超纯水中反复振荡,使用低渗环境让细胞肿胀破裂;将组织块置于离子型去污剂0.5%十二烷基硫酸钠中反复振荡,破坏细胞膜,使基因组DNA释放;将组织块置于非离子型去污剂1%聚乙二醇辛基苯基醚中反复振荡,进一步去除支架中的DNA及免疫源性物质;再将肝硬化组织ECM置于超纯水中反复振荡后,放入4 ℃磷酸缓冲盐溶液中保存。
1.3 残余DNA鉴定分别将肝硬化组织及肝硬化组织ECM放于液氮研磨成粉末状,并于微量电子秤上称量,后将组织粉末溶于1 000 μL去离子水中,室温10 000×g离心1 min,后取上清1 μL,Nanodrop定量检测样本中双链DNA含量。
1.4 组织学染色将制备成功的肝硬化组织ECM以及新鲜肝纤维化组织,放于4%多聚甲醛固定,经过石蜡包埋处理,制备5 μm切片,经脱蜡固定,苏木精-伊红、天狼星红染色,观察组织结构及细胞残留情况和组织胶原沉积情况。
1.5 扫描电镜检测将无细胞肝硬化组织ECM及新鲜肝硬化组织放于戊二醛中固定,样本送至重庆医科大学电子显微镜室进行扫描电镜检测。
1.6 细胞培养PHH培养于肝细胞培养基(Sciencell公司,货号5210),接种前将细胞重悬于培养基中并计数,将已消毒的人源性肝硬化组织ECM转移至96孔板中,将混合的细胞悬液以悬滴的形式分别滴于人源性肝硬化组织ECM表面,接种细胞数为5×105/支架,37 ℃孵育1.5 h后,将细胞悬液再次滴入人源性肝硬化组织ECM上,37 ℃继续孵育30 min,后加入140 μL细胞培养基过夜,并于细胞接种后第2天将含有细胞的人源性肝硬化组织ECM转移至48孔板中。
1.7 qPCR法检测肝细胞的特异性基因表达TRIzol法提取组织细胞的总RNA, qPCR检测不同培养模型下肝脏特异性基因甲胎蛋白(AFP)、白蛋白(ALB)、肝细胞核因子4(HNF4A1)、CYP3A4表达。各引物序列见表 1。PCR反应体系为10 μL,反应条件为:95 ℃预变性3 min;95 ℃ 10 s、60 ℃ 30 s,共40个循环。以β-actin为内参基因,目的基因的相对表达水平用2-ΔΔCt法计算。
| 基因 | 引物 | 片段大小/bp |
| AFP | 上游: 5′-GCGGCTGACATTATTATCG-3′ | 130 |
| 下游: 5′-TGTTTCATCCACCACCAA-3′ | ||
| Albumin | 上游: 5′- TTGATTGCCTTTGCTCAGT-3′ | 199 |
| 下游: 5′- CAGTCAGCCATTTCACCAT-3′ | ||
| HNF4A | 上游: 5′- GGGTCGAGCATCCTGTT-3′ | 128 |
| 下游: 5′- CAGATGAGCCTGACTTCCA-3′ | ||
| CYP3A4 | 上游: 5′-ATGGCACCGTAAGTGGAG-3′ | 105 |
| 下游: 5′-TGGTGTTCTCAGGCACAG-3′ | ||
| β-actin | 上游: 5′- CTCTTCCAGCCTTCCTTCCT-3′ | 118 |
| 下游: 5′- AGCACTGTGTTGGCGTACAG-3′ |
2 结果 2.1 人肝硬化支架外观及细胞残留鉴定
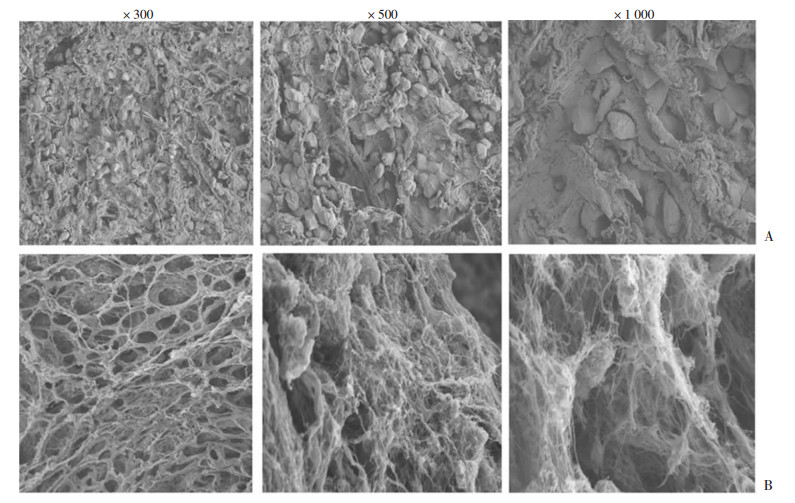
肝硬化组织生物支架外观、组织学染色及扫描电镜染色(图 1):肝硬化组织生物支架经去细胞处理后,外观呈半透明状。肝硬化组织ECM行苏木精-伊红染色和天狼星红染色,与肝硬化组织对比,无细胞残留,但保留支架形态。通过电镜扫描显示超微结构上与新鲜肝硬化组织接近,但无细胞残留(图 2)。

|
| A:切割为约125 mm3大小的组织块,呈棕黄色;B:去细胞后肝硬化组织ECM呈白色半透明状;C:肝组织块苏木精-伊红染色(×20);D:肝硬化组织ECM苏木精-伊红染色显示组织细胞残留情况(×20);E:肝硬化组织块天狼星红染色(×20);F:肝硬化组织ECM天狼星红染色(×20) 示生物支架中胶原蛋白含量多,与新鲜肝硬化组织结构相类似 图 1 肝硬化组织生物支架外观及组织学观察 |
|
| A:肝硬化组织超微结构;B:人肝硬化组织ECM超微结构 与新鲜肝硬化组织接近,但无细胞残留 图 2 肝硬化组织及生物支架超微结构观察 |
2.2 人源性肝硬化组织ECM DNA残留检测
Nanodrop定量检测人源性肝硬化组织ECM样本的DNA残留约为10 ng/mg组织干质量,经过同样处理的肝硬化组织样本的DNA量高达7 000 ng/mg左右,DNA去除率超过99.5%。
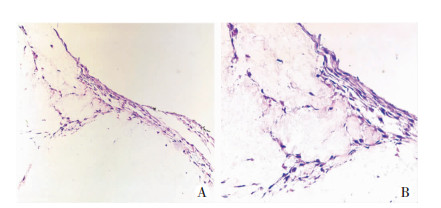
2.3 PHH植入肝硬化组织ECMPHH接种入人源性肝硬化组织ECM。9 d后,HE染色观察细胞植入情况,发现PHH能够植入人源性肝硬化组织ECM中并生长良好(图 3)。
|
| A:肝硬化组织ECM(×20);B:肝硬化组织(×40) 图 3 PHH接种入人源性肝硬化组织ECM 9 d生长情况 |
2.4 PHH离体培养下特异性基因表达水平分析
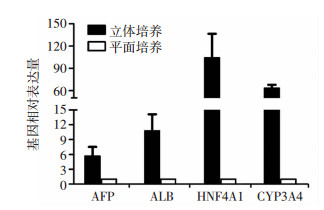
将PHH细胞分别接种于人肝硬化ECM支架及传统细胞培养皿上,9 d后收集细胞,提取总RNA,通过qPCR方法对比PHH在立体培养及传统平面培养模式下,肝脏特异性基因AFP、ALB、HNF4A1、CYP3A4表达水平。结果显示,立体培养条件下,肝脏特异性基因表达水平明显高于传统平面培养(图 4)。提示立体培养情况下,肝细胞相关基因表达水平更高,能更好维持肝细胞分化。
|
| 将平面培养下基因的表达定为1 图 4 肝硬化组织ECM特异性基因表达水平 |
3 讨论
细胞外基质是由组织细胞分泌形成的立体支架结构,其主要成分为胶原蛋白、弹性蛋白、蛋白多糖以及糖蛋白等[7]。细胞外基质在维持组织形态、诱导组织细胞黏附生长等方面发挥重要作用。除此之外,ECM通过分泌包括转化生长因子、表皮生长因子、Wnt信号蛋白等多种信号分子调节ECM结构,参与调控细胞生长与分化,胚胎发育,维护组织器官生理功能[8-10]。利用ECM对细胞进行培养,能在一定程度上模拟细胞在体内的微环境,相较于传统的培养皿培养细胞,利用ECM作为培养平台对组织细胞进行立体培养能够更好地模拟组织细胞在体内的形态及功能,是良好的体外研究平台。已有部分研究小组通过对ECM进行修饰改造后植入动物体内,以期达到组织再生及功能替代的作用[11]。不仅如此,ECM质与量的改变,与纤维化、肿瘤等疾病的发生关系密切,通过制备疾病相关的ECM组织支架,有利于阐明细胞与组织微环境相互作用在疾病发生发展中的意义[11]。
ECM制备的原理在于最大限度地去除原组织结构中的细胞以及核酸,减少ECM的免疫原性,与此同时,尽可能保留组织结构的天然形态,以利于细胞生长。截至目前,ECM主要的制备方法是采用灌流法。该方法将组织器官部分或全部浸入灌流液中,利用组织器官原有的脉管网络,将灌流液灌入组织器官中,以此形成一个循环,洗脱组织器官中原有的细胞。利用组织灌流法已成功在鼠、猪、兔等动物模型上建立ECM,生物支架种类已涵盖肺、肝、食道、小肠、膀胱上皮、皮肤、脂肪、胰腺等几乎所有的组织脏器[12]。但来源于动物的细胞外基质由于其种系及结构上的差异,在人类疾病的相关研究中仍存在缺陷与不足。能够较好的促进细胞分化,增殖以及组织修复及重塑的ECM应该是来自同源组织的天然生物支架。目前人脏器组织的ECM还为数不多,一方面,来源的缺乏以及伦理的限制使人源性正常组织获取困难。另一方面,采用制备动物ECM的方法,往往不能在人组织脏器上制备出合格的ECM[13]。来自意大利的研究小组采用组织灌流法比较了其在猪肝脏组织及5例人肝脏组织中的去细胞效果[14]。结果发现,利用组织灌流法可以完全去除猪肝脏组织中的细胞,而相对于5例正常人肝脏组织,仅仅只有1例肝脏组织中细胞被完全去除,剩余4例均含有较多细胞。这一研究证实,适合于动物的灌流法并不完全适用人类组织器官。对于来自于人体的组织进行ECM的制备应该依据组织结构特点采用不同的方法。2017年,MAZZA等[7]对通过机械震荡+化学裂解相结合的方法成功制备健康人肝脏ECM,为人肝脏组织ECM提供了理论支持。但该小组对于肝脏生物支架研究仅限于正常肝组织,目前尚无对肝硬化组织ECM制备技术的相关报道。
综上所述,本研究成功制备了人源性肝硬化组织ECM生物支架,并进一步探讨其作为细胞立体培养平台的可行性,后续研究将进一步优化细胞立体培养条件,为阐明肝纤维化发生机制奠定基础。
| [1] |
MOON H, CHO K, SHIN S, et al. High risk of hepato-cellular carcinoma development in fibrotic liver: role of the hippo-YAP/TAZ signaling pathway[J]. Int J Mol Sci, 2019, 20(3): E581. DOI:10.3390/ijms20030581 |
| [2] |
ELPEK G Ö. Cellular and molecular mechanisms in the pathogenesis of liver fibrosis: An update[J]. World J Gastroenterol, 2014, 20(23): 7260-7276. DOI:10.3748/wjg.v20.i23.7260 |
| [3] |
JUNG Y K, YIM H J. Reversal of liver cirrhosis: current evidence and expectations[J]. Korean J Int Med, 2017, 32(2): 213-228. DOI:10.3904/kjim.2016.268 |
| [4] |
CRAPO P M, GILBERT T W, BADYLAK S F. An overview of tissue and whole organdecellularization processes[J]. Biomaterials, 2011, 32(12): 3233-3243. DOI:10.1016/j.biomaterials.2011.01.057 |
| [5] |
MCCLELLAND R, WAUTHIER E, URONIS J, et al. Gradients in the liver's extracellular matrix chemistry from periportal to pericentral zones: influence on human hepatic progenitors[J]. Tissue Eng Part A, 2008, 14(1): 59-70. DOI:10.1089/ten.a.2007.0058 |
| [6] |
SUZUKI A, IWAMA A, MIYASHITA H, et al. Role for growth factors and extracellular matrix in controlling differentiation of prospectively isolated hepatic stem cells[J]. Development, 2003, 130(11): 2513-2524. DOI:10.1242/dev.00459 |
| [7] |
MAZZA G, AL-AKKAD W, TELESE A, et al. Rapid production of human liver scaffolds for functional tissue engineering by high shear stress oscillation-decellularization[J]. Sci Rep, 2017, 7(1): 5534. DOI:10.1038/s41598-017-05134-1 |
| [8] |
SCHUPPAN D, RUEHL M, SOMASUNDARAM R, et al. Matrix as a modulator of hepatic fibrogenesis[J]. Semin Liver Dis, 2001, 21(3): 351-372. DOI:10.1055/s-2001-17556 |
| [9] |
ENGLER A J, SEN S, SWEENEY H L, et al. Matrix elasticity directs stem cell lineage specification[J]. Cell, 2006, 126(4): 677-689. DOI:10.1016/j.cell.2006.06.044 |
| [10] |
WELLS R G. The role of matrix stiffness in regulating cell behavior[J]. Hepatology, 2008, 47(4): 1394-1400. DOI:10.1002/hep.22193 |
| [11] |
CHEN Y X, WONG P P, SJEKLOCHA L, et al. Mature hepatocytes exhibit unexpected plasticity by direct dedifferentiation into liver progenitor cells in culture[J]. Hepatology, 2012, 55(2): 563-574. DOI:10.1002/hep.24712 |
| [12] |
BAPTISTA P M, SIDDIQUI M M, LOZIER G, et al. The use of whole organ decellularization for the generation of a vascularized liver organoid[J]. Hepatology, 2011, 53(2): 604-617. DOI:10.1002/hep.24067 |
| [13] |
MAZZA G, ROMBOUTS K, RENNIE HALL A, et al. Decellularized human liver as a natural 3D-scaffold for liver bioengineering and transplantation[J]. Sci Rep, 2015, 5: 13079. DOI:10.1038/srep13079 |
| [14] |
MATTEI G, MAGLIARO C, PIRONE A, et al. Decellularized human liver is too heterogeneous for designing a generic extracellular matrix mimic hepatic scaffold[J]. Artif Organs, 2017, 41(12): E347-E355. DOI:10.1111/aor.12925 |



