2. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院:干细胞与再生医学科
2. Department of Stem Cell and Regenerative Medicine, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
结直肠癌是常见的消化系统肿瘤,而转移则是结直肠癌患者最突出的病理特征和首要死亡原因。然而,目前尚缺乏有效治疗转移的措施和手段[1-2]。因此,深入挖掘转移相关的重要分子,可望获得抗结直肠癌转移的新靶标。
溶酶体主要负责降解包括蛋白质在内的各种大分子或细胞器,在细胞生命活动中起着重要作用[3-4]。既往研究认为:溶酶体可以通过自噬降解细胞连接蛋白[5-6]、胞外分泌基质金属蛋白酶以重塑细胞外基质等多种方式促进肺癌、乳腺癌、黑色素瘤等肿瘤转移。因此,从溶酶体出发,筛选与结直肠癌转移相关的分子,有助于寻找新的防治转移的靶标[7-8]。然而,众多溶酶体结构分子以及溶酶体腔中所包含的酶蛋白分子中,哪些与结直肠癌的转移相关,目前并不清楚。
本研究基于TCGA数据库通过LASSO(least absolute shrinkage and selection operator)算法对溶酶体相关基因进行Logistic回归分析,以筛选结直肠癌转移中的关键溶酶体分子,进一步利用基于LASSO算法的COX回归获得对结直肠癌预后有影响的溶酶体分子,而后通过数据库和人结直肠癌组织切片免疫组织化学染色对筛选所得的分子进行分析,探讨回归系数最大的艾杜糖醛酸-2-硫酸酯酶(iduronic acid-2-sulfatase,IDS)与结直肠癌临床病理参数和生存预后的关系,为探索结直肠癌诊断、治疗的靶点提供新的方向。
1 材料与方法 1.1 生物信息学分析 1.1.1 TCGA数据库下载及溶酶体基因表达谱获取下载结直肠癌数据集(Colon Adenocarcinoma TCGA-632) (http://www.cbioportal.org)的表达谱(数据通过Z-scors标准化)及临床病理数据;利用KEGG(https://www.kegg.jp/)获取溶酶体基因集(map04142)。
1.1.2 基于LASSO算法的Logistic回归和COX回归分析获取Colon Adenocarcinoma TCGA-632数据集中患者临床病理参数及基因表达谱信息;采用R语言包(glmnet)进行基于LASSO算法的Logistic回归[9],以ROC曲线下面积(AUC)指定最小化目标参数,在KEGG溶酶体基因集(map04142)中筛选获得与转移相关的基因,并绘制交叉验证图;进一步采用基于LASSO算法的COX回归,以部分似然偏差指定最小化目标参数,对前述基因进行回归压缩和变量选择,获得具有预后判断意义的基因。
1.2 材料 1.2.1 仪器及试剂纯水仪购自美国Millipore公司,光学显微镜BX40、BX53购自日本奥林巴斯公司,微波炉购自美的公司,保湿盒购自协力塑料制品厂,PBS缓冲粉剂、山羊封闭血清、苏木精染色液购自中杉金桥,无水乙醇、二甲苯、30%过氧化氢、中性树胶封片试剂购自重庆川东化工,枸橼酸、枸橼酸钠购自金锦乐化学有限公司,Envision法鼠兔通用型免疫组化检测试剂盒购自丹麦DAKO公司。
1.2.2 实验样本包含生存信息的人结直肠癌患者结直肠癌原发灶组织50例(男性30例,女性20例)来自本院2007-2008年生物样本库,随访至2013年4月;其中远处转移患者9例,无远处转移患者41例;发生淋巴结转移患者10例,无淋巴结转移患者40例。
1.3 免疫组织化学染色、图像采集及分析① 将组织置于60 ℃烘箱烤片60 min,按标准进行脱蜡处理;②阻断:滴加3%过氧化氢阻断液室温放置15 min;③修复:将组织浸泡于柠檬酸抗原修复液中进行修复;④足量山羊封闭血清,37 ℃封闭45 min;⑤滴加足量IDS一抗工作液(山羊封闭血清:一抗原液=1 :100配比稀释获得),4 ℃孵育过夜;⑥室温复温30 min,PBS溶液洗涤5 min/次×3次,滴加足量鼠兔通用二抗(ChemMateTM EnVision+HRP,鼠/兔)充分覆盖组织,37 ℃孵育60 min;⑦弃二抗,PBS洗15 min/次×3次,DAB法显色;⑧苏木精复染;⑨60 ℃烘箱烘干脱水,二甲苯透明,中性树胶进行封片。光学显微镜采集免疫组化染色图像(>5个高倍视野/切片),Image Pro Plus 5.0(IPP5.0)软件获取累积光密度值(integrated optical density,IOD),计算平均IOD值代表IDS的蛋白表达量。
1.4 Kaplan-Meier生存曲线分析整理包含无病生存期(disease-free survival, DFS)及总体生存期(overall survival, OS)结直肠癌患者的临床病理资料;按照是否发生终点事件(复发/进展或死亡)分为无事件组和事件组,以灵敏度为纵坐标,1-特异度为横坐标绘制ROC曲线,得到约登指数(灵敏度+特异度-1);以最大约登指数所对应的表达值为最佳分界值(即临界值);IDS表达高于临界值为IDS高表达患者,IDS表达低于临界值为IDS低表达患者。
1.5 统计学分析利用Graphpad Prism 7.0软件对两组样本IDS表达量进行两独立样本t检验,数据以x±s表示,生存情况用中位生存期表示;Kaplan-Meier生存分析采用Log Rank检验;采用SPSS 20.0统计软件进行单因素与多因素COX回归分析,其中年龄采用中位数分组。P < 0.05表示差异有统计学意义。
2 结果 2.1 TCGA数据库分析转移性结直肠癌患者IDS表达在Colon Adenocarcinoma TCGA-632数据集中通过基于LASSO算法的Logistic回归,获取与转移相关的溶酶体基因22个,并绘制交叉验证图(图 1A);进一步对22个基因进行OS的COX回归,获取具有预后预测意义的溶酶体基因5个:IDS、NPC2、ASAH1、HEXB、IDUA,回归系数分别为2.081、1.098、-0.734、-0.047、0.571。绘制交叉验证图;选择回归系数最高的基因IDS进行相关研究(图 1B);获取TCGA数据库患者临床样本信息及IDS mRNA表达谱,比较远处转移(M1)与无远处转移(M0)患者及淋巴结转移(N1-2)与无淋巴结转移(N0)患者IDS mRNA表达的差异,发现发生远处转移的患者和发生淋巴结转移的患者,IDS表达量均高于未发生转移的患者(M0 vs M1: 0.017±0.071 vs 0.636±0.296,P=0.003;N0 vs N1-2: -0.103±0.073 vs 0.303±0.123,P=0.003,图 1C、D)。

|
| A:基于LASSO算法Logistic回归的交叉验证图;B:基于LASSO算法COX回归的交叉验证图;C:远处转移(M1)与无远处转移(M0)患者IDS表达量比较a:P=0.003,与M0比较;D:淋巴结转移(N1-2)与无淋巴结转移(N0)患者IDS表达量比较b:P=0.003,与N0比较 图 1 利用TCGA数据库分析转移性与非转移性结直肠癌患者IDS表达 |
2.2 IDS高表达患者预后不良
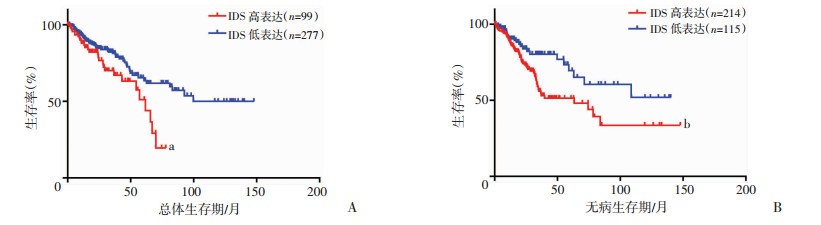
通过TCGA(Colon Adenocarcinoma TCGA-632)对IDS mRNA表达进行生存分析,与IDS低表达患者比较,IDS高表达患者预后不良(中位生存时间:61.79 vs 99.93个月,P=0.008;中位无病生存时间:63.37 vs 147.90个月,P=0.007,Cut-off=0.609,图 2)。进一步利用COX回归分析临床病理参数及IDS mRNA表达量对结直肠癌患者预后的影响,结果表明:IDS mRNA表达是结直肠癌预后的独立预测因素[P=0.014,风险系数(HR)为2.651,95%CI:1.217~5.775,表 1]。
|
| A:总体生存期a:P=0.008,与IDS低表达患者比较; B:无病生存期b:P=0.007,与IDS低表达患者比较 图 2 基于TCGA结直肠癌数据库IDS表达差异的Kaplan-Meier生存曲线分析 |
| 临床病理参数 | 例数 | 单因素回归分析 | 多因素回归分析 | |||
| 中位生存时间/月 | P值 | HR(95%CI) | P值 | |||
| 性别 | ||||||
| 女性 | 116 | 120 | 0.166 | - | - | |
| 男性 | 146 | 93 | - | |||
| 年龄/岁 | ||||||
| <64 | 129 | 119 | 0.181 | - | - | |
| ≥64 | 133 | 99 | - | |||
| 位置 | ||||||
| 结肠 | 197 | 110 | 0.984 | - | - | |
| 直肠 | 65 | 98 | - | |||
| pT | ||||||
| Tis-T2 | 48 | 85 | 0.046 | 1 | 0.299 | |
| T3-T4 | 214 | 106 | 2.982(0.380~23.39) | |||
| pN | ||||||
| N0 | 157 | 115 | 0.001 | 1 | 0.472 | |
| N1-2 | 105 | 94 | 0.455(0.053~3.887) | |||
| pM | ||||||
| M0 | 223 | 116 | <0.001 | 1 | 0.121 | |
| M1 | 39 | 52 | 2.044(0.828~5.048) | |||
| AJCC分期 | ||||||
| Ⅰ-Ⅱ | 153 | 116 | <0.001 | 1 | 0.197 | |
| Ⅲ-Ⅳ | 109 | 94 | 4.638(0.452~47.598) | |||
| IDS表达 | ||||||
| 低表达 | 192 | 100 | 0.008 | 1 | 0.014 | |
| 高表达 | 70 | 62 | 2.651(1.217~5.775) | |||
2.3 转移性结直肠癌IDS表达高于非转移性结直肠癌
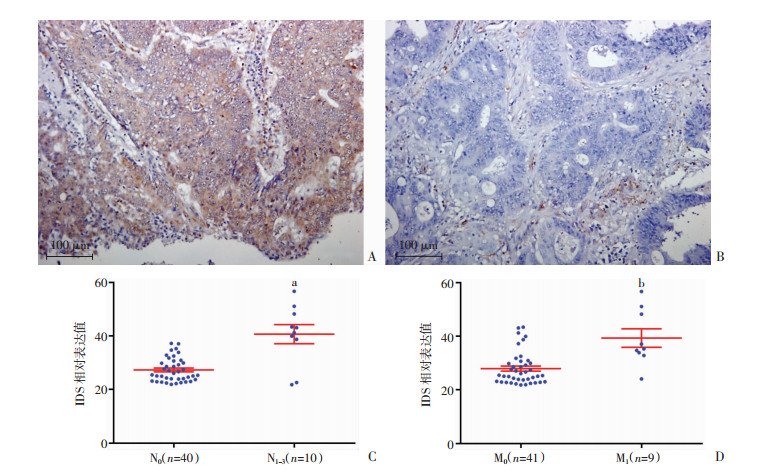
对结直肠癌组织进行IDS免疫组化染色,发现发生淋巴结和/或远处转移的患者IDS表达高于无转移患者(图 3A、B),进一步定量分析发现:发生淋巴结转移(N1-3)的患者IDS表达高于无淋巴结转移(N0)的患者(N0 vs N1-3: 27.324±0.698 vs 40.674±3.528,P=3.0×10-5,图 3C);发生远处转移(M1)的患者IDS表达高于无远处转移(M0)的患者(M0 vs M1: 27.941±0.952 vs 39.320±3.467,P=1.2×10-5,图 3D)。
|
| A:IDS高表达(患者发生淋巴结转移及远处转移);B:IDS低表达(患者无转移);C:淋巴结转移(N1-3)与无淋巴结转移患者(N0)IDS表达的免疫组化染色定量分析a:P=3.0×10-5, 与N0比较;D:远处转移(M1)与无远处转移患者(M0)IDS表达的免疫组化染色定量分析b:P=1.2×10-5, 与M0比较 图 3 免疫组织化学检测IDS在结直肠癌组织中的表达(Envision法) |
2.4 免疫组织化学染色分析IDS高表达患者的预后
对IDS免疫组织化学染色结果进行生存分析,利用约登指数最大值对应的表达量作为Cut-off值,发现IDS高表达的患者预后不良(中位生存时间544 vs 2 244 d,P=7.2×10-5,Cut-off=32.670,图 4)。进一步利用COX回归分析临床病理参数及IDS表达量对结直肠癌患者的影响(表 2),可见IDS表达是结直肠癌预后的独立预测因素[P=0.008,风险系数(HR)为5.847,95%CI:1.585~21.568]。

|
| a:P=7.2×10-5,与IDS低表达比较 图 4 50例结直肠癌患者肿瘤组织IDS高、低表达的生存分析 |
| 临床病理参数 | 例数 | 单因素回归分析 | 多因素回归分析 | |||
| 中位生存时间/d | P值 | HR(95%CI) | P值 | |||
| 性别 | ||||||
| 女性 | 20 | 1 698 | 0.701 | - | - | |
| 男性 | 30 | 1 782 | - | |||
| 年龄/岁 | ||||||
| <58 | 24 | 1 793 | 0.419 | - | - | |
| ≥58 | 26 | 1 706 | - | |||
| 位置 | ||||||
| 结肠 | 24 | 1 730 | 0.878 | - | - | |
| 直肠 | 26 | 1 767 | - | |||
| pN | ||||||
| N0 | 40 | 1 849 | 0.095 | - | - | |
| N1-3 | 10 | 1 350 | - | |||
| pT | ||||||
| Tis-T2 | 33 | 2 030 | 1.190×10-4 | 1 | 0.103 | |
| T3-T4 | 17 | 1 200 | 2.719(0.818~9.034) | |||
| pM | ||||||
| M0 | 36 | 1 953 | 0.001 | 1 | 0.422 | |
| M1 | 14 | 1 223 | 1.593(0.511~4.968) | |||
| IDS表达 | ||||||
| 低表达 | 36 | 2 244 | 7.200×10-5 | 1 | 0.008 | |
| 高表达 | 14 | 544 | 5.847(1.585-21.568) | |||
3 讨论
IDS基因位于Xq28,编码IDS蛋白,主要作用于蛋白多糖、葡萄胺聚糖(GAG)等物质的硫酸酯基团使之游离出无机硫酸,促进这些多糖、聚糖的水解,进而保证碳水化合物的循环利用[10]。此外,作为溶酶体腔内的水解酶,IDS可与β-葡糖醛酸糖苷酶、N-磺基葡糖胺-6-硫酸酯酶等水解酶协同作用,调节和维持碳水化合物代谢[11]。研究发现IDS在神经组织(特别是皮质和海马区)中高表达,同时也广泛表达于其他组织中[12]。IDS缺乏或IDS突变可导致神经元损伤和死亡,是Ⅱ型蛋白聚糖贮积症的主要原因,患者主要表现为脑组织细胞内大量蛋白聚糖蓄积、生长发育迟缓、智力低下等[13],提示IDS和蛋白聚糖在调控生长和神经系统发育中具有重要作用。
然而,IDS表达与肿瘤发生、发展及预后的关系尚不明确。本研究通过基于LASSO算法的Logistic和COX回归分析,筛选获得与结直肠癌患者转移、预后密切相关的溶酶体基因。进一步选择回归系数最高的基因IDS进行研究,利用包含375例临床样本基因表达信息的TCGA数据库进行分析,发现相对于无远处转移/无淋巴结转移的患者,发生远处/淋巴结转移的患者IDS表达显著增高,提示IDS高表达的患者淋巴结转移/远处转移发生率高;不仅如此,生存分析结果表明:高表达IDS的患者疾病复发/进展率和病死率更高;单因素和多因素COX回归分析结果显示:IDS是结直肠癌患者死亡的独立风险因素,对结直肠癌患者生存状态具有重要预测意义。在此基础上,回顾性分析了50例结直肠癌样本肿瘤组织中IDS的表达,通过免疫组化实验发现组织蛋白水平分析结果与数据库分析结果一致,均提示IDS高表达的患者转移发生率高,IDS可作为结直肠癌患者独立预后预测因素。
虽然IDS对肿瘤的影响及其在肿瘤中的作用尚不清楚,但多项研究报道了作用于类固醇中硫酸酯基团的类固醇硫酸酯酶,包括雌二醇硫酸酯酶、孕激素硫酸酯酶等,在乳腺癌[14-15]、前列腺癌[16]、卵巢癌[17]等肿瘤中表达增高、活性增加,参与了肿瘤的侵袭转移,是目前研究的一个重要治疗靶点[15, 18]。更为重要的是,使用类固醇硫酸酯酶抑制剂后,可抑制肿瘤细胞增殖、侵袭等恶性生物学行为[18-19]。其他硫酸酯酶,如作用于细胞外硫酸肝素的细胞外硫酸酯酶在胶质母细胞瘤中表达增高,并可促进肿瘤细胞侵袭[20]。提示肿瘤中硫酸酯酶表达可能是促进肿瘤转移、影响患者预后的重要因素。尽管本研究通过生物信息学和临床样本分析了IDS表达与结直肠癌转移、预后的相关性,但其具体机制尚不清楚。此外,IDS是否参与结直肠癌细胞耐药、复发等恶性行为,还需进一步研究阐明。
硫酸皮肤素、硫酸软骨素等多种蛋白聚糖是IDS的降解底物[10]。研究发现:构建乳腺癌体内模型,在肿瘤内注射软骨素酶以消除内源性硫酸软骨素可促进肺转移,而对原发灶肿瘤的生长并无明显的影响[21]。研究发现体外加入硫酸软骨素可抑制乳腺癌细胞Wnt/β-catenin信号通路,进而抑制肿瘤细胞侵袭转移等恶性生物学行为[22]。此外,TADEO等[23]报道显示:染色体1p36缺失会造成蛋白聚糖减少,进而促进神经母细胞瘤转移。以上结果提示蛋白聚糖可能起着抑制肿瘤侵袭转移的作用。这或许解释了本研究发现的结直肠癌中IDS高表达患者预后不良,即IDS表达增加,促进硫酸软骨素等蛋白聚糖降解,减弱它们对肿瘤转移的抑制作用。由于蛋白聚糖种类多、修饰复杂,结直肠癌组织中IDS表达和功能状态对蛋白聚糖的动态调控作用亟待探索。明确结直肠癌中IDS的具体功能和蛋白聚糖的状态,对了解结直肠癌转移、构建结直肠癌转移预测模型、寻找结直肠癌诊疗靶点具有重要意义。
本研究不足之处在于仅探讨了IDS对结直肠癌转移、预后的影响,缺乏深入机制研究。今后可进一步利用基因敲除手段干预结直肠癌细胞系中IDS表达,明确IDS对结直肠癌细胞生物学功能的影响,并结合CHIP、RNA-seq等实验寻找影响IDS表达的核心转录因子,以探讨结直肠癌中IDS表达变化的原因。
综上所述,本研究发现IDS表达与结直肠癌转移相关,是患者预后不良的独立风险因素,可望成为结直肠癌的诊疗新靶标。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
YU W Y, JIANG J F, XIE L L, et al. Mortality trends in colorectal cancer in China during 2000-2015: A joinpoint regression and age-period-cohort analysis[J]. Prev Chronic Dis, 2018, 15: E156. DOI:10.5888/pcd15.180329 |
| [3] |
DAVIDSON S M, VANDER HEIDEN M G. Critical functions of the lysosome in cancer biology[J]. Annu Rev Pharmacol Toxicol, 2017, 57: 481-507. DOI:10.1146/annurev-pharmtox-010715-103101 |
| [4] |
TOWERS C G, THORBURN A. Targeting the lysosome for cancer therapy[J]. Cancer Discov, 2017, 7(11): 1218-1220. DOI:10.1158/2159-8290.CD-17-0996 |
| [5] |
ZHOU W H, GONG L, WU Q C, et al. PHF8 upregulation contributes to autophagic degradation of E-cadherin, epithelial- mesenchymal transition and metastasis in hepatocellular carcinoma[J]. J Exp Clin Cancer Res, 2018, 37(1): 215. DOI:10.1186/s13046-018-0890-4 |
| [6] |
LIU H, MA Y, HE H W, et al. SPHK1 (sphingosine kinase 1) induces epithelial-mesenchymal transition by promoting the autophagy-linked lysosomal degradation of CDH1/E-cadherin in hepatoma cells[J]. Autophagy, 2017, 13(5): 900-913. DOI:10.1080/15548627.2017.1291479 |
| [7] |
ZHAO T, DING X C, YAN C, et al. Endothelial Rab7 GTPase mediates tumor growth and metastasis in lysosomal acid lipase-deficient mice[J]. J Biol Chem, 2017, 292(47): 19198-19208. DOI:10.1074/jbc.M116.773093 |
| [8] |
KUNDU S T, GRZESKOWIAK C L, FRADETTE J J, et al. TMEM106B drives lung cancer metastasis by inducing TFEB-dependent lysosome synthesis and secretion of cathepsins[J]. Nat Commun, 2018, 9(1): 2731. DOI:10.1038/s41467-018-05013-x |
| [9] |
KIM S M, KIM Y, JEONG K, et al. Logistic LASSO regression for the diagnosis of breast cancer using clinical demographic data and the BI-RADS lexicon for ultrasonography[J]. Ultrasonography, 2018, 37(1): 36-42. DOI:10.14366/usg.16045 |
| [10] |
HOLMES R S. Comparative studies of vertebrate iduronate 2-sulfatase (IDS) genes and proteins: evolution of A mammalian X-linked gene[J]. 3 Biotech, 2017, 7(1): 22. DOI:10.1007/s13205-016-0595-3 |
| [11] |
SMITH C M, FINGER J H, HAYAMIZU T F, et al. The mouse gene expression database (GXD): 2014 update[J]. Nucleic Acids Res, 2014, 42(Database issue): D818-D824. DOI:10.1093/nar/gkt954 |
| [12] |
DA SILVA E M, STRUFALDI M W, ANDRIOLO R B, et al. Enzyme replacement therapy with idursulfase for mucopolysaccharidosis type Ⅱ (Hunter syndrome)[J]. Cochrane Database Syst Rev, 2016, 2: CD008185. DOI:10.1002/14651858.CD008185.pub4 |
| [13] |
MEDEIROS M G, FERREIRA T M, LEITE E L, et al. New pathway of heparan sulphate degradation. Iduronate sulphatase and N-sulphoglucosamine 6-sulphatase act on the polymer chain prior to depolymerisation by a N-sulpho-glucosaminidase and glycuronidases in the mollusc Tagelus gibbus[J]. Comp Biochem Phys B, 1998, 119(3): 539-547. |
| [14] |
PASQUALINI J R. Role, control and expression of estrone sulfatase and 17 beta-hydroxysteroid dehydrogenase activities in human breast cancer[J]. Zentralbl Gynakol, 1997, 119(Suppl 2): 48-53. |
| [15] |
AHMED S, OWEN C P, JAMES K, et al. Review of estrone sulfatase and its inhibitors: An important new target against hormone dependent breast cancer[J]. Curr Med Chem, 2002, 9(2): 263-273. DOI:10.2174/0929867023371210 |
| [16] |
NAKAMURA Y, SUZUKI T, FUKUDA T, et al. Steroid sulfatase and estrogen sulfotransferase in human prostate cancer[J]. Prostate, 2006, 66(9): 1005-1012. DOI:10.1002/pros.20426 |
| [17] |
CHURA J C, BLOMQUIST C H, RYU H S, et al. Estrone sulfatase activity in patients with advanced ovarian cancer[J]. Gynecol Oncol, 2009, 112(1): 205-209. DOI:10.1016/j.ygyno.2008.08.037 |
| [18] |
SHAH R, SINGH J, SINGH D, et al. Sulfatase inhibitors for recidivist breast cancer treatment: A chemical review[J]. Eur J Med Chem, 2016, 114: 170-190. DOI:10.1016/j.ejmech.2016.02.054 |
| [19] |
PUROHIT A, REED M J, MORRIS N C, et al. Regulation and inhibition of steroid sulfatase activity in breast cancer[J]. Ann N Y Acad Sci, 1996, 784: 40-49. DOI:10.1111/j.1749-6632.1996.tb16226.x |
| [20] |
WADE A N, ENGLER J R, TRAN V M, et al. Measuring sulfatase expression and invasion in glioblastoma[J]. Methods Mol Biol, 2015, 1229: 507-516. DOI:10.1007/978-1-4939-1714-3_39 |
| [21] |
PRINZ R D, WILLIS C M, VILORIA-PETIT A, et al. Elimination of breast tumor-associated chondroitin sulfate promotes metastasis[J]. Genet Mol Res, 2011, 10(4): 3901-3913. DOI:10.4238/2011.December.8.9 |
| [22] |
WILLIS C M, KLVPPEL M. Chondroitin sulfate-E is a negative regulator of a pro-tumorigenic Wnt/beta-catenin-Collagen 1 axis in breast cancer cells[J]. PLoS ONE, 2014, 9(8): e103966. DOI:10.1371/journal.pone.0103966 |
| [23] |
TADEO I, GAMERO-SANDEMETRIO E, BERBEGALL A P, et al. 1p36 deletion results in a decrease in glycosaminoglycans which is associated with aggressiveness in neuroblastic tumors[J]. Histol Histopathol, 2018, 33(5): 487-495. DOI:10.14670/HH-11-947 |



