急性肾脏缺血是导致急性肾脏损伤(acute kidney injury,AKI)的主要原因之一,以近端小管内皮结构与功能损伤从而导致肾脏功能下降为主要特征。肾脏缺血再灌注损伤(ischemia reperfusion injury, IRI)在临床上见于外科手术、休克和肾脏移植等过程中,是影响肾功能的一个重要危险因素[1]。促红细胞生成素(erythropoietin,EPO)在缺血再灌注损伤、顺铂诱导的AKI模型中可促进肾小管上皮细胞再生[2]。但高剂量的EPO会存在导致如肾纤维化、高血压、红细胞增多导致红细胞比容增加和血栓风险增加的副作用,这些都会限制EPO的肾脏保护作用。氨甲酰化促红细胞生成素(carbamylated erythropoietin, CEPO)是一种EPO氨甲酰化的衍生物。CEPO与EPO相似,但是不与EPO经典的受体结合,无促红细胞生成活性,所以不会明显引起红细胞比容(hematocrit, Hct)增加,不会增加高血压及血栓形成等风险,但却具有与EPO同等的组织保护效力[3]。本研究通过在体内构建大鼠肾脏缺血再灌注急性肾损伤动物模型及体外模拟培养人肾小管上皮细胞(HK-2)缺血再灌注损伤模型,观察CEPO和EPO对大鼠肾脏缺血再灌注损伤的保护作用及其机制,研究CEPO是否能起到较EPO更好的肾保护作用,从而为缺血性急性肾损伤的治疗提供新思路及实验依据。
1 材料与方法 1.1 实验材料及试剂无特定病原体实验动物(SPF级)雄性SD大鼠40只,2~3月龄,体质量220~260 g,由河北医科大学提供;HK-2细胞株由本实验室保存;EPO购自上海科肽生物科技有限公司;CEPO购自德国Warren Pharmaceutical公司;IL-6、IL-10、ELISA试剂盒购自美国R&D公司。
1.2 大鼠缺血再灌注模型的建立大鼠禁食12 h,以2%戊巴比妥钠按40 mg/kg的剂量麻醉,切口方式为腹部正中。进入腹腔后,对左右两侧的肾蒂用动脉夹进行快速的夹闭,当肾脏颜色由原来比较鲜红的颜色慢慢变成紫黑色后说明手术成功。在夹闭45 min后,移除掉动脉夹,使肾脏血流恢复灌注。在24~29 ℃环境中对大鼠进行术后的保暖复苏。
1.3 动物分组40只SD雄性大鼠采用随机数字表法分为4组,每组10只。假手术(Sham)组:对大鼠进行假手术操作,仅开腹,游离两侧肾脏但不夹闭,45 min后关闭腹腔;缺血再灌注模型(IRI)组:对大鼠肾脏进行缺血再灌注处理;IRI+EPO组:肾脏缺血再灌注造模后0、24、48 h给予EPO(5 000 U/kg)腹腔注射;IRI+CEPO组:缺血再灌注造模后0、24、48 h给予CEPO(5 000 U/kg)腹腔注射。在72 h时处死全部大鼠,处死前对大鼠进行内眦取血留取血标本,处死大鼠后,留取大鼠新鲜肾脏标本进行后续实验。
Sham组存活10只,IRI组存活7只,EPO组存活8只,CEPO组存活8只。大鼠均死于术后24 h内,不列入统计。各组大鼠死亡率比较差异无统计学意义。
1.4 各指标检测大鼠肾功能及Hct检测:全自动生化分析仪检测血肌酐(Scr),尿素氮(BUN);血液细胞分析仪检测红细胞比容(hematocrit,Hct);肾组织匀浆中抗氧化指标及炎症因子,采用黄嘌呤氧化酶法检测超氧化物歧化酶(superoxide dismutase, SOD)活性;硫代巴比妥酸法检测MDA;酶联免疫吸附法(ELISA法)检测TNF-α;ELISA检测各组大鼠血清中IL-6、IL-10水平,按试剂盒说明进行操作。
1.5 大鼠肾脏PAS组织学检查大鼠肾组织进行脱水、包埋、固定切片后,进行PAS染色。200倍光镜下对肾小管损伤程度进行评估,每个片子选取10个视野,对显微镜下各个视野中肾小管上皮刷状缘脱落情况、管腔内管型的有无、细胞的坏死程度以及肾小管管腔扩张所占百分比进行综合性的分析。
1.6 细胞培养采用含有10%胎牛血清的DMEM/F12培养基对HK-2细胞株进行培养。细胞实验分为4组:①对照组(Con):在10%胎牛血清的DMEM/F12培养基、正常条件下(5% CO2+95%空气、37 ℃)培养6 h;②细胞缺血再灌注损伤组(IRI):将细胞在缺氧(0.5%O2+5%CO2+94.5%N2、37 ℃)条件下采用无血清、无糖的培养液在培养2 h后,在正常培养条件下(5%CO2+95%空气、37 ℃)换用含有DMEM/F12的培养基培养4 h;③细胞缺血再灌注损伤+EPO处理组(IRI+EPO)在细胞缺血再灌注损伤模型基础上,在培养基中加入20 U/L的EPO进行干预;④细胞缺血再灌注损伤+CEPO处理组(IRI+CEPO):在细胞缺血再灌注损伤模型基础上,在培养基中加入20 U/L的CEPO进行干预。各组细胞在实验前均同步化24 h。
1.7 实时定量RT-PCR检测炎症因子表达收集各组细胞,采用RNA抽提试剂盒并按说明书操作获取细胞内总RNA并逆转录,将制备好的cDNA进行PCR扩增,借助于Primer Permie 5.0设计分别针对目的检测基因的引物。引物序列如下:IL-6上游5′-CCTTCTCCACAAACATGTAACAAGA-3′,下游5′-TCA-CCAGGCAAGTCTCCTCA-3′,86 bp;TNF-α上游5′-GCCCTACTATTCAGTGGCGA-3′, 下游5′-GCTTCTTCCCA-CCCACAAGA-3′,105 bp;IL-10上游5′-AAGACCCA-GACATCAAGGCG-3′, 下游5′-AGGCATTCTTCACCTGCTCC-3′,80 bp;β-actin上游5′-CAACACAGTGCTGTCTGGTGGTA-3′,下游5′-TTGATCTTCATGGTGCTGGGAG-3′,99 bp。以β-actin为内参,根据2-ΔΔCt计算各基因的相对表达量,各组实验重复3次。
1.8 Western blot检测收集各组细胞匀浆物,用BCA法进行蛋白浓度测定。取20 μg总蛋白在1×SDS缓冲液中煮7 min,电泳、转膜、封闭后滴加兔抗IL-6、IL-10、cleaved-Caspase 3及β-actin的抗体,4 ℃过夜洗涤后滴加1 :5 000的HRP-羊抗兔IgG二抗孵育2 h后再次洗涤。采用UVP照相系统图像采集。Image J软件对条带进行灰度值分析,计算各蛋白的相对表达量,各组实验重复3次。
1.9 统计学分析数据以x±s表示,采用SPSS 20.0统计软件,两组间的比较采用t检验,多组数据间的比较进行单因素方差分析,LSD检验用于方差齐者,如果方差不齐则采用Games-Howell检验,检验水准:α=0.05。
2 结果 2.1 各组大鼠血肌酐(Scr)、尿素氮(BUN)及红细胞比容(Hct)变化与Sham组相比,IRI组Scr及BUN水平明显升高(P < 0.05);与IRI组相比,IRI+EPO组大鼠Scr和BUN水平明显降低(P < 0.05);在EPO和CEPO组连续治疗3 d后,IRI+CEPO组大鼠Scr、BUN相对于IRI组有明显的降低,差异有统计学意义(P < 0.05,表 1);且IRI+CEPO组与IRI+EPO组相比差异也有统计学意义(P < 0.05)。
| 组别 | n | 肌酐/μmol·L-1 | 尿素氮/mmol·L-1 | 红细胞比容(%) |
| Sham组 | 10 | 31.83±4.89 | 8.23±2.91 | 55.00±4.72 |
| IRI组 | 7 | 134.66±12.83a | 49.89±7.38a | 53.00±3.49 |
| IRI+EPO组 | 8 | 86.26±7.82ab | 32.51±5.24ab | 69.00±5.60ab |
| IRI+CEPO组 | 8 | 63.54±5.67abc | 25.71±3.68abc | 61.00±4.16abc |
| a: P < 0.05,与Sham组比较; b: P < 0.05,与IRI组比较; c: P < 0.05,与IRI+EPO组比较 | ||||
实验结果显示IRI+EPO和IRI+CEPO组在应用EPO和CEPO后,相对于IRI组,红细胞比容明显增高,但是IRI+CEPO组Hct的升高明显低于IRI+EPO组,差异具有统计学意义(P < 0.05);相对于Sham组,IRI+EPO和IRI+CEPO组仍然明显升高(P < 0.05,表 1)。
2.2 各组大鼠肾脏组织病理学变化PAS染色显示Sham组肾组织结构正常;IRI组肾组织内可见部分肾小管管腔扩张、有崩解坏死的上皮细胞脱落如管腔,存在颗粒样结构。肾小管上皮细胞可见肿胀、坏死及空泡变性、刷状缘消失,部分小管上皮细胞坏死崩解,肾间质内部有炎细胞浸润。IRI+EPO组大鼠肾脏损伤较IRI组明显减轻,肾小管内上皮细胞坏死减轻,可见不连续的刷状缘。IRI+CEPO组大鼠肾脏损伤较IRI组也明显减轻,但IRI+CEPO组肾脏损伤明显轻于IRI+EPO组,差异具有统计学意义(P < 0.05, 图 1)。
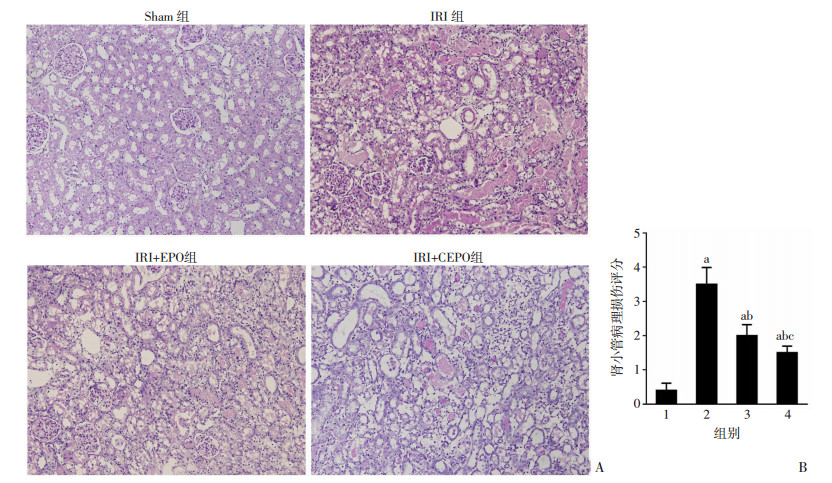
|
| 1: Sham组; 2: IRI组; 3: IRI+EPO组; 4: IRI+CEPO组;a: P < 0.05,与Sham组比较; b: P < 0.05,与IRI组比较; c: P < 0.05,与IRI+EPO组比较 图 1 各组大鼠肾脏组织病理变化(A,PAS×200)及肾小管损伤病理评分(B) |
2.3 各组大鼠肾组织匀浆中SOD、MDA及TNF-α水平
与Sham组比较,IRI组肾组织中MDA和TNF-α明显升高,SOD活性降低(P < 0.05)。与IRI组比较,IRI+EPO组和IRI+CEPO组MDA、TNF-α水平明显降低(P < 0.05),SOD水平明显升高(P < 0.05)。与IRI+EPO组比较,IRI+CEPO组MDA、TNF-α水平也明显降低(P < 0.05), SOD水平明显升高(P < 0.05),差异具有统计学意义(表 2)。
| 组别 | n | SOD/U·mL-1 | MDA/nmol·mL-1 | TNF-α/pg·mL-1 |
| Sham组 | 10 | 108.56±8.62 | 8.23±2.91 | 10.24±3.43 |
| IRI组 | 7 | 53.61±5.47a | 49.89±7.38a | 143.57±18.62a |
| IRI+EPO组 | 8 | 73.84±6.68ab | 32.51±5.24ab | 96.80±8.92ab |
| IRI+CEPO组 | 8 | 87.61±7.43abc | 25.71±3.68abc | 70.39±6.85abc |
| a: P < 0.05,与Sham组比较;b: P < 0.05,与IRI组比较; c: P < 0.05,与IRI+EPO组比较 | ||||
2.4 各组大鼠血清IL-6、IL-10水平
与Sham组比较,IRI组大鼠肾组织IL-6和IL-10水平明显升高。与IRI组比较,IRI+EPO和IRI+CEPO组大鼠肾组织促炎因子IL-6水平明显降低,而抗炎因子IL-10水平明显提升;与IRI+EPO组比较,IRI+CEPO组大鼠肾组织IL-6水平降低,IL-10水平升高,两组比较差异有统计学意义(P < 0.05,图 2)。
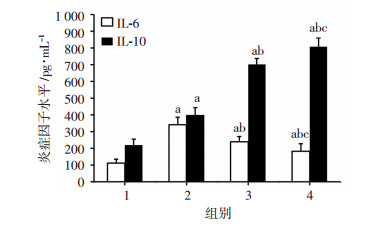
|
| 1: Sham组; 2: IRI组; 3: IRI+EPO组; 4: IRI+CEPO组;a: P < 0.05,与Sham组比较; b: P < 0.05,与IRI组比较; c: P < 0.05,与IRI+EPO组比较 图 2 各组大鼠血清IL-6和IL-10水平 |
2.5 各组细胞炎性细胞因子表达
与Con组比较,IRI组HK-2细胞内TNF-α、IL-6、IL-10 mRNA表达升高(P < 0.05),而IRI+EPO组、IRI+CEPO组TNF-α、IL-6 mRNA表达较IRI组降低(P < 0.05),并且IRI+CEPO组TNF-α、IL-6 mRNA较IRI+EPO组也明显降低(P < 0.05)。与IRI组比较,IRI+EPO组、IRI+CEPO组IL-10 mRNA表达明显升高(P < 0.05),IRI+CEPO组IL-10 mRNA比IRI+EPO组升高更明显(P < 0.05,图 3)。

|
| a: P < 0.05,与Con组比较; b: P < 0.05,与IRI组比较; c: P < 0.05,与IRI+EPO组比较 图 3 各组HK-2细胞TNF-α、IL-6和IL-10 mRNA表达(n=3, x±s) |
2.6 缺血再灌注对各组HK-2细胞cleaved-Caspase 3, IL-6, IL-10蛋白表达的影响
Western blot结果显示:与Con组比较,IRI组细胞内cleaved-Caspase 3和IL-6蛋白表达水平均明显升高(P < 0.05),在EPO及CEPO处理后,cleaved-Caspase 3和IL-6蛋白表达水平明显降低,并且IRI+CEPO组相对于IRI+EPO组降低更明显(P < 0.05)。与Con组比较,IRI组IL-10蛋白表达水平明显升高;与IRI组比较,IRI+EPO组、IRI+CEPO组IL-10蛋白表达明显增高,IRI+CEPO组比IRI+EPO组升高更显著(P < 0.05,图 4)。
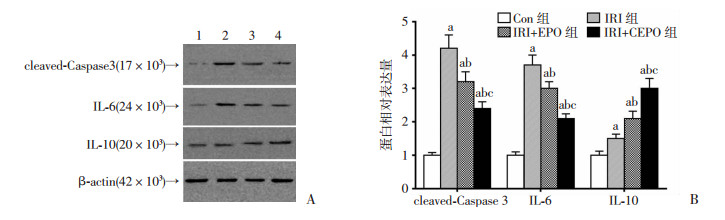
|
| A:Western blot检测炎症及凋亡指标;B:半定量检测结果1: Con组; 2: IRI组; 3: IRI+EPO组; 4: IRI+CEPO组; a: P < 0.05,与Con组比较; b: P < 0.05,与IRI组比较; c: P < 0.05,与IRI+EPO组比较 图 4 各组HK-2细胞cleaved-Caspase 3、IL-6、IL-10蛋白表达(n=3, x±s) |
3 讨论
研究防治肾脏缺血再灌注损伤对于肾脏手术、重症感染、创伤等过程的肾脏恢复有重要的意义。血管内皮细胞、炎症和组织因子等多方面因素参与了肾脏缺血再灌注损伤的过程[4-5]。EPO不仅仅能用于慢性肾脏病肾性贫血的治疗,还可以通过抗炎、抗凋亡、促进血管新生等方式起到对神经、心脏以及肾脏组织损伤的保护作用。然而一些临床研究也发现大剂量的EPO会导致一些如高血压、血栓形成甚至增加死亡率等的严重副作用[6],应用EPO时间过长,会引起增加红细胞数量和升高血液粘稠度等的副作用,最终可能会导致高血压和血栓形成,甚至会增加死亡率[7]。CEPO作为一种EPO的氨甲酰化衍生物,CEPO不具促红细胞特性,其药代动力学特征与EPO相似,同时也能起到对脑、心脏和其他组织等各种损伤的保护作用,即使长期应用甚至在缺氧状态下应用也不会明显导致血红细胞比容的增加[8-9]。
本研究采用大鼠肾脏缺血再灌注模型研究EPO和CEPO对急性肾损伤的肾脏保护作用,探讨CEPO是否比EPO具有更明显的肾脏保护作用。实验结果显示大鼠肾脏缺血再灌注后出现明显的肾脏损伤,EPO和CEPO腹腔注射治疗后,都能够减轻肾脏损伤,但CEPO组治疗效果明显优于EPO组腹腔注射组。红细胞比容增加是EPO应用于肾脏损伤治疗的一个主要副作用,本研究应用EPO和CEPO治疗肾脏缺血再灌注所致肾损伤后,发现明显的红细胞比容的增高,但是可以观察到CEPO组的Hct升高情况明显低于EPO组,证明CEPO治疗相对于EPO治疗能够更加缓和的升高Hct,减轻副作用。
最近研究表明EPO和CEPO可通过抗凋亡、抗炎、抗氧化等多种机制保护肾功能[10-11]。氧化损伤在缺血再灌注所致的急性肾损伤起着重要作用,自由基引发的过氧化反应可导致膜脂质的破坏、膜完整性丧失、细胞功能紊乱等[12]。SOD的主要作用是可以清除超氧自由基,减轻细胞损伤,SOD活性降低后会使脂质氧化程度增强;MDA为脂质过氧化的产物,其作用主要有两个:一是能够反映组织中脂质过氧化的程度,同时又可提示组织内细胞受自由基攻击的损伤程度[13-14]。本研究发现大鼠肾脏缺血再灌注损伤后,肾组织过氧化增强,过氧化物增多,肾脏损伤增加,EPO和CEPO可以逆转这一过程,减轻肾脏损伤,并且CEPO相对于EPO能起到更好的肾保护作用。炎症反应在肾脏IRI发病过程中发挥了重要的作用,IL-6、TNF-α等作为炎症因子在IRI中发挥了比较重要的作用[5]。TNF-α作为一种重要的炎症介质,可通过细胞毒作用、收缩血管、汇聚炎性细胞等导致肾小管上皮细胞凋亡、肾小球滤过率下降、中性粒细胞浸润,造成组织损伤;IL-6是一种促炎因子,在炎症等情况下表达会明显增多;IL-10作为一种抗炎因子,具有抑制过度炎症及免疫反应的作用[15]。本研究发现EPO和CEPO腹腔注射可以明显降低肾脏缺血再灌注损伤后TNF-α和IL-6水平,明显提高抗炎因子IL-10水平,并且CEPO能起到比EPO更好的效果。本研究结果还显示:EPO和CEPO治疗后,与肾脏缺血灌注组比较,Scr、BUN、MDA、TNF-α、IL-6水平明显下降,SOD活性明显升高,IL-10水平提升,提示EPO和CEPO可通过降低氧化应激损伤,减轻炎症损伤从而减轻缺血再灌注所致的急性肾损伤。
肾小管上皮细胞是肾脏最重要的实质细胞之一,肾小管上皮细胞发生凋亡坏死是肾损伤的重要表现,进而造成肾功能障碍。所以本研究采用HK-2细胞来进一步研究EPO和CEPO在缺血再灌注中的作用。结果显示EPO和CEPO能明显抑制TNF-α、IL-6的表达, 并且CEPO显示出了更好的效果。活化的Caspase酶是凋亡过程中重要步骤,Caspase激活后,会发生凋亡的级联反应[16]。Caspase 3是细胞凋亡的主要执行者,Caspase 3切割活化之后就会变成cleaved-Caspase 3[17],本研究结果显示EPO和CEPO能明显减轻HK-2细胞在缺血再灌注中的凋亡,并且CEPO显示出了更明显的作用。此外, 也有研究认为EPO及CEPO抗细胞凋亡作用与JAK2、PKC、mlto KATP、PI3K及NOS等激活有关[18-20]。这些结果表明EPO和CEPO可能通过减轻炎症和减少凋亡来起到缓解缺血再灌注对肾脏的损伤作用。本研究也存在一定的不足和缺陷:本研究主要是论述了CEPO相对于EPO能更好地发挥对缺血再灌注肾脏的肾保护作用,其机制可能通过减轻炎症和减少凋亡来起作用,但还主要是现象层面的研究,具体作用于哪些受体,通过哪些通路来发挥肾保护作用需要更进一步深入的研究。下一步研究中对CEPO在肾脏缺血再灌注损伤中发挥肾保护作用的相关分子机制及可能参与的信号通路是研究的重点。
目前关于CEPO对于肾损伤的研究相对比较少,本研究结果提示EPO和CEPO在治疗肾损伤等方面都能起到对肾脏的保护作用,CEPO相对于EPO不仅没有引起明显的Hct的升高,而且相对于EPO治疗能够起到更明显的肾脏保护作用。这些都表明CEPO相对于EPO在一些前临床应用中能起到更好的保护作用。
| [1] |
KEZIĆ A, STAJIC N, THAISS F. Innate immune response in kidney Ischemia/Reperfusion injury: potential target for therapy[J]. J Immunol Res, 2017, 2017: 6305439. DOI:10.1155/2017/6305439 |
| [2] |
YASSIN M M, HARKIN D W, BARROS D'SA A A, et al. Lower limb ischemia-reperfusion injury triggers a systemic inflammatory response and multiple organ dysfunction[J]. World J Surg, 2002, 26(1): 115-121. DOI:10.1007/s00268-001-0169-2 |
| [3] |
BRINES M, GRASSO G, FIORDALISO F, et al. Erythropoietin mediates tissue protection through an erythropoietin and common beta-subunitheteroreceptor[J]. Proc Natl Acad Sci U S A, 2004, 101(41): 14907-14912. DOI:10.1073/pnas.0406491101 |
| [4] |
FRANCIS A, BAYNOSA R. Ischaemia-reperfusion injury and hyperbaric oxygen pathways: A review of cellular mechanisms[J]. Diving Hyperb Med, 2017, 47(2): 110-117. |
| [5] |
XU Z, ZHAO K, HAN P, et al. Octreotide ameliorates renal Ischemia/Reperfusion injury via antioxidation and anti-inflammation[J]. Transplant Proc, 2017, 49(8): 1916-1922. DOI:10.1016/j.transproceed.2017.05.008 |
| [6] |
REN C C, ZHU W, WANG Q W, et al. The renal protect function of erythropoietin after release of bilateral ureteral obstruction in a rat model[J]. Clin Sci, 2018, 132(18): 2071-2085. DOI:10.1042/CS20180178 |
| [7] |
SHARPLES E J, YAQOOB M M. Erythropoietin and acute renal failure[J]. Semin Nephrol, 2006, 26(4): 325-331. DOI:10.1016/j.semnephrol.2006.05.010 |
| [8] |
ABE T, ISAKA Y, IMAMURA R, et al. Carbamylated erythropoietin ameliorates cyclosporine nephropathy without stimulating erythropoiesis[J]. Cell Transplant, 2012, 21(2/3): 571-580. DOI:10.3727/096368911X605501 |
| [9] |
TÖGEL F E, AHLSTROM J D, YANG Y, et al. Carbamylated erythropoietin outperforms erythropoietin in the treatment of AKI-on-CKD and other AKI models[J]. J Am Soc Nephrol, 2016, 27(11): 3394-3404. DOI:10.1681/ASN.2015091059 |
| [10] |
CASSIS P, AZZOLLINI N, SOLINI S, et al. Bothdarbepoetin alfa and carbamylated erythropoietin prevent kidney graft dysfunction due to ischemia/reperfusion in rats[J]. Transplantation, 2011, 92(3): 271-279. DOI:10.1097/TP.0b013e3182241106 |
| [11] |
CERNARO V, SFACTERIA A, RIFICI C, et al. Renoprotective effect of erythropoietin in zebrafish after administration of gentamicin: An immunohistochemical study for β-catenin and c-kit expression[J]. J Nephrol, 2017, 30(3): 385-391. DOI:10.1007/s40620-016-0353-y |
| [12] |
MALEK M, NEMATBAKHSH M. Renal ischemia/reperfusion injury; from pathophysiology totreatment[J]. J Renal Inj Prev, 2015, 4(2): 20-27. DOI:10.12861/jrip.2015.06 |
| [13] |
ZHAO L S, XU L N, TAO X F, et al. Protective effect of the total flavonoids fromrosa laevigata michx fruit on renal ischemia-reperfusion injury through suppression of oxidative stress and inflammation[J]. Molecules, 2016, 21(7): E952. DOI:10.3390/molecules21070952 |
| [14] |
OLIVEIRA R C, BRITO M V, RIBEIRO R F Júnior, et al. Influence of remote ischemic conditioning and tramadol hydrochloride on oxidative stress in kidney ischemia/reperfusion injury in rats[J]. Acta Cir Bras, 2017, 32(3): 229-235. DOI:10.1590/S0102-865020170030000007 |
| [15] |
GODET C, GOUJON J M, PETIT I, et al. Endotoxin tolerance enhances interleukin-10 renal expression and decreases ischemia-reperfusionrenal injury in rats[J]. Shock, 2006, 25(4): 384-388. DOI:10.1097/01.shk.0000209528.35743.54 |
| [16] |
BANAEI S, AHMADIASL N, ALIHEMMATI A. Combination anti-apoptotic effect of erythropoietin and melatonin on ischemia reperfusion-induced renal injury in rats[J]. Acta Med Iran, 2016, 54(10): 624-630. |
| [17] |
WICHAPOON B, PUNSAWAD C, VIRIYAVEJAKUL P. Expression of cleaved caspase-3 in renal tubular cells in plasmodium falciparum malaria patients[J]. Nephrology (Carlton), 2017, 22(1): 79-84. DOI:10.1111/nep.12715 |
| [18] |
TANG Z H, SUN X C, SHI Q H, et al. Beneficial effects of carbamylated erythropoietin against oxygen-glucose deprivation/reperfusion-induced astrocyte swelling: proposed molecular mechanisms of action[J]. Neurosci Lett, 2012, 530(1): 23-28. DOI:10.1016/j.neulet.2012.09.029 |
| [19] |
LI R, ZHANG L M, SUN W B. Erythropoietin rescues primary rat cortical neurons frompyroptosis and apoptosis via Erk1/2-Nrf2/Bach1 signal pathway[J]. Brain Res Bull, 2017, 130: 236-244. DOI:10.1016/j.brainresbull.2017.01.016 |
| [20] |
ZOU Y R, ZHANG J, WANG J, et al. Erythropoietin receptor activation protects the kidney from Ischemia/Reperfusion-induced apoptosis by activating ERK/p53 signalpathway[J]. Transplant Proc, 2016, 48(1): 217-221. DOI:10.1016/j.transproceed.2016.01.009 |



