2. 400037重庆,陆军军医大学(第三军医大学)第二附属医院呼吸内科,全军呼吸内科研究所,全军呼吸病研究重点实验室
2. Institute of Respiratory Diseases, Key Laboratory of Respiratory Diseases, Second Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400037, China
淋巴瘤作为血液系统常见的恶性肿瘤之一,可浸润全身各个器官,但浸润胸膜导致胸腔积液的病例较为少见,原发性胸膜淋巴瘤更为少见,仅占淋巴瘤病例的7%[1],且此类患者常常临床症状不典型,通过胸水实验室检查及细胞学检查仍难以明确诊断[2],导致在临床上往往容易漏诊甚至误诊。所以本研究总结了陆军军医大学第二附属医院呼吸内科自2013-2018年1 356例经内科胸腔镜检查的患者中,最终确诊为淋巴瘤的6例胸腔积液患者的临床资料,分析其内科胸腔镜镜下表现并复习相关文献,探讨内科胸腔镜在淋巴瘤所致胸腔积液临床诊断中的价值。
1 资料与方法收集2013-2018年陆军军医大学第二附属医院呼吸内科住院行内科胸腔镜检查的1 356例患者中确诊为淋巴瘤的6例患者的临床资料。其中男性3例,女性3例。年龄39~75岁,平均56.5岁。6例患者均经胸腔镜下胸膜活检获得病理和免疫组化分析结果明确诊断。本研究已在2019年4月获得陆军军医大学第二附属医院伦理委员会审批。6例患者的基本资料、主要临床表现、胸腔镜检查及病理结果见表 1。
| 病例 | 性别 | 年龄/岁 | 症状 | 病程 | 胸水情况 | 镜下表现 | 病理结果 |
| 1 | 男 | 74 | 咳嗽、呼吸困难 | 1月 | 双侧、渗出 | 胸膜大结节 | 弥漫大B细胞淋巴瘤 |
| 2 | 女 | 39 | 咳嗽、发热 | 2周 | 双侧、渗出 | 白色斑片状突起 | 结外NK/T细胞淋巴瘤(Ⅳb组) |
| 3 | 男 | 48 | 咳嗽 | 2月 | 左侧、渗出 | 多发小结节 | T淋巴母细胞性淋巴瘤 |
| 4 | 男 | 66 | 咳嗽、胸痛、气促 | 7 d | 左侧、渗出 | 粘连分隔,胸膜肥厚 | 弥漫大B细胞淋巴瘤 |
| 5 | 女 | 46 | 呼吸困难 | 2月 | 右侧、渗出 | 大量结节样新生物 | 淋巴浆细胞性淋巴瘤 |
| 6 | 女 | 63 | 呼吸困难 | 10 d | 双侧、渗出 | 结节伴色素沉着 | 弥漫大B细胞淋巴瘤 |
2 结果 2.1 一般情况
6例患者的年龄跨度较大,男女各3例。所有患者均因咳嗽和/或呼吸困难来院就诊,另有3例患者伴有胸痛,1例患者病程中存在发热,病程在10 d至2个月(平均22 d)。胸部影像学表现提示:3例表现为单肺或双肺多发高密度片状影,2例表现为多发片状影伴肺结节,1例表现为肺门旁新生物。有3例患者表现为双侧胸腔积液,3例为单侧胸腔积液,均为渗出性,其中1例存在分隔。胸水性质2例为非血性,4例为血性。1例胸水ADA正常,4例明显升高,另有1例未行胸水ADA检测。6例患者胸水CEA均在正常范围。胸腔镜下表现分别为:5例患者均有壁层胸膜大小不等的结节,1例患者仅表现为胸膜粘连及增厚;其中有1例患者存在色素沉着及1例胸膜呈纤维板样物。病理免疫组化结果:6例患者均通过病理及免疫组化分析结果明确为非霍奇金淋巴瘤,其中3例为弥漫性大B细胞淋巴瘤,T淋巴母细胞性淋巴瘤、淋巴浆细胞性淋巴瘤、NK/T细胞淋巴瘤各1例。
2.2 典型病例病例6,女性,63岁,因“活动后呼吸困难10 d”于2013年3月2日入院。患者自诉于2013年2月20日受凉后出现活动后呼吸困难,伴有轻微干咳,无咳痰及痰中带血等症状,夜间无法平卧入睡,无畏寒、发热、胸痛等症状。外院行胸部CT提示“双侧胸腔积液,双下肺条片状高密度影”,先后两次行胸腔穿刺抽液术,共抽取血性胸腔积液1 300 mL,患者呼吸困难无明显缓解,诊断不明。为进一步诊治来我院,门诊以“双侧胸腔积液原因待查”收入院。患者既往曾有“血小板减少”病史8年,个人史及家族史无特殊。
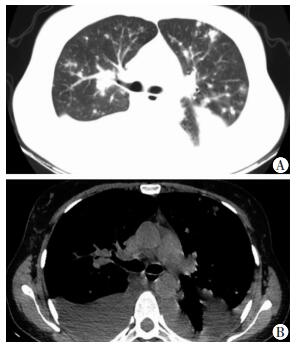
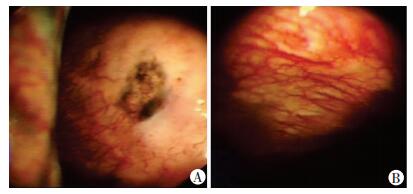
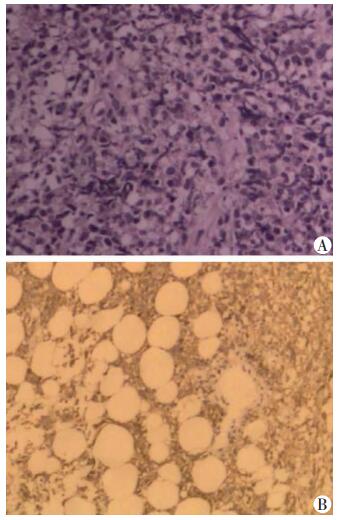
入院后完善常规实验室检查:血常规提示中性粒细胞百分比稍高,肝功能提示低蛋白血症,尿、便常规、肾功、心肌酶谱、BNP等未见明显异常;肿瘤标志物提示:CA125>1 000 U/mL,铁蛋白及NSE轻度升高,结核相关检查未见异常。胸部CT提示:双肺纹理增多、紊乱,双肺野多发斑片状或结节状高密度影;双侧胸腔积液(图 1)。胸水超声提示双侧胸腔积液。先后行胸腔穿刺抽液术及胸腔小导管引流术,引流出黄色浑浊胸腔积液,胸水常规检查提示为渗出液,ADA 31 U/L,胸水抗酸染色阴性,细胞学检查未见癌细胞,均未能明确诊断。因患者一般情况较差并伴有低蛋白血症,予以加强营养支持及纠正低蛋白血症等治疗后,于3月12日行胸腔镜检查示:壁层胸膜及膈胸膜血管增生,散在结节影伴局部色素沉着,脏层胸膜光滑(图 2)。胸膜组织病理活检(图 3)及免疫组织化学支持非霍奇金淋巴瘤(弥漫大B细胞型)。免疫组化染色:CK(-), CA15-3(-), CD3(+), CD20(++), CD43(+), Ki67(45%~50%+), BCL-2(+), BCL-6(-), CD10(-), MUMI(+), CD23(不规则+), CD5(-), LEF-1(-), Cyclin(-), TDT(-)。结合患者症状、临床特征、病理及免疫组化分析结果,明确诊断为:弥漫大B细胞性非霍奇金淋巴瘤。
|
| A:患者胸部肺窗观:双肺纹理增多、紊乱,双肺野多发斑片状或结节状高密度影;B:患者胸部纵隔窗观:双肺多发结节及双侧胸腔积液 图 1 淋巴瘤所致胸腔积液患者的胸部CT表现 |
|
| A:散在结节影伴局部色素沉着;B:壁层胸膜血管增生 图 2 淋巴瘤所致胸腔积液患者的胸腔镜下表现 |
|
| A:非霍奇金B细胞淋巴瘤组织的病理学变化(HE ×100);B:弥漫大B细胞淋巴瘤组织的病理学变化(二步法×100) 图 3 胸膜组织活检染色结果 |
3 讨论
淋巴瘤是血液系统常见恶性肿瘤,临床上淋巴瘤常表现为无痛性进行性淋巴结肿大或局部肿块,但由于淋巴瘤常发生器官浸润,据其浸润部位不同,其临床表现各异。肺作为恶性淋巴瘤较常累及的器官,淋巴瘤肺部浸润发生率达25%~40%[3],以呼吸系统症状为首发的病例则相对较少。但本研究中6例患者均以呼吸系统症状就诊,主要症状为咳嗽(n=4),呼吸困难(n=4),发热(n=1)及胸痛(n=1),咳嗽及发热症状考虑为淋巴瘤或肺部感染所致,呼吸困难则是因为胸腔积液压迫肺导致肺通气功能下降所致。
淋巴瘤所致的胸腔积液大多数为恶性胸腔积液。在霍奇金淋巴瘤中,胸腔积液的发生比例可能达10%~ 30%[4-6],因为霍奇金淋巴瘤胸腔积液形成的原因多为肿大的纵隔淋巴结导致淋巴回流障碍[7],所以其胸腔积液的形成往往在疾病的后期阶段,且多为乳糜样胸水,通常没有恶性细胞[8-11];而在非霍奇金淋巴瘤中,约20%的患者伴有恶性胸腔积液[12],由于大部分胸腔积液是由肿瘤直接浸润顶叶和/或内脏胸膜引起[13],所以在疾病发展的早期阶段即可见胸腔积液[14],胸腔积液可以是单侧或双侧的。本研究中单侧或双侧胸腔积液病例各占一半,所有病例最终均诊断为非霍奇金淋巴瘤,且都以呼吸系统表现为首发症状,这与文献[14]报道的非霍奇金淋巴瘤早期发生恶性胸腔积液的研究结果是一致的。因此,在临床上,以呼吸系统症状就诊的恶性胸腔积液患者,除了考虑肺癌胸膜转移或胸膜原发肿瘤外,不能忽视淋巴瘤所致的恶性胸腔积液,而由于霍奇金淋巴瘤与非霍奇金淋巴瘤形成胸腔积液的机制不同,非霍奇金淋巴瘤往往更容易在早期出现呼吸系统症状。
在疾病的诊断思路上,本组6例患者均以肺部浸润伴胸腔积液为主要临床表现,3例患者胸腔积液为双侧,3例胸腔积液为单侧。2例为非血性胸腔积液,4例为血性胸腔积液。因患者表现为咳嗽、呼吸困难、胸痛不适等呼吸系统症状,故6例患者均首诊于呼吸科。对于此类以“肺部症状和体征”首诊的患者临床上初步考虑淋巴瘤的可能性小,往往倾向于考虑结核性渗出性胸膜炎和其他恶性肿瘤胸膜转移。虽然本研究所有病例都有肺部病灶浸润,但其胸部影像学不典型:其表现为多发高密度片状影,伴或不伴肺结节,且结节可呈单个,也可表现为多发结节,故“胸腔积液”成为病因诊断的切入点。本组中,6例患者胸腔积液均为渗出液,且6例患者胸水癌胚抗原(CEA)值均在正常参考值范围内,4例患者胸水腺苷脱氨酶(ADA)高于正常参考值范围。早期临床研究认为胸水腺苷脱氨酶被认为是诊断结核性胸腔积液的重要诊断依据,对于胸腔积液ADA值>40 U/L的患者其诊断结核性胸腔积液的灵敏度及特异度均大于80%[15],但近年间发现其他疾病(如脓胸、支气管来源的肿瘤、肺吸虫病以及淋巴瘤等)胸水ADA仍明显高于40 U/L[16-17],同时我们也发现,虽然所有患者都考虑恶性胸腔积液,但没有1例患者胸水CEA增高,故单从胸腔积液性质、生化及酶学等指标来诊断疾病仍比较困难,所以内科胸腔镜直视下胸膜活检术成了此类疾病诊断的重要手段。
内科胸腔镜因其具有操作简单、创伤小、耐受性好等优点已在临床上广泛应用。胸腔镜通过全面观察胸膜及肺部表面情况,直接在直视下活检,使得胸腔积液确诊率较以往闭式胸膜活检大大提高[18],而且在结核性胸腔积液、恶性胸腔积液、脓胸、自发性气胸等胸膜疾病的治疗上也有很好的应用[19-20]。HARRIS等[21]报道了182例接受胸腔镜检查的患者,显示其对恶性肿瘤的诊断敏感性为95%,而对恶性胸膜间皮瘤等少见胸膜恶性肿瘤的阳性率也可达87.5%[22],国内同行报道548例通过内科胸腔镜检查的患者,其确诊率高达88.9%,检查失败率仅1.1%[23]。其主要的禁忌证则是由于粘连导致胸膜间隙不足,且内科胸腔镜的并发症较小,还很少发生[24]。本组中6例患者均以胸腔积液为主要表现,病程较长,胸腔穿刺及胸水常规及细胞学等检查均未能明确诊断,因此选择了内科胸腔镜下胸膜活检术。其胸腔镜下表现分别如下:病例1镜下见血性胸水,局部粘连明显,壁层、脏层、膈胸膜表面附着大量纤维板样物,壁胸膜局部呈大结节样改变;病例2可见非血性胸水,1处壁层胸膜白色斑片状突起;病例3镜下见血性胸水,壁层胸膜散在小结节,大小不等;病例4可见血性胸水,壁层胸膜与脏层胸膜严重粘连,较多分隔,大部胸膜表面光滑,可见部分肥厚增生,未见新生物;病例5为血性胸水,脏层胸膜、壁层胸膜及膈胸膜有大量暗红色结节状新生物;病例6镜下见非血性胸水,壁层胸膜及膈胸膜血管增生,散在结节影伴局部色素沉着,脏层胸膜光滑。以上分析可见,淋巴瘤胸膜转移不具有典型特征,临床上,胸腔镜下表现为血性胸腔积液、胸膜多发结节、胸膜粘连及分隔、胸膜增厚或其他非特异性表现,均有可能是淋巴瘤所致,临床上应结合病理及免疫组化分析来明确诊断。
据报道,任何类型的淋巴瘤均可能累及胸膜,但是以弥漫性大B细胞淋巴瘤最常见,其次是滤泡性淋巴瘤,发生率分别为60%和20%[25]。本研究也得出类似的结果:6例患者均通过胸膜组织的病理或免疫组化明确诊断,其结果如下:弥漫性大B细胞淋巴瘤3例,T淋巴细胞性淋巴瘤1例,淋巴浆细胞性淋巴瘤1例,NK/T细胞淋巴瘤1例,均为非霍奇金淋巴瘤,而弥漫大B细胞淋巴瘤占比50%。
综上所述,淋巴瘤患者系免疫力低下人群,易出现肺部感染、肺部浸润表现。但一般晚期多见,而以肺部浸润伴胸腔积液为首发表现却并不多见,这类患者往往需要与结核性渗出性胸膜炎和其他系统恶性肿瘤肺或胸膜转移相鉴别。而淋巴瘤患者临床表现各异,不具备典型的具有鉴别诊断意义的临床症状及生化指标,给淋巴瘤诊断带来诸多困难。本研究共收集了6年1 356例胸腔镜中6例确诊为淋巴瘤的病例,通过内科胸腔镜直视下胸膜活检术,尽管其镜下表现无典型特征,但最终全部明确诊断。但本研究存在其局限性:这是一项回顾性研究,而且本研究最终纳入样本量仅6例,且为单中心研究,我们以后会继续关注类似少见病例,积累更多经验。总之,内科胸腔镜是提高复杂胸膜疾病诊断率的重要手段,在以后的临床工作中,对于以肺部浸润伴胸腔积液为首发症状患者,我们也要考虑到淋巴瘤可能,并尽早进行内科胸腔镜下胸膜活检以明确诊断。
| [1] | CORDIER J F, CHAILLEUX E, LAUQUE D, et al. Primary pulmonary lymphomas[J]. Chest, 1993, 103(1): 201–208. DOI:10.1378/chest.103.1.201 |
| [2] | NA M J. Diagnostic tools of pleural effusion[J]. Tuberc Respir Dis, 2014, 76(5): 199. DOI:10.4046/trd.2014.76.5.199 |
| [3] | FERRARO P, TRASTEK V F, ADLAKHA H, et al. Primary non-Hodgkin's lymphoma of the lung[J]. Ann Thorac Surg, 2000, 69(4): 993–997. DOI:10.1016/s0003-4975(99)01535-0 |
| [4] | DAS D K. Serous effusions in malignant lymphomas: A review[J]. Diagn Cytopathol, 2006, 34(5): 335–347. DOI:10.1002/dc.20432 |
| [5] | ALEXANDRAKIS M G, PASSAM F H, KYRIAKOU D S, et al. Pleural effusions in hematologic malignancies[J]. Chest, 2004, 125(4): 1546–1555. DOI:10.1378/chest.125.4.1546 |
| [6] | HUNTER B D, DHAKAL S, VOCI S, et al. Pleural effusions in patients with Hodgkin lymphoma: clinical predictors and associations with outcome[J]. Leukemia Lymphoma, 2014, 55(8): 1822–1826. DOI:10.3109/10428194.2013.836599 |
| [7] | TOMA P, GRANATA C, ROSSI A, et al. Multimodality imaging of Hodgkin disease and non-Hodgkin lymphomas in children[J]. Radiographics, 2007, 27(5): 1335–1354. DOI:10.1148/rg.275065157 |
| [8] | CASTELLINO A, BLANK N, HOPPE T, et al. Hodgkin disease: contributions of chest CT in the initial staging evaluation[J]. Radiology, 1986, 160(3): 603–605. DOI:10.1148/radiology.160.3.3737899 |
| [9] | URBA W J. Hodgkin's disease[J]. N Engl J Med, 1992, 326(10): 678–87. DOI:10.1056/NEJM199203053261006 |
| [10] | GUERMAZI A, BRICE P, DE KERVILER E, et al. Extranodal hodgkin disease: spectrum of disease[J]. Radio Graphics, 2001, 21(1): 161–179. DOI:10.1148/radiographics.21.1.g01ja02161 |
| [11] | JANJETOVIC S, JANNING M, DAUKEVA L, et al. Chylothorax in a patient with Hodgkin's lymphoma: A case report and review of the literature[J]. Tumori, 2013, 99(3): e96–e99. DOI:10.1700/1334.14813 |
| [12] | MANOHARAN A, PITNEY W R, SCHONELL M E, et al. Intrathoracic manifestations in non-Hodgkin's lymphoma[J]. Thorax, 1979, 34(1): 29–32. DOI:10.1136/thx.34.1.29 |
| [13] | CELIKOGLU F, TEIRSTEIN A S, KNELLENSTEIN D J, et al. Pleural effusion in non-hodgkin's lymphoma[J]. Chest, 1992, 101(5): 1357–1360. DOI:10.1378/chest.101.5.1357 |
| [14] | DAS D K, GUPTA S K, AYYAGARIS, et al. Pleural effusions in non-Hodgkin's lymphoma. A cytomorphologic, cytochemical and immunologic study[J]. Acta Cytol, 1987, 31(2): 119–124. |
| [15] | GUPTA B K, BHARAT V, BANDYOPADHYAY D. Role of adenosine deaminase estimation in differentiation of tuberculous and non-tuberculous exudative pleural effusions[J]. J Clin Med Res, 2010, 2(2): 79–84. DOI:10.4021/jocmr2010.03.280w |
| [16] | KATO F, HIRASAWA Y, IIOKA Y, et al. A case of primary effusion lymphoma with elevation of ADA activity in pleural effusion[J]. Nihon Kokyuki Gakkai Zasshi, 2011, 49(10): 786–791. |
| [17] | SONG J, HONG G, SONG J U, et al. A case of pleuralparagonimiasis confused with tuberculous pleurisy[J]. Tuberc Respir Dis, 2014, 76(4): 175. DOI:10.4046/trd.2014.76.4.175 |
| [18] | WU Y B, XU L L, WANG X J, et al. Diagnostic value of medical thoracoscopy in malignant pleural effusion[J]. BMC Pulm Med, 2017, 17: 109. DOI:10.1186/s12890-017-0451-1 |
| [19] | LIU J Y, XIONG L, ZHANG M, et al. Medical thoracoscopy in China: the present status and the future[J]. J Thorac Dis, 2017, 9(2): 406–413. DOI:10.21037/jtd.2017.02.39 |
| [20] | SUMALANI K K, RIZVI N A, ASGHAR A. Role of medical thoracoscopy in the management of multiloculated empyema[J]. BMC Pulm Med, 2018, 18(1): 179. DOI:10.1186/s12890-018-0745-y |
| [21] | HARRIS R J, KAVURU M S, RICE T W, et al. The diagnostic and therapeutic utility of thoracoscopy[J]. Chest, 1995, 108(3): 828–841. DOI:10.1378/chest.108.3.828 |
| [22] | XU L L, YANG Y, WANG Z, et al. Malignant pleural mesothelioma: diagnostic value of medical thoracoscopy and long-term prognostic analysis[J]. BMC Pulm Med, 2018, 18: 56. DOI:10.1186/s12890-018-0619-3 |
| [23] |
徐智, 林科雄, 姚伟, 等. 内科胸腔镜对548例不明病因胸腔积液的诊断价值[J].
第三军医大学学报, 2014, 36(21): 2211–2215.
XU Z, LIN K X, YAO W, et al. Diagnostic value of medical thoracoscopy for pleural effusion with unknown origin: report of 548 cases[J]. J Third Mil Medl Univ, 2014, 36(21): 2211–2215. DOI:10.16016/j.1000-5404.2014.21.006 |
| [24] | COLT H G. Thoracoscopy. A prospective study of safety and outcome[J]. Chest, 1995, 108(2): 324–329. DOI:10.1378/chest.108.2.324 |
| [25] | VEGA F, PADULA A, VALBUENA J R, et al. Lymphomas involving the pleura:A clinicopathologic study of 34 cases diagnosed by pleural biopsy[J]. Arch Pathol Lab Med, 2006, 130(10): 1497–1502. DOI:10.1043/1543-2165(2006)130[1497:LITPAC]2.0.CO;2 |



