微小RNA(miRNAs)是一类被证实与肿瘤发生、发展密切相关的内源性非编码小分子RNA,与靶基因mRNA的3′非编码区(3′-UTR)特异性结合从而调控mRNA的表达是其主要的分子机制。既往研究[1-3]显示,miR-204-5p在肝癌、前列腺癌和胶质瘤等多种肿瘤组织中低表达,并与癌细胞的增殖、侵袭和迁移等有关。近年来,有研究[4]指出,miR-204-5p在甲状腺乳头状癌组织中表达下调,且参与肿瘤细胞的增殖和凋亡过程,但其在癌细胞转移中的作用及其调控癌细胞增殖的分子机制并不明确。高迁移率族蛋白B1(HMGB1)是一种与肿瘤细胞增殖、侵袭和迁移关系密切的促癌基因,其在甲状腺乳头状癌K1细胞中高表达,且在肿瘤细胞生长和运动过程中发挥着重要的促进作用[5-6]。采用TargetScan生物学信息学软件预测发现,HMGB1 3′-UTR存在与miR-204-5p互补的结合位点,猜测miR-204-5p可能通过靶向HMGB1表达调控甲状腺乳头状癌细胞增殖、侵袭和迁移。已有研究[7-8]证实,人甲状腺乳头状癌K1细胞的增殖活性较高。为了验证上述猜想,本研究以K1细胞为研究对象,旨在从细胞和分子水平探讨miR-204-5p靶向HMGB1对K1细胞增殖、侵袭和迁移的影响,以期为甲状腺乳头状癌的发生、发展机制及分子靶向治疗提供新的线索。
1 材料与方法 1.1 主要材料与试剂人甲状腺乳头状癌细胞系K1(中国上海科学院细胞库),胎牛血清和RPMI1640培养基(美国GIBCO公司),MTT试剂、胰蛋白酶和二甲基亚枫(美国Sigma公司),miR-204-5p mimics/inhibitor及其阴性对照片段(广州锐博生物公司),HMGB1干扰序列siRNA-HMGB1(上海吉玛公司设计合成),HMGB1过表达载体质粒pcDNA3.1-HMGB1(百奥迈科公司设计构建)。TRIzol试剂和RIPA蛋白裂解液(北京百奥莱博科技公司),Matrigel基质胶(美国BD公司),双荧光素酶报告基因检测试剂盒(美国Promega公司),Transwell小室(美国Corning公司),兔抗鼠HMGB1(英国Abcam公司),兔抗鼠β-actin(美国Affinity公司),ECL化学发光试剂盒(美国GE公司),HRP标记羊抗兔IgG(美国EarthOx公司),蛋白上样缓冲液(2×)、逆转录试剂盒和聚合酶链反应试剂盒(中国碧云天生物技术公司),酶标仪(北京昊诺斯科技公司),PCR扩增仪(美国PerkinElmer公司),微量分光光度计(美国Inc公司),CO2孵育箱(美国FormaScientifi公司)。
1.2 细胞培养、实验分组与转染在37 ℃、饱和湿度的5%CO2细胞培养箱内采用RPMI1640培养基(含10%胎牛血清)培养K1细胞。将生长状态良好的对数生长期K1细胞按照每孔2×105个接种至6孔细胞板上,置于37 ℃、5%CO2和饱和湿度的培养箱中常规培养过夜。实验分为:NC组(转染miR-204-5p mimics阴性对照)、miR-204-5p组(转染miR-204-5p mimics)、anti-NC组(转染miR-204-5p inhibitor阴性对照)和anti-miR-204-5p组(转染miR-204-5p inhibitor阴性对照),每组设置3个复孔。根据转染试剂Lipofectamine TM2000说明书步骤按照实验分组转染K1细胞。转染4~6 h后更换新鲜培养基继续培养。48 h后结束培养,收集各组细胞进行后续实验。后期实验为了进一步探讨HMGB1在K1细胞中的作用,通过转染HMGB1干扰序列siRNA-HMGB1和HMGB1过表达质粒pcDNA3.1-HMGB1构建HMGB1低表达和过表达的K1细胞株,并分别记为siRNA-HMGB1组和pcDNA3.1-HMGB1组,将转染相应阴性对照si-NC和空载体pcDNA3.1的细胞作为si-NC组和pcDNA3.1组,观察HMGB1对K1细胞增殖、侵袭和迁移的影响。
1.3 RT-PCR检测miR-204-5p和HMGB1 mRNA的表达采用TRIzol法提取K1细胞的总RNA,并以微量分光光度计对总RNA进行定量。按照反转录试剂盒步骤将RNA逆转录成cDNA,并将cDNA作为模板上PCR仪以U6或β-actin为内参按照设定的条件(94 ℃预变性120 s;94 ℃变性30 s、58 ℃退火30 s、72 ℃延伸40 s,35个循环)进行扩增,采用2-ΔΔCt法计算各组细胞中miR-204-5p的表达水平。其中,miR-204-5p上游引物:5′-GCCAGATCTGGAAGAAGATGGTGGTTAGT-3′,下游引物:5′-GGCGAATTCACAGTTGCCTACAGTATTCA-3′;U6上游引物:5′-GCTCGCTTCGGCAGCACA-3′,下游引物:5′-GAGGTATTCGCACCAGAGGA-3′;HMGB1上游引物:5′-TATGGCAAAAGCGACAAGG-3′,下游引物:5′-CTTCGCAACATCACCAATGGA-3′;β-actin上游引物:5′-GGACCTGACTGACTACCTC-3′,下游引物:5′-TACT-CCTGCTTGCTGAT-3′。
1.4 Western blot检测HMGB1蛋白的表达向转染48 h后的K1细胞中加入细胞裂解液提取总蛋白,并参照BCA蛋白定量试剂盒说明书步骤检测所提总蛋白的浓度。同等体积蛋白上样缓冲液混合沸水浴变性5 min。取50 μg蛋白样品上样至12% SDS-PAGE凝胶孔中进行电泳。待电泳结束后,电转至硝酸纤维膜上。以含50 g/L脱脂奶粉的封闭液处理2 h后,加入1 :1 000稀释的β-actin抗体和HMGB1抗体4 ℃下反应过夜。封闭液洗膜后,加入1 :2 000稀释的二抗常温孵育1 h。经化学发光剂显色后,采用Image J软件分析,以HMGB1条带灰度值与内参β-actin条带灰度值的比值表示HMGB1蛋白的表达水平。实验重复3次。
1.5 MTT法检测细胞增殖将收集转染后的K1细胞平铺于96孔细胞板上,每孔接种细胞数为2×104个。置于培养箱内常规培养24、48和72 h后,加入浓度为5 g/L MTT溶液20 μL。置于培养箱内孵育4 h后,加入100 μL二甲基亚砜震荡至结晶物充分溶解。采用酶标仪(490 nm波长)检测各组细胞的光密度值D(490)。
1.6 Transwell小室法检测细胞侵袭和迁移收集转染后的各组K1细胞,调整细胞浓度为1×104个/mL。分别取各组细胞液200 μL加入到铺有Matrigel基质胶的Transwell小室的上室,下室中加入600 μL细胞培养液(含10%胎牛血清)。放入培养箱中培养24 h后,取出小室,小心擦去基质胶和上室内的细胞,置于40 g/L甲醛中固定15~20 min。经0.1%结晶紫染液处理20 min后,载玻片上封片。置于光学显微镜下观察随机选取的5个视野中的细胞数。结果取平均值。迁移实验:Transwell小室无需基质胶包被,其他步骤同侵袭实验。
1.7 双荧光素酶报告基因实验检测miR-204-5p与HMGB1的靶向关系构建野生型HMGB1-WT和突变型HMGB1-MUT的HMGB1 3′-UTR双荧光报告质粒。将对数生长期的K1细胞以每孔105个接种至12孔细胞板上,将HMGB1-WT、HMGB1-MUT与miR-204-5p mimics或miR-204-5p mimics阴性对照共转染至K1细胞。每组实验设置3个重复。培养箱内培养48 h后,参照双荧光素酶报告基因检测试剂盒步骤检测,以萤火虫荧光强度与海肾荧光强度的比值表示各组细胞的荧光素酶活性。
1.8 统计学分析采用SPSS 22.0统计软件进行分析,实验数据以x±s形式表示,多组间比较使用单因素方差分析,组间多重比较采用SNK-q,两组间比较采用独立样本t检验。检验水准:α=0.05。
2 结果 2.1 各组K1细胞中miR-204-5p表达的比较转染48 h后,RT-PCR检测结果见图 1。与miR-NC组相比,miR-204-5p组细胞中miR-204-5p的表达水平明显升高(P < 0.05),而anti-miR-204-5p组中miR-204-5p的表达水平较anti-miR-NC组明显降低(P < 0.05)。
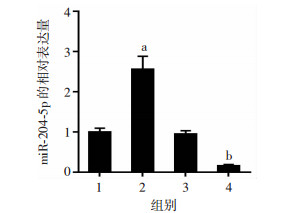
|
| 1:miR-NC组;2:miR-204-5p组;3:anti-miR-NC组;4:anti-miR-204-5p组;a: P < 0.05, 与miR-NC组比较;b: P < 0.05, 与anti-miR-NC组比较 图 1 各组K1细胞中miR-204-5p的相对表达水平 |
2.2 miR-204-5p对K1细胞增殖活力的影响
MTT检测结果见图 2。在miR-204-5p过表达的miR-204-5p组中,细胞的增殖活力在24、48 h和72 h时间下较miR-NC组明显降低(P < 0.05);而在miR-204-5p表达抑制的anti-miR-204-5p组中同一时间下的细胞活力较anti-miR-NC组明显升高(P < 0.05)。
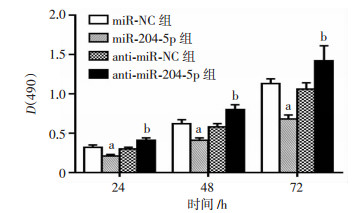
|
| a:P < 0.05,与miR-NC组比较;b:P < 0.05,与anti-miR-NC组比较 图 2 MTT检测miR-204-5p对各组K1细胞增殖活力的影响 |
2.3 miR-204-5p对K1细胞侵袭和迁移能力的影响
Transwell小室实验检测结果见图 3。与miR-NC组相比,miR-204-5p过表达的K1细胞侵袭和迁移能力均明显降低(P < 0.05);而miR-204-5p低表达的K1细胞的侵袭和迁移能力较anti-miR-NC组均明显升高(P < 0.05)。

|
| A:Transwell检测细胞侵袭和迁移(×200);B:定量分析结果1: miR(NC组; 2: miR)204*5p组; 3: anti+miR, NC组; 4: anti-miR.204/5p组;a: P < 0.05, 与miR0NC组比较;b:P < 0.05,与anti1miR2NC组比较 图 3 Transwell检测miR-104-5p对各组K1细胞侵袭和迁移能力的影响 |
2.4 miR-204-5p与HMGB1靶向关系
采用TargetScan(http://www.targetscan.org/)生物学信息学软件预测发现,HMGB1 3′ UTR存在能够与miR-204-5p互补的核苷酸序列,结果见表 1。双荧光素酶报告基因实验结果显示,miR-204-5p过表达可显著降低野生型HMGB1 3′ UTR质粒转染的K1细胞的荧光素酶活性,而抑制miR-204-5p表达则显著升高其荧光素酶活性(P < 0.05,图 4)。
| 基因 | 互补的核苷酸序列 | 结合位点 |
| HMGB1 | 5′...GCCUGAUGCAGCAAAAAAGGGAG...3′ | 417-424 of ECT2 |
| miR-204-5p | 3′......UCCGUAUCCUACUGUUUCCCUU...5′ | ECT23′ UTR |
| 下划线字母代表碱基互补的位点 | ||
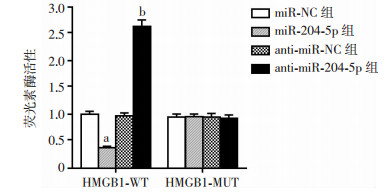
|
| a:P < 0.05,与miR-NC组比较;b:P < 0.05,与anti-miR-NC组比较 图 4 各组K1细胞荧光素酶活性 |
2.5 miR-204-5p对HMGB1表达的调控作用
RT-PCR和Western blot检测HMGB1 mRNA和蛋白的表达(图 5)。miR-204-5p过表达的miR-204-5p组中HMGB1 mRNA和蛋白的表达水平较miR-NC组明显降低(P < 0.05),而miR-204-5p低表达的anti-miR-204-5p组中HMGB1在mRNA和蛋白的表达水平较anti-miR-204-5p明显升高(P < 0.05)。

|
| A: HMGB1 mRNA的相对表达水平;B: Western blot检测HMGB1蛋白的表达;C: HMGB1蛋白的表达水平1: miR-NC组; 2: miR-204-5p组; 3: anti-miR-NC组; 4: anti-miR-204-5p组;a: P < 0.05,与miR-NC组比较;b:P < 0.05,与anti-miR-NC组比较 图 5 miR-204-5p对HMGB1表达的影响 |
2.6 HMGB1对K1细胞增殖、侵袭和迁移的影响
RT-PCR和Western blot检测结果显示,在转染HMGB干扰序列的siRNA-HMGB1组细胞中HMGB1 mRNA和蛋白的表达水平较相应对照siRNA-NC组明显降低;而在转染HMGB1过表达质粒的pcDNA3.1-HMGB1组细胞中HMGB1 mRNA和蛋白的表达水平较相应对照pcDNA3.1组显著升高(P < 0.05,图 6A~C)。MTT实验检测结果显示,与siRNA-NC组相比,siRNA-HMGB1组细胞在48 h作用时间下的细胞增殖活力明显降低;而pcDNA3.1-HMGB1组细胞增殖活力较pcDNA3.1组显著升高(P < 0.05,图 6D)。同时,Transwell小室实验结果显示,在HMGB1低表达的siRNA-HMGB1组细胞侵袭和迁移能力较siRNA-NC组显著降低,而在HMGB1高表达pcDNA3.1-HMGB1组细胞侵袭和迁移能力较pcDNA3.1组显著升高(P < 0.05,图 6E,图 7)。

|
| A:Western blot检测HMGB1蛋白表达;B:HMGB1 mRNA的表达水平;C:HMGB1蛋白的表达水平;D:光密度值;E:Transwell检测细胞侵袭和迁移(×200) 1: siRNA-NC组; 2: siRNA-HMGB1组; 3: pcDNA3.1组; 4: pcDNA3.1-HMGB1组;a:P < 0.05,与siRNA-NC组比较;b:P < 0.05,与pcDNA3.1组比较 图 6 HMGB1对各组K1细胞增殖、侵袭和迁移的影响 |
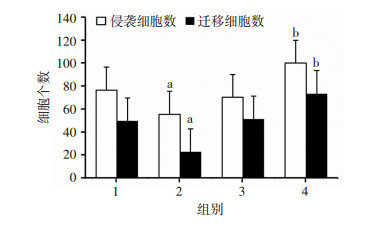
|
| 1: siRNA-NC组; 2: siRNA-HMGB1组; 3: pcDNA3.1组; 4: pcDNA3.1-HMGB1组;a:P < 0.05,与siRNA-NC组比较;b:P < 0.05,与pcDNA3.1组比较 图 7 HMGB1对各组K1细胞迁移、侵袭影响的定量分析结果 |
3 讨论
甲状腺癌是一种常见的甲状腺恶性肿瘤,现阶段其发病率逐年攀高[9-10];尽管肿瘤在治疗方面取得了较多的进展,但其治疗效果并不理想。甲状腺乳头状癌是甲状腺癌的常见病理类型,约占其80%以上[11],其淋巴结转移是导致甲状腺癌复发、预后不良的重要原因[12-13]。因此,探讨甲状腺乳头状癌发生、发展的分子机制,寻找能够抑制癌细胞增殖、侵袭和转移的有效靶点对治疗甲状腺癌具有重要意义。
越来越多的miRNAs包括miR-144-3p、miR-329和miR-26a等被证实与甲状腺癌的发生、发展关系密切[14-16]。作为miRNAs中的重要一员,miR-204-5p在肿瘤发生、发展中的作用被逐渐发现并备受关注[17]。有研究[18]显示,miR-204-5p在胶质瘤组织中低表达,恢复其表达可通过靶向调控RAB22A抑制肿瘤细胞的生长、迁移和侵袭。miR-204-5p在肝癌组织中表达下调,上调其表达后可通过靶向抑制SIRT1抑制肿瘤细胞的快速生长、耐药和转移[19]。同时,恢复胃癌细胞中miR-204-5p的表达后,可通过靶向调控EGFR抑制癌细胞的增殖和转移[20]。尽管已有学者证实[4],miR-204-5p在甲状腺乳头状癌中低表达,但其在甲状腺乳头状癌发生、发展中的功能和作用机制尚不完全清楚。
本研究发现,上调甲状腺乳头状癌K1细胞中miR-204-5p表达后,K1细胞的增殖、侵袭和迁移能力明显受到抑制;而抑制miR-204-5p表达则明显促进K1细胞的增殖、侵袭和迁移。采用生物学信息软件进一步预测miR-204-5p的靶基因发现,HMGB1 3′ UTR存在能够与miR-204-5p互补结合的核苷酸序列。HMGB1是一种与肿瘤发生、发展密切相关的非组蛋白染色体结合蛋白,在DNA的复制、转录、修复和细胞运动过程中发挥着重要作用,在多种肿瘤组织中异常过表达,常被作为癌症患者生存的预后因子[21]。例如:HMGB1通过增强ERK1/2与NF-κB途径,上调MMP-2表达介导ERK/c-Myc途径下调p21来部分促进肝癌的发生、发展[22];另外,HMGB1被miR-34a下调后可抑制宫颈癌和大肠癌细胞的增殖、迁移和侵袭[23]。HMGB1在甲状腺癌组织中表达上调,且可通过引起致癌性miR-221和miR-222的过度表达在肿瘤细胞生长和活动过程中发挥重要的促进作用[6]。本研究采用双荧光素酶报告基因实验检测发现,上调miR-204-5p表达能够降低野生型HMGB1 3′ UTR质粒转染的K1细胞的荧光素酶活性;反之,则促进其活性。同时,采用Western blot检测发现,miR-204-5p可从mRNA和蛋白水平负向调控HMGB1的表达。结果说明,HMGB1是miR-204-5p的潜在靶基因。另外,在K1细胞中成功抑制HMGB1表达后,K1细胞的增殖、侵袭和迁移能力明显受到抑制;而上调HMGB1表达后,K1细胞的增殖、侵袭和迁移能力明显增强。提示,miR-204-5p可通过靶向HMGB1抑制甲状腺乳头状癌K1细胞的增殖、侵袭和迁移。
综上所述,miR-204-5p在甲状腺乳头状癌细胞增殖、侵袭和迁移过程中发挥着重要的抑癌作用,上调其表达可有效抑制肿瘤细胞的增殖、侵袭和迁移,其作用机制可能与靶向抑制HMGB1表达有关。
| [1] |
CHANG J W, KOH Y W, CHUNG W Y, et al. Predictors of thyroid gland involvement in hypopharyngeal squamous cell carcinoma[J]. Yonsei Med J, 2015, 56(3): 812-818. DOI:10.3349/ymj.2015.56.3.812 |
| [2] |
LIN Y C, LIN J F, TSAI T F, et al. Tumor suppressor miRNA-204-5p promotes apoptosis by targeting BCL2 in prostate cancer cells[J]. Asian J Surg, 2017, 40(5): 396-406. DOI:10.1016/j.asjsur.2016.07.001 |
| [3] |
XIA Z Q, LIU F, ZHANG J, et al. Decreased expression of MiRNA-204-5p contributes to glioma progression and promotes glioma cell growth, migration and invasion[J]. PLoS ONE, 2015, 10(7): e0132399. DOI:10.1371/journal.pone.0132399 |
| [4] |
LIU L Y, WANG J N, LI X Q, et al. MiR-204-5p suppresses cell proliferation by inhibiting IGFBP5 in papillary thyroid carcinoma[J]. Biochem Biophys Res Commun, 2015, 457(4): 621-626. DOI:10.1016/j.bbrc.2015.01.037 |
| [5] |
谢珲, 张欢欢, 应华忠, 等. 微RNA-22在甲状腺乳头状癌中的表达及与化疗敏感性的关系[J]. 国际流行病学传染病学杂志, 2017, 44(2): 95-99. XIE H, ZHANG H H, YING H Z, et al. Expression of microRNA-22 in thyroid papillary carcinoma and its relationship with chemotherapy sensitivity[J]. Int J Epidemiol Infect Dis, 2017, 44(2): 95-99. DOI:10.3760/cma.j.issn.1673-4149.2017.02.005 |
| [6] |
MARDENTE S, MARI E, CONSORTI F, et al. HMGB1 induces the overexpression of miR-222 and miR-221 and increases growth and motility in papillary thyroid cancer cells[J]. Oncol Rep, 2012, 28(6): 2285-2289. DOI:10.3892/or.2012.2058 |
| [7] |
黄志强, 曹文斌, 葛志鹏, 等. 肝激酶B1过表达对人甲状腺乳头状癌K1细胞增殖及转移的影响[J]. 山东医药, 2017, 57(9): 36-38. HUANG Z Q, CAO W B, GE Z P, et al. Effects of overexpression of hepatic kinase B1 on proliferation and metastasis of human papillary thyroid carcinoma K1 cells[J]. Shandong Med J, 2017, 57(9): 36-38. DOI:10.3969/j.issn.1002-266X.2017.09.011 |
| [8] |
熊燚, 赵敏, 谭剑斌, 等. 夏枯草诱导人甲状腺乳头状癌细胞K1增殖和凋亡的影响及其作用机制[J]. 现代生物医学进展, 2017, 17(13): 2401-2406. XIONG Y, ZHAO M, TAN J B, et al. Effects and mechanism of prunella vulgaris L.on the proliferation and apoptosis of human papillary thyroid cancer K1 cells[J]. Prog Mod Biomed, 2017, 17(12): 2401-2406. DOI:10.13241/j.cnki.pmb.2017.13.001 |
| [9] |
CHANG J W, KOH Y W, CHUNG W Y, et al. Predictors of thyroid gland involvement in hypopharyngeal squamous cell carcinoma[J]. Yonsei Med J, 2015, 56(3): 812-818. DOI:10.3349/ymj.2015.56.3.812 |
| [10] |
UKRAINSKI M B, PRIBITKIN E A, MILLER J L. Increasing incidence of thyroid nodules and thyroid cancer: does increased detection of a subclinical reservoir justify the associated anxiety and treatment?[J]. Clin Ther, 2016, 38(4): 976-985. DOI:10.1016/j.clinthera.2015.07.013 |
| [11] |
SHI C L, SUN Y, DING C, et al. Correlation between the BRAF V600E mutation status and the clinicopathologic features of papillary thyroid carcinoma[J]. Genet Mol Res, 2015, 14(3): 7377-7385. DOI:10.4238/2015.July.3.13 |
| [12] |
CAZARIN J M, COELHO R G, HECHT F, et al. 5'-AMP-activated protein kinase regulates papillary (TPC-1 and BCPAP) thyroid cancer cell survival, migration, invasion, and epithelial-to-mesenchymal transition[J]. Thyroid, 2016, 26(7): 933-942. DOI:10.1089/thy.2015.0440 |
| [13] |
LUO D Y, CHEN H B, LU P H, et al. CHI3L1 overexpression is associated with metastasis and is an indicator of poor prognosis in papillary thyroid carcinoma[J]. Cancer Biomark, 2017, 18(3): 273-284. DOI:10.3233/CBM-160255 |
| [14] |
LIU C, SU C, CHEN Y C, et al. MiR-144-3p promotes the tumor growth and metastasis of papillary thyroid carcinoma by targeting paired box gene 8[J]. Cancer Cell Int, 2018, 18: 54. DOI:10.1186/s12935-018-0550-y |
| [15] |
WU L, PEI F L, MEN X J, et al. MiR-329 inhibits papillary thyroid cancer progression via direct targeting WNT1[J]. Oncol Lett, 2018, 16(3): 3561-3568. DOI:10.3892/ol.2018.9102 |
| [16] |
GONG Y P, WU W S, ZOU X H, et al. MiR-26a inhibits thyroid cancer cell proliferation by targeting ARPP19[J]. Am J Cancer Res, 2018, 8(6): 1030-1039. |
| [17] |
YE Z H, WEN D Y, CAI X Y, et al. The protective value of miR-204-5p for prognosis and its potential gene network in various malignancies: A comprehensive exploration based on RNA-seq high-throughput data and bioinformatics[J]. Oncotarget, 2017, 8(62): 104960. DOI:10.18632/oncotarget.21950 |
| [18] |
XIA Z Q, LIU F, ZHANG J, et al. Decreased expression of MiRNA-204-5p contributes to glioma progression and promotes glioma cell growth, migration and invasion[J]. PLoS ONE, 2015, 10(7): e0132399. DOI:10.1371/journal.pone.0132399 |
| [19] |
JIANG G B, WEN L, ZHENG H M, et al. MiR-204-5p targeting SIRT1 regulates hepatocellular carcinoma progression[J]. Cell Biochem Funct, 2016, 34(7): 505-510. DOI:10.1002/cbf.3223 |
| [20] |
WANG Y, ZHANG H Y, GE S H, et al. Effects of miR-138-5p and miR-204-5p on the migration and proliferation of gastric cancer cells by targeting EGFR[J]. Oncol Rep, 2018, 39(6): 2624-2634. DOI:10.3892/or.2018.6389 |
| [21] |
WU T Y, ZHANG W, YANG G L, et al. HMGB1 overexpression as a prognostic factor for survival in cancer: A meta-analysis and systematic review[J]. Oncotarget, 2016, 7(31): 50417-50427. DOI:10.18632/oncotarget.10413 |
| [22] |
CHEN Y M, LIN C Z, LIU Y, et al. HMGB1 promotes HCC progression partly by downregulating p21 via ERK/c-Myc pathway and upregulating MMP-2[J]. Tumor Biol, 2016, 37(4): 4399-4408. DOI:10.1007/s13277-015-4049-z |
| [23] |
CHANDRASEKARAN K S, SATHYANARAYANAN A, KARUNAGARAN D. Downregulation of HMGB1 by miR-34a is sufficient to suppress proliferation, migration and invasion of human cervical and colorectal cancer cells[J]. Tumor Biol, 2016, 37(10): 13155-13166. DOI:10.1007/s13277-016-5261-1 |



