疏水性毒物和药物大多数是低水溶性[1]。使用适当的载体溶剂来辅助溶解难溶或低水溶解性试剂,从而提高生物利用率保证适当的暴露浓度[2]。二甲基亚砜(dimethylsulfoxide,DMSO)是一种常用的有机溶剂,被称作“万能溶剂”。根据2002/2012年OECD(Organization for Economic Co-operation and Develop-ment)的建议,DMSO用于溶解低水溶性物质的浓度不应超过100 mg/L(体积比0.01%)。实际DMSO的使用浓度远远大于这一数值。有研究指出,DMSO耐受浓度最高可达10%[3]。但最近一些报道表明低剂量的DMSO(0.1%~2.0%)可诱导小鼠淋巴细胞、大鼠视网膜细胞、体外耳蜗细胞、神经细胞系等多种体外细胞凋亡[4-7]。向BALB/c小鼠腹腔注射DMSO,观察到小鼠各器官的淋巴细胞凋亡情况不同,各亚型淋巴细胞的DMSO耐受剂量不同[4],使用载体溶剂时应审查对特定细胞的阈值。本实验在利用斑马鱼进行神经退行性疾病研究过程中需要DMSO助溶配制试剂,目前关于DMSO在斑马鱼体内的神经毒性报道很少,使用时参考体外神经细胞系的使用浓度(≤0.5%),发现DMSO浓度为0.3%时对斑马鱼间脑细胞增殖有明显影响,而0.1%时没有影响,这与文献推荐的神经细胞系的安全使用浓度不一致。为避免其神经毒性对实验的干扰,建立DMSO在斑马鱼中枢神经系统的阈值剂量尤为重要。在本研究中我们观察不同浓度梯度的DMSO对斑马鱼胚胎及DA神经元发育的影响,包括对斑马鱼形态特征、运动及间脑细胞增殖、凋亡的影响,从而确定DMSO在斑马鱼中枢神经系统研究中的使用阈值,为以后在斑马鱼实验中使用DMSO提供参考浓度。
1 材料与方法 1.1 动物模型制备本实验使用Tg(Vmat2:GFP)转基因斑马鱼(中科院上海神经科学研究所杜九林教授馈赠),北京爱森公司净水系统,在室温28.5~29.5 ℃,pH值7.2~7.6,盐度0.03%~0.04%,光照黑夜(14 h :10 h)条件下喂养。于前一晚20:00选取性成熟斑马鱼1 :1雌雄配对,次日8:00给予光照后,取出挡板,斑马鱼交配自然产卵,受精后1 h(hourspost fertilization,hpf)内收集胚胎,剔除死胚。同亲代斑马鱼单次产卵200~300枚,简单随机化分为10组:①空白对照组;②0.1%DMSO组;③0.3%DMSO组;④0.5%DMSO组;⑤0.8% DMSO组;⑥1.0%DMSO组;⑦1.5%DMSO组;⑧2.0% DMSO组;⑨2.5%DMSO组;⑩3.0%DMSO组。每组30枚胚胎,6 hpf后加DMSO,28.5 ℃培养箱中培养,每隔24 h观察胚胎并拍照记录。
1.2 主要试剂及仪器试剂:DMSO(Sigma-Aldrich),MPTP(美国Sigma),抗体PH3(GeneTex,gtx79055),抗体TH(Millipore,AB152),In Situ Cell Death Detection Kit,TMR red (Roche,12156792910)。仪器:体视荧光显微镜(Olymapus SZX16),激光共聚焦显微镜(Olympus FV-1000)。
1.3 方法每个实验组3个复孔,进行3次独立的实验。按以下浓度梯度将DMSO原液稀释到培养基中:0.1%,0.3%,0.5%,0.8%,1.0%,1.5%,2.0%,2.5%,3.0%(体积比)。6 hpf时将斑马鱼胚胎移到6孔板中,每孔30个胚胎。在不同的浓度梯度下培养胚胎,生化培养箱里(28.0±0.5) ℃条件下孵育72 h。
1.3.1 斑马鱼胚胎发育观察以受精卵凝固、缺乏体节、尾芽没有脱离卵黄囊、缺乏心跳等4个致死条件的任何1个发生为胚胎死亡标准。在24、48、72 hpf使用体视荧光显微镜,分别记录胚胎死亡数。72 hpf时,记录孵化数量;观察斑马鱼胚胎心包水肿、脊椎弯曲、色素沉着减少等,记录畸形数量。对于需要进行共聚焦拍照观察的胚胎,当发育到24 hpf时,加入0.003%(200 μmol/L)的1-苯基-2硫脲(PTU),抑制黑色素生长。
1.3.2 斑马鱼的胚胎行为学观察对于斑马鱼胚胎发育至24 hpf,从黑暗条件下(28.0±0.5)℃饲养的胚胎中随机挑选出8个胚胎,整个过程使用顶置摄像机拍摄60 s,分析其尾部摆动次数,并统计。
1.3.3 整胚免疫组化4%PFA固定72 hpf胚胎24 h,1×PBS洗3次,4 ℃下PBTN固定1 h,anti-PH3 1 :100、anti-TH 1 :50稀释,4 ℃孵育过夜,PT洗5次,每次1 h,Goat anti-Rabbit二抗1 :600稀释,4 ℃孵育过夜。PT洗5次,每次1 h,共聚焦拍照观察。
1.3.4 TUNEL凋亡检测本实验利用In Situ Cell Death Detection Kit,TMR red标记凋亡细胞,收集72 hpf斑马鱼胚胎,4%PFA固定过夜;PBST洗3次,每次5 min;10 μg/mL蛋白酶K处理9 min;PBST快洗2次,慢洗3次,每次5 min;加入新鲜配制的丙酮:无水乙醇(1 :2)放于-20 ℃,40 min。移除上清,PBST洗3次,每次5 min;4%PFA室温下后固定20 min,PBST洗3次,每次5 min;加入36 μL底物label solution 37 ℃避光孵育1 h,加入4 μL Enzyme solution 37 ℃避光孵育1.5 h;2×SSCT 37 ℃洗2次,室温洗1次,每次20 min;PBST洗3次,每次5 min,共聚焦拍照观察。
1.4 统计学分析采用Graphpad 5软件,数据以x±s表示,不同时间点各组的存活率使用双因素方差分析结合Turkey检验;多组间均数比较采用单因素方差分析结合Turkey检验。检验水准:α=0.05。
2 结果 2.1 不同浓度DMSO对斑马鱼存活率、孵化率的影响重复实验取平均值,0~24 hpf,DMSO浓度≥2.5%时斑马鱼胚胎存活率明显下降;>24~48 hpf空白对照组胚胎基本可存活,但DMSO浓度≥2.5%时斑马鱼胚胎存活率下降;>48~72 hpf DMSO浓度为2.0%时斑马鱼胚胎存活率下降,3%DMSO浓度组胚胎全部死亡。使用双因素方差分析,与空白对照组比较,72 hpf时实验组浓度为2.5%时,斑马鱼胚胎死亡率明显增加(P < 0.01, n=30)。表明DMSO浓度≥2.5%会增加72 hpf内斑马鱼胚胎的死亡率。见表 1。
| 组别 | 0~24 hpf | >24~48 hpf | >48~72 hpf |
| 空白对照组 | 65.6±1.6 | 99.0±1.1 | 96.6±2.4 |
| 0.1%DMSO组 | 61.1±5.7 | 99.2±1.4 | 96.1±2.8 |
| 0.5%DMSO组 | 58.9±6.9 | 98.4±1.7 | 96.5±2.5 |
| 1.0%DMSO组 | 61.1±6.9 | 98.8±1.5 | 95.8±5.9 |
| 1.5%DMSO组 | 58.9±6.9 | 98.8±1.9 | 93.7±5.5 |
| 2.0%DMSO组 | 55.5±8.8 | 97.4±3.6 | 71.8±10.3b |
| 2.5%DMSO组 | 28.9±4.2a | 66.0±4.7a | 41.1±6.9a |
| 3.0%DMSO组 | 12.2±4.2a | 53.3±4.7a | 0a |
| a:P < 0.01,b:P < 0.05,与空白对照组比较 | |||
正常胚胎在>48~72 hpf完成孵化。72 hpf时,空白对照组斑马鱼胚胎孵化率(96.6±2.4)%;2.0%DMSO组斑马鱼孵化率(74.6±6.8)%,与空白对照组比较差异具有统计学意义(P < 0.05,n=30),说明DMSO浓度≥2.0%会影响胚胎的孵化率,这可能与斑马鱼胚胎畸形、出膜动力降低有关。
2.2 不同浓度的DMSO对斑马鱼畸形的影响实验记录了斑马鱼胚胎发育至24、48、72 hpf时的发育情况;胚胎发育至24 hpf,3.0%DMSO浓度组及48、72 hpf时,2.0%浓度组均出现脊柱畸形。斑马鱼胚胎发育明显滞后:卵黄较大、吸收缓慢、头部伸直延迟。3.0%DMSO组出现明显心包水肿。72 hpf时,空白对照组畸形率为(1.85±2.62)%,1.5%DMSO组畸形率(6.00±1.12)%,与空白对照组比较差异没有统计学意义。2.0%DMSO组畸形率(48.70±4.34)%,与空白对照组比较差异有统计学意义(P < 0.01),2.5%DMSO组畸形率达100%。说明当DMSO浓度达2.0%时斑马鱼胚胎畸形率升高。见图 1。
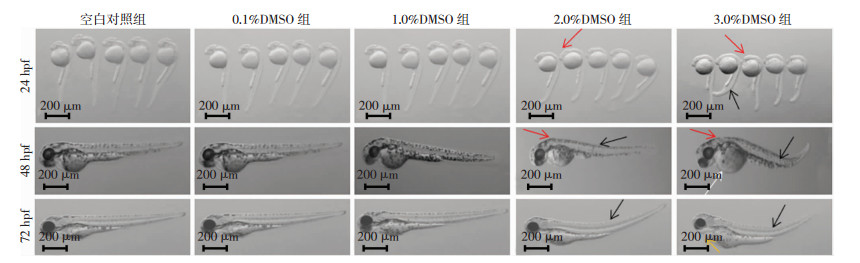
|
| 红色箭头示:头部伸直延迟;黑色箭头示:脊柱弯曲;白色箭头示:卵黄囊较大;黄色箭头示:心包水肿 图 1 受精后不同时间各组斑马鱼胚胎发育形态学观察 |
2.3 不同浓度DMSO对斑马鱼运动行为的影响
24 hpf时观察斑马鱼胚胎的尾部摆动次数,当DMSO浓度>0.5%时可观察到胚胎一过性的爆发运动,空白对照组没有这种行为,与空白对照组比较,差异无统计学意义。当DMSO浓度>2.5%时,胚胎尾部摆动次数明显减少,与空白对照组比较差异有统计学意义(P < 0.05,n=7)。见图 2。
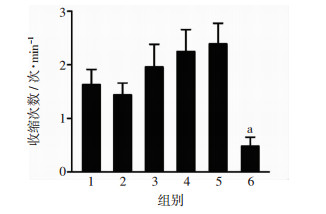
|
| 1:空白对照组;2~6分别为:0.1%、0.5%、1.0%、2.0%、2.5%DMSO组;a:P < 0.01,与空白对照组比较 图 2 不同浓度DMSO对各组斑马鱼胚胎运动行为的影响(n=7,x±s) |
2.4 不同浓度DMSO对斑马鱼间脑DA神经元的影响
当WT型及Tg(Vmat2:GFP)转基因斑马鱼发育到72 hpf,分别使用激光共聚焦显微镜观察胚胎间脑DA神经元发育的情况。斑马鱼间脑相当于哺乳动物的“黑质区”,可观察到大量的DA神经元。当DMSO浓度为0.5%、0.8%时,间脑部位的TH荧光减弱、数量减少(P < 0.05);同样,0.5%、0.8%DMSO浓度组的Vmat2荧光减少更明显(P < 0.01)。说明DA神经元对DMSO敏感的浓度较低,0.5%DMSO可导致间脑DA神经元明显减少。见图 3。
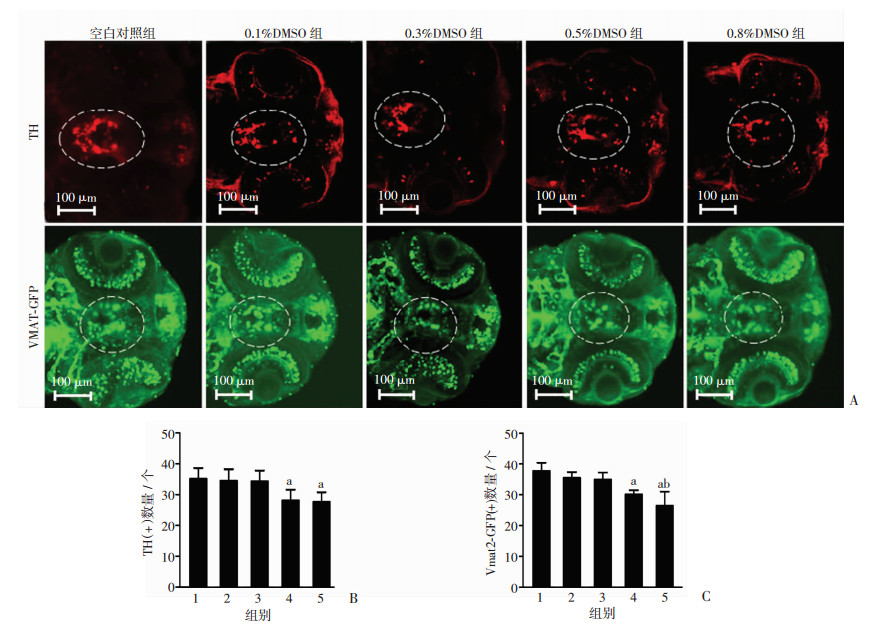
|
| A:免疫荧光检测结果虚线框示间脑区;B:各组TH(+)数量统计(n=5,x±s);C:各组Vmat2(+)数量统计(n=5,x±s) 1:空白对照组;2~5:分别为0.1%, 0.3%, 0.5%, 0.8% DMSO组;a:P < 0.01,与空白对照组比较;b:P < 0.01,与0.3%DMSO组比较 图 3 激光共聚焦显微镜观察各组斑马鱼间脑多巴胺能神经元数量 |
2.5 不同浓度DMSO对斑马鱼间脑细胞增殖的影响
当DMSO浓度>0.3%时,72 hpf间脑细胞增殖受到抑制(P < 0.05,图 4、5),当DMSO浓度增大时,间脑细胞增殖受影响越大(P < 0.01)。0.8%DMSO与0.3%DMSO比较,间脑细胞增殖明显减少(P < 0.05),说明间脑DA神经元增殖在DMSO浓度为0.3%即受到影响。低浓度DMSO(0.5%)影响间脑DA神经元的数量,可能是通过调控间脑细胞增殖影响间脑DA神经元发育。

|
| 1:空白对照组;2:0.1%DMSO;3:0.3%DMSO;4:0.5%DMSO;5:0.8%DMSO;a:P < 0.05,b:P < 0.01,与空白对照组比较;c:P < 0.05,与0.3%DMSO组比较 图 4 不同浓度DMSO对各组斑马鱼间脑细胞增殖的影响(n=5,x±s) |

|
| 虚线框内显示间脑区 图 5 激光共聚焦显微镜观察72 hpf时各组斑马鱼间脑多巴胺神经元增殖 |
2.6 不同浓度DMSO对斑马鱼间脑腹侧DA神经元凋亡的影响
为了分析DMSO处理后,间脑运动神经元发育缺陷是否由细胞凋亡导致,在胚胎发育至72 hpf时,使用TUNEL染色法检测间脑细胞凋亡情况。结果显示,72 hpf时,当DMSO浓度>0.3%时,斑马鱼端脑前部或眼球周围即会出现少许凋亡,随着浓度增高,凋亡增多,DMSO浓度为0.8%时,可见间脑区域出现少许凋亡(图 6),靠近底板区、端脑及后脑凋亡明显增加。这可能与不同部位的组织暴露浓度及其敏感性不同相关。
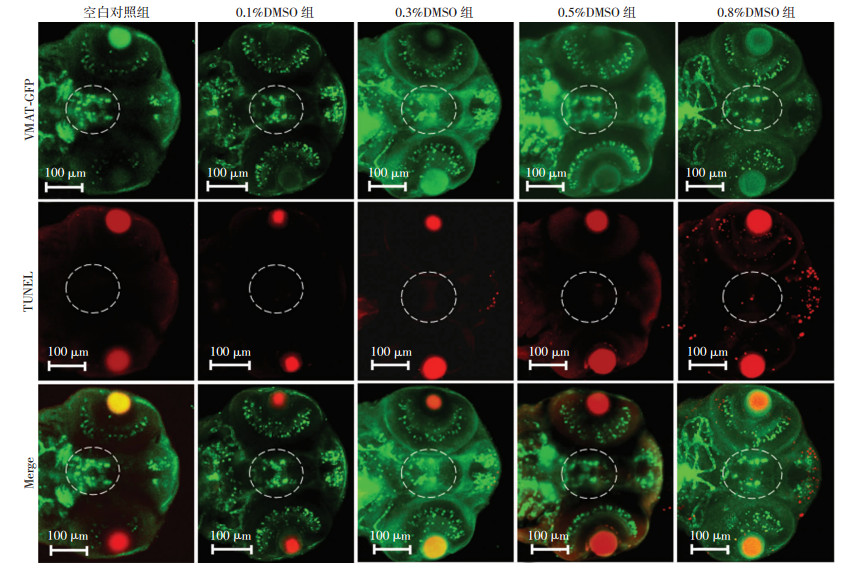
|
| 虚线框示多巴胺神经元凋亡 图 6 激光共聚焦显微镜观察72 hpf时各组斑马鱼间脑多巴胺神经元凋亡情况 |
3 讨论
近年来斑马鱼被广泛用于人类疾病模型及药物筛选、毒理学与环境检测中[8],实验中的疏水性毒物和药物等化学试剂大多数是低水溶性,而DMSO作为“万能溶剂”在这些实验中应用较广。在实验过程中,为避免DMSO对斑马鱼神经系统的影响,需要弄清楚DMSO的安全使用浓度。不同浓度的DMSO发挥不同的作用,包括抗炎[9]、抗氧化[10]、神经保护[11]及促进坏死/凋亡[12]。DMSO可通过调节前凋亡细胞应激反应来延长原代肝细胞的存活[13]。任何药物的毒性都取决于其浓度,DMSO浓度在1%或5%以上可能通过破坏细胞膜导致细胞死亡;而浓度较低时,抗氧化和其他有益的作用可能占主导地位,但其安全浓度是多少仍不清楚。有报道指出斑马鱼胚胎在2%DMSO浓度下未观察到溶剂暴露后的孵化延迟[14]。有研究提出DMSO浓度为0.005%~0.1%时有利于肝细胞增殖,浓度≥0.5%时细胞增殖数目减少。作者推测可能是通过诱导自噬减少肝细胞脂质的累积,从而影响细胞增殖[15]。
仓鼠卵巢细胞DMSO的阈值剂量为0.5%[16];绒毛膜乳头内皮细胞的阈值剂量为1.0%[17];胚胎干细胞的阈值剂量为0.1%[18]。2009年HANSLICK等[19]首次发现DMSO在0.3 mL/kg低剂量下,小鼠大脑发育过程中即产生广泛的凋亡; 同时体外培养的大鼠海马细胞在0.5%DMSO浓度下神经元出现丢失。对于体外培养的神经元,0.5%的DMSO会显著破坏神经形态,降低生存能力,0.5%的DMSO可诱导星形胶质细胞反应性增生[20]。在此研究中,明确了斑马鱼胚胎在0.5%DMSO浓度下暴露3 d,可导致斑马鱼间脑DA数量明显减少,细胞增殖明显减少。0.8%DMSO会导致斑马鱼间脑细胞凋亡增多。
综上所述,本研究通过分析不同浓度梯度的DMSO对斑马鱼胚胎发育及间脑多巴胺神经元数量的影响,提出DMSO在斑马鱼胚胎上的安全使用浓度:在研究药物对死亡率、孵化率、畸形率的影响时,DMSO的最大推荐浓度是2.0%;研究斑马鱼DA神经元数目、细胞增殖时推荐DMSO最大浓度是0.3%,以及DMSO浓度在0.8%时间脑细胞出现凋亡。但DMSO对行为学及认知方面的影响还需要进一步研究,以完善DMSO对斑马鱼综合的影响。
| [1] |
KAIS B, SCHNEIDER K E, KEITER S, et al. DMSO modifies the permeability of the zebrafish (Danio rerio) chorion-implications for the fish embryo test (FET)[J]. Aquat Toxicol, 2013, 140/141: 229-238. DOI:10.1016/j.aquatox.2013.05.022 |
| [2] |
HUTCHINSON T H, SHILLABEER N, WINTER M J, et al. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review[J]. Aquat Toxicol, 2006, 76(1): 69-92. DOI:10.1016/j.aquatox.2005.09.008 |
| [3] |
BURUGULA B, GANESH B S, CHINTALA S K. Curcumin attenuates staurosporine-mediated death of retinal ganglion cells[J]. Invest Ophthalmol Vis Sci, 2011, 52(7): 4263-4273. DOI:10.1167/iovs.10-7103 |
| [4] |
NOTMAN R, NORO M, O'MALLEY B, et al. Molecular basis for dimethylsulfoxide (DMSO) action on lipid membranes[J]. J Am Chem Soc, 2006, 128(43): 13982-13983. DOI:10.1021/ja063363t |
| [5] |
GALVAO J, DAVIS B, TILLEY M, et al. Unexpected low-dose toxicity of the universal solvent DMSO[J]. FASEB J, 2014, 28(3): 1317-1330. DOI:10.1096/fj.13-235440 |
| [6] |
AITA K, IRIE H, TANUMA Y, et al. Apoptosis in murine lymphoid organs following intraperitoneal administration of dimethyl sulfoxide (DMSO)[J]. Exp Mol Pathol, 2005, 79(3): 265-271. DOI:10.1016/j.yexmp.2005.07.001 |
| [7] |
QI W D, DING D L, SALVI R J. Cytotoxic effects of dimethyl sulphoxide (DMSO) on cochlear organotypic cultures[J]. Hear Res, 2008, 236(1/2): 52-60. DOI:10.1016/j.heares.2007.12.002 |
| [8] |
SHI J T, ZHENG T T, LI H. Experimental methods and detection indexes of model animal zebrafish in environmental toxicology[J]. Public Health Capital, 2017(1): 42-44. |
| [9] |
CAPRIOTTI K, CAPRIOTTI J A. Dimethyl sulfoxide: history, chemistry, and clinical utility in dermatology[J]. J Clin Aesthet Dermatol, 2012, 5(9): 24-26. |
| [10] |
DI GIORGIO A M, HOU Y J, ZHAO X R, et al. Dimethyl sulfoxide provides neuroprotection in a traumatic brain injury model[J]. Restor Neurol Neurosci, 2008, 26(6): 501-507. |
| [11] |
YUAN C, GAO J Y, GUO J C, et al. Dimethyl sulfoxide damages mitochondrial integrity and membrane potential in cultured astrocytes[J]. PLoS ONE, 2014, 9(9): e107447. DOI:10.1371/journal.pone.0107447 |
| [12] |
DE MÉNORVAL M A, MIR L M, FERNÁNDEZ M L, et al. Effects of dimethyl sulfoxide in cholesterol-containing lipid membranes: A comparative study of experiments in silico and with cells[J]. PLoS ONE, 2012, 7(7): e41733. DOI:10.1371/journal.pone.0041733 |
| [13] |
BANIČ B, NIPIČ D, SUPUT D, et al. DMSO modulates the pathway of apoptosis triggering[J]. Cell Mol Biol Lett, 2011, 16(2): 328-341. DOI:10.2478/s11658-011-0007-y |
| [14] |
HUANG Y S, CARTLIDGE R, WALPITAGAMA M, et al. Unsuitable use of DMSO for assessing behavioral endpoints in aquatic model species[J]. Sci Total Environ, 2018, 615: 107-114. DOI:10.1016/j.scitotenv.2017.09.260 |
| [15] |
SONG Y M, SONG S O, JUNG Y K, et al. Dimethyl sulfoxide reduces hepatocellular lipid accumulation through autophagy induction[J]. Autophagy, 2012, 8(7): 1085-1097. DOI:10.4161/auto.20260 |
| [16] |
LIU C H, CHEN L H. Promotion of recombinant macrophage colony stimulating factor production by dimethyl sulfoxide addition in Chinese hamster ovary cells[J]. J Biosci Bioeng, 2007, 103(1): 45-49. DOI:10.1263/jbb.103.45 |
| [17] |
ETER N, SPITZNAS M. DMSO mimics inhibitory effect of thalidomide on choriocapillary endothelial cell proliferation in culture[J]. Br J Ophthalmol, 2002, 86(11): 1303-1305. DOI:10.1136/bjo.86.11.1303 |
| [18] |
ADLER S, PELLIZZER C, PAPARELLA M, et al. The effects of solvents on embryonic stem cell differentiation[J]. Toxicol In Vitro, 2006, 20(3): 265-271. DOI:10.1016/j.tiv.2005.06.043 |
| [19] |
HANSLICK J L, LAU K, NOGUCHI K K, et al. Dimethyl sulfoxide (DMSO) produces widespread apoptosis in the developing central nervous system[J]. Neurobiol Dis, 2009, 34(1): 1-10. DOI:10.1016/j.nbd.2008.11.006 |
| [20] |
ZHANG C, DENG Y Y, DAI H M, et al. Effects of dimethyl sulfoxide on the morphology and viability of primary cultured neurons and astrocytes[J]. Brain Res Bull, 2017, 128: 34-39. DOI:10.1016/j.brainresbull.2016.11.004 |



