2. 100048 北京,解放军总医院第六医学中心
2. Sixth Medical Center, Chinese PLA General Hospital, Beijing, 100048, China
宫颈癌是最常见的妇科恶性肿瘤,每年有超过50万患者被诊断为宫颈癌,高发于40岁以上女性,近年来其发病有年轻化的趋势[1]。化疗目前是治疗宫颈癌的重要手段,但化疗不敏感与耐药仍是临床上宫颈癌治疗效果不佳的重要原因[2]。多柔比星是1969年从松链丝菌浅灰色变株中提取分离到的蒽环类抗生素,具有很强的抗癌活性,化疗指数较高,是目前临床上主要的抗肿瘤药物之一[3]。然而随着多柔比星的反复使用,肿瘤细胞(包括宫颈癌细胞)对它的耐药性也越来越强[4]。但目前宫颈癌细胞对多柔比星耐药的机制尚不清楚。
自噬(autophagy)是细胞维持自我稳态的一种重要机制,通过降解、回收细胞内受损的细胞器与蛋白质等成分来保证细胞内环境稳定并促进细胞存活[5]。当细胞面临生存压力(如化疗药物、放射线、细菌或病毒感染等)时,细胞内自噬水平增加,从而增强细胞抗压能力,促进细胞存活,对细胞起保护作用,被称为保护性自噬[6]。研究表明,保护性自噬是导致肿瘤细胞耐药的重要机制[7]。宫颈癌细胞是否通过诱导保护性自噬对多柔比星耐药尚不清楚。因此,本研究以宫颈癌HeLa细胞为模型,探讨保护性自噬在其耐受多柔比星中的作用及可能机制。
1 材料与方法 1.1 细胞株及培养人宫颈癌细胞HeLa购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。细胞培养基为含10%胎牛血清,100 μg/mL链霉素,100 U/mL青霉素的DMEM,于37 ℃、5% CO2条件下静置培养。
1.2 药品及试剂多柔比星购自Sigma公司,DMEM培养基、胎牛血清购自HyClone公司,胰蛋白酶购自Invitrogen公司,蛋白定量试剂盒购自碧云天公司,蛋白分子量标准购自中杉公司,定量PCR试剂盒购自TaKaRa公司,双荧光素酶报告基因检测试剂盒购自Promega公司,GAPDH、Beclin1、ATG4B、LC3、SQSTM1抗体购自Cell Signaling公司,PVDF膜购自Bio-Rad公司。
1.3 细胞处理将HeLa细胞按2×105/孔接种在6孔板中,待长至融合度约80%时,用不同剂量的DOX(终浓度分别为0、2、4、8、16 mg/L)处理细胞,处理24 h后进行分析。
1.4 定量PCR分析待处理结束后,离心收集细胞,TRIzol法提取总RNA,把mRNA反转录为cDNA,再使用SYBR法进行定量PCR测定,结果用2-ΔΔCt法分析。
1.5 Western blot检测待处理结束后,离心收集细胞,用RIPA裂解液将细胞在冰上裂解后离心收集上清,用BCA法测定蛋白含量后将样品标准化。SDS-PAGE电泳上样量为每孔50 μg总蛋白,恒压电泳。待电泳结束后,将蛋白用半干转法从凝胶转移到PVDF膜上,用5%脱脂奶粉室温封闭2 h,然后与第一抗体(1 :1 000稀释)4 ℃孵育过夜,经PBST洗膜3次后,与第二抗体(1 :10 000稀释)室温孵育1 h,洗膜后用ECL发光试剂盒进行显影并采集图像,用Image J软件分析蛋白条带灰度值。
1.6 双荧光素酶报告基因实验根据Beclin1启动子-2 000~-1序列设计引物,PCR扩增后将其插入pGL3-basic报告基因载体中,经酶切、测序鉴定正确后命名为pGL3-Beclin1。将细胞接种在48孔板,长至70%左右时把pGL3-Beclin1报告质粒pRL-TK内参照质粒用脂质体法共转染至细胞中,同时以pGL3-basic空载体和pRL-TK共转染的细胞作为对照组。转染后12 h用DOX处理,36 h后用1×PLB冰上裂解细胞20 min,然后离心收集上清。每20 μL上清加入50 μL虫荧光素酶底物溶液混匀,先检测虫荧光素酶活性,测完加入50 μL反应终止液,再继续测海肾荧光素酶活性。用虫荧光素酶活性与海肾荧光素酶活性的相对比值将各组量化后作图。
1.7 mRNA稳定性实验将细胞接种在48孔板,长至70%左右时分别加入终浓度为5 μg/mL的转录抑制剂放线菌素D(actinomycin D, Act D)、终浓度为4 mg/L的DOX或两者联合加入,每组设置3个复孔。分别于加药前(0 h)、加药后2、4、6、8 h收取细胞,提取总RNA,逆转录后按前述方法经定量PCR分析细胞中mRNA含量变化。
1.8 统计学分析采用Graphpad prism 6.0软件分析,数据以x ± s表示,细胞增殖实验结果采用t检验,定量PCR与Western blot结果采用单因素方差分析,P < 0.05表示差异具有统计学意义。
2 结果 2.1 DOX以剂量依赖性的方式抑制HeLa细胞增殖用不同浓度(0、2、4、8、16 mg/L)的DOX处理HeLa细胞,24 h后CCK-8法测定细胞活力见图 1,DOX以剂量依赖性的方式抑制HeLa细胞增殖(P < 0.05)。
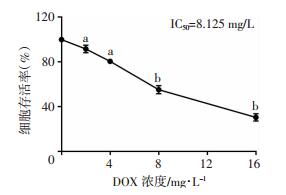
|
| a: P < 0.05,b: P < 0.01,与0 mg/L DOX处理组比较 图 1 DOX剂量依赖性抑制HeLa细胞增殖 |
2.2 DOX增强HeLa细胞的自噬水平
分别用2、4 mg/L的DOX处理细胞,检测自噬标志蛋白LC3-Ⅱ和SQSTM1的表达。可见DOX明显增强LC3-Ⅱ的表达,降低SQSTM1的表达(P < 0.05,图 2)。
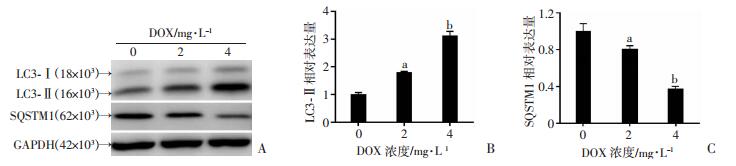
|
| A:Western blot检测结果;B、C:分别为LC3-Ⅱ和SQSTM1表达半定量分析结果a: P < 0.05,b: P < 0.01,与0 mg/L DOX处理组比较 图 2 DOX增强HeLa细胞的自噬水平 |
2.3 抑制自噬增强DOX对HeLa细胞的增殖抑制效应
用自噬抑制剂氯喹(CQ)与DOX联合处理细胞后,LC3-Ⅱ和SQSTM1的表达升高(图 3A),同时,抑制自噬显著增强DOX对HeLa细胞的增殖抑制效应(图 3B)。
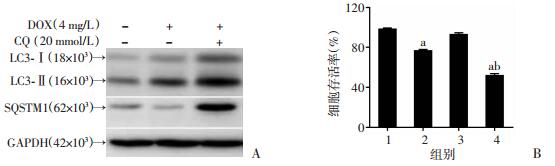
|
| A:Western blot检测细胞中自噬标志蛋白水平;B:不同处理对细胞存活率的影响1:对照组;2:4 mg/L DOX处理组;3:20 mmol/L CQ处理组;4:4 mg/L DOX联合20 mmol/L CQ处理组;a: P < 0.05,与对照组比较;b: P < 0.05,与4 mg/L DOX处理组比较 图 3 抑制自噬增强DOX对HeLa细胞的增殖抑制 |
2.4 DOX上调HeLa细胞中自噬关键蛋白Beclin1的表达
分别用2、4 mg/L的DOX处理细胞24 h后,用定量PCR检测自噬相关基因表达变化,发现DOX处理后可显著上调HeLa细胞中Beclin1的mRNA水平(图 4A),同时Beclin1蛋白水平也明显增强(P < 0.05,图 4B)。
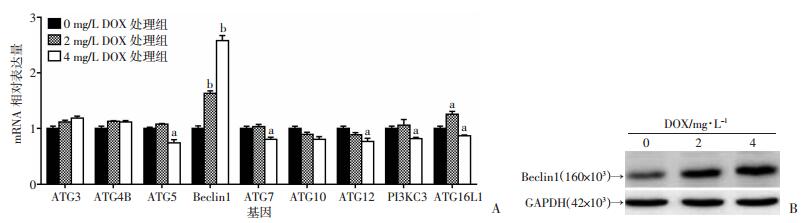
|
| A:定量PCR测定自噬相关基因mRNA表达变化a: P < 0.05,b: P < 0.01,与0 mg/L DOX处理组比较;B:Western blot检测Beclin1蛋白水平变化 图 4 DOX上调HeLa细胞中自噬关键蛋白Beclin1的表达 |
2.5 下调Beclin1增强DOX对HeLa细胞的增殖抑制效应
用siRNA沉默HeLa细胞中Beclin1的表达后,在抑制细胞自噬的同时,DOX对HeLa细胞的增殖抑制效应也显著增强(图 5)。
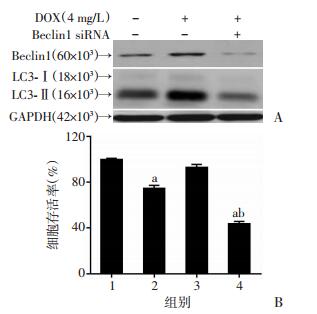
|
| A:Western blot分析细胞中蛋白水平;B:不同处理对细胞存活率的影响1:对照组;2:4 mg/L DOX处理组;3:Beclin1 siRNA处理组;4:4 mg/L DOX联合Beclin1 siRNA处理组;a: P < 0.05,与对照组比较;b: P < 0.01,与4 mg/L DOX处理组比较 图 5 下调Beclin1增强DOX对HeLa细胞的增殖抑制效应 |
2.6 DOX不能增强HeLa细胞中Beclin1启动子活性
将Beclin1基因启动子片段插入pGL3-basic载体中,转染HeLa细胞后用DOX处理,双荧光素酶报告基因系统检测结果发现DOX处理并不能增强Beclin1启动子活性(图 6)。

|
| 图 6 DOX不能增强HeLa细胞中Beclin1启动子活性 |
2.7 DOX可增强Beclin1 mRNA的稳定性
用放线菌素D(Act D)抑制基因转录的同时,用DOX处理细胞,然后在不同时间点定量PCR测定Beclin1 mRNA水平变化,发现DOX处理可显著增强Beclin1 mRNA的稳定性(P < 0.01,图 7)。

|
| a: P < 0.01,与Act D比较 图 7 DOX可增强Beclin1 mRNA的稳定性 |
3 讨论
多柔比星既是抗生素,也是一种细胞周期非特异性抗肿瘤药物,可以有效抑制肿瘤细胞的DNA合成,是目前临床治疗肿瘤的一线化疗用药[4]。研究表明,多柔比星联合顺铂对宫颈癌具有良好的治疗效果,可有效增加患者体内HeLa细胞中促凋亡蛋白FHIT、Bax的表达,抑制促增殖蛋白Ki67的表达,提高患者生存率[8]。但在宫颈癌的临床治疗中,DOX常作为辅助化疗药物使用,单独使用DOX的效果并不好[9]。究其原因,主要是因为宫颈癌细胞对DOX不是很敏感,而且很容易引起药物耐受[10]。本研究结果也表明,DOX可以抑制宫颈癌细胞的增殖,但其半数有效抑制浓度大于8.215 mg/L,远高于其临床血药浓度,说明HeLa细胞对DOX耐受。尽管发现了一些导致宫颈癌细胞对DOX耐受的原因,如Wnt信号通路的改变可引起宫颈癌细胞对DOX耐受[11],乳酸受体HCAR1/GPR81也可通过上调转运体ABCB1而促进耐药[12],RAS的过度激活也是导致宫颈癌细胞对DOX耐受的原因[13]等,而使用唑来膦酸抑制RAS的过度激活可以增强宫颈癌细胞对DOX的敏感性[13],TAK1的抑制剂5Z-7-oxozeaenol和蛋白酶体抑制剂CEP-18770也可以在宫颈癌细胞中增敏DOX[14-15],使用新型纳米载体增加DOX的摄入和靶向性同样可以增强宫颈癌细胞对DOX的敏感性[16]。但保护性自噬是否与宫颈癌细胞耐受DOX有关,使用自噬抑制剂能否在宫颈癌细胞中增敏DOX尚未见报道。
自噬是真核细胞所特有的分解代谢过程,主要参与细胞内物质的降解和再利用。自噬过程中,细胞通过自噬小体把胞内受损的细胞器、蛋白质等送入溶酶体进行降解,并通过回收降解产物为细胞提供能量供应,从而起到促细胞存活的作用。因此,自噬已成为肿瘤细胞抵抗化疗的重要机制[7]。研究发现,DOX的同类药物盐酸吡柔吡星可以在宫颈癌、肝癌、膀胱癌等细胞中诱导保护性自噬反应[17-18];盐酸表柔吡星可以在前列腺癌、乳腺癌、肺癌、肝癌等细胞中诱导保护性自噬反应[19-20];DOX本身也可以在淋巴瘤、白血病、乳腺癌与卵巢癌细胞中诱导保护性自噬[21-23]。表明DOX及其类似药物在多种肿瘤细胞中诱导了保护性自噬反应,提示保护性自噬可能是引起肿瘤细胞对DOX耐受的普遍机制,而联合使用自噬抑制剂可能是增敏DOX的有效措施。本研究结果也表明,DOX在HeLa细胞中同样诱导了明显的保护性自噬反应,而使用自噬抑制剂氯喹则可以显著增强DOX对HeLa细胞的增殖抑制效应。
在自噬小体的形成过程中,自噬关键蛋白Beclin1发挥着重要作用。Beclin1与PI3KC3等形成复合体,共同促进自噬小体膜的形成与延伸。研究表明,Beclin1基因敲除或基因突变小鼠自噬水平降低,易发多种肿瘤[24]。下调乳腺癌耐药细胞中Beclin1的表达则可增强耐药细胞对紫杉醇的敏感性[25]。为探寻DOX处理后HeLa细胞中保护性自噬水平增强的原因,本研究先用定量PCR技术筛选mRNA水平发生变化的自噬相关基因,发现在DOX处理后HeLa细胞中Beclin1的mRNA水平升高最为明显,且在蛋白水平也得到了验证,从而推测Beclin1的表达升高是导致HeLa细胞中保护性自噬水平增强的关键因素。进一步的基因沉默实验证实,敲低Beclin1可显著增强DOX对HeLa细胞的增殖抑制效应,从而证实了这一推测。
由于一个基因mRNA水平的升高既可是转录活性增强所致,也可能是由于其稳定性增加所致。因此,本研究继续检测DOX处理后Beclin1启动子活性与其mRNA稳定性。结果发现,DOX处理并不能增强Beclin1的启动子活性,却能大大提高其mRNA的稳定性,进一步证实DOX可以通过增强Beclin1的mRNA稳定性而增强其表达。由于导致mRNA稳定性增强的原因较多,如RNA酶水平降低、RNA结合蛋白水平改变以及microRNA水平改变等[26],具体机制尚需进一步研究。
总之,DOX可以剂量依赖性的方式抑制宫颈癌HeLa细胞增殖。同时,DOX在HeLa细胞中通过增强Beclin1 mRNA的稳定性而诱导细胞的保护性自噬反应,抑制自噬可能显著增强DOX对HeLa细胞的增殖抑制效应,从而为提高DOX对宫颈癌的治疗效果提供了理论与实验依据。
| [1] | BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394–424. DOI:10.3322/caac.21492 |
| [2] | COHEN P A, JHINGRAN A, OAKNIN A, et al. Cervical cancer[J]. Lancet, 2019, 393(10167): 169–182. DOI:10.1016/S0140-6736(18)32470-X |
| [3] | RIVANKAR S. An overview of doxorubicin formulations in cancer therapy[J]. J Cancer Res Ther, 2014, 10(4): 853–858. DOI:10.4103/0973-1482.139267 |
| [4] | MOHAJERI M, SAHEBKAR A. Protective effects of curcumin against doxorubicin-induced toxicity and resistance: A review[J]. Crit Rev Oncol Hematol, 2018, 122: 30–51. DOI:10.1016/j.critrevonc.2017.12.005 |
| [5] | SAHA S, PANIGRAHI D P, PATIL S, et al. Autophagy in health and disease: A comprehensive review[J]. Biomed Pharmacother, 2018, 104: 485–495. DOI:10.1016/j.biopha.2018.05.007 |
| [6] | PRIETO-DOMÍNGUEZ N, GARCIA-MEDIAVILLA M V, SANCHEZ-CAMPOS S, et al. Autophagy as a molecular target of flavonoids underlying their protective effects in human disease[J]. Curr Med Chem, 2018, 25(7): 814–838. DOI:10.2174/0929867324666170918125155 |
| [7] | TAYLOR M A, DAS B C, RAY S K. Targeting autophagy for combating chemoresistance and radioresistance in glioblastoma[J]. Apoptosis, 2018, 23(11/12): 563–575. DOI:10.1007/s10495-018-1480-9 |
| [8] | YUNIARTI L, MUSTOFA M, ARYANDONO T, et al. Synergistic action of 1, 2-epoxy-3 (3- (3, 4-dimethoxyphenyl)- 4H-1-benzopiyran-4-on) propane with doxorubicin and cisplatin through increasing of p53, TIMP-3, and microRNA-34a in cervical cancer cell line (HeLa)[J]. Asian Pac J Cancer Prev, 2018, 19(10): 2955–2962. DOI:10.22034/APJCP.2018.19.10.2955 |
| [9] | XIA Y, XU T, ZHAO M, et al. Delivery of doxorubicin for human cervical carcinoma targeting therapy by folic acid-modified selenium nanoparticles[J]. Int J Mol Sci, 2018, 19(11): E3582. DOI:10.3390/ijms19113582 |
| [10] | QIU F, ZHAO X. Study on the sensitivity of primary tumor cells of patients with cervical cancer to chemotherapeutic combinations[J]. J BUON, 2018, 23(1): 117–123. |
| [11] | MUTLU P, YALÇIN AZARKAN S, TAGHAVI POURIANAZAR N, et al. Determination of the relationship between doxorubicin resistance and Wnt signaling pathway in HeLa and K562 cell lines[J]. EXCLI J, 2018, 17: 386–398. DOI:10.17179/excli2018-1129 |
| [12] | WAGNER W, KANIA K D, BLAUZ A, et al. The lactate receptor (HCAR1/GPR81) contributes to doxorubicin chemoresistance via ABCB1 transporter up-regulation in human cervical cancer HeLa cells[J]. J Physiol Pharmacol, 2017, 68(4): 555–564. |
| [13] | XU J, PAN Q, JU W. Ras inhibition by zoledronic acid effectively sensitizes cervical cancer to chemotherapy[J]. Anticancer Drugs, 2019. DOI:10.1097/CAD.0000000000000779 |
| [14] | GUAN S, LU J X, ZHAO Y L, et al. TAK1 inhibitor 5Z-7-oxozeaenol sensitizes cervical cancer to doxorubicin-induced apoptosis[J]. Oncotarget, 2017, 8(20): 33666–33675. DOI:10.18632/oncotarget.16895 |
| [15] | GUO K Y, HAN L L, LI X Y, et al. Novel proteasome inhibitor delanzomib sensitizes cervical cancer cells to doxorubicin-induced apoptosis via stabilizing tumor suppressor proteins in the p53 pathway[J]. Oncotarget, 2017, 8(69): 114123–114135. DOI:10.18632/oncotarget.23166 |
| [16] | DAGLIOGLU C, KACI F N. Cascade therapy with doxorubicin and survivin-targeted tailored nanoparticles: An effective alternative for sensitization of cancer cells to chemotherapy[J]. Int J Pharm, 2019, 561: 74–81. DOI:10.1016/j.ijpharm.2019.02.036 |
| [17] | WU Y R, NI Z H, YAN X J, et al. Targeting the MIR34C-5p-ATG4B-autophagy axis enhances the sensitivity of cervical cancer cells to pirarubicin[J]. Autophagy, 2016, 12(7): 1105–1117. DOI:10.1080/15548627.2016.1173798 |
| [18] | XIONG H, NI Z, HE J, et al. LncRNA HULC triggers autophagy via stabilizing Sirt1 and attenuates the chemosensitivity of HCC cells[J]. Oncogene, 2017, 36(25): 3528–3540. DOI:10.1038/onc.2016.521 |
| [19] | KRANZBÜHLER B, SALEMI S, MORTEZAVI A, et al. Combined N-terminal androgen receptor and autophagy inhibition increases the antitumor effect in enzalutamide sensitive and enzalutamide resistant prostate cancer cells[J]. Prostate, 2019, 79(2): 206–214. DOI:10.1002/pros.23725 |
| [20] | SUN W L, WANG L, LUO J, et al. Ambra1 modulates the sensitivity of breast cancer cells to epirubicin by regulating autophagy via ATG12[J]. Cancer Sci, 2018, 109(10): 3129–3138. DOI:10.1111/cas.13743 |
| [21] | ZHANG N, WU Y R, LYU X L, et al. HSF1 upregulates ATG4B expression and enhances epirubicin-induced protective autophagy in hepatocellular carcinoma cells[J]. Cancer Lett, 2017, 409: 81–90. DOI:10.1016/j.canlet.2017.08.039 |
| [22] | CHEN C, LU L, YAN S C, et al. Autophagy and doxorubicin resistance in cancer[J]. Anticancer Drugs, 2018, 29(1): 1–9. DOI:10.1097/CAD.0000000000000572 |
| [23] | FERNANDES Â, AZEVEDO M M, PEREIRA O, et al. Proteolytic systems and AMP-activated protein kinase are critical targets of acute myeloid leukemia therapeutic approaches[J]. Oncotarget, 2015, 6(31): 31428–31440. DOI:10.18632/oncotarget.2947 |
| [24] | DI FAZIO P, MATROOD S. Targeting autophagy in liver cancer[J]. Transl Gastroenterol Hepatol, 2018, 3: 39. DOI:10.21037/tgh.2018.06.09 |
| [25] | WU C L, LIU J F, LIU Y, et al. Beclin1 inhibition enhances paclitaxel-mediated cytotoxicity in breast cancer in vitro and in vivo[J]. Int J Mol Med, 2019, 43(4): 1866–1878. DOI:10.3892/ijmm.2019.4089 |
| [26] | GANDHI M, CAUDRON-HERGER M, DIEDERICHS S. RNA motifs and combinatorial prediction of interactions, stability and localization of noncoding RNAs[J]. Nat Struct Mol Biol, 2018, 25(12): 1070–1076. DOI:10.1038/s41594-018-0155-0 |



