2. 400016重庆,重庆医科大学基础医学院:分子肿瘤研究中心
2. Molecular Medicine and Cancer Research Center, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016, China
糖尿病已经成为重大的公共卫生问题[1]。糖尿病肾病(diabetic nephropathy, DN)是糖尿病患者的严重微血管并发症,约占糖尿病发病人数的1/3,是终末期肾脏病的主要原因[2]。由于DN疾病过程中受到多种遗传及环境因素的调控,一旦发展为终末期肾病,往往比其他肾脏疾病更为棘手,严重影响了糖尿病患者的预后和生存。据报道,慢性肾脏病的病死率增加了26.8%,其中DN是主要病因(69.1%)[3]。DN的发病机制与多种因素密切相关,包括肾小球系膜病变。目前研究发现,DN早期就出现的系膜细胞增殖伴随细胞外基质合成增多,其调控机制与多种细胞因子,miRNAs及蛋白相关,然而,系膜细胞增殖的机制尚未完全阐明。
miRNA是一类在真核生物高度保守的内源性非编码小分子RNA,目前研究发现在多种疾病包括DN的过程中发挥重要作用, 如miR-675抑制前列腺癌转移[4],miR-148a/c参与胃癌转移[5],miR-125b延缓膀胱癌的进展[6],miR-451抑制DN系膜细胞增殖[7]。miR-449a作为miR-34/449家族中新发现的miRNA,有研究报道作为肿瘤抑制因子参与肝癌和前列腺肿瘤的细胞增殖、迁移、分化和凋亡[8-9]。应用生物信息学方法发现:miR-449a的多个靶基因, 包括三结构域蛋白11(tripartite motif containing 11,Trim11)、肿瘤坏死因子受体超家族21(tumor necrosis factor receptor superfamily, member 21,Tnfrsf21)、含有ARID结构域的蛋白质4A(ARID domain-containing protein 4A,Arid4a)、低密度脂蛋白受体A类结构域3(low density lipoprotein receptor class A domain containing 3,Ldlrad3)等。结合课题组前期二代测序结果发现Trim11在DN小鼠肾脏组织中差异表达,本研究拟利用高糖和低糖培养的系膜细胞作为细胞模型,探讨miR-449a是否通过Trim11参与调控DN的系膜细胞增殖。
1 材料与方法 1.1 材料小鼠系膜细胞系(SV40-MES14)保存于本实验室。高糖和低糖DMEM培养基购自美国Gibco公司,冰冻胎牛血清购自上海生工生物工程有限公司。miR-449a mimics,inhibitor和其对照购自上海吉玛基因公司。转染试剂lipofectamine 2000购自Invitrogen公司。TRIzol试剂、RNA逆转录试剂盒及SYBR Green购自日本TaKaRa公司。EdU试剂盒购自广州锐博生物科技公司。RIPA裂解液及10%SDS-PAGE购自上海碧云天生物技术公司,0.45 μm的PVDF膜及ECL显影液购自美国Millipore公司。研究中使用的一抗如下:Trim11抗体(1 :500),购自武汉三鹰生物科技公司,GAPDH抗体(1 : 5 000)购自美国Abcam公司。
1.2 方法 1.2.1 生物信息学预测利用生物信息学在线软件RAIDv2.0(http://www.rna-society.org/raid/)、TargetScan(http://www.targetscan.org/mmu_71/)和RNAv22(https://cm.jefferson.edu/rna22/Interactive/)预测miR-449a的潜在靶基因及结合位点。
1.2.2 细胞培养系膜细胞使用含有15%胎牛血清的DMEM培养基,在5%CO2、37 ℃的环境中培养。将细胞分为两组,高糖组细胞用含有25 mmol/L葡萄糖的DMEM培养基培养,低糖组细胞用含有5.5 mmol/L葡萄糖和19.5 mmol/L甘露醇的DMEM培养基培养[10]。高糖条件模拟糖尿病环境,而低葡萄糖条件模拟正常生长状态。
1.2.3 miR-449a mimics及inhibitor的转染将低糖组细胞分为3组,转染miR-449a inhibitor的细胞命名为低糖inhibitor组,转染miRNA inhibitor阴性对照的细胞命名为低糖对照组,未经处理被命名为低糖空白组。此外,将高糖组分为3组,转染miR-449a mimics的细胞命名为高糖mimics组,转染miRNA mimics阴性对照的细胞命名为高糖对照组,未经处理被命名为高糖空白组。后续实验都按此分组。根据说明书,使用lipofectamine 2000试剂将miR-449a mimics或inhibitor转染到细胞中。序列如下:miR-449a mimics:正义链5′-UGGCAGUGUAUUGUUAGCUGGU-3′, 反义链5′-CAGCUAACAAUACACUGCCAUU-3′;mimics NC:正义链5′-UUCUCCGAACGUGUCACGUTT-3′, 反义链5′-ACGUGACACGUUCGGAGAATT-3′;miR-449a inhibitor:5′-ACCAGCUAACAAUACACUGCCA-3′;inhibitor NC:5′-CAGUACUUUUGUGUAGUACAA-3′。
1.2.4 总RNA提取和实时定量PCR使用TRIzol提取细胞总RNA,采用茎环法以及使用逆转录试剂盒逆转录,具体操作严格按说明书进行。茎环法引物:miR-449a: 5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGACCAGCTA-3′; U6:5′-AACGCTTCACGA-ATTTGCGT-3′。以cDNA为模板,配制10 μL PCR反应体系,进行qPCR实验。qPCR引物:mmu-miR-449a:上游5′-ACACTCCAGCTGGGTGGCAGTGTATTGTTA-3′,下游5′-TGGTGTCGTGGAGTCG-3′,产物大小为88 bp;U6:上游5′-CTCGCTTCGGCAGCACA-3′,下游5′-AAC-GCTTCACGAATTTGCGT-3′,产物大小为94 bp。PCR程序如下:95 ℃预变性3 min,95 ℃ 5 s,58 ℃ 34 s,72 ℃ 60 s,40个循环。以U6为内参,使用2-ΔΔCt方法计算相对表达量。所有实验至少进行3次。
1.2.5 双荧光素酶实验为了构建用于双荧光素酶报告载体,野生型Trim11和突变体Trim11(突变的miR-449a结合位点)由上海吉玛基因公司克隆到GP-miRGLO载体中。用lipofectamine 2000将Trim11wt,Trim11 mut,miR-449a mimics或mimics阴性对照转染到HEK 293细胞。根据制造商的说明,细胞转染后48 h,用双荧光素酶报告系统(Promega)检测荧光素酶活性。
1.2.6 Western blot检测RIPA裂解液加入1%PMSF混合,冰上分组提取转染的系膜细胞的总蛋白。在10%SDS-PAGE上分离定量蛋白质,转移到0.45 μm PVDF膜上,并在室温下用5%脱脂牛奶封闭2 h。一抗4 ℃孵育过夜。二抗室温孵育2 h。使用ECL系统检测蛋白质印迹的条带强度,并使用GAPDH抗体作为对照。通过Image Lab软件定量蛋白质条带的灰度值。
1.2.7 细胞增殖实验将转染miR-449a mimics的高糖组或转染inhibitor的低糖组系膜细胞换为50 μmol/L EdU标记的培养基,在37 ℃、5%CO2条件下培养2 h。用4%多聚甲醛固定30 min后,用0.5%Triton X-100渗透细胞并用PBS洗涤3次。随后,加入100 μL DAPI(5 μg/mL)在室温下孵育30 min,然后用PBS洗涤3次。甘油封片后用荧光显微镜采集图像。阳性细胞率为EdU阳性细胞(红色)与总DAPI阳性细胞(蓝色)的百分比。
1.3 统计学分析采用SPSS 22.0统计软件。结果均以x±s表示。使用t检验进行两组比较,单向方差分析与多重比较检验来分析组间差异的显著性。检验水准:α=0.05。
2 结果 2.1 miR-449a在高糖和低糖培养的系膜细胞中的表达RT-qPCR检测结果显示:高糖组miR-449a的相对表达量较低糖组下降[(0.639±0.060) vs (1.000±0.141), P < 0.01]。
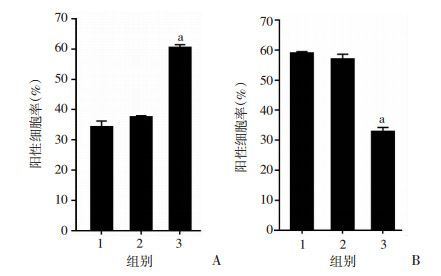
2.2 miR-449a调控系膜细胞增殖的能力在低糖组中转染miR-449a inhibitor抑制miR-449a后,EdU检测系膜细胞增殖效率。结果显示:与空白组比较,转染miR-449a inhibitor的低糖组细胞增殖增加,表明抑制miR-449a对低糖培养的系膜细胞增殖有促进作用(P < 0.01,图 1,图 2A)。

|
| 图 1 EdU检测转染miR-449a inhibitor后低糖组系膜细胞增殖 |
|
| A:转染miR-449a inhibitor后低糖组阳性细胞率1:低糖空白组;2:低糖对照组;3:低糖inhibitor组;a: P < 0.01, 与低糖空白组比较;B:转染miR-449a 1:高糖空白组;2:高糖对照组;3:高糖mimics组;a: P < 0.01, 与高糖空白组比较 图 2 抑制或过表达miR-449a后高糖组或低糖组系膜细胞EdU半定量分析结果 |
高糖组转染miR-449a mimics后,EdU检测系膜细胞增殖效率。结果显示:与空白组比较,转染miR-449a mimics模拟过表达miR-449a后,高糖组细胞增殖减少,表明过表达miR-449a对高糖培养的系膜细胞增殖有抑制作用(P < 0.01, 图 3,图 2B)。

|
| 图 3 EdU检测转染miR-449a mimics后高糖组系膜细胞增殖 |
2.3 Trim11是miR-449a的靶基因
运用生物信息学方法预测miR-449a的潜在靶基因。结果显示:miR-449a有68个潜在靶基因,包括Trim11、Tnfrsf21、Arid4a等。结合前期对DN小鼠肾脏组织二代测序发现的差异mRNA表达谱,Trim11为上调,提示DN中Trim11可能是miR-449a的潜在靶基因。
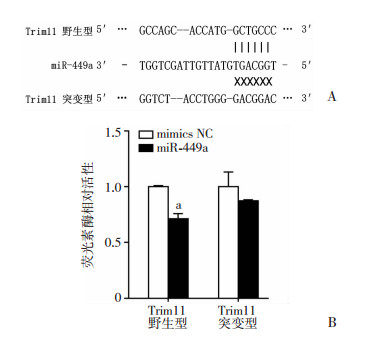
生物信息检测显示:Trim11 3′-UTR区的157~176 nt片段与miR-449a“种子序列”互补配对。为明确miR-449a与Trim11的关系,在预测结果的基础上设计和转染Trim11的突变型和野生型载体(图 4A)并进行荧光素酶检测。与突变型比较,野生型的相对活性降低了30%(P < 0.01,图 4B)。以上结果都证明miR-449a与Trim11具有靶向直接结合关系。
|
| A:miR-449a与Trim11 3′-UTR区的结合位点及突变位点;B:双荧光素酶报告检测miR-449a与Trim11 3′-UTR的结合关系;a:P < 0.01, 与mimics NC组比较 图 4 miR-449a与Trim11的靶向结合关系 |
2.4 miR-449a抑制Trim11蛋白表达
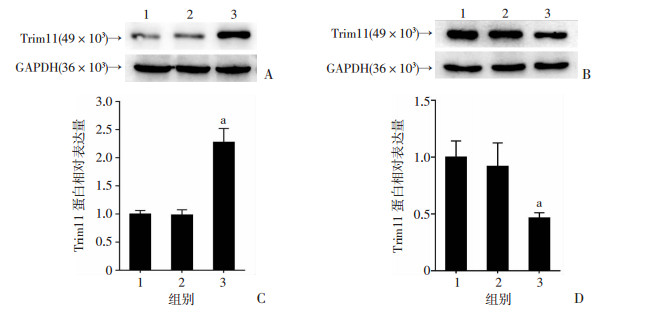
采用Western blot检测过表达或沉默miR-449a后各组细胞中Trim11蛋白水平的变化。结果显示:低糖组沉默miR-449a,Trim11表达显著高于空白组;在高糖组过表达miR-449a,Trim11表达显著低于空白组(P < 0.01),提示Trim11可能参与DN的发生、发展。miR-449a调控Trim11的表达。见图 5。
|
| A、C: Western blot检测miR-449a过表达后Trim11表达及半定量分析结果1:低糖空白组;2:低糖对照组;3:低糖inhibitor组;B、D: Western blot检测miR-449a抑制后Trim11表达及半定量分析结果1:高糖空白组;2:高糖对照组;3:高糖mimics组;a: P < 0.01, 与空白组比较 图 5 Western blot检测miR-449a过表达或抑制后Trim11蛋白表达 |
2.5 miR-449a通过Trim11影响增殖
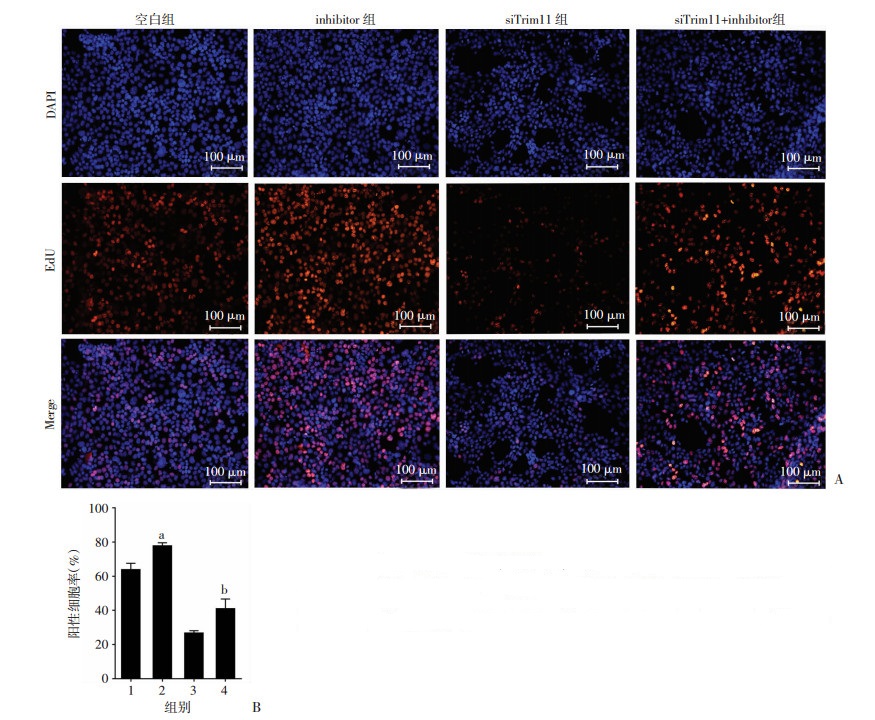
在高糖组中抑制miR-449a的同时沉默Trim11,EdU检测系膜细胞增殖效率。结果显示:与空白组比较,在系膜细胞中抑制miR-449a的表达后,细胞增殖能力增强,而敲低Trim11后,细胞增殖能力降低。沉默miR-449a和Trim11后,系膜细胞增殖能力较抑制miR-449a组降低。表明抑制miR-449a后对系膜细胞增殖的促进作用被Trim11的siRNA拮抗(P < 0.01, 图 6)。
|
| A: EdU检测细胞增殖; B: EdU半定量分析1:空白组;2:inhibitor组;3:siTrim11组;4:siTrim11+inhibitor组;a: P < 0.01, 与空白组比较;b: P < 0.01, 与inhibitor组比较 图 6 EdU检测转染miR-449a inhibitor及Trim11 siRNA后高糖组系膜细胞增殖 |
3 讨论
DN作为糖尿病主要并发症之一,严重影响患者的生命质量,为患者及家庭带来了沉重的经济和精神负担。肾小球系膜病变是DN最突出的病理改变之一。目前,有研究提出,DN系膜细胞增殖受到miRNA及其靶基因的相互作用的调控。miRNA可与靶mRNA的3′或5′非编码区形成不完全的碱基互补,调控靶基因的表达,从而影响疾病的进程。有多项研究报道miRNA沉默基因调节细胞过程参与DN的发生,如miR-21对db/db DN小鼠肾小球系膜增生有抑制作用[11];miR-34a-5p调节lincRNA 1700020I14Rik与靶基因Sirt1,介导HIF-1α信号途径,改善糖尿病肾病肾系膜细胞纤维化及增殖[10]。但miRNA具体机制仍不完全清楚。
miR-34/449家族参与DN的发生目前广受关注。miR-34/449家族包括具有种子序列相似性的6个同源基因:miR-34a,miR-34b,miR-34c,miR-449a,miR-449b和miR-449c [12],在DN中发挥重要作用。miR-34a和miR-34c的过表达抑制高葡萄糖诱导的足细胞凋亡[13-14],miR-34a的下调减轻高糖培养的系膜细胞的增殖[15]。以上均提示miR-34/449家族可能是一个DN相关的重要分子家族。新近研究发现,过表达miR-449a抑制肝癌细胞增殖和细胞迁移,同时诱导肝癌细胞凋亡[16];E2F1激活miR-449a可靶向并抑制癌基因CDK6和CDC25A的表达,抑制细胞增殖[17]。以上研究提示miR-449a是一个重要的细胞增殖相关的miRNA,可能在DN系膜细胞增殖中发挥作用。我们的结果显示,miR-449a在高糖培养的小鼠系膜细胞中低表达, 提示miR-449a可能参与DN。进一步,EdU细胞增殖实验发现在系膜细胞中过表达miR-449a后细胞增殖能力降低,而沉默miR-449a后细胞增殖能力增强,提示miR-449a调控系膜细胞增殖,可能在DN发生、发展中扮演重要角色。
为进一步探索miR-449a影响系膜细胞增殖的机制,本研究运用生物信息学分析其潜在靶基因。结果显示Trim11、Tnfrsf21、Arid4a、Ldlrad3等68个基因为其预测靶基因。结合课题组前期二代测序结果,我们发现Trim11在DN组织表达增高,因此Trim11受到我们的关注。Trim家族蛋白被报道在多种肿瘤的细胞增殖、迁移、分化和凋亡中发挥重要作用;有研究发现Trim11促进肝癌细胞增殖、迁移、侵袭和EMT以及体内肿瘤生长[18];Trim11还可以直接结合miR-24-3p促进细胞增殖并抑制结肠癌中的细胞凋亡[19];在敲低Trim11的肺癌细胞系中,细胞生长、运动性和侵袭性显著降低[20],提示Trim11在细胞生长、增殖中发挥作用。但Trim11在DN中少见报道。荧光素酶结果显示miR-449a的种子序列可直接结合Trim11的3′UTR区调控Trim11,证实Trim11是miR-449a的靶基因。此外,Western blot检测发现过表达miR-449a后, Trim11蛋白质减少,而沉默miR-449a后Trim11蛋白质显著增加。这些结果显示miR-449a可通过靶向结合Trim11 3′UTR,从而抑制Trim11蛋白表达。并且,在同时使用miR-449a inhibitor及Trim11的siRNA,miR-449a inhibitor对系膜细胞增殖的促进作用减弱。结合上述研究结果,可推测miR-449a可能是通过抑制靶基因Trim11表达,调控系膜细胞增殖,参与DN的疾病过程。后续将进一步研究miR-449a通过Trim11参与DN系膜细胞增殖的具体机制。
本研究利用生物信息学技术和荧光素酶检测探索miR-449a与DN相关的Trim11的靶向结合关系,通过分子生物学实验验证miR-449a通过与Trim11相互作用可以调控DN的系膜细胞增殖,为DN的系膜细胞增殖机制研究提供新的实验依据。以miR-449a通过Trim11参与调控高低糖培养的肾小球系膜细胞增殖的研究为基础,为DN早期诊治寻找突破口和重要靶点。
| [1] |
XU Y, WANG L, HE J, et al. Prevalence and control of diabetes in Chinese adults[J]. JAMA, 2013, 310(9): 948-959. DOI:10.1001/jama.2013.168118 |
| [2] |
ZHANG L X, LONG J Y, JIANG W S, et al. Trends in chronic kidney disease inChina[J]. N Engl J Med, 2016, 375(9): 905-906. DOI:10.1056/NEJMc1602469 |
| [3] |
XIE Y, BOWE B, MOKDAD A H, et al. Analysis of the Global Burden of Disease study highlights the global, regional, and national trends of chronic kidney disease epidemiology from 1990 to 2016[J]. Kidney Int, 2018, 94(3): 567-581. DOI:10.1016/j.kint.2018.04.011 |
| [4] |
ZHU M J, CHEN Q, LIU X, et al. LncRNA H19/miR-675 axis represses prostate cancer metastasis by targeting TGFBI[J]. FEBS J, 2014, 281(16): 3766-3775. DOI:10.1111/febs.12902 |
| [5] |
YAN J, GUO X Q, XIA J Z, et al. MiR-148a regulates MEG3 in gastric cancer by targeting DNAmethyltransferase 1[J]. Med Oncol, 2014, 31(3): 879. DOI:10.1007/s12032-014-0879-6 |
| [6] |
HAN Y H, LIU Y C, ZHANG H, et al. Hsa-miR-125b suppresses bladder cancer development by down-regulating oncogene SIRT7 and oncogenic long noncoding RNA MALAT1[J]. FEBS Lett, 2013.[Epub ahead of print]. DOI: 10.1016/j.febslet.2013.10.023.
|
| [7] |
SUN Y, PENG R, PENG H M, et al. MiR-451 suppresses the NF-kappaB-mediated proinflammatory molecules expression through inhibiting LMP7 in diabetic nephropathy[J]. Mol Cell Endocrinol, 2016, 433: 75-86. DOI:10.1016/j.mce.2016.06.004 |
| [8] |
NOONAN E J, PLACE R F, POOKOT D, et al. MiR-449a targets HDAC-1 and induces growth arrest in prostatecancer[J]. Oncogene, 2009, 28(14): 1714-1724. DOI:10.1038/onc.2009.19 |
| [9] |
NOONAN E J, PLACE R F, BASAK S, et al. MiR-449a causesRb-dependent cell cycle arrest and senescence in prostate cancer cells[J]. Oncotarget, 2010, 1(5): 349-358. DOI:10.18632/oncotarget.167 |
| [10] |
LI A L, PENG R, SUN Y, et al. LincRNA 1700020I14Rik alleviates cell proliferation and fibrosis in diabetic nephropathy via miR-34a-5p/Sirt1/HIF-1α signaling[J]. Cell Death Dis, 2018, 9(5): 461. DOI:10.1038/s41419-018-0527-8 |
| [11] |
ZHANG Z, PENG H M, CHEN J X, et al. MicroRNA-21 protects frommesangial cell proliferation induced by diabetic nephropathy in db/db mice[J]. FEBS Lett, 2009, 583(12): 2009-2014. DOI:10.1016/j.febslet.2009.05.021 |
| [12] |
SONG R, WALENTEK P, SPONER N, et al. MiR-34/449miRNAs are required for motile ciliogenesis by repressing cp110[J]. Nature, 2014, 510(7503): 115-120. DOI:10.1038/nature13413 |
| [13] |
LIU X D, ZHANG L Y, ZHU T C, et al. Overexpression of miR-34c inhibits high glucose-induced apoptosis inpodocytes by targeting Notch signaling pathways[J]. Int J Clin Exp Pathol, 2015, 8(5): 4525-4534. |
| [14] |
ZHANG X Y, SONG S P, LUO H X. Regulation ofpodocyte lesions in diabetic nephropathy via miR-34a in the Notch signaling pathway[J]. Medicine (Baltimore), 2016, 95(44): e5050. DOI:10.1097/MD.0000000000005050 |
| [15] |
ZHANG L, HE S Y, GUO S D, et al. Down-regulation of miR-34a alleviatesmesangial proliferation in vitro and glomerular hypertrophy in early diabetic nephropathy mice by targeting GAS1[J]. J Diabetes Complicat, 2014, 28(3): 259-264. DOI:10.1016/j.jdiacomp.2014.01.002 |
| [16] |
SANDBOTHE M, BUURMAN R, REICH N, et al. The microRNA-449 family inhibits TGF-β-mediated liver cancer cell migration by targetingSOX4[J]. J Hepatol, 2017, 66(5): 1012-1021. DOI:10.1016/j.jhep.2017.01.004 |
| [17] |
YE W W, XUE J S, ZHANG Q, et al. MiR-449a functions as a tumor suppressor in endometrial cancer by targeting CDC25A[J]. Oncol Rep, 2014, 32(3): 1193-1199. DOI:10.3892/or.2014.3303 |
| [18] |
LIU J J, RAO J, LOU X M, et al. Upregulated TRIM11 exerts its oncogenic effects in hepatocellular carcinoma through inhibition of P53[J]. Cell Physiol Biochem, 2017, 44(1): 255-266. DOI:10.1159/000484678 |
| [19] |
YIN Y, ZHONG J, LI S W, et al. TRIM11, a direct target of miR-24-3p, promotes cell proliferation and inhibits apoptosis in coloncancer[J]. Oncotarget, 2016, 7(52): 86755-86765. DOI:10.18632/oncotarget.13550 |
| [20] |
WANG X L, SHI W P, SHI H C, et al. TRIM11 overexpression promotes proliferation, migration and invasion of lung cancer cells[J]. J Exp Clin Cancer Res, 2016, 35(1): 100. DOI:10.1186/s13046-016-0379-y |



