2. 730030 兰州,兰州大学第二医院:急诊医学实验室;
3. 730030 兰州,兰州大学第二医院:急诊重症监护室
2. Laboratory of Emergency Medicine, Second Hospital of Lanzhou University, Lanzhou, Gansu Province, 730030, China;
3. Emergency Intensive Care Unit, Second Hospital of Lanzhou University, Lanzhou, Gansu Province, 730030, China
急性胰腺炎(acute pancreatitis, AP)为临床常见急腹症,其发病率高,总体死亡率可达5%~10%,而重症急性胰腺炎(severe acute pancreatitis, SAP)的死亡率更是高达36%~50%。近年来,SAP虽然在发病机制和治疗方面取得了一些进展,但发病率还是逐年升高,病死率仍居高不下[1-8]。核因子E2相关因子2(nuclear factor E2-related factor 2, Nrf2)作为机体内最核心的内源性抗氧化信号通路因子,其首先与抗氧化反应元件(antoxidant response element, ARE)结合后通过Nrf2/ARE信号通路诱导下游血红素加氧酶(heme oxygenase-1, HO-1)和依赖还原型辅酶/Ⅱ醌氧化还原酶1[NAD(P)H:quinone-oxidoreductase-1, NQO1]等多种抗氧化酶的表达,进而发挥抗炎抗氧化损伤,保护受损脏器对抗炎症反应等作用[9-13]。我们前期研究发现[14-15],脂氧素受体激动剂BML-111预处理通过对Nrf2/ARE信号通路的影响从而对SAP小鼠的肺脏具有一定的保护作用。本研究也发现,BML-111对Nrf2/ARE的激活并不能维持足够长的时间[14-15]。基因过表达是一种常用的生物学研究方法,其基本原理是通过人工构建的方式在目的基因上游加入调控元件,使基因可以在人为控制的条件下实现大量转录和翻译,从而实现基因产物的过表达[16]。然而,目前对Nrf2过表达是否对AP具有一定的保护作用还尚不清楚。本研究采用蛙皮素联合脂多糖诱导建立AP大鼠模型,通过携带有Nrf2基因的慢病毒感染大鼠诱导Nrf2过表达,探讨Nrf2过表达对大鼠AP的影响及可能机制。
1 材料与方法 1.1 实验动物32只雄性SPF级10周龄SD大鼠,购自甘肃省中医药大学实验动物中心,合格证号:SYXK(甘)2010-0012,体质量200~250 g。实验室饲养温度为(22±2)℃,湿度50%~70%,自由进食和饮水。
1.2 药物试剂和仪器试剂:Nrf2抗体(Abcam,美国,批号:GR149890-16);HO-1抗体(Abcam,美国,批号:GR195043-16);NQO1抗体(Abcam,美国,批号:GR149890-1696795-8);蛙皮素CER(阿拉丁,批号:31362-50-2);脂多糖LPS(Sigam,美国,批号:057M4013V);淀粉酶检测试剂盒(南京建成,中国,批号:20170331)。仪器:倒置相差显微镜(OLYMPUS,日本);电泳仪电转移仪和酶标仪(Bio-Rad,美国);实时荧光定量PCR仪(ABI,美国)。
1.3 过表达载体构建Nrf2过表达由GeneCopoeia(广州)公司设计合成。选用pReciver-Lv201病毒载体,将大鼠nuclear factor, erythroid 2-like 2(Nrf2,Genbank: NM_031789.2)基因克隆于pReciver-Lv201病毒载体中,该质粒为病毒载体,含有CMV强启动子,此外还有GFP荧光蛋白基因,抗氨苄霉素基因,将上述Nrf2基因克隆构建到该质粒,构建成含有Nrf2过表达的质粒载体。将上述质粒利用慢病毒包装,构建的病毒进行后续实验。
1.4 动物模型及分组采用腹腔联合注射CER和LPS建立大鼠AP模型。每次腹腔内注射蛙皮素50 μg/kg(浓度为5 mg/L,10 mL/kg),间隔1 h注射1次,共7次,最后1次同时注射脂多糖10 mg/kg(浓度为0.1 g/L,10 mL/kg),术后大鼠可以自由饮水。
32只健康雄性SD大鼠按照随机数字表法分为阴性对照组[NC,尾静脉注射100 μL空载体慢病毒,48 h后腹腔内注射生理盐水(每次10 mL/kg),间隔1 h注射1次,共7次,最后1次生理盐水加倍],胰腺炎组(NC+LPS+CER,尾静脉注射100 μL空载体慢病毒,48 h后按照上述方法造模),过表达组[Nrf2+/+,尾静脉注射100 μL(1×107 TU)Nrf2过表达慢病毒,方法同NC组],过表达胰腺炎组[Nrf2+/++LPS+CER,尾静脉注射100 μL(1×107 TU)Nrf2过表达慢病毒,48 h后按照上述方法造模]。
1.5 标本收集及预处理各组大鼠分别于造模成功后24 h用3%戊巴比妥钠溶液肌肉注射麻醉(0.25 mL/100 g)后,无菌条件下开胸经右心室用无热原注射器准确抽取血,注入无抗凝试管内,室温下静置待析出血清后,迅速低温离心10 min(1 000 r/min),吸出上清液,另置于一灭热源的试管内,-80 ℃保存用于血清淀粉酶的检测。剖腹仔细分离胰腺,取胰头部胰腺组织用4%多聚甲醛溶液固定后用于HE染色行病理学检查;取剩余胰腺并立即置于液氮中快速冷冻后保存于-80 ℃冰箱中用于检测Nrf2, HO-1和NQO1的mRNA及蛋白表达情况。
1.6 血清中胰淀粉酶活性检测将收集的大鼠血清从-80 ℃取出,室温溶解后,按照试剂盒说明书的操作方法,利用淀粉酶活性检测试剂盒检测血清中胰淀粉酶活性。
1.7 HE染色胰腺组织于4%多聚甲醛固定48 h后,酒精梯度脱水,二甲苯透明后进行石蜡包埋并切片。将脱水后的切片进行脱蜡至水,苏木精侵染5 min,流水冲洗5 min后,盐酸分化5 s,伊红染液侵染5 min,流水冲洗5 min后,树脂封片并进行拍照,采集照片。病理常规石蜡包埋HE染色切片质量标准及评分参考文献[15]。
1.8 Real-time PCR(RT-PCR检测)取相同部位胰腺组织置于TRIzol中,提取胰腺总RNA,按照试剂盒说明书提取并纯化RNA。相关引物由GeneCopoeia(广州)公司设计合成,见表 1。实时荧光定量PCR过程按照TaKaRa Prime Ex TaqTM Ⅱ PCR扩展试剂盒操作说明进行。所有结果经GAPDH内参校正后,ΔΔCt法计算最终结果并采用2-ΔΔCt表示。
| 基因 | 正向引物(5′-3′) | 反向引物(5′-3′) | 引物长度/bp |
| Nrf2 | TTGGCAGAGACATTCCCATTTGTA | GAGCTATCGAGTGACTGAGCCTG | 109 |
| NQO1 | TGGAAGCTGCAGACCTGGTG | CCCTTGTCATACATGGTGGCATAC | 106 |
| HO-1 | AGGTGCACATCCGTGCAGAG | CTTCCAGGGCCGTATAGATATGGTA | 128 |
| GAPDH | GGCACAGTCAAGGCTGAGAATG | ATGGTGGTGAAGACGCCAGTA | 218 |
1.9 Western blot检测
各组取含20 μg蛋白质样品,上样于12% SDS-PAGE中,20 mA浓缩分离20 min,30 mA分离胶分离至胶下边缘。100 V电压下将PAGE胶中的蛋白转移至PVDF膜上,加入2%的BSA 10 mL,震荡1.5 h。分别将Nrf2、HO-1和NQO1一抗用PBST稀释(1 :1 000),加入上述PVDF膜上4 ℃过夜孵育。加入相应的二抗(1 :5 000稀释)后,将PVDF膜放入数码凝胶图像分析仪进行曝光,所得图片采用Image-Pro plus 6.0软件进行扫描,利用GAPDH校准后计算相应的灰度值。
1.10 统计学分析数据统计采用SPSS 20.0统计软件完成,计量资料以x±s表示,每组8个平行重复(n=8)。两组间是否存在差异采用Student’s t test进行分析,多组间是否存在差异采用单因素方差分析。检验水准:α=0.05。
2 结果 2.1 过表达Nrf2效率筛选结果造模24 h后处死动物,验证过表达效率。结果显示,与阴性对照组比较,过表达组Nrf2蛋白表达量显著升高(P < 0.01),相比升高2.26倍,提示大鼠胰腺组织慢病毒感染成功,Nrf2蛋白被有效表达,见图 1。

|
| A:Western blot检测结果;B:半定量分析a:P < 0.01,与NC组比较 图 1 Western blot检测过表达效率筛选结果 |
2.2 各组大鼠血清淀粉酶活性检测结果
胰腺炎组和过表达胰腺炎组血清淀粉酶活性均明显高于阴性对照组,差异有统计学意义(P < 0.01);且过表达胰腺炎组血清淀粉酶活性明显低于胰腺炎组(P < 0.05),说明Nrf2过表达能有效降低急性胰腺炎大鼠淀粉酶活性。见图 2。
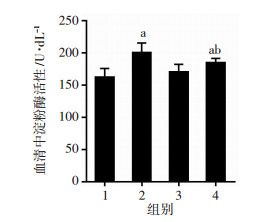
|
| 1:NC组;2:胰腺炎组;3:过表达组;4:过表达胰腺炎组;a: P < 0.01,与NC组比较;b: P < 0.01,与胰腺炎组比较 图 2 Nrf2过表达处理后各组大鼠血清淀粉酶活性检测结果 |
2.3 各组大鼠胰腺病理检查结果
胰腺组织切片HE染色镜下观察,阴性对照组和过表达组胰岛和胰腺腺泡清晰,胰腺小叶结构完整,镜下观察不到炎症细胞及浸润,无坏死和出血。胰腺炎组胰腺组织可见不同程度导管扩张、炎性细胞浸润及出血,部分组织点状坏死,而过表达组和胰腺炎组导管扩张及炎性细胞浸润程度较胰腺炎组减轻,出血减少,无明显点状坏死。各组大鼠胰腺组织HE染色结果见图 3。
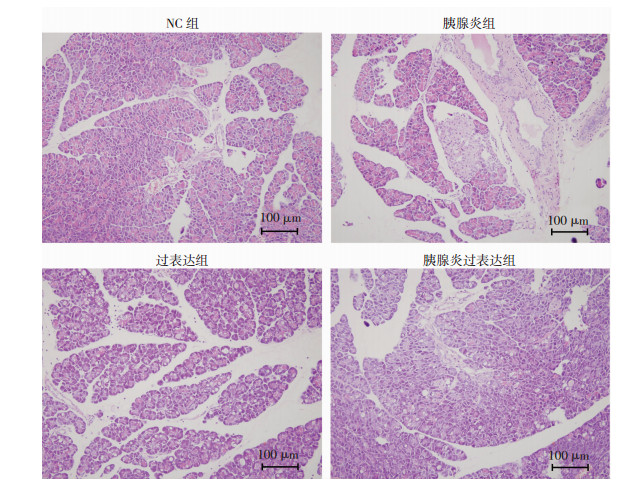
|
| 图 3 Nrf2过表达处理后各组大鼠胰腺组织病理学变化 |
2.4 各组大鼠胰腺组织病理学评分结果
与阴性对照组比较,胰腺炎组及过表达胰腺炎组胰腺损伤病理学评分均升高,差异有统计学意义(P < 0.01),而与过表达组比较胰腺损伤病理学评分差异无统计学意义(P>0.05)。与胰腺炎组相比较,过表达胰腺炎组胰腺损伤病理学评分显著降低(P < 0.05,图 4)。
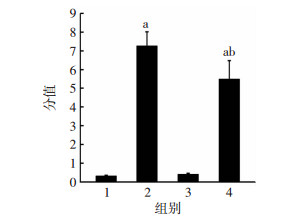
|
| 1:NC组;2:胰腺炎组;3:过表达组;4:过表达胰腺炎组;a: P < 0.01,与NC组比较;b: P < 0.05,与胰腺炎组比较 图 4 各组大鼠胰腺组织病理学评分(x±s,n=8) |
2.5 各组大鼠胰腺组织中Nrf2、NQO1和HO-1 mRNA表达结果
与阴性对照组相比,胰腺炎组和过表达胰腺炎组大鼠胰腺组织Nrf2、NQO1、HO-1基因表达均明显升高(P < 0.01),提示Nrf2过表达诱导了下游抗氧化基因的表达;与胰腺炎组相比,过表达胰腺炎组Nrf2 mRNA表达明显增高(P < 0.05),NQO1、HO-1基因表达虽然有上升趋势,但差异无统计学意义(P>0.05,图 5)。
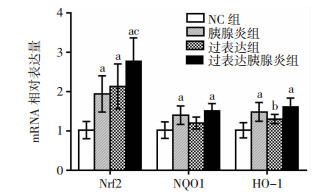
|
| a: P < 0.01,b: P < 0.05,与NC组比较;c:P < 0.05,与胰腺炎组比较 图 5 Nrf2过表达处理后各组大鼠胰腺中Nrf2、NQO1和HO-1 mRNA表达 |
2.6 各组大鼠胰腺组织中Nrf2、NQO1和HO-1蛋白表达结果
Nrf2过表达处理后,各组大鼠胰腺组织Nrf2和NQO1蛋白表达均较慢病毒阴性对照组升高(P < 0.01);与胰腺炎组相比,过表达胰腺炎组Nrf2和NQO1蛋白表达也明显增高(P < 0.01),提示Nrf2过表达诱导了下游抗氧化蛋白的表达,以上结果提示Nrf2过表达能有效提高其下游抗氧化蛋白的表达。与阴性对照组比较,HO-1蛋白表达量在过表达胰腺炎组和胰腺炎组均明显升高(P < 0.01),但在过表达组虽然有所上升,但差异无统计学意义(P>0.05),与胰腺炎组相比,过表达胰腺炎组HO-1蛋白表达量虽然有所增高,但差异无统计学意义(P>0.05,图 6)。
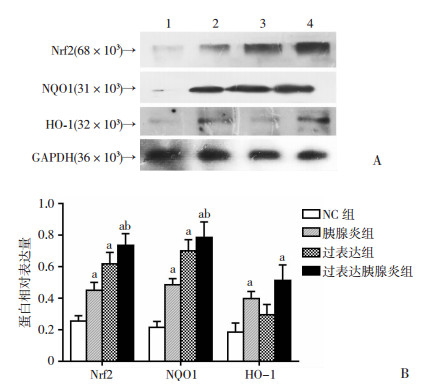
|
| A:Western blot检测结果1:NC组;2:胰腺炎组;3:过表达组;4:过表达胰腺炎组;B:半定量分析a: P < 0.01, 与NC组比较,b: P < 0.01, 与胰腺炎组比较 图 6 Nrf2过表达处理后各组大鼠胰腺中Nrf2、NQO1和HO-1蛋白表达 |
3 讨论
Nrf2/ARE是机体重要的抗氧化信号通路,Nrf2作为该通路的关键因子而被认为是多脏器的“保护器”及细胞抗氧化还原的中枢调节者[17-19]。研究表明[20],Nrf2基因过表达能够通过Nrf2/ARE信号通路缓解和改善大鼠微囊藻素诱导的肝毒性,其主要是通过上调下游的抗氧化酶如HO-1和NQO1等抗氧化酶基因的表达来对抗细胞氧化损伤,缓和炎症反应,而其在胰腺炎中是否也有相似的效果有待进一步研究。本研究通过携带有Nrf2基因的慢病毒感染大鼠诱导Nrf2过表达,为了验证大鼠胰腺组织Nrf2过表达的效率,我们检测了Nrf2过表达慢病毒组Nrf2蛋白的表达情况。结果显示,与慢病毒阴性对照组比较,Nrf2过表达慢病毒组Nrf2蛋白表达量显著升高了2.26倍(P < 0.01),提示大鼠胰腺组织慢病毒感染成功,Nrf2蛋白被有效表达,表明利用基因过表达技术可以作为一种激活机体内源性抗氧化通路的方法。
随后我们采用蛙皮素联合LPS腹腔注射法制作大鼠AP模型[14-15]。本研究发现,慢病毒阴性胰腺炎组和Nrf2过表达胰腺炎组血清淀粉酶活性均明显高于慢病毒阴性对照组,差异有统计学意义(P < 0.01);另外胰腺病理检查结果提示,慢病毒阴性胰腺炎组胰腺组织可见不同程度导管扩张及炎性细胞浸润,可见出血及部分组织点状坏死,符合AP胰腺病理特点,以上特点均说明成功诱导了大鼠AP模型。Nrf2过表达胰腺炎组血清淀粉酶活性明显低于慢病毒阴性胰腺炎组(P < 0.05),说明Nrf2过表达能有效降低急性胰腺炎大鼠淀粉酶活性。而使用Nrf2过表达处理后,与慢病毒阴性胰腺炎组相比较,Nrf2过表达胰腺炎组胰腺导管扩张及炎性细胞浸润程度均较减轻,坏死灶也明显减少,胰腺病理评分及血清淀粉酶水平也明显下降,说明过表达Nrf2基因对AP大鼠的胰腺具有一定的保护作用。
为了进一步探讨过表达Nrf2基因对AP大鼠胰腺保护作用的机制,我们从mRNA和蛋白水平两方面对Nrf2/ARE信号通路中重要因子Nrf2及下游重要抗氧化酶HO-1、NQO1进行了检测,结果显示,与慢病毒阴性对照组相比,慢病毒阴性胰腺炎组和Nrf2过表达胰腺炎组大鼠胰腺组织Nrf2、NQO1、HO-1 mRNA和蛋白水平表达均明显升高,提示胰腺炎和Nrf2过表达均可诱导下游抗氧化基因的表达,以上结果提示,胰腺炎情况下机体也可以启动内源性防御机制及下游抗氧化酶的表达作为一种自我保护方式,对抗疾病导致的氧化损伤。我们的研究也发现,与慢病毒阴性胰腺炎组相比,Nrf2过表达胰腺炎组Nrf2表达明显增高,NQO1蛋白表达也明显增高,说明通过Nrf2过表达,激活了Nrf2/ARE信号通路,促进了下游抗氧化酶的表达,对抗胰腺炎时胰腺组织的氧化损伤,从而对胰腺具有一定的保护作用。但我们的研究也发现,NQO1 mRNA和HO-1的mRNA及蛋白表达虽然均有上升趋势,但差异无统计学意义,分析其可能原因:一则由于机体内存在的众多信号通路构成复杂网络不但相互联络、相互影响,而且还有其他调节Nrf2活性的调控模式参与了AP的发病过程;二则可能与我们仅仅选择了造模后24 h此单一时间点进行观察有关,而各种基因表达的高峰及被其他方式灭活的程度不一致也是本实验的局限性之一。同时,我们的研究中对Nrf2/ARE信号转导通路其他关键酶没有进行观察,还有对慢病毒转染的时机、途径、未能连续观察足够的时间等,将在以后的实验中进一步探讨。
总之,本研究结果提示,过表达Nrf2基因对蛙皮素联合脂多糖诱导的AP大鼠的胰腺具有一定的保护作用,这种作用可能与通过Nrf2的过表达,诱导Nrf2/ARE信号转导通路下游抗氧化酶HO-1及NQO1的表达有关。
| [1] |
BANKS P A, BOLLEN T L, DERVENIS C, et al. Classification of acute pancreatitis: 2012: revision of the Atlanta classification and definitions by international consensus[J]. Gut, 2013, 62(1): 102-111. DOI:10.1136/gutjnl-2012-302779 |
| [2] |
PEERY A F, CROCKETT S D, MURPHY C C, et al. Burden and cost of gastrointestinal, liver, and pancreatic diseases in the United States: update 2018[J]. Gastroenterology, 2019, 156(1): 254-272. DOI:10.1053/j.gastro.2018.08.063 |
| [3] |
TENNER S, BAILLIE J, DEWITT J, et al. American College of Gastroenterology guideline: management of acute pancreatitis[J]. Am J Gastroenterol, 2013, 108(9): 1400-1415, 1416. DOI:10.1038/ajg.2013.218 |
| [4] |
SHEN H, BEN Q W, JIANG Y, et al. Body mass index and the risk and prognosis of acute pancreatitis: A meta-analysis[J]. Eur J Gastroenterol Hepatol, 2011, 23(12): 1136-1143. DOI:10.1097/MEG.0b013e32834b0e0e |
| [5] |
KRISHNA S G, HINTON A, OZA V, et al. Morbid obesity is associated with adverse clinical outcomes in acute pancreatitis: A propensity-matched study[J]. Am J Gastroenterol, 2015, 110(11): 1608-1619. DOI:10.1038/ajg.2015.343 |
| [6] |
PEERY A F, CROCKETT S D, BARRITT A S, et al. Burden of gastrointestinal, liver, and pancreatic diseases in the United States[J]. Gastroenterology, 2015, 149(7): 1731-1741. DOI:10.1053/j.gastro.2015.08.045 |
| [7] |
HAZRA N, GULLIFORD M. Evaluating pancreatitis in primary care: A population-based cohort study[J]. Br J Gen Pract, 2014, 64(622): e295-e301. DOI:10.3399/bjgp14X679732 |
| [8] |
DONNELLY P E, WINCH D E. Acute pancreatitis[J]. N Engl J Med, 2017, 376(6): 597. DOI:10.1056/NEJMc1616177 |
| [9] |
SCHMIDLIN C J, DODSON M B, MADHAVAN L, et al. Redox regulation by NRF2 in aging and disease[J]. Free Radic Biol Med, 2019, 134: 702-707. DOI:10.1016/j.freeradbiomed.2019.01.016 |
| [10] |
SHA H C, MA Q Y, JHA R K. Trypsin is the culprit of multiple organ injury with severe acute pancreatitis[J]. Med Hypotheses, 2009, 72(2): 180-182. DOI:10.1016/j.mehy.2008.09.007 |
| [11] |
JEONG W S, JUN M, KONG A N. Nrf2: a potential molecular target for cancer chemoprevention by natural compounds[J]. Antioxid Redox Signal, 2006, 8(1/2): 99-106. DOI:10.1089/ars.2006.8.99 |
| [12] |
RUBIOLO J A, MITHIEUX G, VEGA F V. Resveratrol protects primary rat hepatocytes against oxidative stress damage: activation of the Nrf2 transcription factor and augmented activities of antioxidant enzymes[J]. Eur J Pharmacol, 2008, 591(1/2/3): 66-72. DOI:10.1016/j.ejphar.2008.06.067 |
| [13] |
KIM S K, YANG J W, KIM M R, et al. Increased expression of Nrf2/ARE-dependent anti-oxidant proteins in Tamoxifen-resistant breast cancer cells[J]. Free Radic Biol Med, 2008, 45(4): 537-546. DOI:10.1016/j.freeradbiomed.2008.05.011 |
| [14] |
WANG Y Z, ZHANG Y C, CHENG J S, et al. BML-111, a lipoxin receptor agonist, ameliorates 'two-hit'-induced acute pancreatitis-associated lung injury in mice by the upregulation of heme oxygenase-1[J]. Artif Cells Nanomed Biotechnol, 2014, 42(2): 110-120. DOI:10.3109/21691401.2013.794355 |
| [15] |
WANG Y Z, ZHANG Y C, CHENG J S, et al. Protective effects of BML-111 on cerulein-induced acute pancreatitis-associated lung injury via activation of Nrf2/ARE signaling pathway[J]. Inflammation, 2014, 37(4): 1120-1133. DOI:10.1007/s10753-014-9836-y |
| [16] |
ZHANG F, FEI J, ZHAO B, et al. Protective effect of adenoviral transfer of heme oxygenase-1 gene on rats with severe acute pancreatitis[J]. Am J Med Sci, 2014, 348(3): 224-231. DOI:10.1097/MAJ.0000000000000225 |
| [17] |
LEE J M, LI J, JOHNSON D A, et al. Nrf2, a multi-organ protector?[J]. FASEB J, 2005, 19(9): 1061-1066. DOI:10.1096/fj.04-2591hyp |
| [18] |
CHO H Y, REDDY S P, DEBIASE A, et al. Gene expression profiling of NRF2-mediated protection against oxidative injury[J]. Free Radic Biol Med, 2005, 38(3): 325-343. DOI:10.1016/j.freeradbiomed.2004.10.013 |
| [19] |
YU X, KENSLER T. Nrf2 as a target for cancer chemoprevention[J]. Mutat Res, 2005, 591(1/2): 93-102. DOI:10.1016/j.mrfmmm.2005.04.017 |
| [20] |
LU Y F, LIU J, WU K C, et al. Overexpression of Nrf2 protects against microcystin-induced hepatotoxicity in mice[J]. PLoS ONE, 2014, 9(3): e93013. DOI:10.1371/journal.pone.0093013 |



