三阴性乳腺癌(Triple Negative Breast Cancer,TNBC)是一种特殊类型的乳腺癌,TNBC中雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(Her-2)均阴性表达。此类乳腺癌具有复发率高,易转移的特点,治疗和预后较差[1]。
PGC-1α是PGC-1家族的亚型之一,是过氧化物酶体增殖物激活受体γ (peroxisome proliferator-activated receptor γ,PPARγ)的辅激活因子[2]。主要存在于高能量、高代谢、含有线粒体较多的细胞中。有研究表明,在浸润性乳腺癌中PGC-1α通过增强线粒体的功能促进癌细胞的远处转移[3]。PGC-1α上游的许多微小RNA (microRNA, miRNA)参与了对PGC-1α的表达调控。我们通过在线软件预测分析(http://www.microrna.org)发现,小鼠PGC-1α的3′UTR端非翻译区有11个潜在的miRNA结合位点。miRNA是小型非编码RNA,约含20-22个核苷酸,主要通过与靶信使RNA(mRNA)的3′非翻译区(3′-UTR)进行特异性结合,从而促进或抑制靶信使mRNA 3′-UTR的翻译,促进和抑制癌细胞的作用。许多研究都表明,miRNA在细胞生长过程,包括代谢、稳态、增殖和凋亡的过程中都发挥着重要的作用[4]。有研究发现miR-382的表达水平与乳腺癌的预后密切相关[5]。我们前期研究发现在肿瘤相关巨噬细胞(tumor associated macrophages,TAMs)可以通过细胞内的miR-382抑制PGC-1α的表达,从而阻止TAMs的M2型分化及其后PGC-1α介导的氧化过程,进而抑制肿瘤环境代谢重编程和癌细胞的转移[6-7]。但是在乳腺癌细胞中本身就存在的miR-382是否通过调节PGC-1α介导乳腺癌细胞的转移目前尚不清楚。本课题主要研究TNBC的4T1细胞株中miR-382对PGC-1α及细胞生物学特征的影响,以便为TNBC的诊治提供更多的实验数据。
1 材料与方法 1.1 主要试剂和仪器质粒和细胞株4T1细胞株、293T细胞株购自中国科学院上海生命科学研究院细胞库; pcDNA3.1与pcDNA3.1- PGC-1α质粒(#1026, addgene, USA);pMIR-REPORT (Applied Biosystems Inc公司);miR-382以及Anti-miR-382 (#4464066, Invitrogen)及Control miR (#446405 8, Invitrogen);逆转录试剂盒和qRT-PCR试剂盒(TaKaRa); GAPDH(碧云天公司); 抗pgc1抗体(Abcam公司),Western blot其他相关试剂(鼎国公司);质粒大提无内毒素试剂盒(QIAGEN公司)、荧光素酶检测试剂盒(promega)、opti-MEM(TBD)、TransIT-293 Transfection Reagent 2700(Mirus Bio LLC)、Transwell小室(孔径0.4 m)购自Corning公司、PROMEGA20/20 LUMINOMETER GLOMAX(promega)。细胞培养瓶、细胞培养板(Corning)、DMEM高糖培养基、RPMI1640培养基和胎牛血清(GIBCO); BB5060UV二氧化碳培养箱(Heraeus)、倒置相差显微镜(Leica)。
1.2 细胞培养4T1细胞培养于含10%胎牛血清(FBS)、1%的青霉素-链霉素双抗的RPMI1640培养基中,在培养箱中常规培养,37 ℃、5%CO2,饱和湿度。293T细胞培养于含有10%胎牛血清(FBS)的DMEM中,在培养箱中常规培养,37 ℃、5%CO2, 饱和湿度。
1.3 小鼠喂养BALB/c小鼠,雌性, SPF级,6~8周龄,每只18~20 g,共40只,饲养于重庆医科大学动物实验中心。
1.4 实验分组 1.4.1 4T1 (miR-382和PGC-1α相关表达)实验分组:①对照组:对照miR转染4T1细胞;②miR-382实验组:miR-382mimics转染4T1细胞;③anti-miR-382实验组: miR-382的抑制性探针anti-miR-382转染至4T1细胞。每组实验重复3次。
1.4.2 细胞荧光素酶实验分组① 野生对照组:将对照miR与含有核心互补序列的3′UTR报告质粒共转染4T1细胞;②野生实验组:将miR-382 mimics与含有核心互补序列的3′UTR报告质粒共转染4T1细胞;③突变对照组:将对照miR与含有突变的核心互补序列的3′UTR报告质粒共转染4T1细胞;④突变实验组:将miR-382 mimics与含有突变的核心互补序列的3′UTR报告质粒共转染4T1细胞。每组实验重复3次。
1.4.3 检测4T1细胞生物学特征及动物成瘤模型实验分组① 对照miR pCDNA3.1组:对照miR pCDNA3.1共转染于4T1细胞;②对照miR pCDNA-PGC-1α组:对照miR pCDNA-PGC-1α共转染于4T1细胞;③miR-382+pCDNA3.1组: miR-382 mimics和pCDNA3.1共转染于4T1细胞;④miR-382+pCDNA-PGC-1α组:miR-382 mimics和pCDNA-PGC-1α共转染于4T1细胞。每组实验重复3次。
1.5 qRT-PCR实验收集各组细胞,使用TRIzol提取RNA,之后使用逆转录试剂盒合成cDNA再进行qRT-PCR检测,小鼠PGC-1α mRNA PCR引物:正义链:5′-AACCACACCCACAGGATCAGA-3′;反义链:5′-TCTTCGCTTTATTGCTCCATGA-3′。反应条件及RNA的相对表达水平计算同前期研究[6]。
1.6 Western blot检测收集各组细胞后BCA法蛋白定量,测定蛋白浓度,具体方法见文献[6]报道。
1.7 双荧光素酶实验利用Target Scan和PicTar软件预测miR-382靶基因筛选出预测结果一致的靶基因。结合Target Scan和NCBI数据库, 我们利用PrimerPremier 5软件设计PGC-1 3UTR PCR引物: (正义链:5′-GCAAGCTTCGTGTTCCCAGGCTGAGGAATG-3′反义链:5′-CGGAGCT-CGTCTGCTCCTCAGAAGGAGCCA-3′。以DNA为模板进行PCR扩增,合成3′-UTR序列片段扩增产物经2%琼脂糖凝胶电泳鉴定, 胶回收PCR产物,选择HindⅢ/SacⅠ限制性内切酶加入引物5′端,并加上碱基GC做保护,37 ℃酶切过夜。将质粒和目的片段纯化,加入T4连接酶在4 ℃反应过夜,然后将连接产物转化至感受态细胞中。之后挑取单菌落进行培养,使用质粒抽提试剂提取质粒后进行测序验证,测序由上海吉凯公司完成。测序正确后提取质粒,293T细胞培养至对数生长期,接种于24孔板,每孔细胞数为5×104个,使用Mirus转染试剂转染,按照实验分组要求,取对照、正常或突变质粒,分别用opti-MEM 50 μL稀释,并加入miR382轻柔混匀;opti-MEM 50 μL加入Mirus 2 μL,室温孵育5 min; 将以上两步骤溶液混合在一起,常温孵育20 min;将混合物1次加入24孔板中并十字混匀; 在培养箱中温育5~6 h后,用正常培养基替换,然后进行荧光素酶测定。
1.8 Transwell共培养实验将miR-382或对照miR分别与pCDNA3.1或pCDNA-PGC1α共转染于4T1细胞,使细胞处于对数生长期,用D-Hanks液充分洗涤2次,再加入无血清RPMI1640培养基,使细胞饥饿生长12 h。用0.25%胰酶消化后加入无血清RPMI1640培养基制备细胞悬液,调整至细胞密度为1.33×106/mL。Transwell板中加入500 μL含20% FBS的完全培养基,将小室放入板中。在Transwell小室中加入200 μL的细胞悬液,将Transwell板37 ℃下于CO2培养箱中培养24 h。将小室取出,用PBS洗去培养基,结晶紫染色10 min;自来水将表面的结晶紫洗除干净,用棉签将上室中接种侧的细胞擦除干净,于显微镜下对非细胞接种侧拍照。在显微镜下观察并计数穿膜细胞数,随机取5个视野取均值。
1.9 CCK-8检测将miR-382或对照miR分别与pCDNA3.1或pCDNA-PGC1α共转染于4T1细胞,在96孔培养板中配置100 μL(约10 000个细胞)的细胞悬液,每组设5个复孔。将培养板在培养箱预培养48 h,使细胞贴壁。然后在培养板加入100 μL各组待测物质。将培养板在培养箱干预6、12、24、48 h后,每孔分别加入10 μL CCK-8溶液,将培养板继续放在培养箱内孵育。用酶标仪测定在450 nm处的光密度值D(450)。所得数值以细胞数量为X轴,光密度值为Y轴,就可以制作标准曲线。
1.10 皮下移植瘤实验将miR-382或对照miR分别与pCDNA3.1或pCDNA-PGC-1α共转染于4T1细胞,取5×106/100 μL细胞悬液接种于小鼠右侧腹股沟下方,每只注射0.2 mL (细胞数为1×107/只),同时在左侧腹股沟下方注射0.2 mL的生理盐水作为阴性对照,每天观察小鼠注射部位肿瘤生长情况。并用游标卡尺测量和计算小鼠肿瘤体积。
1.11 尾静脉移植瘤实验将miR-382或对照miR分别与pCDNA3.1或pCDNA-PGC-1α共转染于4T1细胞,取5×106/100 μL细胞悬液,在无菌条件下通过尾静脉注射接种, 每只注射0.2 mL(细胞数为1×107/只)。10 d后处死小鼠,取其肺脏组织,使用4%多聚甲醛固定后用石蜡包埋切片,之后苏木精和伊红染色,封片后在显微镜下观察。使用OlympusCX41显微镜系统对图像进行分析,圈定肿瘤面积利用软件分析系统计算各组切片肿瘤面积,记录面积的数据后算出肿瘤相对面积的比值。
1.12 统计学分析采用SPSS 20.0软件进行统计处理,数据以x±s表示,组间比较行方差分析及t检验。检验水准:α=0.05。
2 结果 2.1 miR-382对PGC-1α表达的影响 2.1.1 过表达miR-382对PGC-1α表达水平的影响通过生物信息学在线网站(http://www.microrna.org/microrna)发现小鼠PGC1α基因3′UTR存在多个潜在的miR结合位点,分别是:mmu-miR-382、mmu-miR-539、mmu-miR-218、mmu-miR-202-3p、mmu-miR-451、mmu-miR-320、mmu-miR-375、mmu-miR-129-5p、mmu-miR-335-5p、mmu-miR-362-3p、mmu-miR-543。取预测分数前5位的miRs,转染小鼠乳腺癌细胞4T1,如图 1所示,miR-382对PGC-1α的mRNA的表达水平(0.30±0.09)的抑制作用最为显著。48 h收集蛋白,行Western blot检测,如图 2所示,与对照组(0.38±0.03)相比,miR-382可大幅抑制PGC-1α蛋白水平[(0.14±0.02), P < 0.05]。
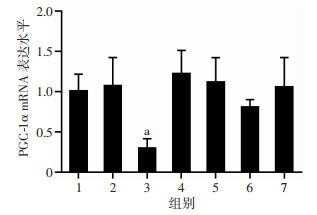
|
| 1:空白;2:对照;3:miR-382;4:miR-539;5:miR-218;6:miR-202-3p;7:miR-451;a:P < 0.05, 与对照组比较 图 1 在线预测的潜在miR对PGC-1αmRNA的表达的影响 |

|
| 1:对照组;2:miR-382实验组 图 2 过表达miR-382对PGC-1α蛋白表达的影响 |
2.1.2 抑制miR-382表达对PGC-1α表达的影响
抑制性探针anti-miR-382或对照miR转染4T1细胞,48 h后行Real-time PCR检测和Western blot检测。如图 3所示,与对照组(0.32±0.02)相比,anti-miR-382显著上调PGC-1α的mRNA水平(0.56±0.07)和蛋白水平(P < 0.05)。
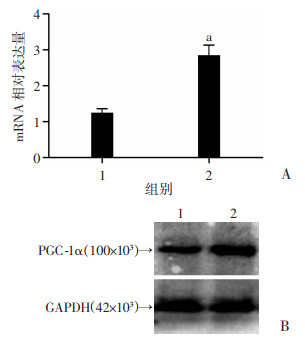
|
| 1:对照组;2:anti-miR-382实验组;A:QT-PCR检测PGC-1α mRNA相对表达量a:P < 0.05,与对照组比较;B:Western blot检测结果 图 3 抑制miR-382对PGC-1α表达的影响 |
2.2 荧光素酶实验检测miR-382与PGC-1α的可能作用位点
如图 4所示,小鼠miR-382(mmu-miR-382)的序列与小鼠野生型PGC1α 3′UTR有较高互补性,作用位点位于PGC-1α 3′UTR 565-582,核心互补序列为ACAACUU。构建核心互补序列被突变为UAAAUCU的质粒,转染293T细胞行荧光素酶报告基因检测,结果显示:相比对照[相对荧光素酶活性为(1.00±0.14)],miR-382显著抑制野生型报告质粒的活性[相对荧光素酶活性为(0.31±0.09),P < 0.05];而在突变型报告质粒组,miR-382无明显抑制效应。
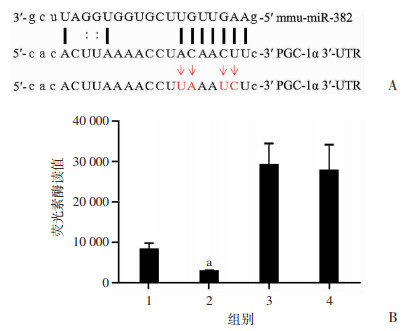
|
| A:在线软件预测两者之间的作用位点;B:荧光素酶实验结果读值1:野生对照组;2:野生实验组;3:突变对照组;4:突变实验组; a:P < 0.05,与对照组比较 图 4 荧光素酶实验检测miR-382与PGC-1α的作用位点 |
2.3 miR-382/PGC-1α信号通路对4T1细胞生物学特性的影响 2.3.1 对4T1细胞增殖能力的影响
将miR-382mimics或对照miR分别与pCDNA3.1或pCDNA-PGC1α共转染于4T1细胞,应用CCK-8法检测细胞增殖活力,如图 5所示,根据第48小时的数据,与对照+pCDNA3.1组(1.27±0.11)比较,miR-382可显著抑制4T1细胞体外增殖[(0.87±0.08),P < 0.05];对照+pCDNA-PGC1a的表达值为(1.61±0.17),证明过表达PGC-1α可明显促进细胞增殖活力,抵消了miR-382对PGC-1α的抑制作用(P < 0.05)。
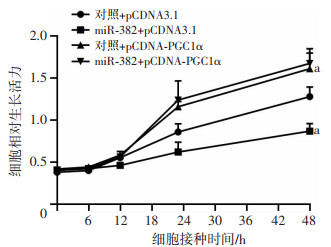
|
| a: P < 0.05,与对照+pCDNA3.1组比较 图 5 CCK-8检测miR-382/PGC-1α信号通路对4T1细胞体外增殖的影响 |
2.3.2 对4T1细胞迁移能力的影响
如图 6所示,对照+pCDNA3.1组的穿膜细胞数(830±119)个;miR-382+pCDNA3.1组为(219±31)个,miR-382可显著抑制4T1细胞的迁移能力(P < 0.05);对照+pCDNA-PGC-1α组细胞数为(3 480±246)个,证明过表达PGC-1α可明显促进4T1细胞的迁移活性,抵消了miR-382对PGC1α的抑制作用(P < 0.05)。
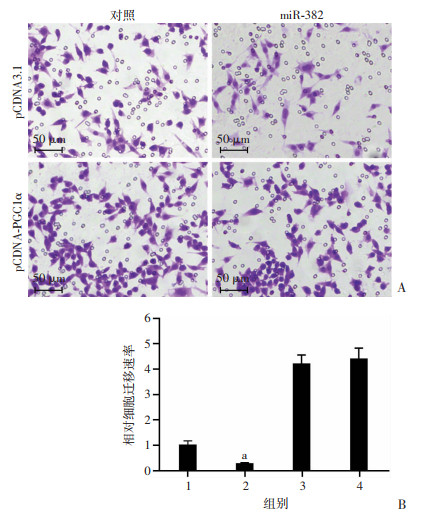
|
| 1:对照+pCDNA3.1组;2:miR-382+pCDNA3.1组;3:对照+pCDNA-PGC-1α组;4:miR-382+pCDNA-PGC-1α组;A:各组细胞镜下穿膜图片;B:各组细胞穿膜相对速率柱状统计分析a: P < 0.05,与对照+pCDNA3.1组比较 图 6 Transwell检测miR-382/PGC-1α信号通路对4T1细胞迁移能力的影响 |
2.3.3 对皮下移植瘤生长的影响
如图 7所示,将miR-382mimics或对照miR分别与pCDNA3.1或pCDNA-PGC1α共转染于4T1细胞,后建立小鼠皮下移植瘤模型,参照第10天的数据,结果显示:对照+pCDNA3.1组移植瘤体积为(0.98±0.17)cm3,miR-382+pCDNA3.1组为(0.36±0.10)cm3,miR-382可显著抑制4T1移植瘤的生长(P < 0.05);对照+pCDNA-PGC-1α组为(1.89±0.19)cm3,过表达PGC1α可明显促进移植瘤的生长(P < 0.05);miR-382的抑瘤效应因PGC1α过表达而被阻断,过表达PGC-1α可明显促进移植瘤的生长。
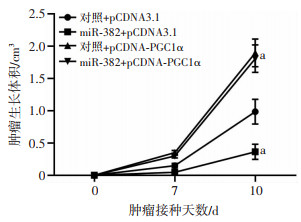
|
| a: P < 0.05,与对照+pCDNA3.1组比较 图 7 皮下移植瘤实验检测miR-382/PGC-1α信号通路对4T1细胞皮下移植瘤成瘤能力的影响 |
2.3.4 对尾静脉肺移植灶生长的影响
如图 8所示,对照+pCDNA3.1组转移瘤面积为(7 996±1 617)μm2,miR-382+pCDNA3.1组为(2 848±166)μm2,miR-382可显著抑制4T1肿瘤肺部转移灶的形成(P < 0.05);对照+pCDNA-PGC-1α组为(29 233±4 268)μm2,过表达PGC-1α可明显促进4T1细胞的肺部转移能力(P < 0.05);miR-382的抑制转移效应因PGC1α过表达而被阻断,过表达PGC-1α可明显促进移植瘤的生长。
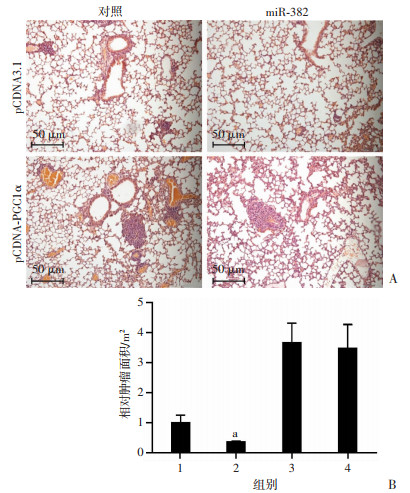
|
| 1:对照+pCDNA3.1组;2:miR-382+pCDNA3.1组;3:对照+pCDNA-PGC-1α组;4:miR-382+pCDNA-PGC-1α组;a: P < 0.05,与对照+ pCDNA3.1组比较 图 8 尾静脉肺移植灶实验检测miR-382与PGC-1α对4T1细胞肺转移瘤生长的影响 |
3 讨论
三阴性乳腺癌中是一种起源复杂的异质性疾病,其发生、发展与环境、遗传等因素息息相关[8],占所有乳腺癌的15%~20%, 具有独特的临床病理特征,如病理组织学分级高、易局部复发、转移早、侵袭性强、预后差等特点[9-10]。目前,随着手术水平的不断提高,放射治疗和化疗方案的进一步规范,乳腺癌的诊断和治疗水平也取得了很大进展。然而,远处转移仍然是治疗瓶颈,是乳腺癌的研究热点之一。
这PGC-1α是PGC-1家族的亚型之一,是过氧化物酶体增殖物激活受体γ(peroxisomeprolife-rator-activated receptor γ,PPARγ)的辅激活因子[11]。人PGC-1基因位于染色体4p15,分子量为91kDAa,最早是PUIGSERVER[12]利用酵母双杂交技术从小鼠的棕色脂肪组织构建的cDNA库中发现的,并且ST-PIERRE等[13]研究发现,PGC-1α能有效抑制ROS生成,促进线粒体复制和转录,增加ATP生成,进而促进肿瘤细胞转移。在乳腺癌方面,血浆PGC-1α水平高的患者相比血浆PGC-1α水平低的乳腺癌患者预后和生存率要差[12]。在浸润性乳腺癌中PGC-1α通过增强线粒体的功能来促进癌细胞的远处转移[14]。但调控PGC-1α的上游具体机制尚未明确。
我们通过基因在线预测软件发现PGC-1α基因3′UTR存在多个潜在的miR结合位点。miRNA是转录后调控因子中最大的一组。microRNA(miRNA)是转录后调控因子之一[15],其5’末端可与靶基因的3’非翻译区(3′UTR)结合,从而使基因翻译退化并减少蛋白质表达[16]。miRNA参与一系列生物过程,包括细胞周期,生长,凋亡,分化和应激反应[17],多种miRNA通过靶向基因调节乳腺癌的细胞增殖、血管生成、侵袭和转移。首次发现与乳腺癌相关的miRNA是miR-206。乳腺癌组织中miR-206显著下降,低miR-206水平与晚期临床分期也和总体生存率较短密切相关[18]。miR-125也可通过RTNK抑制ErBb2,miR-145对乳腺癌的转移也起到一定作用[14, 19]。有研究表明,miR-382也与癌症的发生发展息息相关。例如,miR-382通过抑制SETD8表达参与非小细胞肺癌发生和转移[20]。结直肠癌中,miR-382调节NR2F2促进癌症的发生发展[21]。但miR-382在乳腺癌中是否与PGC-1α有靶向调节关系仍待确定。我们前期研究发现在TAMs中miR-382通过降低PGC-1α表达,阻止有氧氧化依赖的M2巨噬细胞活化,进而抑制癌细胞转移[6-7]。但在乳腺癌细胞中两者的关系还不清楚。
所以本实验首先利用生物信息学网站发现有多个miRNA对PGC-1α潜在的结合位点,分别是mmu-miR-382、mmu-miR-539、mmu-miR-218、mmu-miR-202-3p、mmu-miR-451、mmu-miR-320、mmu-miR-375、mmu-miR-129-5p、mmu-miR-335-5p、mmu-miR-362-3p、mmu-miR-543。其中miR-382可以明显抑制PGC-1α的基因和蛋白表达,抑制miR-382后PGC-1α的表达显著增高,说明PGC-1α受miR-382的调控,但是作用位点尚不清楚。
于是我们构建PGC-1α双荧光素酶报告质粒和突变质粒,与miR-382 mimics共转染293T细胞,检测荧光素酶活性的变化。荧光素酶报告基因的原理在于miRNA主要通过作用于靶基因的3′UTR起作用,可以将目的基因3′UTR区域构建至载体中报告基因Luciferase的后面,构建荧光素酶质粒。然后转染至细胞中,通过比较过表达或者干扰miRNA后,监测荧光素酶的活性变化,检测报告基因表达的改变从而可以定量反映miRNA对目的基因的抑制作用。本实验发现miR-382可明显降低PGC-1α的荧光素酶活性的表达,证明miR-382对PGC-1α有调节作用,作用位点位于PGC-1α 3′UTR 565-582。
虽然我们通过上述两部分实验说明miR-382对PGC-1α有调节作用,作用位点位于PGC-1α 3′UTR 565-582,但是miR-382对PGC-1α的调控具体在乳腺癌生物学特征方面的作用尚不清楚,因此我们运用pcDNA3.1与pcDNA3.1-PGC-1α质粒改变miR-382/ PGC-1α信号通路在4T1细胞的增殖、迁移、成瘤及肺转移方面的作用,结果发现过表达miR-382能明显降低细胞体外增殖和迁移能力,并显著抑制癌细胞的成瘤和肺转移;而过表达PGC-1α可显著增加细胞体外增殖和迁移能力,并明显促进癌细胞的成瘤和肺转移。
综上,miR-382可能通过PGC-1α抑制4T1细胞株的增殖和肺转移;其作用位点位于PGC-1α 3′UTR 565-582位点,本实验为我们后续研究人体乳腺癌组织中两者关系进行了进一步探究,为TNBC的治疗提供了新的实验数据,为该型靶向药物的研究提供的新的思路。
| [1] |
BOSCH A, EROLES P, ZARAGOZA R, et al. Triple-negative breast cancer:molecular features, pathogenesis, treatment and current lines of research[J]. Cancer Treatment Rev, 2010, 36(3): 206-215. DOI:10.1016/j.ctrv.2009.12.002 |
| [2] |
LEBLEU V S, O'CONNELL J T, GONZALEZ HERRERA K N, et al. PGC-1α mediates mitochondrial biogenesis and oxidative phosphorylation in cancer cells to promote metastasis[J]. Nat Cell Biol, 2014, 16(10): 992-1003. DOI:10.1038/ncb3039 |
| [3] |
PUIGSERVER P, WU Z, PARK C W, et al. A cold-inducible coactivator of nuclear receptors linked to adaptive thermogenesis[J]. Cell, 1998, 92(6): 829-839. DOI:10.1016/S0092-8674(00)81410-5 |
| [4] |
CALIN G A, CROCE C M. MicroRNA signatures in human cancers[J]. Nat Rev Cancer, 2006, 6(11): 857-866. DOI:10.1038/nrc1997 |
| [5] |
FU L, LI Z, ZHU J, et al. Serum expression levels of microRNA-382-3p, -598-3p, -1246 and-184 in breast cancer patients[J]. Oncol Letters, 2016, 12(1): 269. DOI:10.3892/ol.2016.4582 |
| [6] |
代朦, 靳鑫, 雷优扬, 等. 过表达miR-382的肿瘤相关巨噬细胞对三阴性乳腺癌生物学特性的影响[J]. 第三军医大学学报, 2018, 40(15): 1375-1382. DAI M, JIN X, LEI Y Y, et al. Effect of miR-382 overexpressing tumor-associated macrophages on biological properties of triple-negative breast cancer 4T1 cells[J]. J Third Mil Med Univ, 2018, 40(15): 1375-1382. DOI:10.16016/j.1000-5404.201801107 |
| [7] |
靳鑫, 倪田根, 王宁, 等. PGC-1α通过线粒体介导巨噬细胞极化状态的机制研究[J]. 第三军医大学学报, 2019, 41(1): 56-62. JIN X, NI T G, WANG N, et al. Mechanism of mitochondria-mediated PGC-1α in macrophage polarization[J]. J Third Mil Med Univ, 2019, 41(01): 56-62. DOI:10.16016/j.1000-5404.201808139 |
| [8] |
FAN L, STRASSER-WEIPPL K, LI J J, et al. Breast cancer in China[J]. Lancet Oncology, 2014, 15(7): e279-e289. DOI:10.1016/S1470-2045(13)70567-9 |
| [9] |
COSTA R, SHAH A N, SANTA-MARIA C A, et al. Targeting Epidermal Growth Factor Receptor in triple negative breast cancer:New discoveries and practical insights for drug development[J]. Cancer Treatment Rev, 2017, 53: 111-119. DOI:10.1016/j.ctrv.2016.12.010 |
| [10] |
DENKERT C, LIEDTKE C, TUTT A, et al. Molecular alterations in triple-negative breast cancer-the road to new treatment strategies[J]. Lancet, 2017, 389(10087): 2430-2442. DOI:10.1016/S0140-6736(16)32454-0 |
| [11] |
LEBLEU V S, O'CONNELL J T, GONZALEZ HERRERA K N, et al. PGC-1α mediates mitochondrial biogenesis and oxidative phosphorylation in cancer cells to promote metastasis[J]. Nat Cell Biol, 2014, 16(10): 992-1003. DOI:10.1038/ncb3039 |
| [12] |
PUIGSERVER P, WU Z, PARK C W, et al. A cold-inducible coactivator of nuclear receptors linked to adaptive thermogenesis[J]. Cell, 1998, 92(6): 829-839. DOI:10.1016/S0092-8674(00)81410-5 |
| [13] |
ST-PIERRE J, DRORI S, ULDRY M, et al. Suppression of reactive oxygen species and neurodegeneration by the PGC-1α transcriptional coactivators[J]. Cell, 2006, 127(2): 397-408. DOI:10.1016/j.cell.2006.09.024 |
| [14] |
YU Z, BASERGA R, CHEN L, et al. MicroRNA, cell cycle, and human breast cancer[J]. Am J Pathol, 2010, 176(3): 1058-1064. DOI:10.2353/ajpath.2010.090664 |
| [15] |
STENVANG J, PETRI A, LINDOW M, et al. Inhibition of microRNA function by antimiR oligonucleotides[J]. Silence, 2012, 3(1): 1. DOI:10.1186/1758-907X-3-1 |
| [16] |
ZHANG H, LI Y, LAI M. The microRNA network and tumor metastasis[J]. Oncogene, 2010, 29: 937-948. DOI:10.1038/onc.2009.406 |
| [17] |
JOVANOVIC M, HENGARTNER M O. miRNAs and apoptosis:RNAs to die for[J]. Oncogene, 2006, 25: 6176-6187. DOI:10.1038/sj.onc.1209912 |
| [18] |
LI Y, HONG F, YU Z. Decreased expression of microRNA-206 in breast cancer and its association with disease characteristics and patient survival[J]. J Int Med Res, 2013, 41(3): 596-602. DOI:10.1177/0300060513485856 |
| [19] |
KONG Y W, FERLAND-MCCOLLOUGH D, JACKSON T J, et al. MicroRNAs in cancer management[J]. Lancet Oncol, 2012, 13(6): e249-e258. DOI:10.1016/S1470-2045(12)70073-6 |
| [20] |
CHEN T, REN H, THAKUR A, et al. MiR-382 inhibits tumor progression by targeting SETD8 in non-small cell lung cancer[J]. Biomedicine&Pharmacotherapy, 2017, 86: 248-253. DOI:10.1016/j.biopha.2016.12.007 |
| [21] |
ZHOU B, SONG J, HAN T, et al. MiR-382 inhibits cell growth and invasion by targeting NR2F2 in colorectal cancer[J]. Mol Carcinogen, 2016, 55(12): 2260-2267. DOI:10.1002/mc.22466 |



