种植义齿作为一种修复方法已被临床广泛接受。然而,种植体植入区域的骨量通常不利于种植体获得良好的骨整合[1]。引导骨再生(GBR)是一种成熟的促进新骨生成的治疗方法,已成功地应用于治疗颌骨不同类型的缺损[2]。口腔环境中来自食块、唇颊舌肌的压力会使引导骨再生部位发生形变,导致成骨效率降低。单独使用引导骨再生膜的传统GBR不能满足临床需要。钛网具有良好的机械强度和生物相容性,可为骨增量部位提供有效的空间支撑,已广泛应用于颌骨大面积缺损及牙槽骨重建[3]。但钛是不可吸收金属,需要二次手术取出,增加患者的负担。镁合金作为一种新型的生物降解材料[4],有良好的生物相容性和力学性能,在骨科及心血管领域得到了广泛关注[5-6]。镁可以促进新骨骼的形成,其合金表现出更好的骨传导活性[7-8]。镁合金的弹性模量与天然骨十分接近并且还具有抗菌性和耐蚀性[9],将镁合金网应用于口腔GBR前景十分广阔。
利用数字化技术建立模型,结合3D打印技术打印的个性化支架网能够很好地支撑种植位点的解剖骨外形,并提高骨愈合效率[10]。支架网要有足够的厚度才能在口腔环境复杂的应力下维持其三维外形,然而过厚的支架网会对GBR部位的黏膜产生过大的刺激而暴露于口腔环境,进一步的炎症感染导致GBR失败。因此,本文建立了牙槽骨缺损模型,设计了不同厚度的个性化镁合金网,模拟骨增量部位的骨愈合过程,使用三维有限元(Finite element analysis, FEA)技术计算不同厚度镁合金网及骨植入材料的应力应变分布,从生物力学角度为镁合金网的临床应用提供参考。
1 材料及方法 1.1 三维模型的建立 1.1.1 应用软件Mimics19.0(Materialise公司, 比利时);Geomagic Studio(Raindrop公司, 美国);3-matic Research10.0(Materialise公司, 比利时);Solid Works(Dassault Systemes, 法国);ANSYS Workbench 17.0(ANSYS, Inc., Canonsburg, PA, 美国)。
1.1.2 建立下颌骨缺损模型及虚拟骨增量模型获得患者的知情同意后, 将1例C2-D2缺失并伴有较大面积牙槽骨缺损非常规种植患者的CBCT数据导入到Mimics19.0软件重建下颌骨的三维模型(图 1A), 使用Geomagic Studio软件创建皮质骨及松质骨的模型后进行虚拟骨增量并对模型进行精细化处理, 使模型光滑圆顺便于后期镁合金网及植骨材料模型的设计(图 1B)。

|
| A:下颌骨缺损CBCT重建模型; B:下颌骨缺损虚拟骨增量模型 图 1 下颌骨缺损及虚拟骨增量模型 |
1.1.3 建立个性化镁合金网及骨植入材料模型
使用3-matic Research10.0读取下颌骨模型后确定种植体植入位点, 根据重建的下颌骨缺损模型在3-matic Research10.0中设计0.3 mm、0.4 mm和0.5 mm厚度的镁合金网(建模所用参数来自铸态的Mg-Zn-Y-Nd镁合金)以及骨植入材料模型(图 2)。

|
| A:骨植入物; B:镁合金网; C:颌骨+骨植入物+镁合金网 图 2 模拟骨增量的三维有限元模型 |
1.2 实验设定和相关参数
模拟下颌骨不移动状态, 设定附着于下颌骨的肌束为固定约束, 镁合金网通过固位钉固定于颌骨,固位钉与颌骨之间为连续、均匀的骨性接合[11]。设定骨愈合时镁合金网分三个阶段降解:骨植入材料植入后的初期纤维肉芽组织模型、中期不成熟骨模型、晚期成熟骨模型,对应的镁合金网厚度为0.5、0.4、0.3 mm。将镁合金网、固位钉、骨植入材料、下颌骨的三维模型导入ANSYS Workbench17.0。根据学者对咀嚼力的测定[12],本实验将100 N的载荷加载于牙合面作有限元的力学分析。对模型进行网格划分,单元数及节点数见表 1。实验中相关材料的弹性模量和泊松比见表 2。
| 材料 | 节点数 | 单元数 |
| 皮质骨 | 17 917 | 30 889 |
| 松质骨 | 13 132 | 23 256 |
| 黏膜 | 31 113 | 9 337 |
| 镁合金网 | 31 709 | 10 728 |
| 骨植入物 | 109 796 | 30 845 |
2 结果 2.1 不同厚度镁合金网的应力应变分布
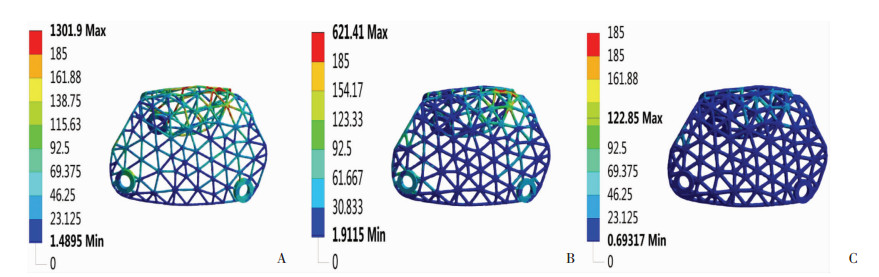
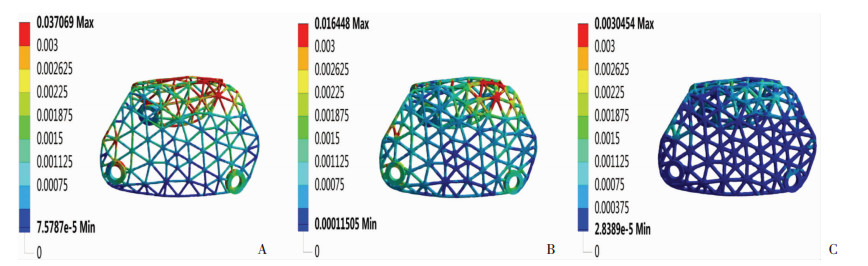
骨植入材料植入初期,应力在不同厚度镁合金网中分布均匀,无明显应力集中,本实验采用Mg-Zn-Y-Nd合金,其屈服强度是185 MPa[13]。0.3、0.4、0.5 mm厚度镁合金网的最大应力值为:1301.9、621.41、122.85 MPa (图 3),与屈服强度的比值为:7.04、3.36和0.66,最大等效应力随厚度增加而减小。0.5 mm厚度镁合金网的最大等效应力在安全线以内,0.3、0.4 mm厚度镁合金网中大于屈服强度的单元有523个和109个,占总单元数的3.5%和1%。三种厚度镁合金网的最大应变为:0.037069、0.016448、0.0030454(图 4)。当镁合金网的厚度增加时,应变随之下降,0.5 mm组的应变下降最为明显。
|
| A: 0.3 mm厚度镁合金网的应力分布;B: 0.4 mm厚度镁合金网的应力分布C: 0.5 mm厚度镁合金网的应力分布 图 3 不同厚度镁合金网的应力分布 |
|
| A: 0.3 mm厚度镁合金网的应变分布; B: 0.4 mm厚度镁合金网的应变分布; C: 0.5 mm厚度镁合金网的应变分布 图 4 不同厚度镁合金网的应变分布 |
2.2 骨愈合过程中骨植入材料的应力应变分布
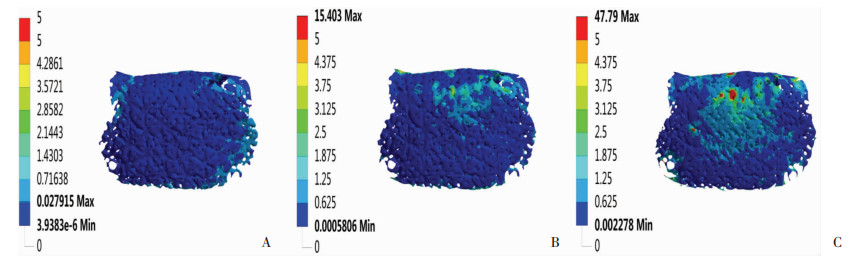
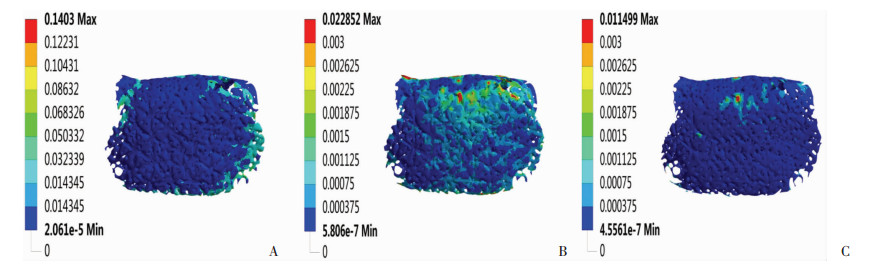
骨愈合的不同阶段中,纤维肉芽组织、不成熟骨和成熟骨的最大等效应力为:0.027 915、15.403、47.79 MPa,随着骨愈合的进展,骨植入材料不断成熟,逐渐能够承受更大的应力(图 5)。Wolff’s定律指出:骨愈合过程中,骨质所受应变在50-3000微应变时,利于骨愈合的发生,骨质所受应变超过25 000微应变时,则有断裂的可能[14]。最大应变在纤维肉芽组织、不成熟骨和成熟骨中分别为0.140 3、0.022 852和0.011 499(图 6),利于骨愈合的单元数分别为1 598、27 981、28 734,占总单元数的5.7%、98.8%和95.3%(图 7)。
|
| A:纤维肉芽组织的应力分布; B:不成熟骨的应力分布; C:成熟骨的应力分布 图 5 骨愈合不同阶段的应力分布 |
|
| A:纤维肉芽组织的应变分布; B:不成熟骨的应变分布; C:成熟骨的应变分布 图 6 骨愈合不同阶段的应变分布 |

|
| A:不同厚度镁合金网的最大等效应力与屈服强度的比值; B:不同厚度镁合金网的最大应变对比; C:各阶段骨植入材料最大应变对比; D:各阶段骨植入材料的适宜应变单元数的百分比; E:镁合金网降解不同阶段的最大等效应力与屈服强度的比值 图 7 镁合金网及骨植入材料的相关结果分析 |
2.3 骨愈合过程中镁合金网的应力分布
骨愈合进展的同时,镁合金网也在逐渐降解。初期、中期和晚期三阶段的最大等效应力分别为122.85(图 3)、70.072、214.18 MPa(图 8)。与屈服强度的比值分别为:0.66、0.38、1.16,0.3 mm组中有5个应力单元大于屈服强度,占总单元数的0.03%,见图 7。
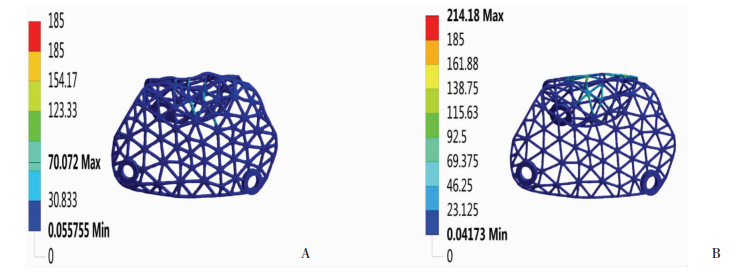
|
| A:不成熟骨阶段0.4 mm镁合金网的应力分布; B:成熟骨阶段0.3 mm镁合金网的应力分布 图 8 镁合金网降解不同阶段的应力分布 |
3 讨论
对于口腔GBR的支架网而言,其重要功能就是维持三维骨增量空间,承受口腔环境中的复杂应力[15]。支架网还必须能将骨增量部位的各种应力均匀地传递到周围的骨组织,这与材料的弹性模量密切相关。镁合金弹性模量约为42 000 MPa,密度约为1.78 g/cm3,相比于纯钛(约96 000 MPa,4.5 g/cm3), 更接近于人骨(约20 000 MPa,1.8-2.1 g/cm3)。当支架网与周围骨组织的力学性能相匹配时,才能获得良好的生物力学相容性,因此镁合金网能有效降低应力遮挡进而诱导骨生长。本实验应用三维有限元的分析方法研究Mg-Zn-Y-Nd合金的应力应变分布,初步探讨简单降解条件下骨愈合过程中的骨植入材料和镁合金网的应力应变变化,为镁合金的临床应用提供参考。
在骨植入材料植入初期模型中,随着镁合金网厚度的增加其应力承载能力得到加强,因此应力应变呈下降趋势,其中0.5 mm厚度镁合金网最大等效应力始终处于安全范围之内,因此0.5 mm厚度的镁合金网适用于前后牙区域较大面积骨缺损的GBR;0.3 mm和0.4 mm厚度镁合金网的最大等效应力有3.5%和1%的单元数超过了屈服强度,有可能会在正常受力时断裂,虽然厚度越薄对黏膜的刺激越小,考虑到镁合金网的降解性,在中小面积骨缺损GBR中仍要慎重选用0.3 mm和0.4 mm厚度的镁合金网。
本文设定骨愈合早期、中期和晚期的镁合金网厚度分别为0.5、0.4、0.3 mm。骨愈合早期纤维肉芽组织应力承载能力较弱,随着骨质的不断成熟,骨植入材料的应力承载能力不断提高,应变不断减小。中期不成熟骨和晚期成熟骨阶段骨植入材料最大应变均小于断裂应变,说明不同厚度的镁合金网能承载绝大部分载荷,可为骨愈合过程提供很好的保护,使得骨植入材料在骨愈合过程中不会发生断裂。根据Wolff’s定律[14],在骨愈合中期和晚期两阶段当中分别有98.8%和95.3%的单元数处在适宜骨愈合的应变范围之内,这说明镁合金网在支撑三维骨增量空间的同时也为其下的骨植入材料传递了适宜的应力,为骨愈合过程提供了有利刺激。
随着骨愈合的进展,0.5 mm厚度镁合金网不断吸收变薄,理论上讲,镁合金网吸收变薄后其最大等效应力应该逐渐增大,然而骨愈合早期到中期的过程中镁合金网的最大等效应力却出现下降趋势,且均小于其屈服强度。随着骨植入材料由纤维肉芽组织逐渐发展为不成熟骨,其应力承载能力大大加强,能够为镁合金网分担更多的应力,且此时0.4 mm厚度的镁合金网仍能承载一定的应力,因此当镁合金网由0.5 mm吸收至0.4 mm时其最大等效应力出现下降并且不发生断裂。随着骨植入材料由不成熟骨发展为成熟骨,其应力承载能力再次得到强化,然而随着镁合金网的进一步吸收其应力承载能力急剧下降,分析结果显示骨愈合晚期0.3 mm厚度的镁合金网的最大等效应力明显上升且大于其屈服强度,但只有5个应力单元(占总单元数0.03%)超过这一阈值,且此时骨植入材料已经发育为成熟骨质,能够正常行使功能。综上,从0.5 mm厚度逐渐变薄的镁合金网能适应GBR的应力支撑要求,并能引导良好的骨愈合进程。
本实验设定了不同骨愈合阶段以及镁合金网降解后的不同厚度,但骨愈合和镁合金网吸收的实际过程会更为复杂,需要用更准确的公式来进行三维有限元模拟。此外,还需要机械性能测试和细胞、动物实验来对不同厚度的镁合金网的力学性能和远期安全性加以验证。
| [1] |
GUGLIELMOTTI M B, OLMEDO D G, CABRINI R L. Research on implants and osseointegration[J]. Periodontology, 2000, 2019, 79(1): 178-189. DOI:10.1111/prd.12254 |
| [2] |
WESSING B, URBAN I, MONTERO E, et al. A multicenter randomized controlled clinical trial using a new resorbable non-cross-linked collagen membrane for guided bone regeneration at dehisced single implant sites: interim results of a bone augmentation procedure[J]. Clin Oral Implants Res, 2017, 28(11): e218-e226. DOI:10.1111/clr.12995 |
| [3] |
ABDEL-HADY GEPREEL M, NⅡNOMI M. Biocompatibility of Ti-alloys for long-term implantation[J]. J Mech Behav Biome Mater, 2013, 20: 407-415. DOI:10.1016/j.jmbbm.2012.11.014 |
| [4] |
KAMRANI S, FLECK C. Biodegradable magnesium alloys as temporary orthopaedic implants: A review[J]. Biometals, 2019, 32(2): 185-193. DOI:10.1007/s10534-019-00170-y |
| [5] |
LIU C, REN Z, XU Y D, et al. Biodegradable magnesium alloys developed as bone repair materials: A review[J]. Scanning, 2018, 2018: 9216314. DOI:10.1155/2018/9216314 |
| [6] |
POGORIELOV M, HUSAK E, SOLODIVNIK A, et al. Magnesium-based biodegradable alloys: Degradation, application, and alloying elements[J]. Interv Med Appl Sci, 2017, 9(1): 27-38. DOI:10.1556/1646.9.2017.1.04 |
| [7] |
AGARWAL S, CURTIN J, DUFFY B, et al. Biodegradable magnesium alloys for orthopaedic applications: A review on corrosion, biocompatibility and surface modifications[J]. Mater Sci Eng C Mater Biol Appl, 2016, 68: 948-963. DOI:10.1016/j.msec.2016.06.020 |
| [8] |
DING W J. Opportunities and challenges for the biodegradable magnesium alloys as next-generation biomaterials[J]. Regen Biomater, 2016, 3(2): 79-86. DOI:10.1093/rb/rbw003 |
| [9] |
QIN H, ZHAO Y C, AN Z Q, et al. Enhanced antibacterial properties, biocompatibility, and corrosion resistance of degradable Mg-Nd-Zn-Zr alloy[J]. Biomaterials, 2015, 53: 211-220. DOI:10.1016/j.biomaterials.2015.02.096 |
| [10] |
CUCCHI A, VIGNUDELLI E, NAPOLITANO A, et al. Evaluation of complication rates and vertical bone gain after guided bone regeneration with non-resorbable membranes versus titanium meshes and resorbable membranes. A randomized clinical trial[J]. Clin Implant Dent Relat Res, 2017, 19(5): 821-832. DOI:10.1111/cid.12520 |
| [11] |
SARRAFPOUR B, SWAIN M, LI Q, et al. Tooth eruption results from bone remodelling driven by bite forces sensed by soft tissue dental follicles: A finite element analysis[J]. PLoS ONE, 2013, 8(3): e58803. DOI:10.1371/journal.pone.0058803 |
| [12] |
SINGH S, UTREJA A K, SANDHU N, et al. An innovative miniature bite force recorder[J]. IJCPD, 2011, 4: 113-118. DOI:10.5005/jp-journals-10005-1093 |
| [13] |
张其美.基于有限元分析的Mg-Zn-Y-Nd合金骨螺钉的结构优化[D].郑州: 郑州大学, 2017. ZHANG Q M. Structural optimization of mg-zn-Y-nd alloy bone screws based on finite element analysis[D]. Zhengzhou: Zhengzhou University, 2017. |
| [14] |
FROST H M. A 2003 update of bone physiology and Wolff's Law for clinicians[J]. Angle Orthod, 2004, 74(1): 3-15. DOI:10.1043/0003-3219(2004)074<0003:AUOBPA>2.0.CO;2 |
| [15] |
RAKHMATIA Y D, AYUKAWA Y, FURUHASHI A, et al. Current barrier membranes: titanium mesh and other membranes for guided bone regeneration in dental applications[J]. J Prosthodont Res, 2013, 57(1): 3-14. DOI:10.1016/j.jpor.2012.12.001 |



