早期脑损伤(early brain injury, EBI)是指蛛网膜下腔出血(subarachnoid hemorrhage, SAH)后72 h内发生的一系列病理生理变化,也是其高致死率和致残率的重要原因[1],文献报道[2-3]SAH后早期脑皮质中的自噬随即显著加强,并在EBI的整个阶段持续存在。铁死亡是一种新型程序性细胞死亡方式,主要特征是细胞内过量的铁沉积诱导活性氧(reactive oxygen species, ROS)堆积、细胞内抗氧化剂谷胱甘肽(glutathione, GSH)耗竭以及清除脂质ROS所需的谷胱甘肽过氧化物酶4(glutathione peroxidase 4, GPX4)表达减少、活性降低[4]。课题组前期研究发现[5],SAH后神经元内游离铁含量增加,进而导致了铁死亡,它可能是导致SAH后EBI的又一重要病理机制。
自噬和铁死亡均被证实参与SAH后EBI的病理过程,然而,此过程中二者的关系以及其相互作用机制尚不清楚。铁稳态对维持细胞的正常结构和功能起关键作用,细胞中的游离铁储存在铁蛋白(ferritin)中,铁蛋白重链1(ferritin heavy polypeptide 1, FTH1)是铁蛋白的重要组成部分[6]。HOU等[6]和GAO等[7]通过离体细胞实验报道了自噬和铁死亡在基因层面的关系——自噬通过降解铁蛋白导致细胞内游离铁含量增加,从而激活铁死亡。这种以铁蛋白为降解底物的特殊的自噬途径被称为铁自噬(ferrotinophagy),是一种自噬性细胞死亡方式(autophagic cell death)。SAH后早期自噬即被激活,但它是否通过降解神经元内铁蛋白,进而诱导神经元铁死亡,仍需进一步探明。本实验拟探究SAH后自噬和铁死亡的关系,揭示自噬影响神经元铁稳态并最终导致神经元死亡的具体机制,旨在对SAH后自噬的作用进行更为客观的分析,为临床治疗提供新的思路和靶点。
1 材料与方法 1.1 实验动物及分组实验动物为健康成年SD大鼠,体质量280~320 g,购于重庆医科大学动物实验中心。大鼠随机抽签法分为假手术组(Sham组)、蛛网膜下腔出血组(SAH组)、蛛网膜下腔出血+空载病毒组(SAH+LV-Scramble组)、蛛网膜下腔出血+慢病毒抑制自噬组(SAH+LV-ATG5组),每组12只。
1.2 药品与试剂用于沉默自噬相关基因5(autophagy-related gene 5, ATG5)的慢病毒(LV-ATG5)和对照慢病毒(LV-Scramble)由上海吉玛制药有限公司合成,其序列为: 5′-GAAGGTTATGAGACAAGAAGA-3′。试剂:ATG5抗体(Cell Singnaling Technology公司,美国)、LC3Ⅱ/Ⅰ抗体(Cell Singnaling Technology公司,美国)、FTH1抗体(Cell Singnaling Technology公司,美国)、GPX4抗体(武汉三鹰生物技术有限公司)、β-actin抗体(武汉三鹰生物技术有限公司)、神经元核抗原NEUN抗体(Monoclonal公司,美国)、荧光二抗(山羊抗兔抗体,山羊抗小鼠抗体,武汉三鹰生物技术有限公司)、荧光定量PCR相关试剂(Takara公司,日本)、尼氏(Nissl)染色液(碧云天生物技术有限公司),组织铁含量测定试剂盒、GSH试剂盒、脂质过氧化物产物丙二醛(malonaldehyde, MDA)试剂盒、GPX4活性试剂盒均购于南京建成生物试剂公司。
1.3 SD大鼠SAH模型构建采用SURUKI等[8]报道的血管内穿刺法构建SAH模型,选用戊巴比妥(50 mg/kg)通过腹腔注射麻醉大鼠,使其仰卧位固定,取正中切口暴露和分离颈总动脉、颈外动脉和颈内动脉。于颈外动脉远端结扎并切断颈外动脉,上静脉夹于颈内动脉及颈总动脉以阻断血流,并于颈外动脉残端作一“V”形切口,再将4-0尼龙线沿切口导入,经颈总动脉至颈内动脉颅内段,自觉有阻力感后继续进线0.2 cm,有落空感即为穿刺成功。10 s后抽出尼龙线,结扎颈外动脉残端并缓慢松开静脉夹,缝合伤口。假手术组操作方法同模型组,但尼龙线穿入后不刺破血管。
1.4 慢病毒侧脑室注射自噬相关(Atg)基因在自噬的介导中起着重要作用。其中,Atg5对自噬体的形成至关重要[7],因此选择用LV-ATG5沉默ATG5 mRNA的表达,从而抑制自噬。在SAH手术前7 d,于SD大鼠侧脑室内注射LV-ATG5或LV-Scramble。简言之,腹腔注射戊巴比妥(50 mg/kg)使大鼠麻醉并置于立体定位装置(Stoelting,美国)中。于右半球前囟旁1.3 mm,后1.5 mm处钻1个孔,将10 μL Hamilton注射器(Hamilton Co.,美国)通过立体定位插入到为侧脑室注射准备的孔中(硬脑膜表面下3.8 mm)。将5 μL LV-ATG5(1×109 TU/mL)或LV-Scramble(1×109 TU/mL)以0.5 μL/min的速度注入右半球。将针保持在适当位置5 min以防止回流,然后缓慢取出。
1.5 指标检测及方法 1.5.1 免疫荧光检测大鼠于SAH后24 h用生理盐水、4%多聚甲醛灌注后取出脑组织,经后固定、脱水后冻存于-80 ℃,而后制作成10 μm厚的冰冻切片备用。取出晾干10 min,PBS洗片3次,每次10 min;0.5%Triton破膜2 h后洗片3次,每次10 min;枸橼酸盐溶液修复后自然冷却,洗片3次,每次10 min;山羊血清37℃孵育2 h后,擦干周围多余血清,滴加目的蛋白一抗和NEUN一抗4 ℃过夜。次日37 ℃复温1 h后洗片3次,每次10 min,滴加绿色与红色荧光二抗于37 ℃孵育2 h后洗片3次,每次10 min;DAPI染核10 min后洗片5次,每次10 min,甘油封片后观察ATG5、FTH1和GPX4在SAH 24 h后脑皮质的表达定位情况。
1.5.2 Real-time PCR检测按Takara公司说明书提取各组大鼠大脑皮质总RNA,用于PCR检测。引物购于上海生工,根据GenBank提供的基因序列,扩增大鼠ATG5 mRNA引物为Forward:5′- TGAACGAGA-AGCAGAGCCATAC-3′,Reverse: 5′-TGTGATGTTCCAA-GGCAGAGC-3′,扩增长度220 bp,参考基因β-actin引物序列为Forward: 5′-TGTCACCAACTGGGACGATA-3′,Reverse: 5′-GGGGTGTTGAAGGTCTCAAA-3′。扩增条件为预变性95 ℃ 30 s,PCR反应95 ℃ 5 s、60 ℃ 30 s,40个循环。
1.5.3 Western blot检测既往研究报道,SAH后24 h自噬出现高峰,其标志蛋白LC3Ⅱ表达量达到最高[3]。因此选择24 h作为干预时间点,以判断LV-ATG5对沉默ATG5和抑制自噬的效果。细胞内富余的游离铁以铁蛋白形式储存,而FTH1是细胞内铁蛋白的重要组成部分,也是反映细胞内铁稳态的关键指标。GPX4是调控铁死亡的重要蛋白,铁死亡发生时GPX4的表达减少、活性降低。于SAH后24 h将脑组织取出,置于EP管中冻存于-80 ℃。分别称取各组皮质0.2 g于EP管中,每管加入组织裂解液和蛋白酶抑制剂混合液600 μL,超声打碎组织后于冰上静置20 min。4 ℃,12 000 r/min离心15 min,取上清液,用BCA试剂盒侧浓度后稀释为同一浓度标准,煮沸5~8 min,3 000 r/min离心1 min后加样。凝胶电泳后将蛋白转至PVDF膜,5%脱脂牛奶封闭2 h后置于一抗中4 ℃过夜。次日洗膜3次,每次10 min,然后滴加二炕孵育1 h,再洗膜3次,每次10 min。滴加ECL发光液后即可显影,用Fusion软件分析条带灰度值。
1.5.4 早期脑损伤指标及检测方法① 神经行为学评分:参照SUGAWARA等[9]的方法,在SAH后24 h(动物被处死前)使用Modified Garcia Scale以盲法评估神经功能缺损情况。通过这个总分为18分的评分系统,测试了以下6个项目:自主活动,四肢自主运动,前肢伸展性,攀爬运动,肢体的本体感觉以及触须反应。得分越低提示神经功能缺损情况越严重;②干湿法测定脑水含量:脑水含量通过HE等[10]报道的标准干/湿法测量。
在SAH后24 h麻醉并处死大鼠,立即取出大脑并分离出左、右半球,小脑和脑干。去除表面血块、脑膜后,立即称量各脑区脑组织质量,即为湿质量,然后在烘箱中干燥24 h后再次称取,获得干质量。脑组织含水量=(湿质量-干质量)/湿质量×100%。
1.5.5 尼氏染色将脑组织冰冻切片取出后放入双蒸水中洗2次,每次2 min。然后将切片放入尼氏染色液中染色10 min,蒸馏水洗涤2次,每次5 s。之后在95%的乙醇中脱水5 s,70%的乙醇中脱水2次,每次5 s,最后蒸馏水洗涤1次,中性树脂封片后在光镜下观察。
1.5.6 铁死亡检测及方法铁死亡检测指标包括:细胞内铁沉积、组织铁含量、脂质过氧化物产物MDA含量、GSH含量、GPX4活性等[4, 11-12]。①普鲁士蓝染色(Koeppen’s Perls’Prussian blue staining)检测细胞内铁沉积情况:SAH后24 h大鼠脑组织用于普鲁士蓝染色。将脑组织制作成厚度为10 μm的石蜡切片,然后放入二甲苯Ⅰ和二甲苯Ⅱ中各15 min;用100%、95%、85%、80%、75%和70%的乙醇溶液梯度水合各1 min,放入Perls′染色液(80 mL 20%HCl和80 mL 10%亚铁氰化钾)中浸泡20~30 min并用蒸馏水洗涤3次;HE染色1 min后,置于80%、85%、90%和100%的乙醇溶液中快速梯度脱水,每次5 s。最后用二甲苯固定切片,并用中性树脂封片;②用组织铁含量试剂盒、脂质过氧化物产物MDA试剂盒、GSH试剂盒及GPX4试剂盒分别检测抑制自噬前后脑组织铁含量、脂质过氧化物含量、GSH表达量以及GPX4活性的变化。以上检测具体步骤均参照厂家说明书。
1.6 统计学分析所有数据运用SPSS 20.0统计软件,计量资料均用 x±s表示,两组间比较采用t检验; 多组间比较采用单因素分析,事后检验采用Dunnett’s检验比较两组之间的差异。检验水准α= 0.05。
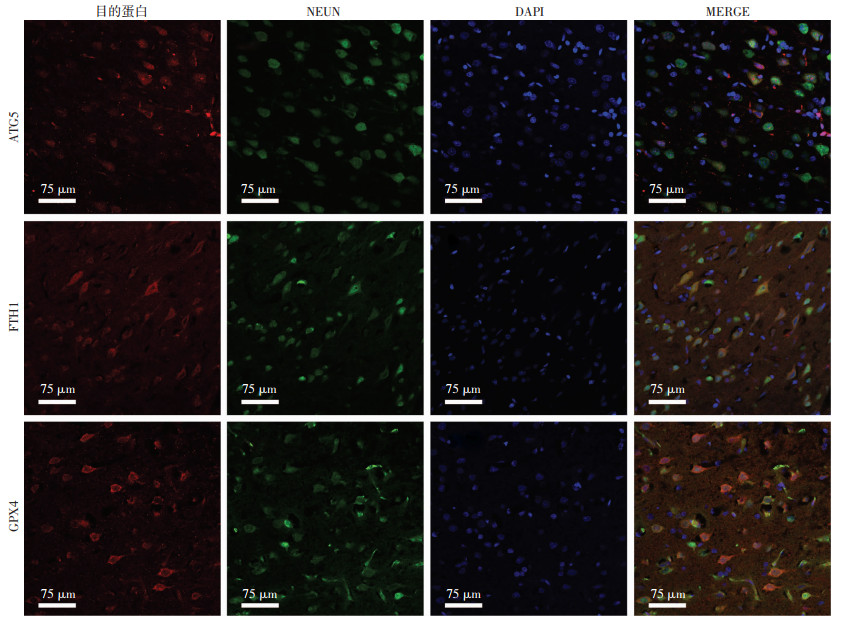
2 结果 2.1 ATG5、FTH1和GPX4在大鼠皮质神经元的定位取大鼠SAH后24 h脑组织切片进行免疫荧光染色,结果显示:ATG5、FTH1和GPX4在脑组织中广泛表达。采用神经元标记物NEUN分别与ATG5、FTH1和GPX4进行荧光双染,发现三者均主要表达于神经元胞质中(图 1)。
|
| 图 1 免疫荧光检测ATG5、FTH1和GPX4在大鼠皮质神经元中的表达定位情况 |
2.2 自噬抑制及抑制自噬后神经元损伤、早期脑损伤的变化 2.2.1 LV-ATG5干预后ATG5 mRNA和ATG5、LC3Ⅱ蛋白表达情况
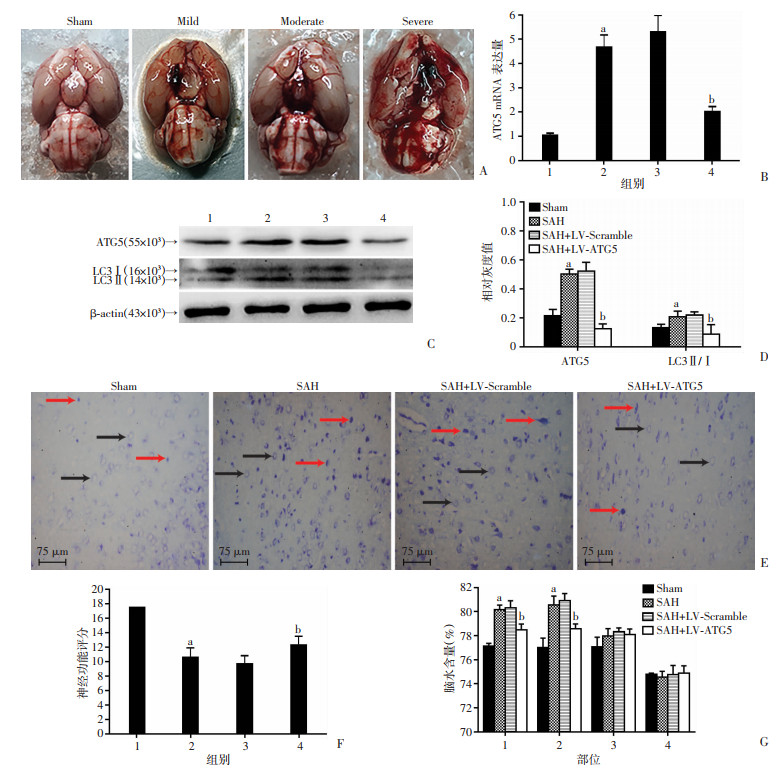
SAH后24 h后,假手术组未见明显出血,SAH组脑组织表面可见不同程度的明显出血(图 2A)。慢病毒干预后,与SAH组和SAH+LV-Scramble组比较,SAH+LV-ATG5组ATG5 mRNA的表达显著降低(P < 0.05),SAH+LV-ATG5组ATG5和LC3Ⅱ/Ⅰ蛋白水平也明显降低(P < 0.05,图 2B~D),说明LV-ATG5有效地沉默了ATG5 mRNA,从而达到了抑制自噬的目的。
|
| A:造模后,脑底部蛛网膜下腔出血程度的观察;B:PCR检测LV-ATG5干预后,ATG5 mRNA表达1:Sham组;2:SAH组;3:SAH+LV-Scramble组;4:SAH+LV-ATG5组;C:Western blot检测LV-ATG5干预后ATG5和LC3Ⅱ/Ⅰ蛋白表达1:Sham组;2:SAH组;3:SAH+LV-Scramble组;4:SAH+LV-ATG5组;D:Western blot半定量分析;E:Nissl染色检测自噬抑制前后神经元的形态结构和存活情况黑色箭头示正常神经元,红色箭头示受损神经元;F:自噬抑制前后神经行为学评分1:Sham组;2:SAH组;3:SAH+LV-Scramble组;4:SAH+LV-ATG5组;G:自噬抑制前后脑水肿变化情况1:左脑半球;2:右脑半球;3:小脑;4:脑干a:P < 0.05,与Sham组比较;b:P < 0.05,与SAH组和SAH+LV-Scramble组比较 图 2 自噬抑制及抑制自噬后神经元损伤、早期脑损伤的变化 |
2.2.2 LV-ATG5抑制自噬后神经元损伤的变化情况
尼氏体是神经元内合成蛋白质的重要部位,当神经元受到刺激后,胞质内的尼氏体数量、形态发生变化。在Sham组中,Nissl染色显示神经元轮廓清晰,结构紧凑,富含胞质和尼氏体。然而,在SAH组和SAH+LV-Scramble组中观察到明显的神经元丢失和变性,神经元排列稀疏,轮廓模糊。抑制自噬显著增加了存活神经元的数量,改善了神经元的形态(图 2E)。
2.2.3 LV-ATG5抑制自噬后EBI变化情况的检测神经行为学评分和脑水肿是反映SAH后EBI的重要指标。与Sham组相比,SAH后24 h神经行为学评分显著降低,左右脑半球脑水含量明显增加(P < 0.05);而用LV-ATG5抑制自噬后,与SAH和SAH+LV-Scramble两组相比,神经行为学评分和脑水肿显著改善(P < 0.05,图 2F、G)。
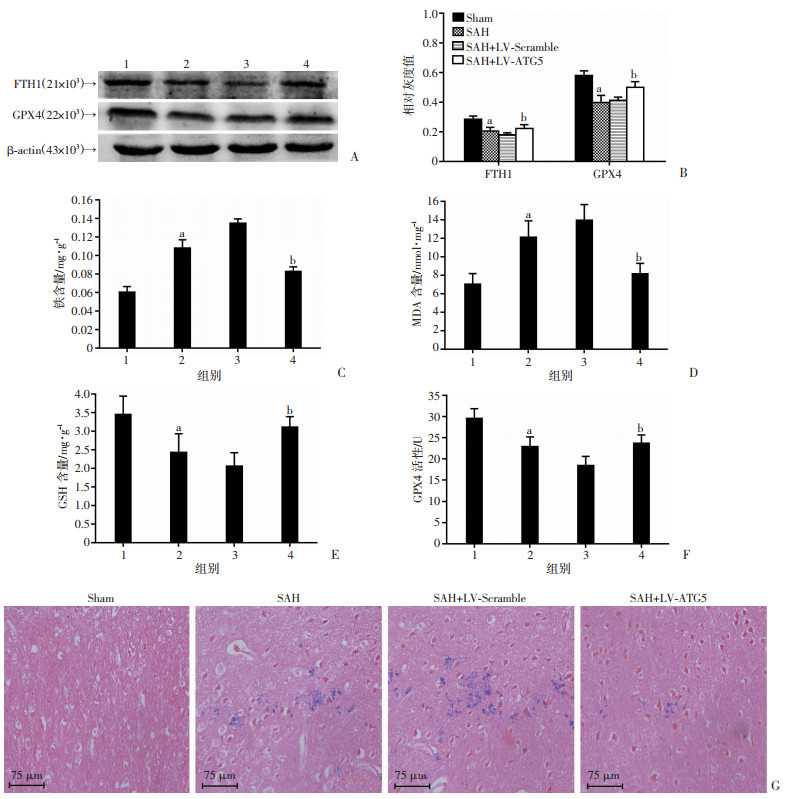
2.3 抑制自噬前后通路相关蛋白及下游指标的变化 2.3.1LV-ATG5抑制自噬后铁代谢及铁死亡相关蛋白FTH1和GPX4的表达SAH后,FTH1和GPX4的表达量明显下降(P < 0.05)。用LV-ATG5抑制自噬后发现,与SAH组和SAH+LV-Scramble组相比,SAH+LV- ATG5组内FTH1和GPX4的表达量显著增加(P < 0.05, 图 3A, B),铁蛋白的降解和铁死亡减轻。以上结果提示自噬参与调控细胞内铁代谢,通过降解细胞内铁蛋白从而诱导细胞铁死亡。
|
| A:Western blot检测LV-ATG5干预前后FTH1和GPX4蛋白表达1:Sham组;2:SAH组;3:SAH+LV-Scramble组;4:SAH+LV-ATG5组;B:Western blot半定量分析;C~G:抑制自噬前后细胞内铁沉积、游离铁含量、MDA含量、GSH含量及GPX4活性 1:Sham组;2:SAH组;3:SAH+LV-Scramble组;4:SAH+LV-ATG5组;a:P < 0.05,与Sham组比较;b:P < 0.05, 与SAH组和SAH+LV-Scramble组比较 图 3 自噬促进神经元死亡的通路相关蛋白及下游指标变化 |
2.3.2
LV-ATG5抑制自噬后铁死亡相关指标的变化SAH后,普鲁士蓝染色显示细胞内游离铁沉积明显增加,脑组织内游离铁含量、脂质过氧化物(MDA)含量明显增加,而GSH含量显著减少,GPX4酶活性降低。与SAH组、SAH+LV-Scramble组相比,SAH+LV-ATG5组中普鲁士蓝染色提示细胞内铁沉积减少,脑组织内铁含量、脂质过氧化物(MDA)含量减少(P < 0.05),而GSH含量和GPX4酶活性增加(P < 0.05,图 3C~G)。提示抑制自噬后,神经元内游离铁含量减少,铁死亡减轻。
3 讨论自噬是一种进化保守的降解途径,在维持细胞稳态中起关键作用。自噬途径参与神经退行性变、脑缺血和创伤性脑损伤等多种中枢神经系统(CNS)疾病[13]。研究发现,自噬是介导SAH后EBI的关键病理机制之一。LEE等[2]和WU等[14]报道了SAH后急性期神经元中的自噬途径即被激活并参与SAH后EBI的病理过程。
2012年,DIXON等[4]报道了一种新型程序性细胞死亡模式——铁死亡,其特征是谷胱甘肽(GSH)耗竭、GPX4的失活,最终导致铁依赖的脂质过氧化物(lipid peroxidation,LPO)蓄积。有趣的是,新近研究发现自噬和铁死亡存在着重要联系。HOU等[6]通过在永生化小鼠胚胎成纤维细胞(MEFs)、人胰腺癌细胞系(PANC1和PANC2.03)和人纤维肉瘤细胞系HT-1080中敲低ATG5和ATG7,进而抑制自噬后发现,细胞内游离铁水平和脂质过氧化终产物(如MDA)水平均显著下降,而细胞内稳定铁蛋白标志物FTH1的表达显著上升。其研究揭示了自噬和铁死亡在基因层面的关系,自噬通过降解铁蛋白,增加细胞内游离铁含量,从而促进细胞内LPO蓄积,随后铁死亡发生。GAO等[7]在随后的研究里进一步证实了此种关系。这种以铁蛋白为降解底物的特殊自噬途径被称为铁自噬(ferrotinophagy)[6, 7, 15],是一种自噬性细胞死亡方式(autophagic cell death),它极大地引起了我们的兴趣。铁死亡被证实参与神经退行性变、缺血/再灌注损伤和癌症等疾病的病理过程[16],而自噬可以通过促进铁蛋降解诱发铁死亡,由此大家把目光转向了铁自噬,以期通过调节铁自噬达到治疗上述疾病的目的。近年来铁自噬在神经退行性变、肿瘤和感染性疾病中均有研究[17-19],其相关性也得到了直接或间接的证实。
课题组前期研究发现[5],SAH后神经元内游离铁含量增加,铁死亡发生并加重EBI。有研究发现[2, 14],SAH后早期阶段同侧额-基底皮质的自噬活性显著增加,且在EBI的过程中发挥深远影响。自噬和铁死亡均参与SAH后EBI的病理过程,但二者的关系和相互作用机制却鲜有报道。由此我们猜想,自噬可能通过降解神经元内铁蛋白,增加神经元内游离铁和脂质过氧化物含量,从而促进神经元铁死亡,加重EBI。
本研究中,我们采用免疫荧光双标法发现SAH后24小时ATG5、FTH1、GPX4均在大鼠脑皮质神经元内广泛表达,采用Lentivirus-ATG5(LV-ATG5)有效抑制自噬后,SAH模型大鼠脑皮质神经元损伤、神经功能缺损情况明显改善,脑水肿减轻,提示SAH后早期抑制自噬达到了减轻脑损伤的作用。为进一步明确SAH后自噬引起神经元铁死亡的可能机制,我们分别检测了铁蛋白和铁死亡的相关指标,本研究结果表明抑制自噬后可上调脑内FTH1和GPX4的表达,降低神经元内游离铁含量和MDA含量,增加GSH含量,提高GPX4活性,表明SAH后自噬可能通过降解铁蛋白促进神经元铁死亡。
目前自噬在细胞中的作用仍存在争议。在大多数条件下,自噬作为一种促生存机制,对细胞起正向保护作用[20]。另一方面,新近研究报道,在某些特定背景下,自噬也可能是促进细胞死亡的方式,即自噬性细胞死亡,如前述的自噬通过降解铁蛋白导致细胞铁死亡。对于自噬在中枢神经系统疾病中的作用也是富有争议性的。部分学者[21-23]认为SAH后自噬通过抑制神经元凋亡等途径减轻EBI,但也有学者在脑缺血、脑缺氧、外伤性脑出血模型中报道了抑制自噬后神经元死亡减少,神经功能改善的现象[24-26]。
本研究通过从基因层面抑制自噬,达到了改善神经元死亡,减轻SAH后EBI的效果。通过对其具体机制的进一步探索发现,自噬可能通过降解神经元内铁蛋白,从而促进神经元铁死亡,加重EBI。但对于自噬在SAH中的作用仍不可一概而论,需根据其作用背景对其作用进行更为客观、全面的分析。本研究旨在探明自噬在SAH后促进神经元铁死亡的方式,将对阻断神经元铁死亡从而改善SAH患者的预后提供重要依据。实验仍存在一些不足之处,如未对更深入、具体的机制进行探索,EBI的检测时间点较单一等。在后期的实验中,我们将对自噬促进神经元铁死亡的具体通路进行深入研究。
| [1] |
SEHBA F A, HOU J, PLUTA R M, et al. The importance of early brain injury after subarachnoid hemorrhage[J]. Prog Neurobiol, 2012, 97(1): 14-37. DOI:10.1016/j.pneurobio.2012.02.003 |
| [2] |
LEE J Y, HE Y, SAGHER O, et al. Activated autophagy pathway in experimental subarachnoid hemorrhage[J]. Brain Res, 2009, 1287: 126-135. DOI:10.1016/j.brainres.2009.06.028 |
| [3] |
ZHAO H, JI Z, TANG D, et al. Role of autophagy in early brain injury after subarachnoid hemorrhage in rats[J]. Mol Biol Rep, 2013, 40(2): 819-827. DOI:10.1007/s11033-012-2120-z |
| [4] |
DIXON S J, LEMBERG K M, LAMPRECHT M R, et al. Ferroptosis:an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5): 1060-1072. DOI:10.1016/j.cell.2012.03.042 |
| [5] |
张红霞, 蒋登志, 车旭东, 等. 依布硒林减轻DMT1诱导的铁死亡在实验性大鼠蛛网膜下腔出血中的研究[J]. 第三军医大学学报, 2017, 39(16): 1618-1624. ZHANG H X, JIANG D Z, CHE X D, et al. Ebselen relieves ferroptosis induced by divalent mental transporter 1 in rats with subarachnoid hemorrhage[J]. J Third Mil Med Univy, 2017, 39(16): 1618-1624. DOI:10.16016/j.1000-5404.201701128 |
| [6] |
HOU W, XIE Y, SONG X, et al. Autophagy promotes ferroptosis by degradation of ferritin[J]. Autophagy, 2016, 12(8): 1425-1428. DOI:10.1080/15548627.2016.1187366 |
| [7] |
GAO M, MONIAN P, PAN Q, et al. Ferroptosis is an autophagic cell death process[J]. Cell Res, 2016, 26(9): 1021-1032. DOI:10.1038/cr.2016.95 |
| [8] |
SUZUKI H, HASEGAWA Y, KANAMARU K, et al. Mechanisms of osteopontin-induced stabilization of blood-brain barrier disruption after subarachnoid hemorrhage in rats[J]. Stroke, 2010, 41(8): 1783-1790. DOI:10.1161/strokeaha.110.586537 |
| [9] |
SUGAWARA T, AYER R, JADHAV V, et al. A new grading system evaluating bleeding scale in filament perforation subarachnoid hemorrhage rat model[J]. J Neurosci Methods, 2008, 167(2): 327-334. DOI:10.1016/j.jneumeth.2007.08.004 |
| [10] |
HE Z, OSTROWSKI RP, SUN X, et al. CHOP silencing reduces acute brain injury in the rat model of subarachnoid hemorrhage[J]. Stroke, 2012, 43(2): 484-490. DOI:10.1161/strokeaha.111.626432 |
| [11] |
关鹏, 石振华, 李亚青, 等. 铁死亡:一种新的细胞死亡方式[J]. 生物化学与生物物理进展, 2013, 40(02): 137-140. GUAN P, SHI Z H, LI Y Q, et al. Ferroptosis:a new kind of cell death[J]. Prog Biochem and Biophys, 2013, 40(2): 137-140. |
| [12] |
XIE Y, HOU W, SONG X, et al. Ferroptosis:process and function[J]. Cell Death Differ, 2016, 23(3): 369-379. DOI:10.1038/cdd.2015.158 |
| [13] |
SHI L, LIANG F, ZHENG J, et al. Melatonin regulates apoptosis and autophagy via ROS-MST1 pathway in subarachnoid hemorrhage[J]. Front Mol Neurosci, 2018, 11: 93. DOI:10.3389/fnmol.2018.00093 |
| [14] |
WU H, NIU H, WU C, et al. The autophagy-lysosomal system in subarachnoid haemorrhage[J]. J Cell Mol Med, 2016, 20(9): 1770-1778. DOI:10.1111/jcmm.12855 |
| [15] |
MANCIAS J D, WANG X, GYGI S P, et al. Quantitative proteomics identifies NCOA4 as the cargo receptor mediating ferritinophagy[J]. Nature, 2014, 509(7498): 105-109. DOI:10.1038/nature13148 |
| [16] |
SANTANA-CODINA N, MANCIAS J D. The role of NCOA4-mediated ferritinophagy in health and disease[J]. Pharmaceuticals (Basel), 2018, 11(4). DOI:10.3390/ph11040114 |
| [17] |
DO VAN B, GOUEL F, JONNEAUX A, et al. Ferroptosis, a newly characterized form of cell death in Parkinson's disease that is regulated by PKC[J]. Neurobiol Dis, 2016, 94: 169-178. DOI:10.1016/j.nbd.2016.05.011 |
| [18] |
BAUCKMAN K A, MYSOREKAR I U. Ferritinophagy drives uropathogenic Escherichia coli persistence in bladder epithelial cells[J]. Autophagy, 2016, 12(5): 850-863. DOI:10.1080/15548627.2016.1160176 |
| [19] |
ROCKFIELD S, FLORES I, NANJUNDAN M. Expression and function of nuclear receptor coactivator 4 isoforms in transformed endometriotic and malignant ovarian cells[J]. Oncotarget, 2018, 9(4): 5344-5367. DOI:10.18632/oncotarget.23747 |
| [20] |
MASALDAN S, CLATWORTHY SAS, GAMELL C, et al. Iron accumulation in senescent cells is coupled with impaired ferritinophagy and inhibition of ferroptosis[J]. Redox Biol, 2018, 14: 100-115. DOI:10.1016/j.redox.2017.08.015 |
| [21] |
JING C H, WANG L, LIU P P, et al. Autophagy activation is associated with neuroprotection against apoptosis via a mitochondrial pathway in a rat model of subarachnoid hemorrhage[J]. Neuroscience, 2012, 213: 144-153. DOI:10.1016/j.neuroscience.2012.03.055 |
| [22] |
FANG Y, CHEN S, REIS C, et al. The role of autophagy in subarachnoid hemorrhage:an update[J]. Curr Neuropharmacol, 2018, 16(9): 1255-1266. DOI:10.2174/1570159x15666170406142631 |
| [23] |
HO W M, AKYOL O, REIS H, et al. Autophagy after subarachnoid hemorrhage:can cell death be good?[J]. Curr Neuropharmacol, 2018, 16(9): 1314-1319. DOI:10.2174/1570159x15666171123200646 |
| [24] |
WEN Y D, SHENG R, ZHANG L S, et al. Neuronal injury in rat model of permanent focal cerebral ischemia is associated with activation of autophagic and lysosomal pathways[J]. Autophagy, 2008, 4(6): 762-769. DOI:10.4161/auto.6412 |
| [25] |
KOIKE M, SHIBATA M, TADAKOSHI M, et al. Inhibition of autophagy prevents hippocampal pyramidal neuron death after hypoxic-ischemic injury[J]. Am J Pathol, 2008, 172(2): 454-469. DOI:10.2353/ajpath.2008.070876 |
| [26] |
XING S, ZHANG Y, LI J, et al. Beclin 1 knockdown inhibits autophagic activation and prevents the secondary neurodegenerative damage in the ipsilateral thalamus following focal cerebral infarction[J]. Autophagy, 2012, 8(1): 63-76. DOI:10.4161/auto.8.1.18217 |



