2. 400016 重庆,重庆医科大学基础医学院:发育生物学研究室
2. Department of Developmental Biology, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016, China
肾间质纤维化是慢性肾脏疾病发展为终末期肾脏衰竭的共同病变过程,而肾小管上皮细胞间充质转分化(epithelial-mesenchymal transition, EMT)是肾间质纤维化的主要病变原因[1]。越来越多的研究表明, 引起Peutz-Jeghers综合征(PJS)的丝氨酸/苏氨酸蛋白激酶Lkb1[2]调节肿瘤细胞的EMT、转移和侵袭过程,如肝癌细胞[3]、肺癌细胞[4]、卵巢癌细胞[5]、胃癌细胞[6]等。受lkb1调节的EMT相关分子如ZEB1、E-cadherin、vimentin、β-catenin,已经明确引起EMT的信号通路如TGF-β[7]、Ras[8-9]都与lkb1相关,但目前关于lkb1引起EMT的机制还不明确。另一方面初级纤毛是大多数类型的细胞表面非运动性丝状结构(包括肾小管),纤毛含有复杂的大分子运输系统接受信号刺激,并影响细胞大小、极性、细胞周期及迁移。肾脏纤毛病与囊肿、炎症和纤维化密切相关,而lkb1作为纤毛中的代谢传感器[10],在肾脏发育和疾病发生中的作用机制不清楚。因此,研究肾脏发育过程中lkb1的作用对深入认识lkb1在EMT进展中的机制至关重要。近几年CRISPR/Cas9基因编辑技术因高效、成本低等优势已经在体外[11-12]和体内[13-14]实验中得到广泛应用,本课题组利用CRISPR/Cas9基因编辑技术成功构建了其他基因的敲除模型[15]。通过比较发现人与斑马鱼lkb1蛋白有82%的同源性,目前已经利用斑马鱼研究了lkb1基因对血糖稳态的影响[16],更重要的是斑马鱼整个发育过程都在体外完成,个体小,产卵量大,胚胎透明,容易干预,肾脏结构简单,已经成为研究肾脏的良好模式生物。因此,本研究选择斑马鱼作为研究对象,利用CRISPR/Cas9基因编辑技术构建斑马鱼lkb1突变体,为进一步阐释Lkb1在肾脏EMT中的作用奠定基础。
1 材料与方法 1.1 材料 1.1.1 实验动物AB品系斑马鱼, 海圣水循环系统中喂养。胚胎使用holtfreter溶液置于28.5 ℃恒温培养箱培养。
1.1.2 试剂质粒SP6-Cas9由重庆大学王业启教授馈赠;NotⅠ核酸内切酶购自TaKaRa公司;phusion® hot start flex 2×master Mix和HiScribe T7 Quick High Yield RNA Synthesis Kit(E2050S)购自NEB公司;天根普通DNA产物纯化试剂盒(DP204-02)和miRcute miRNA lsolation Kit(DP501)购自天根生化科技有限公司;mMessAGE mMACHINE® SP6 Transcription Kit(AM1340)购自Invitrogen公司;RNA lnhibitor购自sigma公司;qiagen RNeasy® Mini Kit(74104)购自Qiagen公司;兔抗人GAPDH(10494-1-AP)和LKB1(10746-1-AP)多克隆抗体购自Proteintech公司。
1.1.3 仪器显微注射器,p-97微电极拉制仪和毛细玻璃管购自Sutter公司;PCR仪购自Bio-Rad公司;体式显微镜购自Zeiss公司;全自动凝胶成像系统购自北京赛智创业科技有限公司。
1.2 斑马鱼lkb1基因敲除 1.2.1 gRNA靶位点及鉴定引物设计① 斑马鱼lkb1 gRNA靶位点设计:根据http://chopchop.cbu.uib.no/选择两个位于斑马鱼lkb1基因外显子上没有脱靶、高效的gRNA靶位点(表 1)。②鉴定引物设计:设计前、后引物应距靶位点两端200~300 bp(表 2)。
| 靶位点 | 序列5′→3′ | 位置 |
| gRNA1 | AGCTTGGCACGCTTGCGGCGCGG | 2号外显子上 |
| gRNA2 | GATCGGGAAATACCTGATGGGGG | 2号外显子上 |
| 靶位点 | 引物序列5′→3′ | 片段大小 |
| gRNA1 | 上游:AGATGTCCGGATCTCCAGTAGT | 574 bp |
| 下游:TCACCATATACTGAATGTCGCA | ||
| gRNA2 | 上游:ACAGGCGTTTATCGGCTATTAT | 452 bp |
| 下游:TCACCATATACTGAATGTCGCA |
1.2.2 体外合成gRNA和Cas9 mRNA
① gRNA体外合成。委托生工公司合成上游引物:5′-AATTAATACGACTCACTATA+Lkb1-gRNA+GTTTTAGAGCTAGAAATAGC-3′;下游引物:5′-GATCCGCACCGACCCGACTCGGTGCCACTTTTTCAAGTTGATA ACGGACTAGCCTTATT- TTAACTTGCTATTTCTAGCTCTAAAAC-3′。phusion® hot start flex 2×master Mix PCR扩增,Tian Gen KIT胶回收、纯化PCR产物制备gRNA体外转录模板;HiScribe T7 Quick High Yield RNA Synthesis Kit体外转录gRNA,转录结束后加TURBO DNase消化DNA模板,模板消化后用1%琼脂糖凝胶电泳检测gRNA转录效率,miRcute miRNA lsolation Kit纯化gRNA,Nanodrop测定浓度并用RNase-free water稀释到600 ng/μL, 分装后-80 ℃保存。②Cas9 mRNA体外合成。限制性内切酶NotⅠ线性化pSP6-Cas9质粒,TIANGEN纯化试剂盒纯化酶切产物,Invitrogen mMESSAGE mMACHINETM SP6试剂盒体外转录Cas9 mRNA,转录结束后用TURBO DNase消化DNA模板。模板消化后用1%琼脂糖凝胶电泳检测Cas9 mRNA转录效率。转录产物用qiagen RNeasy Mini Kit纯化。Nanodrop测定Cas9 mRNA浓度并用RNase-free water稀释到800 ng/μL, 分装后-80 ℃保存。
1.2.3 检测gRNA有效性并筛选出突变体① 检测gRNA有效性。将gRNA和Cas9 mRNA混合物显微注射到斑马鱼胚胎一细胞期卵黄中,48 h后用50 mmol/L NaOH和1 mol/L Tris-HCL提取单个幼鱼基因组,用鉴定引物PCR扩增,PCR产物用T7E1核酸内切酶酶切鉴定突变效率,并对可疑产物测序确认。②选择产生高效突变的gRNA显微注射,将幼鱼养到1.5月剪尾鳍测序筛选出突变体,突变体喂养到成鱼后与野生型(wild type,WT)鱼杂交,胚胎测序筛选出可遗传突变体。
1.2.4 杂合子的筛选及纯合子表型鉴定① 杂合子的筛选。可遗传突变体与野生鱼杂交,幼鱼喂养到1.5月剪尾鳍测序筛选出杂合子,杂合子继续喂养到成鱼。②纯合子表型鉴定。相同突变类型杂合子雌鱼和雄鱼自交,观察胚胎发育过程的异常表型(统计死亡数量)拍照并测序鉴定。
1.3 验证纯合子表型 1.3.1 Western blot检测lkb1纯合子蛋白表达情况① 蛋白提取:分别配野生型和杂合子斑马鱼,收取6 d的野生型(WT)和lkb1纯合子(lkb1-/-)幼鱼各100枚,用RIPA裂解液提取蛋白。②免疫印迹。
1.3.2 RT-PCR检测lkb1纯合子糖代谢关键酶和肾小管标志蛋白的mRNA水平① 设计RT-PCR引物见表 3。②总RNA提取。分别配野生型和杂合子斑马鱼,收取7 d野生型和纯合子幼鱼各30枚,使用TRIzol提取总RNA,并测定RNA浓度。③使用TaKaRa逆转录试剂盒逆转录成cDNA。④RT-PCR检测糖代谢关键酶和肾小管标志蛋白的mRNA水平。
| 基因 | 引物序列5′→3′ | 片段大小 |
| g6pase | 上游:TATGGGAGACCCGAAAGC | 165 bp |
| 下游:TGTCCAATCCACCAGTAAGG | ||
| pdk2b | 上游:TTAGGAACAGGCACAATGAC | 135 bp |
| 下游:ATGCGAATGGAAACACG | ||
| pepck1 | 上游:GCTGCCCTCTGCCACTCAA | 258 bp |
| 下游:CCGCTGCGAAATACTTCTTTG | ||
| trmp7 | 上游:AGATGAAATAGTGCCGACCAA | 255 bp |
| 下游:GAGGACGCAGTTCTTTAGTG | ||
| slc12a1 | 上游:CAGGGCAAGGGCAACA | 286 bp |
| 下游:GCAGACGAAACGGCTCAAT | ||
| slc12a3 | 上游:GATGAGGCAACAAAGGAAT | 188 bp |
| 下游:CAAGCCATGTAAAGAGGACTA |
1.4 统计学处理
各实验至少重复3次,使用SPSS 21.0统计软件进行单因素方差分析。检验水准:α=0.05。
2 结果 2.1 制备了sgRNA和Cas9 mRNA琼脂糖凝胶电泳结果表明成功转录出了lkb1-gRNA1、gRNA2(图 1A)和Cas9 mRNA(图 1B)。Nanodrop测定lkb1-gRNA1、gRNA2和Cas9 mRNA浓度分别为2400、4900、1200 ng/μL。

|
| A:体外转录lkb1-gRNA M:DNA标准(DL2000);1: lkb1-gRNA1;2:lkb1-gRNA2;B:体外转录Cas9 mRNA M:DNA标准(DL10000);1:第1份线性化sp6-Cas9质粒转录的mRNA;2:第2份线性化sp6-Cas9质粒转录的mRNA 图 1 体外转录合成gRNA和Cas9 mRNA |
2.2 鉴定出lkb1-sgRNA2有效
lkb1-gRNA2与Cas9 mRNA显微共注射后提48 h胚胎基因组,鉴定引物PCR产物使用T7E1酶切后琼脂糖凝胶电泳(图 2A)表明lkb1-gRNA2注射后(胚胎5)产生明显突变。PCR产物测序,测序重叠峰(图 2B)出现在lkb1-gRNA2靶位点(黑色线框所标注的序列)酶切位点附近,确定lkb1-gRNA2诱导突变有效。

|
| A:T7E1酶切PCR产物(注射lkb1-gRNA2和Cas9mRNA后48 h提基因组,用鉴定引物PCR)鉴定突变效率M:DNA标准(DL2000);1~6:6枚胚胎各自的PCR产物酶切结果;5号鱼酶切条带最明显;B:5号测序结果与野生型比较WT:表示野生鱼的测序结果;黑线框表示lkb1-gRNA2靶位点序列;MU(MIX):表示5号鱼测序结果,与野生鱼比较,在靶位点处产生明显重叠峰 图 2 T7E1酶切及测序鉴定gRNA有效性 |
2.3 筛选出3种杂合子突变体
lkb1-gRNA2注射产生的胚胎喂养到1.5月剪尾鳍测序筛选出突变体,将突变体喂养到成鱼,与野生型杂交检测胚胎基因型筛选出可遗传突变体,将野生鱼和可遗传突变体杂交产生F1代,喂养到1.5月剪尾鳍测序筛选出3种预测产生移码突变并且提前终止翻译的杂合子K48、K44、K68(图 3A),其中K68突变体缺失7个碱基,预测只翻译59个氨基酸(图 3B);K44突变体缺失4个碱基,预测只翻译60个氨基酸;K48突变体缺失3个碱基,预测产生较长的移码突变氨基酸序列。

|
| A:lkb1的3种突变类型WT:野生型,下划线:表示野生型靶位点序列;红色字母:示PAM区;K48:缺失3个碱基的突变体;K44:缺失4个碱基的突变体;K68:缺失7个碱基的突变体;B:K68杂合子测序结果在靶位点处产生双峰 图 3 杂合子突变体类型和k68杂合子测序结果 |
2.4 斑马鱼lkb1纯合子表型
同种突变类型的杂合子成鱼雌雄自交产生F2代胚胎,通过观察发育期发现在受精后第5天有25%幼鱼未形成鱼鳔,体轴靠近头部轻微出现腹侧、侧向弯曲,卵黄比野生型更小,肠道开始出现坏死水肿,头尾同时高频率摆动做无定向运动。6 d出现死亡,体轴弯曲更加明显,躯干更加纤细,肠道病变坏死水肿加重,肝脏变暗。7 d死亡更多(主要是躯干严重弯曲型),肝脏变黑,肠道水肿坏死更加明显(图 4A、B)。9 d大多数死亡(图 4C)。同时对这种异常表型测序进行验证,结果都是纯合子(图 4D)。氨基酸序列比对及移码突变在Lkb1蛋白的位置(图 4E),确定纯合子lkb1-K68-/-突变体只翻译了59个氨基酸,且与野生型一样的氨基酸只有49个,在Lkb1功能域之前终止,表明lkb1-K68-/-突变体完全敲除了Lkb1。
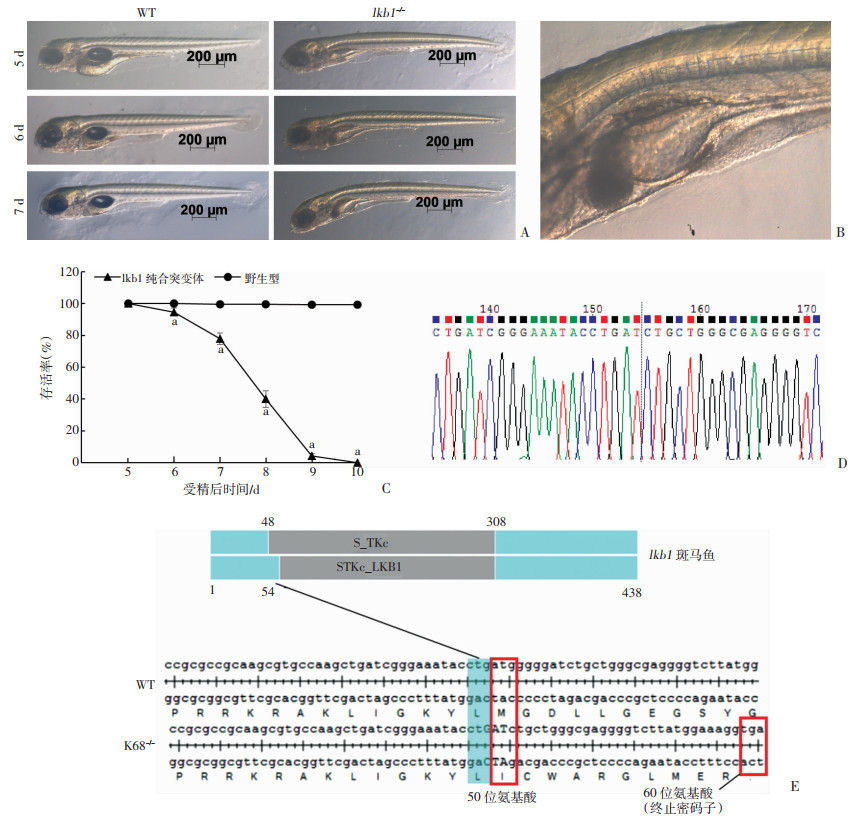
|
| A:lkb1纯合子表型WT:野生型受精后的表型;lkb1-/-:K68纯合子突变体受精后的表型,鱼鳔缺失,肝脏逐渐变黑,体轴逐渐弯曲,肠道水潴留;B:的K68纯合子7 d局部表型;C:lkb1纯合子生存曲线;D:K68纯合子测序结果与较野生型缺失了7个碱基;E:纯合子lkb1-K68-/-突变体氨基酸序列及蛋白质位置WT:野生型斑马鱼序列;K68-/-:K68纯合子序列;绿色背景示K68-/-从这个氨基酸开始产生移码突变,红色线框(50位氨基酸)表示第1个产生移码突变的氨基酸是第50位;60位氨基酸(终止密码子)表示K68-/-突变体翻译到这个位点终止,黑色实线表示移码突变发生在Lkb1功能域起点位置 图 4 斑马鱼lkb1-k68纯合子对表型、基因及蛋白表达的影响 |
2.5 Western Blot检测不到纯合子Lkb1表达
提取6 d的k68-lkb1-/-和野生幼鱼蛋白,免疫印迹检测Lkb1表达情况,结果表明鉴定出的lkb1-/-表型与野生型比较完全不表达Lkb1(P < 0.05,图 5A),证明鉴定出的纯合子表型是敲除Lkb1特异的,同时也确定敲除了Lkb1。
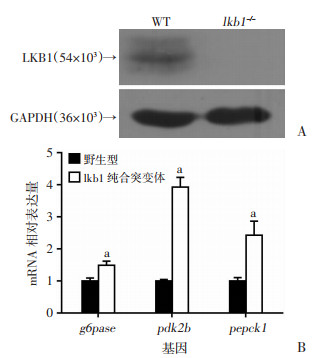
|
| A:Western blot检测lkb1纯合子蛋白表达WT:6 d的野生型鱼;lkb1-/-:6 d的lkb1纯合子鱼;B:RT-PCR检测lkb1纯合子g6pase、pdk2b、pcpck1的水平 野生型:7 d的野生型鱼;lkb1纯合突变体:7 d的lkb1纯合子鱼;a:P < 0.05, 与野生型比较 图 5 Western blot和RT-PCR验证lkb1突变体 |
2.6 lkb1纯合子能量代谢功能相关的酶RNA水平上调
Lkb1敲除表现出饥饿状态,葡萄糖产生增多,葡萄糖-6-磷酸酶(g6Pase)、磷酸烯醇丙酮酸羧激酶1(pepck1)和丙酮酸脱氢酶激酶(pdks)上调。为了验证鉴定的纯合子表型的特异性,从mRNA水平检测了斑马鱼g6pase, pdk2b, pcpck1的表达情况。发现纯合子第7天g6pase增加了49%,pdk2b增加了约3倍,pcpck1增加了约1.5倍, 与野生型比较差异均有统计学意义(P < 0.05,图 5B)。进一步证实观察到的是lkb1敲除纯合子的特异表型,同时也验证了Lkb1敲除出现饥饿状态。
2.7 Lkb1对斑马鱼肾小管发育的影响选择肾小管标志蛋白trmp7(近直小管)、slc12a1(远端小管前段)和slc12a3(远端小管后段)分析lkb1纯合子对肾小管的影响。Real-time PCR结果显示斑马鱼lkb1纯合子肾小管各个区段标志物,与野生型(设为1)比较,纯合子表达都显著增加(P < 0.05,图 6),肾小管远端增加更加明显,表明lkb1基因对斑马鱼肾小管产生明显影响。
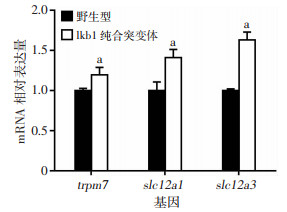
|
| 野生型:7 d的野生型鱼;lkb1纯合突变体:7 d的lkb1纯合子鱼;trmp7:近直小管标志蛋白;slc12a1:远端小管前段标志蛋白;slc12a3:远端小管后段标志蛋白;a:P < 0.05,与野生型比较 图 6 Real-time PCR检测lkb1纯合子肾脏标志物trmp7、slc12a1及slc12a3的mRNA表达水平 |
3 讨论
目前得到广泛应用的基因编辑技术包括锌指核酸酶技术(zincfinger nucleases, ZFNs)、转录激活样效应核酸酶技术(transcription activator-like effectors nucleases, TALENs)和CRISPR/Cas9(Clustered regularly interspaced short palindromic repeats-CRISPR-associated proteins)基因编辑。与ZFNs和TALENs相比,CRISPR/Cas9有明显优势。ZFNs和TALENs都是基于蛋白质工程,需要复杂且耗时的蛋白质工程选择和验证。相比之下,CRISPR/Cas9仅需要用于DNA靶向的sgRNA,其相对便宜且易于设计和生产。在内源CRISPR/Cas9系统中,成熟crRNA与反式激活crRNA(tracrRNA)组合以形成tracrRNA:crRNA复合物,其将Cas9引导至靶位点。在靶位点,CRISPR/Cas9介导的序列特异性切割需要与crRNA匹配的DNA序列原型间隔区(gRNA)和短的原型间隔区相邻基序(PAM)。与靶位点结合后,与crRNA匹配的DNA链和相反链分别被Cas9的HNH核酸酶结构域和RuvC样核酸酶结构域切割,在靶位点产生双链断裂(DSB)。CRISPR/Cas9产生的DSB将触发细胞DNA修复过程,包括非同源末端连接(NHEJ)介导的易错DNA修复和同源定向修复(HDR)介导的无错误DNA修复。NHEJ介导的DNA修复可快速连接DSB,但在靶位点产生小的插入和缺失突变。这些突变有助于破坏或废除靶基因或基因组元件的功能[17]。
Lkb1是AMPK的主要上游激酶,Lkb1与假激酶STRAD和支架蛋白MO25形成复合物,磷酸化AMPK及其他密切相关的激酶,如盐诱导型激酶(SIK)和微管亲和力调节激酶(MARK),发挥多功能生物学功能,如细胞生长和增殖[18]、细胞极性[19]、自噬[20]。
本研究利用CRISPR/Cas9基因编辑技术敲除斑马鱼lkb1基因,设计了2条sgRNA,经过验证发现有1条非常高效。经过测序筛选和传代,筛选出3种杂合子突变体。通过观察杂合子自交产生的胚胎,发现3种突变体纯合子都产生相同异常表型,但是表型的严重程度有所不同,而3种突变体都产生了移码突变且提前终止翻译,认为移码突变产生的氨基酸在蛋白功能中可能也发挥了部分作用。
Lkb1主要调节能量代谢,小鼠肝脏敲除Lkb1导致高血糖症,主要是通过葡萄糖生成增加产生的。糖异生途径增强,而这种饥饿状态在斑马鱼中有所不同,有研究表明斑马鱼敲除Lkb1也表现出饥饿状态[15],但卵黄消耗完之前就出现低血糖症状,表明Lkb1敲除后加快能量消耗。而这与观察到的lkb1纯合子卵黄消耗过快,体轴纤细表型一致。通过RT-PCR检测到糖异生途径增强也证实了这一结论,同时肝脏发黑有可能是肝脏负荷太大导致肝脏衰竭坏死,而肠道水肿坏死有可能是继发于肝脏坏死,导致腹腔水潴留。lkb1纯合子斑马鱼体轴弯曲,特异性发生在头部近端,这种表型未见报道过,而Lkb1在蠕虫的同源物PAR-4和Lkb1在果蝇都是前后轴形成必需的[21],但这种表型在脊椎动物中没有得到证实,由于得到的3种突变体都产生这种体轴弯曲表型,所以我们猜测Lkb1对于斑马鱼前后轴的形成也是必需的。lkb1纯合子还表现出明显的兴奋和头尾同时剧烈摆动,可能与调节神经元极性的Lkb1-Sad / Mark途径受限导致轴突发育异常有关[22]。更重要的是电生理研究表明Lkb1通过控制MCU(线粒体钙单向转运体)摄取Ca2+的能力来调节神经递质释放,在Lkb1缺失的轴突中,线粒体依赖性突触前Ca2+稳态的改变导致神经递质释放性质的急剧变化,增强了异步和同步形式的神经递质释放以及短期突触前可塑性的改变[23]。我们猜测lkb1纯合子斑马鱼异常兴奋有可能是MCU(线粒体钙单向转运体)下调, 神经递质异常释放增强导致的。文献[10]报道小鼠肾小管远端条件性敲除Lkb1导致尿浓度发生变化,尿量增加,肾脏随着时间逐渐变小,组织学显示肾小管扩张,增厚肾小管基底膜,间质性炎症和纤维化,与本研究中检测到纯合子突变体肾小管标志蛋白mRNA水平增加是一致的。因此,Lkb1可能对斑马鱼肾小管发育有影响。下一步将研究lkb1纯合子突变体对肾小管的影响机制。
综上所述,Lkb1对斑马鱼体轴形成,神经发育、维持正常神经反射,维持肝脏和肠道正常功能和存活都是至关重要的。本研究构建的lkb1突变体为进一步探究Lkb1的作用机制提供了依据,也为研究Lkb1对斑马鱼肾脏发育的影响构建了良好的模型。
| [1] |
LOVISA S, LEBLEU V S, TAMPE B, et al. Epithelial-to-mesenchymal transition induces cell cycle arrest and parenchymal damage in renal fibrosis[J]. Nat Med, 2015, 21(9): 998-1009. DOI:10.1038/nm.3902 |
| [2] |
YADAV H, DEVALARAJA S, CHUNG S T, et al. TGF-β1/smad3 pathway targets PP2A-AMPK-FoxO1 signaling to regulate hepatic gluconeogenesis[J]. J Biol Chem, 2017, 292(8): 3420-3432. DOI:10.1074/jbc.M116.764910 |
| [3] |
QIU B J, WEI W, ZHU J W, et al. EMT induced by loss of LKB1 promotes migration and invasion of liver cancer cells through ZEB1-induced YAP signaling[J]. Oncol Lett, 2018, 16(5): 6465-6471. DOI:10.3892/ol.2018.9445 |
| [4] |
YAO Y H, CUI Y, QIU X N, et al. Attenuated LKB1-SIK1 signaling promotes epithelial-mesenchymal transition and radioresistance of non-small cell lung cancer cells[J]. Chin J Cancer, 2016, 35: 50. DOI:10.1186/s40880-016-0113-3 |
| [5] |
HONG B, ZHANG J, YANG W, et al. Activation of the LKB1-SIK1 signaling pathway inhibits the TGF-β-mediated epithelial-mesenchymal transition and apoptosis resistance of ovarian carcinoma cells[J]. Mol Med Rep, 2018, 17(2): 2837-2844. DOI:10.3892/mmr.2017.8229 |
| [6] |
HU M, ZHAO T K, LIU J, et al. Decreased expression of LKB1 is associated with epithelial-mesenchymal transition and led to an unfavorable prognosis in gastric cancer[J]. Hum Pathol, 2019, 83: 133-139. DOI:10.1016/j.humpath.2018.08.017 |
| [7] |
LIN H, LI N, HE H, et al. AMPK inhibits the stimulatory effects of TGF-β on Smad2/3 activity, cell migration, and epithelial-to-mesenchymal transition[J]. Mol Pharmacol, 2015, 88(6): 1062-1071. DOI:10.1124/mol.115.099549 |
| [8] |
SHORNING B Y, JARDÉ T, MCCARTHY A, et al. Intestinal renin-angiotensin system is stimulated after deletion of Lkb1[J]. Gut, 2012, 61(2): 202-213. DOI:10.1136/gutjnl-2011-300046 |
| [9] |
MCGHEE A, SIVARAJAH M, GONG Q, et al. Angiotensin Ⅱ type 2 receptor blockade inhibits fatty acid synthase production through activation of AMP-activated protein kinase in pancreatic cancer cells[J]. Surgery, 2011, 150(2): 284-298. DOI:10.1016/j.surg.2011.06.002 |
| [10] |
VIAU A, BIENAIMÉ F, LUKAS K, et al. Cilia-localized LKB1 regulates chemokine signaling, macrophage recruitment, and tissue homeostasis in the kidney[J]. EMBO J, 2018, 37(15): e98615. DOI:10.15252/embj.201798615 |
| [11] |
CLAUDE-TAUPIN A, FONDERFLICK L, GAUTHIER T, et al. ATG9A is overexpressed in triple negative breast cancer and its in vitro extinction leads to the inhibition of pro-cancer phenotypes[J]. Cell, 2018, 7(12): E248. DOI:10.3390/cells7120248 |
| [12] |
FORRESTER A, DE LEONIBUS C, GRUMATI P, et al. A selective ER-phagy exerts procollagen quality control via a Calnexin-FAM134B complex[J]. EMBO J, 2019, 38(2): e99847. DOI:10.15252/embj.201899847 |
| [13] |
DING F, HU Q, WANG M, et al. Knockout of SlSBPASE suppresses carbon assimilation and alters nitrogen metabolism in tomato plants[J]. Int J Mol Sci, 2018, 19(12): E4046. DOI:10.3390/ijms19124046 |
| [14] |
RAMANAGOUDR-BHOJAPPA R, CARRINGTON B, RAMASWAMI M, et al. Multiplexed CRISPR/Cas9-mediated knockout of 19 Fanconi anemia pathway genes in zebrafish revealed their roles in growth, sexual development and fertility[J]. PLoS Genet, 2018, 14(12): e1007821. DOI:10.1371/journal.pgen.1007821 |
| [15] |
刘菁, 梁森, 袁志. CRISPR/Cas9技术敲除faf1基因对斑马鱼软骨及肌节发育的影响[J]. 第三军医大学学报, 2017, 39(17): 1709-1714. LIU J, LIANG S, YUAN Z. Effects of faf1 gene knockout by CRISPR/Cas9 on zebrafish cartilage and sarcomere development[J]. J Third Mil Med Univ, 2017, 39(17): 1709-1714. DOI:10.16.16/j.10000-5404.201612182 |
| [16] |
KUANG X, LIU C, FANG J, et al. The tumor suppressor gene lkb1 is essential for glucose homeostasis during zebrafish early development[J]. FEBS Lett, 2016, 590(14): 2076-2085. DOI:10.1002/1873-3468.12237 |
| [17] |
ZHANG F, WEN Y, GUO X. CRISPR/Cas9 for genome editing:progress, implications and challenges[J]. Hum Mol Genet, 2014, 23(R1): R40-R46. DOI:10.1093/hmg/ddu125 |
| [18] |
NGUYEN H B, BABCOCK J T, WELLS C D, et al. LKB1 tumor suppressor regulates AMP kinase/mTOR-independent cell growth and proliferation via the phosphorylation of Yap[J]. Oncogene, 2013, 32(35): 4100-4109. DOI:10.1038/onc.2012.431 |
| [19] |
LI J, LIU J, LI P P, et al. Loss of LKB1 disrupts breast epithelial cell polarity and promotes breast cancer metastasis and invasion[J]. J Exp Clin Cancer Res, 2014, 33: 70. DOI:10.1186/s13046-014-0070-0 |
| [20] |
SUN A, LI C, CHEN R, et al. GSK-3β controls autophagy by modulating LKB1-AMPK pathway in prostate cancer cells[J]. Prostate, 2016, 76(2): 172-183. DOI:10.1002/pros.23106 |
| [21] |
MARTIN S G, ST JOHNSTON D. A role for drosophila LKB1 in anterior-posterior axis formation and epithelial polarity[J]. Nature, 2003, 421(6921): 379-384. DOI:10.1038/nature01296 |
| [22] |
SHELLY M, POO M M. Role of LKB1-SAD/MARK pathway in neuronal polarization[J]. Dev Neurobiol, 2011, 71(6): 508-527. DOI:10.1002/dneu.20884 |
| [23] |
KWON S K, SANDO R, LEWIS T L, et al. LKB1 regulates mitochondria-dependent presynaptic calcium clearance and neurotransmitter release properties at excitatory synapses along cortical axons[J]. PLoS Biol, 2016, 14(7): e1002516. DOI:10.1371/journal.pbio.1002516 |



