2. 401331 重庆,重庆医科大学附属大学城医院:急诊科;
3. 400016 重庆,重庆医科大学基础医学院病理生理学教研室
2. Department of Emergency, University-Town Hospital of Chongqing Medical University, Chongqing, 401331;
3. Department of Pathophysiology, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016, China
脓毒症是宿主对感染反应失调而造成的严重威胁生命安全的器官功能障碍[1],发病率高、死亡率高,可出现多种并发症,其中脓毒症相关性脑病(sepsis associated encephalopathy, SAE)发生率最高,是造成死亡的主要并发症。SAE是由脓毒症引起,全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)诱导的弥漫性脑功能障碍,而中枢神经系统并没有直接感染的证据,相关机制目前尚未阐明,但大量研究表明其可能与血脑屏障(blood brain barrier, BBB)功能障碍、氧化应激和炎症因子的释放有关[2-3]。动物实验结果显示在脓毒症发生的最初几个小时内,BBB就已经受损[4]。BBB的渗透性增加将进一步加剧脑内炎症,而炎症因子可促进一氧化氮(nitric oxide, NO)和活性氧自由基(reactive oxygen species, ROS)的合成和分泌。因此,抑制BBB损伤,抗炎症及抗氧化应激反应是治疗脓毒症脑病的重要方向。而寻找治疗SAE安全有效的药物并阐明其机制对于改善脓毒症患者的预后具有重大临床意义。
二甲双胍是目前糖尿病的一线使用药物,研究表明二甲双胍可通过肝激酶B1(liver kinase B1, LKB1)/AMP依赖的蛋白激酶(AMP-activated protein kinase, AMPK)信号通路发挥抗炎作用,从而提高脓毒症小鼠生存率[5]。本课题组前期研究发现,二甲双胍能通过抑制炎症反应、降低肿瘤坏死因子-α(tumor necrosis factor, TNF-α)等减轻脂多糖(lipopolysaccharide, LPS)诱导的肝炎并提高小鼠成活率[6]。此外,体内外研究均表明二甲双胍可抑制内毒素诱导的大脑血管内皮尼克酰胺腺嘌呤二核苷酸磷酸氧化酶(NADPH oxidase 2, gp91phox)的上调[7],显示出抗氧化应激的效应。在自体免疫性脑脊髓炎的动物实验中,二甲双胍也显示出了在多发性硬化等神经系统的炎症性疾病中的治疗作用[8]。可见,二甲双胍可能是有外周和中枢抗炎、抗氧化应激作用。因此,本研究以LPS诱导的脓毒症小鼠模型为对象,探讨二甲双胍对内毒素诱导的脓毒症造成的脑损伤是否有改善作用。
1 材料与方法 1.1 实验动物及分组于重庆医科大学实验动物中心[动物生产许可证:SCXK(渝)2012-0001;动物使用许可证:SYXK(渝)2012-0001]购置出生后21 d的SPF级雄性BALB/c小鼠104只,体质量为16~25 g,饲养于SPF级动物房,室温24 ℃,相对湿度60%,正常光照(8:00光照,20:00熄灯),4只/笼,自由饮水和进食,适应新环境1周后进行动物实验,本研究获重庆医科大学生物医学伦理委员会批准(2016-03-01), 研究方案符合医学伦理原则和赫尔辛基宣言的各项要求。实验结束后,小鼠尸体交回重庆医科大学实验动物中心妥善处理。
采用随机数字表法将104只小鼠分为4组(n=26)。对照组:先后予等二甲双胍和LPS用量体积的生理盐水腹腔注射。单纯二甲双胍组:给予二甲双胍(400 mg/kg)腹腔内注射[6],放回笼中正常饲养30 min后,再给予等LPS用量体积的0.9%的生理盐水腹腔注射。LPS组:给予等二甲双胍体积的生理盐水,放回笼中正常饲养30 min后,按LPS(20 mg/kg)再予以该组小鼠腹腔内注射,以建立脓毒症模型。LPS+二甲双胍组:首先给予该组小鼠二甲双胍(400 mg/kg)腹腔内注射,放回笼中正常饲养30 min后,再予LPS(20 mg/kg)腹腔内注射。密切观察小鼠一般情况,在给药后逐渐表现脓毒症相关的症状如寒战、皮肤温度下降、身躯蜷缩、竖毛、眼周分泌物、稀便等,行为活动表现出进食减少、闭眼,则表示脓毒症小鼠造模成功[9]。
1.2 主要试剂脂多糖(Escherichia coli, 055:B5)购于美国Sigma公司,二甲双胍购于上海碧云天有限公司。TNF-α、IL-6、ELISA试剂盒均购于Neobioscience科技有限公司。神经元特异性烯醇化酶(neuron-specific enolase, NSE)、中枢神经特异蛋白(S100-β)ELISA试剂盒均购于上海信帆生物科技有限公司。髓过氧化物酶(myeloperoxidase, MPO)、丙二醛(malondialdehyde, MDA)试剂盒均购于南京建成生物科技有限公司。含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase-3,Caspase-3)活性检测试剂盒购于碧云天生物技术公司。
1.3 苏木精-伊红染色法观察小鼠脑组织形态变化采用随机数字表法取每组小鼠7只,在腹腔注射LPS 18 h后,用10%水合氯醛腹腔注射0.1 mL麻醉小鼠,开胸暴露心脏,采用100 mL左右的生理盐水灌注左心室,至肝色变浅且流出液变清后,停止灌注生理盐水,改用4%多聚甲醛再灌注。断头取脑,去除嗅球、小脑、脑干等部位保留端脑,4%多聚甲醛4 ℃浸泡后依次经梯度乙醇脱水、石蜡包埋、组织切片、二甲苯脱蜡后HE染色,光镜下观察病理变化。
1.4 伊文思蓝染色评价血脑屏障通透性采用随机数字表法取每组小鼠7只,在腹腔注射LPS 17h后,按4 mL/kg剂量予以2% EB尾静脉注射。腹腔内注射LPS 18 h后,予以10%水合氯醛0.1 mL腹腔注射麻醉小鼠,从左心室灌注生理盐水清除小鼠血液中的EB染料,断头收集全脑标本,称质量后放入盛有2 mL二甲酰胺的EP管,于60 ℃水浴24 h,离心10 min(3 000 r/min)后取上清液。采用分光光度计于波长632 nm处检测其光密度值[D(632)]。根据EB标准曲线,计算EB浓度:EB浓度=EB含量/脑组织质量。
1.5 ELISA测定小鼠血清中神经损伤标志物NSE和S100-β含量建模成功后,随机数字表法取每组小鼠6只,立即置于乙醚罐中进行麻醉,快速夹去眼球取血液标本于1 mL EP管中,4 ℃离心15 min(3 000 r/min),取上清液,按照ELISA试剂盒说明书测定NSE和S100-β含量。
1.6 测定Caspase-3活性按Caspase-3活性检测试剂盒操作步骤进行。测定pNA标准曲线,随机数字表法取造模成功的每组小鼠各6只的端脑组织用裂解缓冲液匀浆后离心(4 ℃,16 000×g)15 min收集上清液,立即测定Caspase-3酶的活性,同时取少量用Bradford法测定蛋白浓度。最后将样本置于405 nm荧光计中进行检测光密度值[D(405)]。计算脑组织中Caspase-3活性。
1.7 测定炎症因子IL-6、TNF-α、MPO于-80 ℃冰箱取出待测小鼠端脑组织标本每组6份以制备匀浆液,经离心后取上清液,按试剂盒操作步骤进行IL-6、TNF-α测定。制备10%匀浆液,在温度为4 ℃、转数为2 500 r/min的条件下离心10 min,弃沉渣取上清液,按照MPO试剂盒说明书测定波长为460 nm下的光密度值[D(460)],进而测算MPO活性。MPO活性计算公式:MPO单位/L=(测定光密度值-对照光密度值)/11.3/待测样本蛋白浓度(mg/mL)。
1.8 测定氧化应激指标MDA首先制备10%匀浆液,取出待测小鼠端脑组织每组6份,加入冰生理盐水,在温度为4 ℃、转数为2 500 r/min的条件下离心10 min,弃沉渣取上清液,按照MDA试剂盒说明书对MDA进行测定。组织中MDA含量(mmol/mg)=(测定光密度值-对照光密度值)/(标准光密度值-空白光密度值)×标准品浓度(10 nmol/mL)/待测标本蛋白浓度(mg/mL)。
1.9 统计学分析所有实验结果均采用SPSS 22.0统计软件进行分析,对于符合正态分布资料采用x±s描述其分布,多组间的比较则采用双因素方差分析。对不符合正态分布的数据,可采用中位数和四分位间距进行描述性分析,组间比较采用秩和检验。检验水准:α=0.05。
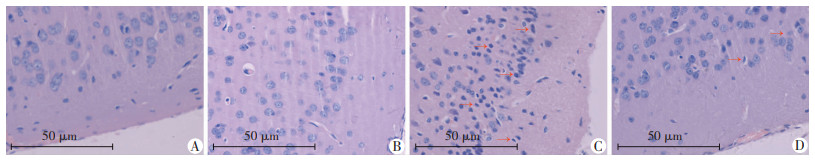
2 结果 2.1 小鼠脑组织形态学观察 2.1.1 小鼠皮层脑组织HE染色对照组皮层神经结构正常、边界清晰。LPS组皮层神经元变性:神经元核深染,细胞体回缩变小、形状不规则。经二甲双胍治疗后,即LPS+二甲双胍组神经元形态异常改善,皮层变性神经元数目也相对减少(图 1)。
|
| A:对照组;B:单纯二甲双胍组;C:LPS组;D:LPS+二甲双胍组; 红色箭头示变性神经元 图 1 HE染色观察二甲双胍改善LPS造成的小鼠大脑皮层病理变化 |
2.1.2 小鼠海马脑组织HE染色
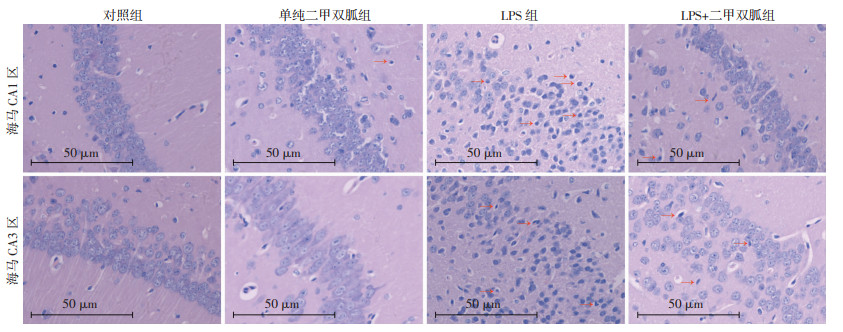
对照组海马区域及其神经元显示出正常的结构以及清晰的边界。LPS组小鼠海马CA1区神经元丢失后形成的区域更加松散、紊乱,且在海马CA3区广泛存在稀疏呈回缩状的不规则神经元。经二甲双胍治疗后,即LPS+二甲双胍组神经元形态异常改善,海马变性神经元数目也相对减少(图 2)。
|
| 红色箭头示变性、排列松散的神经元 图 2 HE染色观察二甲双胍改善LPS造成的小鼠海马CA1、CA3区域病理变化 |
2.2 小鼠BBB通透性检测
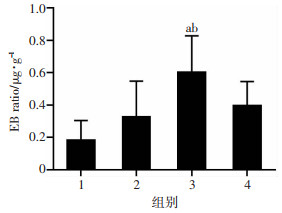
小鼠脑组织EB染色剂含量:LPS组小鼠脑组织中萃取的EB含量显著高于对照组,差异有统计学意义(P < 0.01);与LPS组相比,LPS+二甲双胍组小鼠脑组织中的EB含量较低,差异有统计学意义(P < 0.05,图 3)。
|
| 1:对照组;2:单纯二甲双胍组;3:LPS组;4:LPS+二甲双胍组;a:P < 0.01, 与对照组比较;b:P < 0.05,与LPS+二甲双胍组比较 图 3 二甲双胍对LPS造成小鼠的血脑屏障的损伤的治疗作用(n=7) |
2.3 小鼠血清中的神经损伤标记物
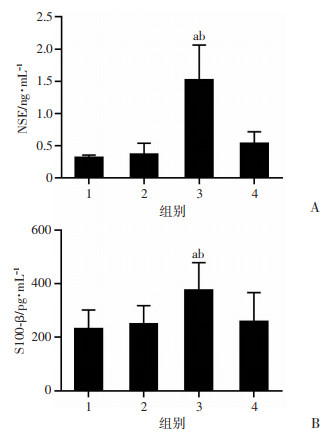
小鼠血清中的NSE和S100-β水平:与对照组相比,LPS组明显升高,差异有统计学意义(P < 0.05);与LPS组相比,LPS+二甲双胍组显著下降,差异有统计学意义(P<0.05,图 4)。
|
| 1:对照组;2:单纯二甲双胍组;3:LPS组;4:LPS+二甲双胍组;a:P < 0.05,与对照组比较;b:P < 0.05,与LPS+二甲双胍组比较; A~B:各组小鼠血清NSE、S100-β蛋白表达 图 4 二甲双胍降低LPS引起小鼠血清中S100-β和NSE水平变化(n=6) |
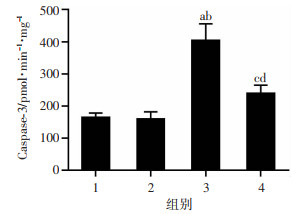
2.4 小鼠脑组织Caspase-3水平测定
小鼠脑组织中Caspase-3水平:与对照组相比,LPS组明显升高,差异有统计学意义(P < 0.01);与LPS组相比,LPS+二甲双胍组下降,差异有统计学意义;与对照组和单纯二甲双胍组相比,LPS+二甲双胍组升高,差异有统计学意义(P < 0.05,图 5)。
|
| 1:对照组;2:单纯二甲双胍组;3:LPS组;4:LPS+二甲双胍组;a:P < 0.01,与对照组比较;b:P < 0.05,与LPS+二甲双胍组比较;c:P < 0.05,与对照组比较;d:P < 0.05,与单纯二甲双胍组比较 图 5 二甲双胍降低LPS导致增加小鼠脑组织中Caspase-3水平变化(n=6) |
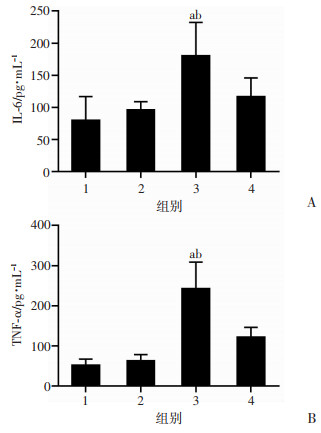
2.5 小鼠脑组织炎症因子水平测定 2.5.1 小鼠脑组织IL-6、TNF-α的水平
与对照组相比,LPS组显著升高,差异有统计学意义(P < 0.05);相对于LPS组,LPS+二甲双胍组下降,差异有统计学意义(P < 0.05,图 6)。
|
| 1:对照组;2:单纯二甲双胍组;3:LPS组;4:LPS+二甲双胍组;a:P < 0.05,与对照组比较;b:P < 0.05,与LPS+二甲双胍组比较;A~B:各组小鼠脑组织中IL-6、TNF-α蛋白表达 图 6 二甲双胍对LPS诱导升高的脓毒症小鼠脑组织炎症因子水平的影响(n=6) |
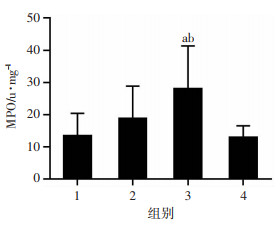
2.5.2 小鼠脑组织中MPO的活性
与对照组相比,LPS组较高,差异有统计学意义(P < 0.05);LPS+二甲双胍组较LPS组低,差异有统计学意义(P < 0.05,图 7)。
|
| 1:对照组;2:单纯二甲双胍组;3:LPS组;4:LPS+二甲双胍组;a:P < 0.05,与对照组比较;b:P < 0.05,与LPS+二甲双胍组比较 图 7 二甲双胍对LPS诱导升高的脓毒症小鼠脑组织炎症因子水平的影响(n=6) |
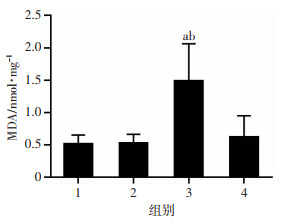
2.6 小鼠脑组织中氧化指标测定
小鼠脑组织MDA含量:与对照组小鼠相比,LPS组较高,差异有统计学意义(P<0.01);LPS+二甲双胍组较LPS组低,差异有统计学意义(P < 0.01,图 8)。
|
| 1:对照组;2:单纯二甲双胍组;3:LPS组;4:LPS+二甲双胍组;a:P < 0.01,与对照组比较;b:P < 0.01,与LPS+二甲双胍组比较 图 8 二甲双胍降低LPS导致增加小鼠脑组织中MDA含量(n=6) |
3 讨论
近年来脓毒症严重的脑并发症SAE逐渐得到重视,寻找治疗SAE安全有效的药物并阐明其机制意义重大。本研究使用LPS注射制备脓毒症小鼠模型,模拟临床中SAE的病理生理特点。
本实验组织病理学分析结果显示,在注射LPS后,LPS组脓毒症小鼠大脑皮层和海马严重的神经元变性:神经元呈现核深染,胞体萎缩、形状不规则,并广泛分布在皮质区域及海马CA1和CA3区。类似的变化也出现在由盲肠的结扎和穿刺的SAE模型中[10]。相较于LPS组,二甲双胍有效地改善了LPS+二甲双胍组的脓毒症小鼠的神经元变性和数目的减少,说明二甲双胍能减轻脓毒症小鼠大脑的病理损害,改善由LPS造成的大脑损伤,是二甲双胍起到神经保护作用的有力证据,其具体机制我们也进行了初步探索。
BBB功能障碍是脓毒症相关性脑病发生、发展的关键过程[11]。电子显微镜观察结果显示,LPS诱导的脓毒症小鼠的脑毛细血管内皮细胞肿胀和细胞膜破裂[12]。本研究采用EB染色法检测脓毒症小鼠BBB的通透性:在注射LPS 18h后,LPS组小鼠端脑组织匀浆中EB的浓度远高于对照组,然而EB属于大分子染色剂,在正常情况下不能透过BBB,提示脓毒症小鼠BBB功能障碍。实验结果显示LPS组血清NSE、S100-β水平较对照组明显升高。NSE在大脑神经元和神经内分泌细胞胞质中广泛以二聚体的形式特异性存在,血液和脑脊液中含量较低,而在脑损伤的情况下,NSE能够通过破坏的血脑屏障释放入血,且血清中其水平与脑损伤程度正相关。存在于血清中的可溶性S100-β蛋白由神经胶质细胞分泌,在神经组织中广泛分布,脑损伤后其水平呈时间依赖性升高,也可反映血脑屏障功能障碍。而LPS+二甲双胍组EB含量及NSE、S100-β水平较LPS组明显降低,均提示二甲双胍可能通过保护血脑屏障减轻内毒素诱导的脑损伤,其具体机制有学者亦进行了相关探索:二甲双胍可通过激活AMPK信号通路下调细胞间黏附分子-1(intercellular cell adhesion molecule-1, ICAM-1)、gp91phox等下游产物改善BBB损伤[7, 13-14];也可通过激活PI3K/AKT信号通路保护因脓毒症受损的BBB[15],且这一保护作用可以被磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)抑制剂LY294002逆转。
此外,在脊髓损伤的研究发现二甲双胍还可以通过调节哺乳动物雷帕霉素靶蛋白/P70-S6激酶(mammalian target of rapamycin/P70-S6 Kinase, mtor/p70s6k)信号通路抑制凋亡,从而保护受损的BBB[16]。本实验我们也对内毒素诱导的脑损伤进行了凋亡水平检测, 结果显示Caspase-3是细胞凋亡过程中最主要的终末剪切酶,正常生理情况下高度保守,其活性与组织细胞的凋亡水平正相关。我们发现LPS组小鼠脑组织内Caspase-3活性明显升高,而LPS+二甲双胍组脑组织内Caspase-3活性较LPS组明显降低,表明二甲双胍在一定程度上可抑制脓毒症小鼠脑组织中的凋亡,这与既往研究类似:二甲双胍联合藏红花治疗1型糖尿病大鼠能降低Caspase-3水平[17];二甲双胍可通过抑制细胞色素c释放、Caspase-3的活化和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)的磷酸化,显著降低谷氨酸处理的小鼠的小脑神经元凋亡[18]。在一项缺血再灌注脑损伤的研究中发现[19],二甲双胍能促进蛋白激酶B-1(protein kinase B-1, Akt-1)的活化,降低氨基末端激酶-3(c-Jun N-terminal kinase-3, JNK-3)的磷酸化以及Caspase-3的表达,而PI3K抑制剂则逆转这一保护作用,再次表明二甲双胍可能通过PI3K/AKT信号通路减轻脂多糖诱导的脓毒症小鼠的脑损伤。同时我们发现:与对照组和单纯二甲双胍组相比,LPS+二甲双胍组的Caspase-3水平仍然较高,说明二甲双胍不能完全抑制脓毒症小鼠脑组织中的凋亡水平,提示在内毒素诱导的脓毒症小鼠脑损伤病理生理过程中还有其他因素参与。
炎性细胞因子的释放被认为是SAE的重要因素之一。我们观察到在LPS注射18 h后,LPS组小鼠脑组织的炎症因子如IL-6、TNF-α和MPO水平明显增加。IL-6是炎症反应标志性因子,更是与脓毒症的严重程度、并发症及预后密切相关[20]。TNF-α是炎症通路中显著增加的炎性因子,可增加BBB通透性,引起脑组织中性粒细胞浸润,还可直接损伤线粒体膜电位导致大量氧自由基的产生,进而引发神经元细胞凋亡。MPO则广泛存在于中性粒细胞中促进炎症细胞的增殖与活化,反映炎症程度。而二甲双胍能降低内毒素诱导的脑组织中炎症因子水平:LPS+二甲双胍组较LPS组脑组织中IL-6、TNF-α和MPO水平显著降低。我们发现也与既往研究类似:CHEN等[21]发现二甲双胍可通过抑制氧化应激反应减轻哮喘模型小鼠的气道炎症、气道重塑;YUAN等[6]的研究发现二甲双胍能缓解LPS诱导的肝炎并提高小鼠成活率;文献[17]报道二甲双胍可减轻盲肠结扎穿孔法诱导的脓毒症大鼠肺组织炎症反应;NATH等[8]发现二甲双胍可改善自体免疫性脑脊髓炎;ZHU等[22]还发现二甲双胍能通过抑制NF-κB介导的炎症途径使慢性永久性脑缺血的大鼠受益。
如前所述,炎症因子还可诱导氧化应激,氧化应激也是脓毒症的关键特性。我们的研究发现二甲双胍还可能通过减少氧化应激减轻脂多糖诱导的脓毒症小鼠的脑损伤:LPS组的MDA较对照组升高,经二甲双胍处理后,LPS+二甲双胍组的MDA水平降低。发生脓毒症时,脂质过氧化可通过损伤细胞膜和线粒体膜导致细胞凋亡和坏死[23]。MDA作为脂质过氧化反应的主要产物, 在氧化应激反应里被认为是重要的标志物,MDA的降低则表示脓毒症氧化应激的减轻[24-25]。我们的研究结果与GHAVIMI等[26]的研究一致:二甲双胍可降低盲肠结扎穿孔法诱导的脓毒症大鼠肺组织中MDA、MPO水平,起到抗氧化应激的作用。KESHAVARZI等[27]认为二甲双胍可能是通过激活环磷腺苷效应元件结合蛋白/脑源性神经营养因子(cyclic adenosine monophosphate response element binding protein/brain-derived neurotrophic factor, CREB/BDNF)或AKT/糖原合成酶激酶-3(glycogen synthase kinase-3, GSK3)信号传导途径的蛋白表达,从而控制氧化应激反应,保护神经系统。
综上,本研究发现二甲双胍可能通过保护血脑屏障、抑制凋亡、抗炎及减轻氧化应激等多方面有效改善LPS诱导的小鼠脑损伤。为二甲双胍的使用提供了一个新的视角,对防治脓毒症的严重并发症的用药的策略提供了新证据。本研究仍存在不足,例如缺少脑功能的实验结果进一步支持,而二甲双胍在保护脓毒症相关性脑病的过程中具体通过哪些信号通路发挥保护作用,也值得深入探索。
| [1] |
SHANKAR-HARI M, PHILLIPS G S, LEVY M L, et al. Developing a new definition and assessing new clinical criteria for septic shock:For the third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 775-787. DOI:10.1001/jama.2016.0289 |
| [2] |
ZHAO L, AN R, YANG Y, et al. Melatonin alleviates brain injury in mice subjected to cecal ligation and puncture via attenuating inflammation, apoptosis, and oxidative stress:the role of SIRT1 signaling[J]. J Pineal Res, 2015, 59(2): 230-239. DOI:10.1111/jpi.12254 |
| [3] |
YANG Y, JIANG S, DONG Y S, et al. Melatonin prevents cell death and mitochondrial dysfunction via a SIRT1-dependent mechanism during ischemic-stroke in mice[J]. J Pineal Res, 2015, 58(1): 61-70. DOI:10.1111/jpi.12193 |
| [4] |
DU MOULIN G C, PATERSON D, HEDLEY-WHYTE J, et al. E.coli peritonitis and bacteremia cause increased blood-brain barrier permeability[J]. Brain Res, 1985, 340(2): 261-268. DOI:10.1016/0006-8993(85)90922-9 |
| [5] |
YANG Y, DONG R L, HU D L, et al. Liver kinase B1/AMP-activated protein kinase pathway activation attenuated the progression of endotoxemia in the diabetic mice[J]. Cell Physiol Biochem, 2017, 42(2): 761-779. DOI:10.1159/000478068 |
| [6] |
YUAN H M, LI L J, ZHENG W P, et al. Antidiabetic drug metformin alleviates endotoxin-induced fulminant liver injury in mice[J]. Int Immunopharmacol, 2012, 12(4): 682-688. DOI:10.1016/j.intimp.2012.01.015 |
| [7] |
WANG X N, XUE G X, LIU W C, et al. Melatonin alleviates lipopolysaccharide-compromised integrity of blood-brain barrier through activating AMP-activated protein kinase in old mice[J]. Aging Cell, 2017, 16(2): 414-421. DOI:10.1111/acel.12572 |
| [8] |
NATH N, KHAN M, PAINTLIA M K, et al. Metformin attenuated the autoimmune disease of the central nervous system in animal models of multiple sclerosis[J]. J Immunol, 2009, 182(12): 8005-8014. DOI:10.4049/jimmunol.0803563 |
| [9] |
张锟, 李仁杰, 刘涛, 等. 两种脓毒症小鼠模型的比较[J]. 中华临床医师杂志(电子版), 2012, 6(8): 1998-2001. ZHANG K, LI R J, LIU T, et al. Comparison of two distinct animal models for polymicrobial sepsis in mice[J]. Chin J Clinicians (Electr Ed), 2012, 6(8): 1998-2001. DOI:10.3877/cma.j.issn.1674-0785.2012.08.006 |
| [10] |
YOKOO H, CHIBA S, TOMITA K, et al. Neurodegenerative evidence in mice brains with cecal ligation and puncture-induced sepsis:preventive effect of the free radical scavenger edaravone[J]. PLoS ONE, 2012, 7(12): e51539. DOI:10.1371/journal.pone.0051539 |
| [11] |
VARATHARAJ A, GALEA I. The blood-brain barrier in systemic inflammation[J]. Brain Behav Immun, 2017, 60: 1-12. DOI:10.1016/j.bbi.2016.03.010 |
| [12] |
GAO R, TANG Y, TONG J, et al. Systemic lipopolysaccharide administration-induced cognitive impairments are reversed by erythropoietin treatment in mice[J]. Inflammation, 2015, 38(5): 1949-1958. DOI:10.1007/s10753-015-0175-4 |
| [13] |
LIU Y, TANG G, LI Y, et al. Metformin attenuates blood-brain barrier disruption in mice following middle cerebral artery occlusion[J]. J Neuroinflam, 2014, 11(1): 177. DOI:10.1186/s12974-014-0177-4.DOI:10.1186/s12974-014-0177-4 |
| [14] |
FARBOOD Y, SARKAKI A, KHALAJ L, et al. Targeting adenosine monophosphate-activated protein kinase by metformin adjusts post-ischemic hyperemia and extracellular neuronal discharge in transient global cerebral ischemia[J]. Microcirculation, 2015, 22(7): 534-541. DOI:10.1111/micc.12224 |
| [15] |
TANG G, YANG H, CHEN J, et al. Metformin ameliorates sepsis-induced brain injury by inhibiting apoptosis, oxidative stress and neuroinflammation via the PI3K/Akt signaling pathway[J]. Oncotarget, 2017, 8(58): 97977-97989. DOI:10.18632/oncotarget.20105 |
| [16] |
GUO Y, WANG F, LI H, et al. Metformin Protects Against Spinal Cord Injury by Regulating Autophagy via the mTOR Signaling Pathway[J]. Neurochem Res, 2018, 43(5): 1111-1117. DOI:10.1007/s11064-018-2525-8 |
| [17] |
DELKHOSH-KASMAIE F, FARSHID AA, TAMADDON-FARD E. The effects of safranal, a constitute of saffron, and metformin on spatial learning and memory impairments in type-1 diabetic rats:behavioral and hippocampal histopathological and biochemical evaluations[J]. Biomed Pharmacother, 2018, 107: 203-211. DOI:10.1016/j.biopha.2018.07.165 |
| [18] |
ZHOU C, SUN R, ZHUANG S, et al. Metformin prevents cerebellar granule neurons against glutamate-induced neurotoxicity[J]. Brain Res Bull, 2016, 121: 241-245. DOI:10.1016/j.brainresbull.2016.02.009 |
| [19] |
GE X H, ZHU G J, GENG D Q, et al. Metformin protects the brain against ischemia/reperfusion injury through PI3K/Akt1/JNK3 signaling pathways in rats[J]. Physiol Behav, 2017, 170: 115-123. DOI:10.1016/j.physbeh.2016.12.021 |
| [20] |
张莹, 范霞, 杨雪, 等. 吴茱萸碱对脓毒症小鼠急性肺损伤的保护作用[J]. 第三军医大学学报, 2016, 38(21): 2309-2314. ZHANG Y, FAN X, YANG X, et al. Evodiamine protects septic mice against acute lung injury[J]. J Third Mil Med Univ, 2016, 38(21): 2309-2314. DOI:10.16016/j.1000-5404.201604138 |
| [21] |
CHEN C Z, HSU C H, LI C Y, et al. Insulin use increases risk of asthma but metformin use reduces the risk in patients with diabetes in a Taiwanese population cohort[J]. J Asthma, 2017, 54(10): 1019-1025. DOI:10.1080/02770903.2017.1283698 |
| [22] |
ZHU X C, JIANG T, ZHANG Q Q, et al. Chronic metformin preconditioning provides neuroprotection via suppression of NF-κB-Mediated inflammatory pathway in rats with permanent cerebral ischemia[J]. Mol Neurobiol, 2015, 52(1): 375-385. DOI:10.1007/s12035-014-8866-7 |
| [23] |
AN R, ZHAO L, XI C, et al. Melatonin attenuates sepsis-induced cardiac dysfunction via a PI3K/Akt-dependent mechanism[J]. Basic Res Cardiol, 2016, 111(1): 8. DOI:10.1007/s00395-015-0526-1 |
| [24] |
JI M H, XIA D G, ZHU L Y, et al. Short-and long-term protective effects of melatonin in a mouse model of sepsis-associated encephalopathy[J]. Inflammation, 2018, 41(2): 515-529. DOI:10.1007/s10753-017-0708-0 |
| [25] |
NING Q, LIU Z, WANG X, et al. Neurodegenerative changes and neuroapoptosis induced by systemic lipopolysaccharide administration are reversed by dexmedetomidine treatment in mice[J]. Neurol Res, 2017, 39(4): 357-366. DOI:10.1080/01616412.2017.1281197 |
| [26] |
GHAVIMI H, SHEIDAEI S, VAEZ H, et al. Metformin-attenuated sepsis-induced oxidative damages:a novel role for metformin[J]. Iran J Basic Med Sci, 2018, 21(5): 469-475. DOI:10.22038/IJBMS.2018.24610.6126 |
| [27] |
KESHAVARZI S, KERMANSHAHI S, KARAMI L, et al. Protective role of metformin against methamphetamine induced anxiety, depression, cognition impairment and neurodegeneration in rat:The role of CREB/BDNF and Akt/GSK3 signaling pathways[J]. Neurotoxicology, 2019, 72: 74-84. DOI:10.1016/j.neuro.2019.02.004 |



