伏立康唑(voriconazole,VRCZ)为新一代广谱三唑类抗真菌药,该药在氟康唑结构丙基骨架上加入一个甲基,并用一个氟代嘧啶环取代了氟康唑的一个三唑环,大大增强了其抗菌谱和抗菌活性[1]。伏立康唑是目前临床上广泛使用的抗真菌药物之一,具有抗菌谱广口服生物利用度高等特点,抗菌谱主要包括急性侵袭性曲霉菌、侵袭性念珠菌属、足放线病菌属和镰刀菌属等[2],还可以用于预防侵入性真菌感染免疫功能低下的患者[3-4]。但由于伏立康唑药代动力学个体差异大,药动学具有复杂性,且与免疫抑制剂如环孢素A、他克莫司等很多药物相互干扰作用,其血药浓度与临床疗效和不良反应,如肝功能异常视觉改变或视觉障碍等显著相关,因此临床治疗过程需进行伏立康唑的治疗药物监测[5-6]。
伏立康唑的主要代谢物为伏立康唑氮氧化物(voriconazole N-oxide,VNO),主要通过细胞色素CYP450氧化酶包括CYP3A4、CYP2C19和CYP2C9代谢,其中CYP2C19是主要的代谢酶[7]。伏立康唑氮氧化物抗真菌活性弱,研究表明伏立康唑氮氧化物可以抑制CYP3A4或CYP2C19的体外代谢活性[8]。伏立康唑氮氧化物浓度的测定可能有助于确定伏立康唑向伏立康唑氮氧化物转化的主要代谢途径中伏立康唑浓度是否存在个体间变异,并进一步评估伏立康唑氮氧化物潜在的副作用。
国外相关文献[9-10]报道采用高效液相色谱法对伏立康唑和伏立康唑氮氧化物进行血药浓度测定,而目前国内对伏立康唑的治疗药物监测主要采用高效液相色谱法、高效液相串联质谱法对伏立康唑进行浓度测定,但未见对其代谢产物伏立康唑氮氧化物进行测定的相关报道。本实验在参考文献[11-15]的基础上,建立了LC-MS/MS法同时测定人血浆中伏立康唑和伏立康唑氮氧化物的浓度,并应用于临床样本血药浓度测定。
1 材料与方法 1.1 仪器、药品与试剂 1.1.1 仪器SHIMADZU SIL-30AC高效液相色谱仪,AB Sciex QTRAP 5500质谱仪;Biofuge primo R型低温离心机(美国Thermo公司);Milli-Q plus超纯水仪(美国Millipore公司);KQ-400KDE型高功率数控超声波清洗器(昆山市超声仪器有限公司);GENIUS 3型漩涡混匀器(德国IKA);BP211D型赛多利斯电子天平(德国赛多利斯公司);数据采集和处理系统:Analyst1.6.2。
1.1.2 药品与试剂伏立康唑对照品:100862-200701,含量100%,中国药品生物制品检定所;伏立康唑氮氧化物:7-DPM-64-3,TORONTO RESEARCH CHEMICALS INC;甲醇(色谱纯),美国迪马公司;乙酸铵(色谱纯),FLUKA公司;水为超纯水。
1.2 方法 1.2.1 色谱条件色谱柱:Inertsil ODS-3(2.1 mm×50 mm,5 μm),Dikma公司生产;柱温:40 ℃;流动相:甲醇:10 mmol/L乙酸铵水溶液=90 :10;流速:0.4 mL/min;进样量:2 μL。
1.2.2 质谱条件电喷雾ESI源,正离子模式,多反应监测(MRM);定量分析离子对:伏立康唑m/z350.1→m/z127.0,伏立康唑氮氧化物m/z366.1→m/z 224.0,酮康唑(内标)m/z531.0→m/z82.1(图 1);离子源电压:5 500 V,离子源温度:550.0 ℃,去簇电压(DP):13.5 V/49.0 V/15.6 V,碰撞能(CE):46 V/13.8 V/78.8 V。
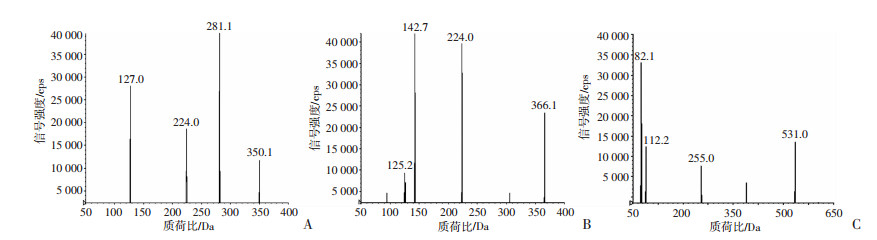
|
| 图 1 伏立康唑(A)、伏立康唑氮氧化物(B)和酮康唑(C)质谱分析 |
1.2.3 标准溶液的配制
精密称取伏立康唑对照品10.02 mg,置于10 mL容量瓶中,甲醇溶解并稀释至刻度摇匀,配成浓度为1.0 mg/mL的储备液Ⅰ;并用甲醇稀释成浓度为0.8,0.4,0.2,0.1,0.05,0.04 mg/mL的系列标准曲线工作液,-20 ℃冰箱保存备用。精密称取伏立康唑氮氧化物对照品10.00 mg,置于10 mL容量瓶中,甲醇定容配成浓度为1.0 mg/mL的储备液Ⅱ;并用甲醇稀释成浓度为0.8,0.4,0.2,0.1,0.05,0.04 mg/mL的系列标准曲线工作液,-20 ℃冰箱保存备用。
精密称取酮康唑对照品10.03 mg,置于10 mL容量瓶中,用甲醇溶解并稀释至刻度,获得浓度为1.0 mg/mL的储备液;取500 μL 1.0 mg/mL的储备液,置于10 mL容量瓶中,甲醇定容,配成浓度为50 μg/mL的内标工作液,-20 ℃冰箱保存备用。
1.2.4 血浆样品处理方法取待测血浆10 μL,加入10 μL酮康唑内标甲醇溶液(50 μg/mL),混匀0.5 min;加入990 μL甲醇,混匀2 min,离心5 min(13 000 r/min),取上清液10 μL,加入990 μL甲醇,混匀1 min,离心5 min(13 000 r/min),取上清液进样2 μL测定。
1.2.5 方法学验证 1.2.5.1 方法特异性选用6个不同来源空白血浆10 μL,除不加标准溶液和内标溶液外,按1.2.4方法操作得空白血浆色谱图;取空白血浆10 μL,加入内标溶液,同法操作得相应的色谱图;将一定浓度的伏立康唑、伏立康唑氮氧化物和酮康唑标准溶液加入空白血浆中,同法操作得相应的色谱图;取临床患者给药后的血浆样品,同法操作得相应的色谱图。
1.2.5.2 标准曲线和最低定量限从浓度分别均为1.0、0.8、0.4、0.2、0.1、0.05、0.04 mg/mL伏立康唑、伏立康唑氮氧化物系列标准液中取10 μL分别加入990 μL空白血浆中,得浓度分别为10.0、8.0、4.0、2.0、1.0、0.5、0.4 μg/mL的伏立康唑、氮氧化伏立康血样,按样品处理方法处理后进样分析,以待测物浓度X为横坐标,待测物与内标的峰面积比值Y为纵坐标,进行回归运算求得伏立康唑、伏立康唑氮氧化物的标准曲线。同法配制伏立康唑、伏立康唑氮氧化物血浆浓度均为0.4 μg/mL的样品,对该浓度样品进行5样本分析,并根据当日标准曲线计算每一样本测得浓度即为最低定量限。
1.2.5.3 基质效应分别取6个不同来源100 μL空白血浆按1.2.4处理血样,取上清液作为溶剂,配制与质控样品浓度一致的低、高浓度质控样品进样后所得峰面积为AMatrix;另用甲醇作溶剂配制与其相同浓度的低、高浓度对照品进样后所得峰面积为AStandard,按公式AMatrixA·Standard-1×100%计算所得基质效应因子MF(matrix factor),同法处理内标得到内标的MF,伏立康唑、伏立康唑氮氧化物与内标的比值为内标归一化基质效应因子(IS-normalized MF)。
1.2.5.4 精密度与准确度按1.2.5.2方法配制最低定量限低、中、高4个浓度QC样品,按样品处理方法处理后每一浓度进行5样本分析,根据当天的标准曲线求得QC样品浓度,并计算本法的日内精密度与准确度;同法连续测定3 d,根据各自当天的标准曲线求得QC样品浓度,并计算本法的日间精密度与准确度。
1.2.5.5 提取回收率按1.2.5.2方法配制低、中、高3个浓度QC样品和水溶液样品,按样品处理方法处理后每一浓度进行5样本分析。根据血浆中峰面积与相同浓度水溶液样品测得的峰面积之比计算其提取回收率。
1.2.5.6 稳定性考察配制低、中、高3个浓度的血浆样品,每一种浓度水平进行3样本分析,分别考察伏立康唑和伏立康唑氮氧化物血浆样品经处理后进样器放置5 h的稳定性,血浆样品室温放置2 h的稳定性,血浆样品经历3次冷冻-解冻循环的稳定性,血浆样品-70 ℃冷冻保存60 d的稳定性,此外还考察了储备液-20 ℃冷冻保存7 d,全血4 ℃放置4 h的稳定性。
1.2.6 入选患者的确定及血样采集选取陆军军医大学第一附属医院近期收治的使用伏立康唑抗真菌治疗的患者开展血药浓度监测,并通过电子病历系统回顾性收集患者的基本资料以及用药信息。患者用伏立康唑3 d后,于下次给药前0.5~1 h抽取患者外周静脉血2 mL,保存于EDTA抗凝管中,4 ℃冷藏备用。本研究经陆军军医大学第一附属医院医学伦理委员会审核批准[2015年科研第(15)号]。
2 结果 2.1 方法特异性伏立康唑、伏立康唑氮氧化物和酮康唑的保留时间分别为0.47、0.41、0.60 min,不同来源的空白血浆在相应色谱峰保留时间内均无干扰峰,结果表明在本实验条件下,空白血浆中的内源性物质不干扰伏立康唑和伏立康唑氮氧化物的检测,方法特异性良好,典型色谱图见图 2。
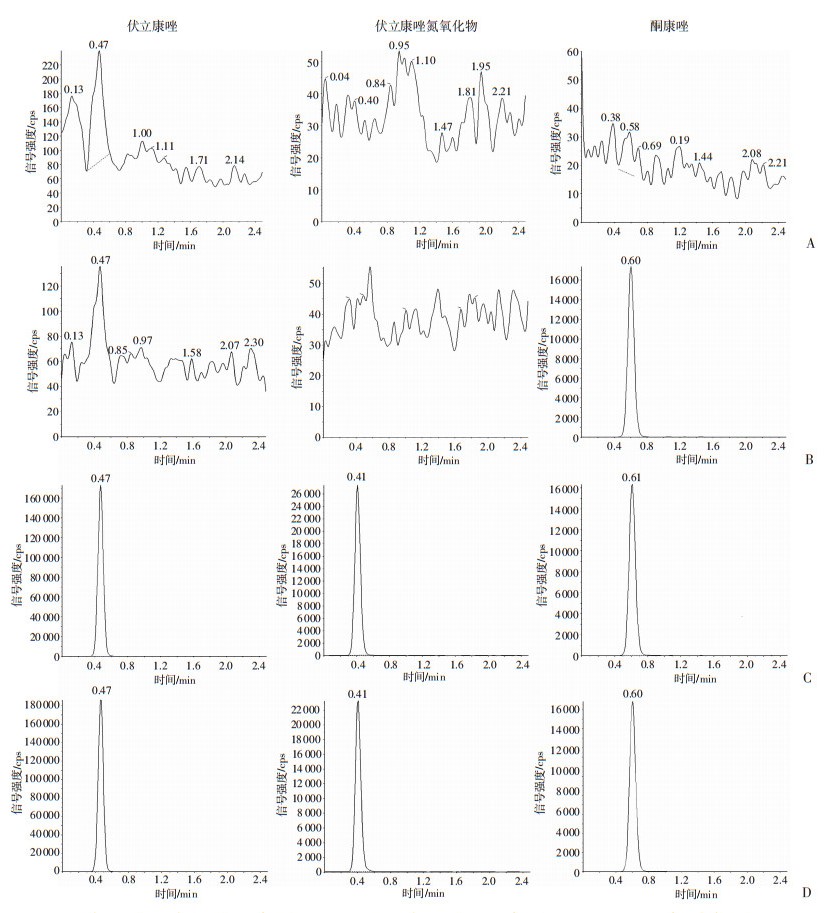
|
| A:空白血浆;B:空白血浆+酮康唑(50.0 μg/mL);C:空白血浆+伏立康唑(4.0 μg/mL)+伏立康唑氮氧化物(4.0 μg/mL)+酮康唑(50.0 μg/mL);D:患者给药后谷浓度血样 图 2 人血浆中伏立康唑、伏立康唑氮氧化物和酮康唑的典型色谱图 |
2.2 标准曲线和定量下限
以伏立康唑、伏立康唑氮氧化物浓度X为横坐标,伏立康唑、伏立康唑氮氧化物与酮康唑的峰面积比值Y为纵坐标,进行回归运算得伏立康唑标准曲线方程为Y=0.000 774X+0.019 8(权重系数1/X2),r=0.999 8;伏立康唑氮氧化物标准曲线方程为Y=0.000 13X+0.001 96(权重系数1/X2),r=0.999 5。伏立康唑、伏立康唑氮氧化物的线性范围均为0.4~10.0 μg/mL。伏立康唑和伏立康唑氮氧化物的定量下限均为0.4 μg/mL,该浓度下伏立康唑、伏立康唑氮氧化物的RSD分别为3.26%、2.73%。
2.3 基质效应伏立康唑低浓度、高浓度内标归一化基质效应因子为(88.46±2.15)%、(97.76±1.95)%,RSD分别为2.43%、2.00%;伏立康唑氮氧化物低浓度、高浓度内标归一化基质效应因子为(91.92±2.80)%、(98.95±2.03)%,RSD分别为3.04%、2.05%,见表 1、2。
| 理论浓度/μg·mL-1 | 批内(n=5) | 批间(n=15) | 提取回收率/% | 基质效应/% | |||||
| 测得浓度/μg·mL-1 | 精密度RSD/% | 准确度RE/% | 测得浓度/μg·mL-1 | 精密度RSD/% | 准确度RE/% | ||||
| 0.4 | 0.38±0.01 | 2.63 | 95.00 | 0.36±0.03 | 8.33 | 90.00 | - | - | |
| 0.5 | 0.49±0.01 | 2.04 | 98.00 | 0.47±0.03 | 6.38 | 94.00 | 112.06±1.61 | 88.46±2.15 | |
| 2 | 2.02±0.03 | 1.49 | 101.00 | 1.97±0.06 | 3.05 | 98.50 | 90.69±2.96 | - | |
| 8 | 7.94±0.28 | 3.53 | 99.25 | 7.84±0.19 | 2.42 | 98.00 | 100.00±1.19 | 97.76±1.95 | |
| 理论浓度/μg·mL-1 | 批内(n=5) | 批间(n=15) | 提取回收率/% | 基质效应/% | |||||
| 测得浓度/μg·mL-1 | 精密度RSD/% | 准确度RE/% | 测得浓度/μg·mL-1 | 精密度RSD/% | 准确度RE/% | ||||
| 0.4 | 0.38±0.01 | 2.63 | 95.00 | 0.37±0.02 | 5.41 | 92.50 | - | - | |
| 0.5 | 0.48±0.01 | 2.08 | 96.00 | 0.48±0.02 | 4.17 | 96.00 | 90.35±1.07 | 91.92±2.80 | |
| 2.0 | 1.98±0.02 | 1.01 | 99.00 | 1.94±0.07 | 3.61 | 97.00 | 87.17±1.57 | - | |
| 8.0 | 7.88±0.21 | 2.66 | 98.50 | 7.76±0.21 | 2.71 | 97.00 | 100.00±1.98 | 98.95±2.03 | |
2.4 精密度与准确度
伏立康唑和伏立康唑氮氧化物每一浓度水平样品的批内精密度RSD分别为1.49%~3.53%、1.01%~2.66%,准确度分别为95.00%~101.00%、95.00%~99.00%;批间精密度RSD分别为2.42%~8.33%、2.71%~5.41%,准确度分别为90.00%~98.50%、92.50%~97.00%,见表 1、2。
2.5 提取回收率伏立康唑、伏立康唑氮氧化物低、中、高3个浓度的质控样品提取回收率分别在90.69%~112.06%、87.17%~100.00%之间,RSD值均小于15%,结果见表 1、2。
2.6 稳定性考察考察伏立康唑、伏立康唑氮氧化物血样经处理后室温放置5 h,血样室温放置2 h,血样经历3次冷冻-解冻循环,血样-70 ℃冷冻保存60d的稳定性,结果见表 3、4,各样品浓度的RSD<15%;伏立康唑及其氮氧化物储备液-20 ℃冷冻保存7d RSD分别为1.37%,1.07%;3名患者全血4 ℃放置4 h测得伏立康唑及其氮氧化物浓度的RSD分别为0.44%~8.04%,1.43%~8.75%。
| 理论浓度/μg·mL-1 | 室温放置 | 处理后稳定性 | 反复冻融3次 | 冷冻稳定性 | |||||||
| 测得浓度/μg·mL-1 | RSD/% | 测得浓度/μg·mL-1 | RSD/% | 测得浓度/μg·mL-1 | RSD/% | 测得浓度/μg·mL-1 | RSD/% | ||||
| 0.5 | 0.51±0.04 | 7.84 | 0.50±0.02 | 4.00 | 0.49±0.02 | 4.08 | 0.47±0.01 | 2.13 | |||
| 2.0 | 2.07±0.05 | 2.42 | 2.08±0.03 | 1.44 | 2.04±0.19 | 9.31 | 1.83±0.02 | 1.09 | |||
| 8.0 | 7.87±0.21 | 2.67 | 8.02±0.31 | 3.87 | 7.57±0.85 | 11.23 | 7.17±0.06 | 0.84 | |||
| 理论浓度/μg·mL-1 | 室温放置 | 处理后稳定性 | 反复冻融3次 | 冷冻稳定性 | |||||||
| 测得浓度/μg·mL-1 | RSD/% | 测得浓度/μg·mL-1 | RSD/% | 测得浓度/μg·mL-1 | RSD/% | 测得浓度/μg·mL-1 | RSD/% | ||||
| 0.5 | 0.50±0.01 | 2.00 | 0.50±0.02 | 4.00 | 0.50±0.01 | 2.00 | 0.49±0.01 | 2.04 | |||
| 2.0 | 2.06±0.05 | 2.43 | 2.04±0.04 | 1.96 | 2.04±0.15 | 7.35 | 1.97±0.02 | 1.02 | |||
| 8.0 | 8.03±0.15 | 1.87 | 8.14±0.25 | 3.07 | 7.94±0.15 | 1.89 | 7.91±0.04 | 0.51 | |||
2.7 临床应用
应用本法对我院23例59次使用伏立康唑治疗的患者进行血药浓度监测,血样主要来自肾科、ICU、血液科、老年科、神经外科和呼吸科严重侵袭性真菌病患者。通过电子病历系统查阅患者基本信息和用药情况,23例患者中男性15例,女性8例,年龄10~92岁,用药途径为静脉注射和口服给药,用药剂量为50 mg(2次/d),75 mg(2次/d),100 mg(2次/d),200 mg(1次/d),200 mg(2次/d),600 mg(2次/d)。本文以伏立康唑血药浓度0.5~5 μg/mL为参考范围,对23例患者共计59次的伏立康唑血药浓度监测结果进行分析,测得患者伏立康唑稳态谷浓度范围为0.4~14.3 μg/mL,其中5次测定结果小于0.5 μg/mL,43次测定结果在0.5~5 μg/mL之间,11次测定结果大于5 μg/mL;伏立康唑氮氧化物稳态谷浓度范围为0.5~7.2 μg/mL,具体结果见表 5。伏立康唑体内的转化率=伏立康唑氮氧化物浓度/伏立康唑浓度,转化率值的范围为0.1~4.2。并对31次口服给药后患者的伏立康唑和伏立康唑氮氧化物血药浓度与剂量进行相关性分析,r值分别为0.4736、0.8861,表明伏立康唑、伏立康唑氮氧化物的血药浓度与剂量的相关性不明显,结果见图 3。
| 用药剂量 | 次数 | 伏立康唑浓度/μg·mL-1 | RSD/% | 伏立康唑氮氧化物浓度/μg·mL-1 | RSD/% |
| 100 mg/d | 6 | 0.6±0.5 | 83.3 | 0.4±0.1 | 25.0 |
| 150 mg/d | 1 | 1.7±0.0 | - | 0.6±0.0 | - |
| 200 mg/d | 10 | 2.4±3.7 | 154.2 | 3.3±1.4 | 42.4 |
| 300 mg/d | 4 | 3.4±2.9 | 85.3 | 2.6±1.1 | 42.3 |
| 400 mg/d | 28 | 4.1±3.1 | 91.2 | 3.3±1.3 | 39.4 |
| 600 mg/d | 10 | 3.6±1.8 | 50.0 | 4.5±2.3 | 51.1 |

|
| A:伏立康唑;B:伏立康唑氮氧化物 图 3 31次口服患者血药浓度测定结果与剂量相关性散点图 |
3 讨论
本研究报道了LC-MS/MS同时测定人血浆中伏立康唑和伏立康唑氮氧化物的浓度方法,并将本法用于23例患者59次临床样本的检测。本方法采用甲醇直接沉淀蛋白对血浆进行处理,取样量仅为10 μL,样本分析时间为3 min,并对方法学进行确认,伏立康唑和伏立康唑氮氧化物的线性范围满足临床样本的检测需求。
本研究中,患者的用药剂量为每天100~600 mg,伏立康唑血药浓度个体间变异系数为50.0%~154.2%,伏立康唑氮氧化物血药浓度变异系数为25.0%~51.1%,结果表明给予相同的剂量,不同个体的血药浓度差异显著,即相同剂量下不同患者疗效和不良反应存在显著的个体差异。在对患者进行血药浓度监测时发现,伏立康唑、伏立康唑氮氧化物的血药浓度与剂量的相关性不明显,与文献[9]报道的结果一致。分析原因主要有以下两个方面:一是CYP2C19基因多态性是导致伏立康唑临床效应个体差异的主要原因;二是本研究纳入的患者年龄跨度大,基础疾病复杂,肝功能异常对药物的浓度也存在一定的影响。
据文献报道,VNO可以抑制CYP3A4或CYP2C19的体外代谢活性[8],伏立康唑氮氧化物浓度/伏立康唑浓度比值的增长可能导致治疗效果不佳[10]。因此在治疗性药物监测中除了常规监测伏立康唑血药浓度,还应该对伏立康唑氮氧化物血药浓度进行监测,以尽早发现在药物代谢中由于不管是基因多态性和药物相互作用导致的血药浓度异常。结合对患者基因型的检测,对患者伏立康唑代谢转化率与患者自身基因型是否存在一定的联系有待进一步研究。
| [1] |
郝晔, 王永韧. 高效液相色谱法测定人血浆中伏立康唑的浓度[J]. 儿科药学杂志, 2017, 23(6): 33-36. HAO Y, WANG Y R. Determination of voriconazole concentrations in plasma by HPLC[J]. J Pediatric Pharmacy, 2017, 23(6): 33-36. DOI:10.13407/j.cnki.jpp.1672-108X.2017.06.012 |
| [2] |
宋艳, 贾淼鑫, 尹冬虹, 等. HPLC法测定伏立康唑血药浓度及其应用[J]. 中国临床药学杂志, 2017, 26(4): 230-234. SONG Y, JIA M X, YIN D H, et al. HPLC method for voriconazole therapeutic drug monitoring and its application[J]. Chin J Clin Pharmacy, 2017, 26(4): 230-234. DOI:10.19577/j.cnki.issn10074406.2017.04.004 |
| [3] |
MARKS D I, PAGLIUCA A, KIBBLER C C, et al. Voriconazole versus itraconazole for antifungal prophylaxis following allogeneic haematopoietic stem-cell transplantation[J]. Br J Haematol, 2011, 155(3): 318-327. DOI:10.1111/j.1365-2141.2011.08838.x |
| [4] |
WINGARD J R, CARTER S L, WALSH T J, et al. Randomized, double-blind trial of fluconazole versus voriconazole for prevention of invasive fungal infection after allogeneic hematopoietic cell transplantation[J]. Blood, 2010, 116(24): 5111-5118. DOI:10.1182/blood-2010-02-268151 |
| [5] |
陈璐, 涂碎萍, 张丽娟, 等. HPLC法测定伏立康唑血药浓度的临床应用[J]. 临床合理用药杂志, 2017, 10(2): 1-2, 22. CHEN L, TU S P, ZHANG L J, et al. Determination of Voriconazole in the human plasma by HPLC for clinical application[J]. Chin J of Clin Rational Drug Use, 2017, 10(2): 1-2, 22. DOI:10.15887/j.cnki.13-1389/r.2017.02.001 |
| [6] |
UEDA K, NANNYA Y, KUMANO K, et al. Monitoring trough concentration of voriconazole is important to ensure successful antifungal therapy and to avoid hepatic damage in patients with hematological disorders[J]. Int J Hematol, 2009, 89(5): 592-599. DOI:10.1007/s12185-009-0296-3 |
| [7] |
TEMESVÁRI M, KBORI L, PAULIK J, et al. Estimation of drug-metabolizing capacity by cytochrome P450 genotyping and expression[J]. J Pharmacol Exp Ther, 2012, 341(1): 294-305. DOI:10.1124/jpet.111.189597 |
| [8] |
JEU L, PIACENTI F J, LYAKHOVETSKIY A G, et al. Voriconazole[J]. Clin Ther, 2003, 25(5): 1321-1381. DOI:10.1016/s0149-2918(03)80126-1 |
| [9] |
YAMADA T, MINO Y, YAGI T, et al. Rapid simultaneous determination of voriconazole and its N-oxide in human plasma using an isocratic high-performance liquid chromatography method and its clinical application[J]. Clin Biochem, 2012, 45(1/2): 134-138. DOI:10.1016/j.clinbiochem.2011.11.004 |
| [10] |
EIDEN C, MATHIEU O, PEYRIRE H, et al. Simultaneous quantification of voriconazole and its N-oxide metabolite in human plasma by an easy and rapid isocratic LC method with UV detection[J]. Chroma, 2008, 67(3/4): 275-280. DOI:10.1365/s10337-007-0508-z |
| [11] |
LI J L, MA J, WAGAR E A, et al. A rapid ultra-performance LC-MS/MS assay for determination of serum unbound fraction of voriconazole in cancer patients[J]. Clinica Chimica Acta, 2018, 486: 36-41. DOI:10.1016/j.cca.2018.07.022 |
| [12] |
向瑾, 余勤, 梁茂植, 等. HPLC-MS/MS测定人血浆中伏立康唑质量浓度及其生物等效性研究[J]. 四川大学学报(医学版), 2018, 49(1): 102-106. XIANG J, YU Q, LIANG M Z, et al. Determination of voriconazole in human plasma and its bioequivalence by HPLC-MS/MS[J]. J Sichuan Univ(Med Sci Edi), 2018, 49(1): 102-106. DOI:10.13464/j.scuxbyxb.2018.01.021 |
| [13] |
刘洋, 邱婷婷, 张弨, 等. HPLC-MS/MS法测定人血浆中伏立康唑浓度[J]. 中国临床药理学杂志, 2018, 34(10): 1222-1225. LIU Y, QIU T T, ZHANG C, et al. Concentration determination of voriconazole in human plasma by HPLC-MS/MS[J]. Chin J Clin Pharmacol, 2018, 34(10): 1222-1225. DOI:10.13699/j.cnki.1001-6821.2018.10.024 |
| [14] |
张素洁, 孙贺伟, 郭君君, 等. 液相色谱-串联质谱法同时测定血清中5个三唑类抗真菌药物浓度及其治疗药物监测应用[J]. 药物分析杂志, 2017, 37(6): 1038-1045. ZHANG S J, SUN H W, GUO J J, et al. Quantitative determination of five azole antifungals in human serum by LC-MS/MS and its application to therapeutic drug monitoring[J]. Chin J Pharmaceutical Anal, 2017, 37(6): 1038-1045. DOI:10.16155/j.0254-1793.2017.06.16 |
| [15] |
向荣凤, 戴青, 周艳, 等. HPLC-MS/MS测定大鼠血浆中人参皂苷Rg3的浓度[J]. 第三军医大学学报, 2018, 40(12): 1073-1078. XIANG R F, DAI Q, ZHOU Y, et al. Determination of ginsenoside Rg3 in rat plasma using high-performance liquid chromatography-tandem mass spectrometry[J]. J Third Mil Med Univ, 2018, 40(12): 1073-1078. DOI:10.16016/j.1000-5404.201712007 |



