急性心肌梗死(Acute Myocardial Infarction,AMI)是临床常见的危重症,严重威胁着人类生命和健康。近年来,利用骨髓间充质干细胞(bone marrow derived mesenchymal stem cells,BMSCs)移植治疗AMI,心梗后心功能得到改善[1]。然而,在损伤局部组织缺血、缺氧微环境下,大部分移植的BMSCs因环境不适而死亡,难以达到预期治疗效果。近年来,基因修饰与细胞治疗相结合技术的发展,为受损心脏组织的修复和改善移植疗效提供了一种新的策略。本课题组前期研究发现,Toll样受体4 (Toll-like receptor-4, TLR4)能抑制BMSCs的凋亡[2],促进BMSCs增殖的作用[3]。因此,本研究利用重组慢病毒将TLR4基因转移到BMSCs中,进而把TLR4基因修饰的BMSCs移植治疗大鼠急性心肌梗死,观察其能否提高BMSCs的存活率,抑制心肌纤维化,改善心功能。
1 材料及方法 1.1 主要试剂与仪器过表达TLR4基因(Lv-EGFP-TLR4)和空载体携带EGFP的慢病毒载体(Lv-EGFP)(南京凯基生物公司);兔抗大鼠TLR4多克隆抗体(美国SANTA CRUZ公司);兔抗大鼠β-actin多克隆抗体(美国SANTA CRUZ公司);BCA蛋白浓度测定试剂盒(碧云天生物公司);倒置荧光显微镜(日本OLYMPUS);电泳仪(美国BIO-RAD);电热恒温水浴箱(HH.W21.600型);心脏超声心动图机(Philips公司);小动物呼吸机(上海奥尔特公司)。
1.2 BMSCs的培养、鉴定及转染本研究参照课题组前期的实验方法[2-4]进行细胞培养和鉴定,6周龄SD雄性大鼠,快速断颈处死,取出股骨和胫骨,于两侧骨骺端剪开骨髓腔,用磷酸盐缓冲液(PBS)冲出骨髓离心弃去上清,L-DMEM完全培养基制成单细胞悬液,移至细胞培养瓶,置于37 ℃、5%CO2培养箱中培养。取生长良好的第3代BMSCs接种于细胞培养瓶中,37 ℃孵箱过夜,弃掉培养基,再加入培养基,根据MOI值为20,滴加Lv-EGFP-TLR4及Lv-EGFP病毒液,混匀后,在二氧化碳培养箱37 ℃孵育过夜,转染48 h后的BMSCs用于正式实验。
1.3 酶联免疫吸附测定法(ELISA)检测BMSCs中TLR4的分泌转染48 h后的BMSCs弃掉培养基,再加入新的培养基继续培养48 h,收集上清液,按照ELISA试剂盒具体步骤检测BMSCs中TLR4的分泌情况。
1.4 实验动物分组将54只体质量为200 g左右的健康雄性SD大鼠(购自重庆腾鑫生物技术有限公司),随机分为对照组、Lv-EGFP-BMSCs组、Lv-EGFP-TLR4-BMSCs组,每组18只,各实验组均建立急性心肌梗死模型。对照组仅在心肌交界区注射PBS培养液,而后两组在心肌梗死后分别移植Lv-EGFP-BMSCs和Lv-EGFP-TLR4-BMSCs(均含细胞5×105个/75 μL)。
1.5 建立心肌梗死模型本实验动物模型制备参照本课题组前期的实验方法建立大鼠急性心肌梗死模型[5],实验大鼠经腹腔麻醉,于手术台上,固定,剪开颈部皮肤,行气管分离,剪开气管,气管插管后固定,连接小动物呼吸机。于胸骨左缘第3、4肋间打开胸腔,撕开心包,使心脏充分暴露。于肺动脉圆锥与左心耳根部交叉点顺左冠状静脉下方约1 mm处为结扎点,结扎左冠脉前降支,结扎冠脉供血区域心肌因缺血而变苍白,则模型建立成功。倘若大鼠出现提前死亡,及时补足各组大鼠数量。
1.6 细胞移植方法与途径术前将转染病毒的BMSCs经消化离心后用PBS重悬,细胞数量调整为5×105/75 μL,放置37 ℃孵箱中保存备用。待心肌梗死模型成功1 h后,用微量注射器在心肌梗死交界区,进行心肌内多点注射,为了防止细胞外溢,注射结束后,针头需停留数秒才能拔出。
1.7 荧光显微镜追踪EGFP细胞移植后第7 d,颈椎脱臼处死大鼠6只,快速剪开胸腔,分离粘连组织,取出心脏,用OCT包埋,制作冰冻切片(6 μm),行免疫荧光染色,观察心肌梗死交界区移植BMSCs的存活情况,携带EGFP的BMSCs显绿色荧光,为阳性细胞。
1.8 Western blot检测BMSCs中TLR4蛋白的表达细胞移植后第7 d,颈椎脱臼处死大鼠6只,取梗死交界区心脏组织,加入适量的蛋白裂解液和PMSF(100 :1)后在冰上低温快速研磨匀浆、离心,取上清液,用BCA蛋白定量试剂盒测定蛋白浓度。制备凝胶,样品上样,电泳,将蛋白转移至硝酸纤维素膜上(转膜),脱脂奶粉溶液于室温下封闭2 h,洗膜,加入一抗于4 ℃摇床孵育过夜,洗膜,加二抗于室温下避光孵育1 h,加入显色剂在Image Lab凝胶成像系统曝光,Image-Pro plus 6.0图像分析软件测出条带的积分光密度值(IOD),利用目的蛋白IOD与内参蛋白IOD的比值进行统计学分析。
1.9 心功能测定细胞移植后第28 d,大鼠经麻醉后,用心脏超声心动图机对大鼠心脏进行检测。测量3个连续心动周期内左室收缩末内径(LVSd)、左室舒张末内径(LVDd)、左室缩短分数(LVFS)和左室射血分数(LVEF),心功能检测完毕后,颈椎脱臼处死动物,行相关病理学检查。
1.10 用ELISA测定血清中胶原代谢产物PⅠCP和PⅢNP的表达水平在细胞移植后第28 d,取大鼠6只,经麻醉后,分离颈总动脉,采取动脉血,经离心处理后,收集血清,根据ELISA试剂盒方法检测血清中胶原代谢产物PⅠCP和PⅢNP的表达水平。
1.11 HE、Masson染色大鼠经采取动脉血后,快速剪开胸腔,下腔静脉注射10 %氯化钾(3 mL/kg),让心脏在舒张期停搏,将取出的心脏放置于4 %多聚甲醛固定24 h,然后进行石蜡包埋。石蜡切片,进行HE、Masson染色。在置于显微镜下观察各组心肌纤维化程度,每张切片分别选取4~6个不重复视野并于高倍镜下拍照,应用Image-Pro plus 6.0图像分析软件计算胶原纤维在整个心肌面积中所占百分比。红色为正常心肌组织,蓝色为胶原蛋白。
1.12 统计学分析用SPSS19.0统计学软件分析。所有实验数据均用x±s来表示,组间的差异行t检验。
2 结果 2.1 BMSCs培养上清中TLR4分泌表达检测转染的细胞培养48 h后,与单纯BMSCs组(TLR4浓度2.86 pg/5×105个细胞/mL)比较,Lv-EGFP-BMSCs组和Lv-EGFP-TLR4-BMSCs组TLR4表达均明显增加,Lv-EGFP-TLR4-BMSCs组TLR4的表达更加显著,浓度达到31.55pg/5×105个细胞/mL。
2.2 荧光显微镜追踪EGFP阳性细胞细胞移植后第7天,用免疫荧光法检测结果发现,对照液组未见绿色荧光,Lv-EGFP-BMSCs组和Lv-EGFP- TLR4-BMSCs组均可见绿色荧光,Lv-EGFP-TLR4-BMSCs组的绿色荧光强度明显优于Lv-EGFP-BMSCs组,见图 1。

|
| 图 1 大鼠心肌梗死并转染TLR4的BMSCs移植后7 d免疫荧光检测心肌梗死局部EGFP表达(携带EGFP的BMSCs发绿光,与DAPI染的细胞核共同定位移植的BMSCs) |
2.3 TLR4基因修饰BMSCs移植对心肌梗死区TLR4表达的影响
细胞移植后第7天,用Western blot法检测结果发现,Lv-EGFP-BMSCs组和Lv-EGFP-TLR4-BMSCs组与对照组相比,TLR4蛋白表达均明显升高,Lv-EGFP-TLR4-BMSCs组TLR4蛋白升高更为明显,见图 2。
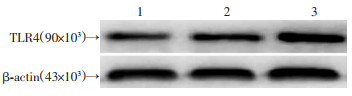
|
| 1:对照组; 2:Lv-EGFP-BMSCs组; 3:Lv-EGFP-TLR4-BMSCs组 图 2 大鼠心肌梗死并转染TLR4的BMSCs移植后28 d Western blot检测梗死心肌TLR4蛋白表达情况 |
2.4 心功能指标检测
细胞移植后第28天,用心脏超声心动图检测结果发现,与对照组相比,Lv-EGFP-BMSCs组和Lv-EGFP-TLR4-BMSCs组左室射血分数(LVEF)和短轴缩短率(LVFS)值均显著提高(P < 0.01),左室收缩末径(LVDs)和左心室舒张末径(LVDd)值均明显缩小(P < 0.01);与Lv-EGFP-BMSCs组相比,Lv-EGFP-TLR4-BMSCs组LVEF和LVFS值均明显增加(P < 0.01),LVDs和LVDd值均明显减小(P < 0.01),见图 3、表 1。
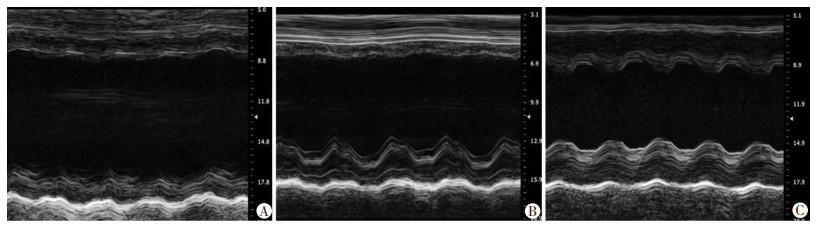
|
| A:对照组; B:Lv-EGFP-BMSCs组; C:Lv-EGFP-TLR4-BMSCs组 图 3 大鼠心肌梗死并转染TLR4的BMSCs移植后28 d用心脏超声心动图检测LVEF、LVFS、LVDd和LVDs表达 |
| 组别 | LVEF(%) | LVFS(%) | LVDd(mm) | LVDs(mm) |
| 对照组 | 22.35±1.33 | 9.98±0.98 | 9.05±0.88 | 8.12±0.69 |
| Lv-EGFP-BMSCs组 | 36.41±2.65a | 18.41±5.66a | 8.06±0.96a | 6.66±0.91a |
| Lv-EGFP-TLR4-BMSCs组 | 44.36±5.62ab | 22.88±9.89ab | 7.11±0.79ab | 5.41±0.77ab |
| a:P < 0.01,与对照组比较;b:P < 0.01,与Lv-EGFP-BMSCs组比较 | ||||
2.5 心脏的病理学检查结果
细胞移植后第28天,HE染色结果显示,对照组梗死区域心肌组织大多被瘢痕组织所替代,心肌细胞大量坏死,残存的心肌细胞也不同程度增生、肥大;与对照组比较,Lv-EGFP-TLR4-BMSCs组和Lv-EGFP-BMSCs组心肌瘢痕组织明显减少,存活心肌细胞明显增多;与Lv-EGFP-BMSCs组比较,Lv-EGFP-TLR4-BMSCs组心肌瘢痕组织减少更加明显,存活心肌细胞也明显增多。Masson染色结果显示,对照组左心室梗死区有大量的蓝色胶原纤维,呈条索状,部分胶原纤维融合;与对照组比较,Lv-EGFP-BMSCs组和Lv-EGFP-TLR4- BMSCs组蓝色胶原纤维明显减少,Lv-EGFP-TLR4-BMSCs组蓝色胶原纤维较Lv-EGFP-BMSCs组更少,见图 4。
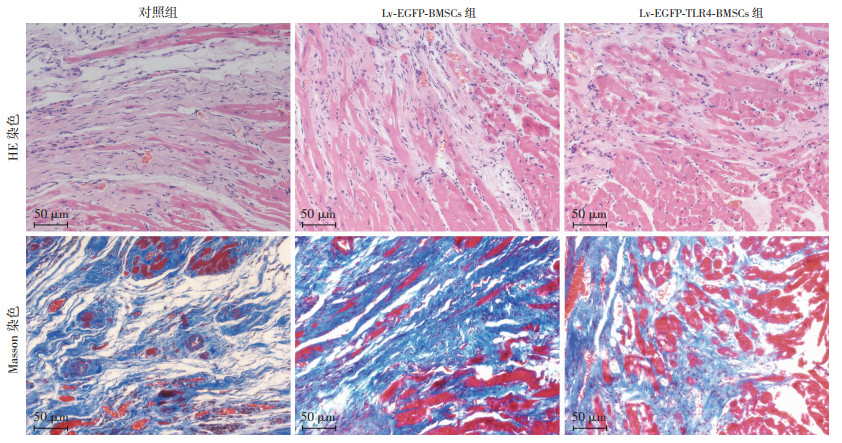
|
| 图 4 大鼠心肌梗死并转染TLR4的BMSCs移植后28 d用H.E染色和Masson染色观察心肌组织病理学变化 |
2.6 血清中胶原代谢产物PⅠCP和PⅢNP的水平
细胞移植后第28 d,用ELISA法检测结果发现,与对照组比较,Lv-EGFP-TLR4-BMSCs组和Lv-EGFP-BMSCs组大鼠血清中PⅠCP和PⅢNP蛋白浓度均降低(P < 0.05,P < 0.01);与Lv-EGFP-BMSCs组比较,Lv-EGFP-TLR4-BMSCs组PⅠCP和PⅢNP蛋白浓度均明显降低(P < 0.05),表 2。
| 组别 | PⅠCP(μg/L) | PⅢNP(μg/L) |
| 对照组 | 90.32±7.36 | 13.57±1.89 |
| Lv-EGFP-BMSCs组 | 83.79±8.02a | 9.51±1.37a |
| Lv-EGFP-TLR4-BMSCs组 | 72.88±8.55bc | 7.33±1.75bc |
| a:P < 0.05,b:P < 0.01,与对照组比较;c:P < 0.05,与Lv-EGFP-BMSCs组比较 | ||
3 讨论
近年来,大量BMSCs移植治疗心肌梗死的研究结果表明[6-7],移植后的BMSCs通过旁分泌作用和分化作用能够有效地改善心肌梗死后的心功能,而且方法安全可靠。但是,BMSCs移植后在数天之内有大量的细胞凋亡发生,严重制约了其诱导心肌组织修复以及再生的作用[8]。因此,采取有效的手段延缓移植后BMSCs的凋亡,并保持甚至提高其治疗作用,就能够有效地提高干细胞移植治疗AMI的效果。
Toll样受体(Toll-like receptors,TLRs)基因被确认为基因家族中相对保守的跨膜受体之一,属于Ⅰ型跨膜糖蛋白受体,20世纪90年代末初次被发现于果蝇的细胞系上,现在至少有13种TLRs(TLR-1~TLR-13)已被确定存在于哺乳动物中[9],TLRs作为人类天然性免疫的基本成员之一,广泛分布于人类所有的细胞[10]。在TLRs家族中,TLR4是首次被发现且极为关键的模式识别受体之一,不仅是相关抗原识别和机体自身免疫炎性反应过程中的关键受体,同时还是免疫炎性级联反应信号传导过程中的起始蛋白[11]。多项研究表明TLR4能够参与调节BMSCs迁移、分化、细胞因子分泌、免疫调节等多种生物学功能[12]。本课题组前期工作证实BMSCs表达TLR4,且利用TLR4激动剂脂多糖(lipopolysaccharide, LPS)刺激BMSCs能够抑制BMSCs的凋亡。在体内,我们用LPS处理BMSCs后,移植到心肌梗死周边区域发现,与单纯移植BMSCs相比,BMSCs在移植部位的存活率以及对大鼠心功能的改善没有明显的差异。因此,我们选择TLR4基因修饰BMSCs,结果发现,经TLR4基因修饰的BMSCs在移植部位的存活率明显提高,对大鼠心功能的改善明显优于单纯BMSCs,这可能是与外源基因(TLR4)能够在细胞长时间表达有关。提示,BMSCs经TLR4基因修饰后,提高移植细胞的存活率,从而增强BMSCs的移植治疗效应。
心肌梗死后,受损的心肌组织在缺血缺氧条件下,引起局部心肌细胞发生凋亡,心肌成纤维细胞增殖增强,以胶原纤维为主的细胞外基质增多,并过量沉积,各型胶原比例失调,导致心肌纤维化的发生[13]。心肌纤维化过程同时伴随着多种心肌胶原代谢相关产物的增加,如: Ⅰ型前胶原羧基端肽(PⅠCP)、Ⅲ型前胶原氨基端肽(PⅢNT)等。PⅠCP和PⅢNP是心肌Ⅰ型和Ⅲ型胶原的前体多肽(心肌Ⅰ型和Ⅲ型胶原合成的间接标志),是前胶原转换为胶原过程中脱离前胶原的游离肽段,其随胶原纤维合成的增加而增加[14]。近年来研究表明,在大鼠心肌梗死模型血清中PⅠCP和PⅢNT的表达高于正常对照组[15-16],另外,在心肌梗死患者PⅠCP和PⅢNT的表达也明显高于正常人群[17]。本研究结果发现,在大鼠心肌梗死细胞移植后28 d,TLR4基因修饰的BMSCs移植组PⅠCP和PⅢNT表达明显低于单纯BMSCs移植组,心肌纤维化改善程度也明显优于单纯BMSCs移植组;心动超声结果显示,TLR4基因修饰的BMSCs移植组的心功能的改善程度也明显优于单纯BMSCs移植组。
综上所述,TLR4基因修饰BMSCs移植治疗心肌梗死,可能通过局部TLR4表达增加,提高BMSCs移植的存活率,进一步减轻心肌纤维化程度,改善心肌梗死大鼠的心功能。
| [1] |
唐一锋, 石蓓, 王冬梅, 等. HMGB-1联合MSCs移植对急性心肌梗死大鼠心脏功能影响的实验研究[J]. 重庆医学, 2018, 47(12): 1583-1588. DOI:10.3969/j.issn.1671-8348.2018.12.005 |
| [2] |
陈文明, 蹇明辉, 赵永超, 等. Toll样受体4通过PI3K/Akt信号通路调节骨髓间充质干细胞凋亡[J]. 遵义医学院学报, 2017, 40(6): 617-621. CHEN W M, JIAN M H, ZHAO Y C, et al. Toll-like receptor 4 regulats apoptosis of bone marrow mesenchymal stem cells through PI3K/Akt signaling pathways[J]. J Zunyi Med Univ, 2017, 40(6): 617-621. DOI:10.14169/j.cnki.zunyixuebao.2017.0135 |
| [3] |
陈文明, 龙仙萍, 赵然尊, 等. Toll样受体4激活Wnt/β-catenin信号通路促进骨髓间充质干细胞增殖[J]. 中国老年学杂志, 2018, 38(03): 666-668. CHEN W M, LONG X P, ZHAO R Z, et al. Wnt/beta-catenin signaling pathway activated by Toll like receptor 4 promotes the proliferation of bone marrow mesenchymal stem cells[J]. Chin J Gerontol, 2018, 38(03): 666-668. DOI:10.3969/j.issn.1005-9202.2018.03.063 |
| [4] |
刘志江, 石蓓, 束波, 等.高迁移率族蛋白1及其受体对大鼠骨髓间充质干细胞增殖及细胞因子水平的影响[J].中国动脉硬化杂志, 2017(4), 25(4): 337-342.DOI: 10.3969/j.issn.1007-3949.2017.04.003. LIU Z J, SHI B, SHU B, et al.Effects of high mobility group box 1 and its receptor on proliferation and cytokine levels of rat marrow mesenchymal stem cells[J].Chin J Arterioscler, 2017, 25(4):337-342.DOI: 10.3969/j.issn.1007-3949.2017.04.003. |
| [5] |
龙仙萍, 邓文文, 赵然尊, 等. 干扰Nrf2基因后骨髓间充质干细胞移植对大鼠心肌梗死后心肌凋亡的影响[J]. 第三军医大学学报, 2015, 37(13): 1319-1324. LONG X P, DENG W W, ZHAO R, et al. Effect of silencing Nrf2 gene on myocardial apoptosis after rat myocardial infarction with bone marrow mesenchymal stem cell transplantation[J]. J Third Mil Med Univ, 2015, 37(13): 1319-1324. DOI:10.16016/j.1000-5404.201501143 |
| [6] |
邹松平, 王宇, 李春雨, 等. 骨髓间充质干细胞旁分泌对急性心肌梗死心肌的保护作用[J]. 中国组织工程研究, 2014, 18(23): 3653-3659. ZOU S, WANG Y, LI C Y, et al. Bone marrow mesenchymal stem cells protect myocardial function in acute myocardial infarction through a paracrine mechanism[J]. Chin J Tissue Engineering Res, 2014, 18(23): 3653-3659. DOI:10.3969/j.issn.2095-4344.2014.23.008 |
| [7] |
MIAO C, LEI M, HU W, et al. A brief review:The therapeutic potential of bone marrow mesenchymal stem cells in myocardial infarction[J]. Stem Cell Res Ther, 2017, 8(1): 1-6. |
| [8] |
XING A J, XUE D, WANG T, et al. Catalpol promotes the survival and VEGF secretion of bone marrow-derived stem cells and their role in myocardial repair after myocardial infarction in rats[J]. Cardiovascular Toxicology, 2018, 18(5): 471-481. DOI:10.1007/s12012-018-9460-4 |
| [9] |
WOJTKOWIAK-GIERA A, DERDA M, AGNIESZKA KOLASA-WOłOSIUK, et al. Toll-like receptors in the brain of mice following infection with Acanthamoeba spp[J]. Parasitol Res, 2016, 115(11): 4335-4344. DOI:10.1007/s00436-016-5217-9 |
| [10] |
AKIRA S. Toll-like receptors in innate immunity[J]. Adv Immunol, 2001, 78(1): 1-56. DOI:10.1016/S0065-2776(01)78001-7 |
| [11] |
MOLTENI M, GEMMA S, ROSSETTI C. The role of toll-like receptor 4 in infectious and noninfectious inflammation[J]. Mediators Inflamm, 2016, 2016: 1-9. DOI:10.1155/2016/6978936 |
| [12] |
SHIRJANG S, MANSOORI B, SOLALI S, et al. Toll-like receptors as a key regulator of mesenchymal stem cell function:An up-to-date review[J]. Cellular Immunology, 2017, 315: 1-10. DOI:10.1016/j.cellimm.2016.12.005 |
| [13] |
WANG Y C, DING Y S, LIU M L. The molecular mechanism of different factors caused myocardial fibrosis[J]. Medical Recapitulate, 2012, 18(17): 2736-2740. DOI:10.3969/j.issn.1006-2084.2012.17.003 |
| [14] |
J DÍEZ, LAVIADES C, MAYOR G, et al. Increased serum concentrations of procollagen peptides in essential hypertension:relation to cardiac alterations[J]. Circulation, 1995, 91(5): 1450-1456. DOI:10.1161/01.CIR.91.5.1450 |
| [15] |
赵丽晶, 安英, 陈雪, 等. 叶黄素对异丙肾上腺素诱导的大鼠心肌纤维化的抑制作用[J]. 中国临床药理学杂志, 2018, 34(5): 544-547. ZHAO L J, AN Y, CHEN X, et al. Inhibitory effect of Lutein on myocardial fibrosis induced with isoprenaline in rats[J]. Chin J Clin Pharmacol, 2018, 34(5): 544-547. DOI:10.13699/j.cnki.1001-6821.2018.05.016 |
| [16] |
郑兴, 张国元. 大鼠心肌梗死后血浆PⅢNP和PⅠCP的变化及其与心肌胶原含量的相关性研究[J]. 临床心血管病杂志, 2001, 17(9): 409-412. ZHENG X, ZHANG G Y. Changes of plasma concentrations of PⅢNP and PⅠCP after myocardial infarction and their relationship to the content of myocardial collagen in rat[J]. J Clin Cardiol, 2001, 17(9): 409-412. DOI:10.3969/j.issn.1001-1439.2001.09.010 |
| [17] |
郑兴, 章同华, 秦永文, 等. 心肌梗死患者血浆Ⅲ型前胶原氨基末端肽和Ⅰ型前胶原羧基末端肽含量的观察[J]. 中华心血管病杂志, 2001, 29(4): 213-215. ZHENG X, ZHANG T H, QIN Y W, et al. Plasma concentrations of PⅢ NP and PⅠCP in patients with acute myocardial infarction[J]. Chin J Cardiol, 2001, 29(4): 213-215. DOI:10.3760/j:issn:0253-3758.2001.04.007 |



