非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)是世界范围内最常见的肝病,可以引起广泛的疾病,从脂肪变性、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)到纤维化,最终发生肝硬化和肝细胞癌(hepatocellular carcinoma,HCC)。NAFLD影响着全球超过三分之一的人口,并导致2 000万人死亡[1-3]。NAFLD多发生于肥胖人群,与代谢综合征的存在和糖尿病的发展密切相关[4-7]。
NAFLD的患病率与其严重的并发症显著相关,迫切需要一个安全、有效和广泛适用的治疗方式。虽然通过某些生活方式改变有可能改善NAFLD,但目前的一些治疗策略如FXR激动剂、抗糖尿病药物以及诸如饮食、运动减肥等生活方式的改变,已被证明无法起到保护肝脏的作用[8]。
粪便细菌移植(fecal microbiota transplantation, FMT)作为一种可行的、安全有效的治疗手段逐渐被人们所接受,并应用于各种难治性疾病,包括慢性胃肠道感染、复发性炎症性肠病(inflammatory bowel disease, IBD)和艰难梭菌感染(clostridium difficile infrtion,CDI)[9-10]。本课题组在前期的研究中发现FMT对肝性脑病大鼠的肝功能改善有积极的作用[11],在此基础上,本研究探讨FMT在高脂饮食诱导的NAFLD大鼠模型中的作用及其可能的机制。
1 材料与方法 1.1 动物和大鼠NAFLD模型雄性Sprague Dawley大鼠,体质量180~220 g,购自重庆腾信生物科技有限公司。在恒温(25 ℃)恒湿12 h的大鼠饲养笼中,饲喂普通饲料和水。NAFLD模型大鼠连续8周饲喂高脂饲料。NAFLD模型是遗传模型,高脂饮食或胆碱蛋氨酸缺乏的饮食,其中高脂肪饮食被认为是可重复的、可靠的、技术上简单易行的[12-13]。大鼠NAFLD模型建立标准为体质量增加大于30%,并通过组织学检查进一步证实(图 1)。
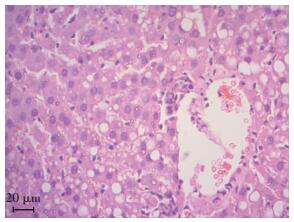
|
| 图 1 HE染色观察造模大鼠干细胞脂肪变性 |
1.2 实验设计
本实验将大鼠分为4组。正常对照组(n=6)接受0.2 mL生理盐水灌胃和正常完全饮食。模型大鼠连续饲喂高脂饲料,分为3组(每组6只):模型组、FMT组和益生菌组,分别给予0.2 mL生理盐水、粪便细菌溶液(含有细菌2.7×109)和益生菌溶液(含有益生菌2.7×109),每日灌胃1次,连续8周。
特殊药品的准备:VSL#3益生菌购于美国VSL公司,每粒含细菌112.5×109(包括乳酸杆菌属4个菌株、拟杆菌属3个菌株、链球菌属1个菌株),溶于8.333 mL PBS溶液,即13.5×109/mL,4 ℃保存。
供体粪便材料的制备:选取非月经期女性健康志愿者1名,年龄36岁,无特殊既往史,无巨细胞病毒感染史,无肝炎等传染病史,近期内无发热、腹痛、腹泻及便秘等消化道症状及感染症状,近期内未服用任何抗生素、抗病毒药物以及一切可能影响肠道功能及细菌的药物。于提取细菌前1 d,嘱该志愿者流质饮食。
粪便材料收集和分离:大约50 g来自健康女性供体的粪便材料收集并在250 mL无菌生理盐水中均质化。然后将浆料通过不锈钢茶滤器以除去较大的颗粒。然后将浆料通过2、1、0.5和0.25 mm不锈钢实验室筛(WS泰勒),以除去未消化的食物和较小的颗粒材料。将所得材料通过0.25 mm筛子离心150 min,再悬浮于无菌生理盐水中。通过计算粪肠球菌(粪肠球菌)的光密度值,对所得粪便细菌进行再悬浮和定量。
1.3 测定肝功能及血清胰岛素、白细胞介素-6和肿瘤坏死因子-α水平用自动化学分析仪分析血清参数,包括丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、HDL胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、甘油三酯(TG)和总胆固醇(T-CHO)。
收集各组大鼠血液,在30 000×g离心5 min,将上清血清小心地转移到另一管中,并保存在80 ℃冷冻箱中。用ELISA试剂盒检测胰岛素、IL-6和TNF-α水平。
1.4 统计学分析采用SPSS 19.0统计软件进行处理。使用卡方检验或Fisher精确检验比较定性变量,定量变量采用t检验。各组间均数比较采用方差分析,所有统计检验均为双侧检验。P < 0.05表示差异有统计学意义。
2 结果 2.1 粪便细菌移植可显著改善大鼠NAFLD模型的肝功能紊乱各组大鼠处理8周后,未观察到感染和死亡。对各组大鼠进行肝功能评价。与正常对照组比较,模型组大鼠肝脏质量与总体质量的比值(称为肝指数)升高(P < 0.01),提示肝脏肿大和肝脏脂肪过多;与模型组比较,益生菌组和FMT组大鼠肝指数明显减少(P < 0.01,图 2);而益生菌与FMT组差异无统计学意义(P>0.05)。
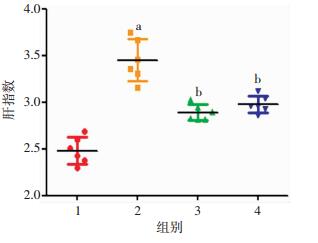
|
| 1:正常对照组;2:模型组;3:益生菌组;4:FMT组;a:P < 0.01,与正常对照组比较;b:P < 0.01,与模型组比较 图 2 各组大鼠肝指数比较 |
2.2 粪便细菌移植降低肝脏生化紊乱和脂质代谢紊乱
与正常对照组比较,HFD诱导模型大鼠肝损伤的两种主要循环标志物ALT和AST显著升高(P < 0.01)。值得注意的是,益生菌组和FMT组大鼠ALT和AST水平低于模型组大鼠(P < 0.01,图 3)。
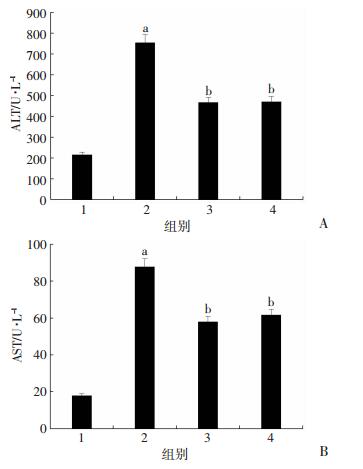
|
|
1:正常对照组;2:模型组;3:益生菌组;4:FMT组;a:P < 0.01,与正常对照组比较;b:P < 0.01,与模型组比较 A:ALT;B:AST 图 3 各组大鼠肝功能指标的比较 |
2.3 各组大鼠血脂相关指标的比较
模型组LDL-C、TG、T-CHO较正常对照组明显升高。但与模型组比较,益生菌组和FMT组大鼠上述指标明显下降(P < 0.01,图 4)。相反,减少多余的循环胆固醇的HDL-C在模型组中显著降低。在益生菌组和FMT组大鼠中HDL-C部分恢复(P < 0.01,图 5)。提示模型组大鼠发生了严重的肝损伤,而在FMT和益生菌治疗组均得到了明显的恢复。
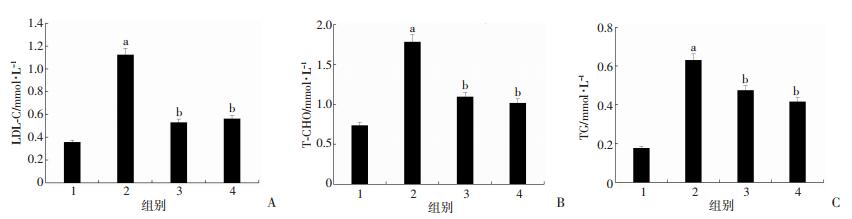
|
| 1:正常对照组;2:模型组;3:益生菌组;4:FMT组;a:P < 0.01,与正常对照组比较;b:P < 0.01,与模型组比较 图 4 各组大鼠LDL-C(A)、T-CHO(B)、TG(C)的比较 |
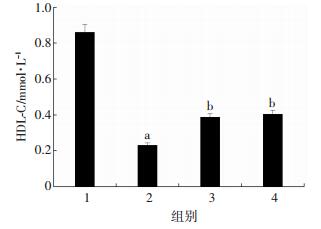
|
| 1:正常对照组;2:模型组;3:益生菌组;4:FMT组;a:P < 0.01,与正常对照组比较;b:P < 0.01,与模型组比较 图 5 各组大鼠HDL-C水平的比较 |
2.4 各组大鼠胰岛素抵抗相关指标的比较
通过使用空腹血糖(FBG)和空腹胰岛素水平(FIN)计算胰岛素抵抗(HOMA-IR)的稳态模型评估胰岛素抵抗。结果显示,这些参数在模型大鼠中更高。相比之下,益生菌和FMT治疗明显减弱了胰岛素抵抗的这些参数,起到了肝保护作用(P < 0.01,图 6)。
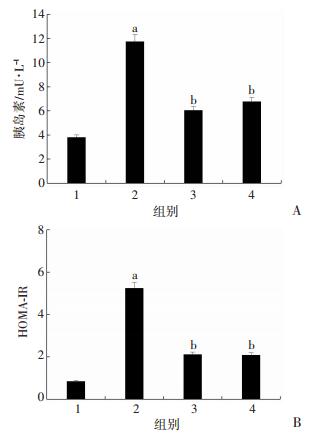
|
|
1:正常对照组;2:模型组;3:益生菌组;4:FMT组;a:P < 0.01,与正常对照组比较;b:P < 0.01,与模型组比较 A:胰岛素水平;B:HOMA-IR 图 6 各组大鼠胰岛素抵抗相关指标的比较 |
2.5 粪便微生物群移植抑制循环IL-6和TNF-α的系统性炎症反应
免疫细胞和脂肪细胞释放的大量循环炎症介质导致肝脏持续损伤和肝脏疾病进展。因此,检测NAFLD患者中最常见的循环炎症因子IL-6和TNF-α。结果显示,模型组大鼠IL-6和TNF-α水平分别为正常对照组的3~4倍。与模型组比较,益生菌组和FMT组大鼠IL-6和TNF-α水平降低约40%(P < 0.01,图 7)。表明FMT能够通过减少循环炎症因子如IL-6和TNF-α来抑制炎症反应。

|
| 1:正常对照组;2:模型组;3:益生菌组;4:FMT组;a:P < 0.01,与正常对照组比较;b:P < 0.01,与模型组比较 图 7 各组大鼠IL-6(A)和TNF-α(B)水平的比较 |
3 讨论
NAFLD是近年来不断被重视的公共健康问题,其参与了从脂肪变性到炎症、纤维化、肝硬化甚至肝癌的多个疾病演变阶段。据估计,其全球发病率为20%~30%。因此,迫切需要有效的治疗方案,而目前的治疗策略是极其有限的。最新的证据已经把肠道菌群失调与人类肝脏疾病的发病机制联系起来,主要关注其在NAFLD和相关代谢紊乱中的作用[14]。在这种情况下,益生菌虽然可以通过减少炎症反应,并刺激宿主免疫,而成为NAFLD的治疗选项之一。但由于其可能引发细菌移位及继发性菌血症的潜在风险[15],益生菌并没有被广泛应用于临床。在多项随机对照试验中的数据表明,FMT在不良生物条件下,如复发性艰难梭状芽孢杆菌感染的结肠炎治疗中是有效的[9-10]。
而FMT是否可以有效治疗NAFLD尚未被证实。本研究评估了FMT在喂饲高脂饮食NAFLD大鼠模型当中的治疗潜力。NAFLD的发生和发展通常伴随着生化循环障碍[16]。FMT治疗可以显著改善模型大鼠由高脂饮食诱发的脂肪变性及小叶炎症。另一方面,FMT明显降低ALT和AST水平,除了生化循环紊乱以外,脂质代谢的紊乱也参与了大鼠NAFLD的进展[17-18]。FMT通过降低LDL-C、TG和胆固醇水平,诱导HDL-C表达改善脂质代谢失调,揭示了FMT对NAFLD大鼠的肝脏保护作用。
值得注意的是,胰岛素抵抗是NAFLD的标志[19]。NAFLD常常由胰岛素抵抗而显得复杂,而胰岛素抵抗在NAFLD的发病过程中扮演着重要的角色[19-21]。此外,循环促炎细胞因子的稳态是控制全身炎症和肝胰岛素作用的基础。NAFLD患者中TNF-α水平较高,并被认为可以促进脂肪性肝炎的进展。此外,TNF-α多基因多态性与较高的HOMA-IR指数相关,并与NAFLD的发生相关。IL-6促进肝再生的同时也可以刺激肝脏损伤,诱导肝细胞凋亡及胰岛素抵抗,参与NASH的进展。本实验通过评价白细胞介素-6和肿瘤坏死因子-α水平的改变,以检验FMT是否能改善炎症反应。结果表明,大鼠接受FMT治疗后IL-6和TNF-α水平明显降低。FMT组胰岛素抵抗明显减弱,提示FMT能通过减少IL-6和TNF-α的表达以抑制全身炎症反应,从而改善胰岛素抵抗和NAFLD进展。
考虑到男性不良生活习惯多于女性,例如:吸烟、饮酒等,故选择女性作为志愿者,为了排除细菌质量对实验结果的影响,本实验只选择1名志愿者而没有设置健康对照。而针对不同种属之间的粪便细菌移植是否可以产生治疗效果,在2013年及2016年分别有实验团队进行过人体粪便细菌移植用于治疗啮齿类动物模型的相关研究,结果表明大鼠对于人类粪便细菌移植是可操作的[22-23]。
总之,本研究证明FMT对大鼠NAFLD模型的治疗是有效的,并探讨了其可能的机制。首先,FMT可以通过降低LDL-C、TG和胆固醇水平,诱导HDL-C表达从而逆转脂质代谢失调。其次,FMT可以降低IL-6和TNF-α水平进而抑制小叶间炎症反应。另外,FMT可以降低模型大鼠空腹血糖和胰岛素水平而削弱胰岛素抵抗,进一步起到肝脏保护作用,从而达到改善肝功能目的。本实验各组数据中FMT组与益生菌组差异并无统计学意义(P>0.05),表明FMT可能成为一种安全、有效的治疗手段,揭示了其良好的应用前景。由于本实验样本量较少,作为FMT对于大鼠非酒精性肝病治疗作用的初步探讨参考价值有限,但仍提供了宝贵的在体实验基础,为NAFLD患者提供了潜在的治疗选择。
| [1] | KHAN R S, NEWSOME P N. NAFLD in 2017: Novel insights into mechanisms of disease progression[J]. Nat Rev Gastroenterol Hepatol, 2018, 15(2): 71–72. DOI:10.1038/nrgastro.2017.181 |
| [2] | GEORGE J, ANSTEE Q, RATZIU V, et al. NAFLD: the evolving landscape[J]. J Hepatol, 2018, 68(2): 227–229. DOI:10.1016/j.jhep.2017.11.016 |
| [3] | YOUNOSSI Z, ANSTEE Q M, MARIETTI M, et al. Global burden of NAFLD and NASH: trends, predictions, risk factors and prevention[J]. Nat Rev Gastroenterol Hepatol, 2018, 15(1): 11–20. DOI:10.1038/nrgastro.2017.109 |
| [4] | ADAMS L A, WATERS O R, KNUIMAN M W, et al. NAFLD as a risk factor for the development of diabetes and the metabolic syndrome: An eleven-year follow-up study[J]. Am J Gastroenterol, 2009, 104(4): 861–867. DOI:10.1038/ajg.2009.67 |
| [5] | KANWAR P, NELSON J E, YATES K, et al. Association between metabolic syndrome and liver histology among NAFLD patients without diabetes[J]. BMJ Open Gastroenterol, 2016, 3(1): e000114. DOI:10.1136/bmjgast-2016-000114 |
| [6] | LIM J S, MIETUS-SNYDER M, VALENTE A, et al. The role of fructose in the pathogenesis of NAFLD and the metabolic syndrome[J]. Nat Rev Gastroenterol Hepatol, 2010, 7(5): 251–264. DOI:10.1038/nrgastro.2010.41 |
| [7] | NOBILI V, CIANFARANI S, AGOSTONI C. Programming, metabolic syndrome, and NAFLD: the challenge of transforming a vicious cycle into a virtuous cycle[J]. J Hepatol, 2010, 52(6): 788–790. DOI:10.1016/j.jhep.2010.02.010 |
| [8] | ROMERO-GÓMEZ M, ZELBER-SAGI S, TRENELL M. Treatment of NAFLD with diet, physical activity and exercise[J]. J Hepatol, 2017, 67(4): 829–846. DOI:10.1016/j.jhep.2017.05.016 |
| [9] | KAO D N, ROACH B, SILVA M, et al. Effect of oral capsule- vs colonoscopy-delivered fecal microbiota transplantation on recurrent clostridium difficile infection: A randomized clinical trial[J]. JAMA, 2017, 318(20): 1985–1993. DOI:10.1001/jama.2017.17077 |
| [10] | RAO K, YOUNG V B, MALANI P N. Capsules for fecal microbiota transplantation in recurrent clostridium difficile infection: the new way forward or a tough pill to swallow?[J]. JAMA, 2017, 318(20): 1979–1980. DOI:10.1001/jama.2017.17969 |
| [11] |
王威巍, 张宇, 尤楠, 等. 粪便细菌移植对肝性脑病大鼠肝功能及血氨的影响[J].
第三军医大学学报, 2017, 39(13): 1321–1326.
WANG W W, ZHANG Y, YOU N, et al. Effects of fecal microbiota transplantation on liver function and blood ammonia in hepatic encephalopathy rats[J]. J Third Mil Med Univ, 2017, 39(13): 1321–1326. DOI:10.16016/j.1000-5404.201610152 |
| [12] | SHELDON R D, PADILLA J, JENKINS N T, et al. Chronic NOS inhibition accelerates NAFLD progression in an obese rat model[J]. Am J Physiol Gastrointest Liver Physiol, 2015, 308(6): G540–G549. DOI:10.1152/ajpgi.00247.2014 |
| [13] | PASARÍN M, ABRALDES J G, RODRÍGUEZ-VILARRUPLA A, et al. Insulin resistance and liver microcirculation in a rat model of early NAFLD[J]. J Hepatol, 2011, 55(5): 1095–1102. DOI:10.1016/j.jhep.2011.01.053 |
| [14] | HENAO-MEJIA J, ELINAV E, JIN C C, et al. Inflammasome-mediated dysbiosis regulates progression of NAFLD and obesity[J]. Nature, 2012, 482(7384): 179–185. DOI:10.1038/nature10809 |
| [15] | SANDERS M E, AKKERMANS L M, HALLER D, et al. Safety assessment of probiotics for human use[J]. Gut Microbes, 2010, 1(3): 164–185. DOI:10.4161/gmic.1.3.12127 |
| [16] | TORRES D M, HARRISON S A. NAFLD: Predictive value of ALT levels for NASH and advanced fibrosis[J]. Nat Rev Gastroenterol Hepatol, 2013, 10(9): 510–511. DOI:10.1038/nrgastro.2013.138 |
| [17] | TAN T C, CRAWFORD D H, JASKOWSKI L A, et al. Altered lipid metabolism in Hfe-knockout mice promotes severe NAFLD and early fibrosis[J]. Am J Physiol Gastrointest Liver Physiol, 2011, 301(5): G865–G876. DOI:10.1152/ajpgi.00150.2011 |
| [18] | MUSSO G, GAMBINO R, CASSADER M. Recent insights into hepatic lipid metabolism in non-alcoholic fatty liver disease (NAFLD)[J]. Prog Lipid Res, 2009, 48(1): 1–26. DOI:10.1016/j.plipres.2008.08.001 |
| [19] | CALDWELL S H, ARGO C K, AL-OSAIMI A M. Therapy of NAFLD: insulin sensitizing agents[J]. J Clin Gastroenterol, 2006, 40(Suppl 1): S61–S66. DOI:10.1097/01.mcg.0000168647.71411.48 |
| [20] | ALLARD J P, AGHDASSI E, MOHAMMED S, et al. Nutritional assessment and hepatic fatty acid composition in non-alcoholic fatty liver disease (NAFLD): A cross-sectional study[J]. J Hepatol, 2008, 48(2): 300–307. DOI:10.1016/j.jhep.2007.09.009 |
| [21] | GAGGINI M, CARLI F, ROSSO C, et al. Altered amino acid concentrations in NAFLD: Impact of obesity and insulin resistance[J]. Hepatology, 2018, 67(1): 145–158. DOI:10.1002/hep.29465 |
| [22] | PLANER J D, PENG Y Q, KAU A L, et al. Development of the gut microbiota and mucosal IgA responses in twins and gnotobiotic mice[J]. Nature, 2016, 534(7606): 263–266. DOI:10.1038/nature17940 |
| [23] | RIDAURA V K, FAITH J J, REY F E, et al. Gut microbiota from twins discordant for obesity modulate metabolism in mice[J]. Science, 2013, 341(6150): 1241214. DOI:10.1126/science.1241214 |



