2. 453000 河南 新乡,新乡医学院基础医学院病理教研室
2. Department of Pathology, School of Basic Medical Sciences, Xinxiang Medical College, Xinxiang, Henan Province, 453000, China
胶质瘤是颅内高发恶性肿瘤,侵袭力强、易复发、病死率高是其主要特点[1],尽管现有的手术及辅助放化疗手段不断进步,但患者总体预后依然较差[2]。研究表明,侵袭性生长是导致胶质瘤预后不佳的主要因素[3]。因此,深入探索与胶质瘤恶性生物学行为相关的靶标基因,对指导治疗及改善患者预后具有重要意义。
溶酶体相关4次跨膜蛋白B(lysosome-associated protein transmembrane-4 beta,LAPTM4B)是新近发现的一种具有癌基因特性的基因,广泛存在于机体内,在调控细胞增殖、分化、迁移、侵袭及凋亡中发挥重要作用[4],在多种恶性肿瘤组织中呈高表达,参与了肿瘤发生、进展及转移浸润过程[5-7]。本研究检测胶质瘤组织中LAPTM4B蛋白表达,探讨其与临床指标及预后的关系,并观察其对胶质瘤U251细胞增殖、凋亡及侵袭力的影响,以期为胶质瘤机制研究提供基础资料。
1 资料与方法 1.1 临床资料选取2011年6月至2015年6月在新乡市中心医院行手术切除的胶质瘤患者86例,术前未接受放化疗,术后病理学检查确诊。其中,男性51例,女性35例,年龄20~69(47.25±10.64)岁,根据WHO分级标准[8]:Ⅰ级10例,Ⅱ级26,Ⅲ级22例,Ⅳ级28例。同期,选取因脑外伤行颅内减压患者25例作为对照,男性13例,女性12例,年龄20~65(46.85±11.21)岁,两组患者性别、年龄差异无统计学意义(P>0.05)。术中留取胶质瘤组织和正常脑组织。所有患者术后进行随访,随访形式包括电话、门诊复查,随访截止时间2018年6月30日,以死亡作为终点事件,随访中,失访5例,随访率94.19%。
1.2 主要试剂免疫组化试剂盒及配套试剂购自北京中衫金桥生物,兔抗人LAPTM4B一抗购自Abcam公司,辣根过氧化物酶标记的羊抗兔二抗和DMSO购自Sigma公司,U251细胞购自中科院上海生科院细胞资源中心,DMEM培养基、胎牛血清、胰蛋白酶、链霉素和链霉素购自Gibico公司,Lipofectamine 2000转染试剂和TRIzol总RNA提取试剂购自Invitrogen公司,LAPTM4B干扰序列(siRNA-LAPTM4B)和阴性对照序列(siRNA-NC)由上海美轩生物科技有限公司构建,反转录和PCR试剂购自Promega公司,LAPTM4B和GAPDH由生工生物工程(上海)股份有限公司设计合成,MTT购自上海炎熙生物科技公司,Transwell小室购自Corning公司,Matrigel基质胶购自BD公司,兔抗人E-cadherin、N-cadherin及Vimentin一抗购自Proteintech公司。
1.3 方法 1.3.1 免疫组化采用S-P法检测LAPTM4B的表达情况。采用半定量法判定结果[9]:①染色强度:按无染色、浅黄色、黄色、黄褐色分别赋予0、1、2、3分;②阳性细胞百分比:按<5%、5%~25%、25%~50%、50%~75%、>75%分别赋予0、1、2、3、4分。将①×②得分判定结果,0~3分为阴性(-),≥4分为阳性(+)。每个病理切片均由病理科2位具有副主任医师职称的医师盲法完成观察。
1.3.2 细胞培养用含10%胎牛血清的DMEM培养基在37℃、饱和湿度、5%CO2培养箱中对U251细胞培养。胰酶消化,传导培养,待细胞融合度在80%以上时,分组转染。①siRNA-LAPTM4B组:按照小分子干扰RNA(small interfering RNA,siRNA)技术操作步骤,利用Lipofectamine 2000转染试剂转染LAPTM4B siRNA序列:正义链:5′-GGAUCAGUAUAACUUUUCATT-3′,反义链:5′-UGAAAAGUUAUACUGAUCCGG-3′;②siRNA-NC组:方法同siRNA-LAPTM4B组,转染阴性对照序列:正义链:5′-GAAUUAAUUAAAGAUGGCCCGUUGUACU-3′,反义链:5′-UCAUCGAAGUUAUAGGGAUACAUUACGUGAUC-3′;③空白组:不作任何处理。
1.3.3 实时荧光定量PCR技术检测用总RNA提取试剂提取细胞中总RNA,使用紫外分光光度计检测纯度。按反转录试剂盒说明反转录为cDNA,使用实时荧光定量PCR仪按PCR试剂盒说明对引物扩增。引物序列:上游:5′-TGTTACCAGCAATGACACTACG-3′,下游:5′-ATGTCTGCAAAGTCAAGCTG-3′;GAPDH:上游:5′-CCATCAATGACCCCTTCATTG-3′,下游:5′-GACGGTGCCATGGAATTT-3′。反应条件:95 ℃ 3 min,94 ℃ 20 s,60 ℃ 30 s,75 ℃ 30 s,连续循环38次。用2-△△Ct法计算细胞中LAPTM4B mRNA相对表达量。
1.3.4 MTT细胞增殖实验收集各组转染24 h细胞,消化,接种于96孔板,细胞数为2×104/孔,继续在37 ℃、饱和湿度、5%CO2培养箱中培养。分别于12、24、48、72、96 h时,各孔中加入MTT液(5 mg/mL)50 μL,室温培养5 h,弃去培养液,加入DMSO,充分震荡使结晶物充分溶解,用酶标仪检测各孔在490 nm波长处光密度值[D(490)]。
1.3.5 肿瘤细胞克隆形成实验各组细胞转染后培养48 h,胰酶消化,1 000 r/min离心15 min,取沉淀,用完全培养液重悬,细胞数为500/mL,取1×103个细胞均匀平铺于塑料培养皿中,在37 ℃、饱和湿度、5%CO2培养箱中培养,2周后,用甲醇和冰醋酸混合液固定,结晶紫染色,倒置显微镜观察,以≥50个细胞集落为1个克隆,计数克隆数。
1.3.6 Transwell法检测细胞迁移和侵袭能力细胞迁移能力检测:各组细胞转染后培养48 h,胰酶消化,离心,无血清培养液重悬,细胞数为5×105/mL,取200 μL加入上室,下室加入含20%血清培养液600 μL,在37 ℃、饱和湿度、5%CO2培养箱中培养24 h,甲醛固定,结晶紫染色,显微镜观察,计数穿膜细胞数。细胞侵袭力检测:将基质胶用预冷无血清培养液稀释后,加入Transwell小室上室,风干备用,其余步骤同细胞迁移能力检测。
1.3.7 蛋白质提取以及Western blot检测使用总蛋白提取试剂盒提取各组细胞中总蛋白,按BCA蛋白浓度测定试剂盒检测蛋白浓度。取30 μg总蛋白,行SDS-PAGE凝胶电泳,电转至PVDF膜,用5%脱脂奶粉封闭60 min,TBST冲洗3次,加入兔抗人E-cadherin、N-cadherin和Vimentin抗体一抗,4 ℃下过夜孵育,TBST冲洗3次,加入二抗,室温孵育120 min,TBST冲洗3次,暗室下加入ECL液反应10 min,拍照,使用Image J图像分析软件,以β-actin为参考分析各目的蛋白相对表达量。
1.4 统计学分析采用SPSS 21.0统计软件分析,每项实验至少重复3次,计量资料以x±s表示,多组间比较采用单因素方差分析和LSD-t检验;计数资料采用率值表示,组间比较采用χ2检验;生存分析采用Kaplan-Meier法和Log-Rank检验,影响患者预后的风险因素分析采用Cox比例风险模型分析。检验水准:α=0.05。
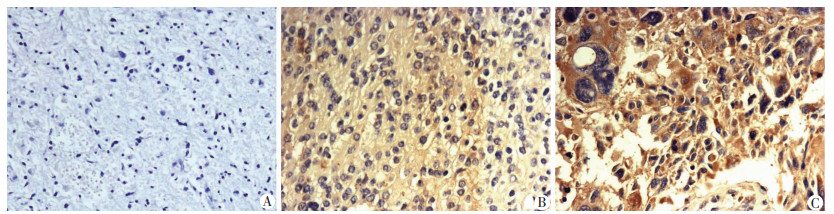
2 结果 2.1 胶质瘤组织中LAPTM4B蛋白表达LAPTM4B蛋白阳性表达主要定位于胶质瘤及正常脑组组的细胞质中。在胶质瘤组织中的阳性表达率为77.91%(67/86),而正常脑组织中则为28.00%(7/25),差异有统计学意义(χ2=21.710,P < 0.001,图 1)。
|
| A:LAPTM4B蛋白在正常脑组织阴性表达;B:LAPTM4B蛋白在Ⅰ和Ⅱ级胶质瘤组织中弱表达;C:LAPTM4B蛋白在Ⅲ和Ⅳ级胶质瘤组织中强表达 图 1 LAPTM4B蛋白在胶质瘤和正常脑组织中表达(S-P ×200) |
2.2 LAPTM4B在胶质瘤组织中表达与临床病理特征的关系
不同性别、不同年龄、不同肿瘤位置、不同KPS评分的LAPTM4B蛋白阳性表达率差异无统计学意义(P>0.05),不同WHO分级的LAPTM4B蛋白阳性表达率差异有统计学意义(P < 0.05),见表 1。
| 临床病理特征 | 例数 | LAPTM4B蛋白 | χ2值 | P值 | |
| + | - | ||||
| 性别 | 0.150 | 0.698 | |||
| 男性 | 51 | 39(76.47) | 12(23.53) | ||
| 女性 | 35 | 28(80.00) | 7(20.00) | ||
| 年龄/岁 | |||||
| ≥48 | 54 | 43(79.63) | 11(20.37) | 0.250 | 0.617 |
| < 48 | 32 | 24(75.00) | 8(25.00) | ||
| 肿瘤位置 | |||||
| 小脑幕上 | 68 | 52(76.47) | 16(23.53) | 0.389 | 0.533 |
| 小脑幕下 | 18 | 15(83.33) | 3(16.67) | ||
| 肿瘤大小/cm | |||||
| ≥3 | 56 | 45(80.36) | 11(19.64) | 0.560 | 0.454 |
| < 3 | 30 | 22(73.33) | 8(26.67) | ||
| WHO分级 | |||||
| Ⅰ~Ⅱ级 | 36 | 23(63.89) | 13(36.11) | 7.069 | 0.008 |
| Ⅲ~Ⅳ级 | 50 | 44(88.00) | 6(12.00) | ||
| KPS评分/分 | |||||
| ≥80 | 38 | 31(81.58) | 7(18.42) | 0.533 | 0.465 |
| < 80 | 48 | 36(75.00) | 12(25.00) | ||
2.3 LAPTM4B蛋白表达与胶质瘤患者预后的关系
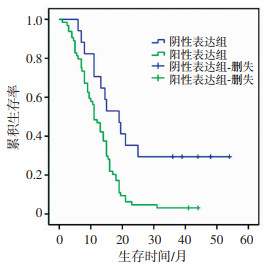
81例患者术后随访时间1~54个月,中位随访时间13.2个月。Kaplan-Meier生存分析结果显示,LAPTM4B蛋白阳性表达组患者中位生存时间11个月,累积生存率3.1%,LAPTM4B蛋白阴性表达组患者中位生存时间19个月,累积生存率29.4%,Log-Rank检验差异有统计学意义(χ2=9.309,P=0.002,图 2)。
|
| 图 2 LAPTM4B蛋白表达对胶质瘤患者预后的影响 |
2.4 Cox比例风险模型分析影响胶质瘤患者预后的因素
Cox比例风险模型分析结果显示,WHO分级和LAPTM4B蛋白表达是影响胶质瘤患者预后的风险因素(HR=2.614和1.969,P < 0.05),见表 2。
| 指标 | B | SE | Wald | P | HR(95%CI) |
| 性别 | 0.040 | 0.284 | 0.020 | 0.887 | 1.041(0.597~1.817) |
| 年龄 | 0.105 | 0.270 | 0.152 | 0.697 | 1.111(0.654~1.886) |
| 肿瘤位置 | 0.091 | 0.299 | 0.092 | 0.762 | 1.095(0.609~1.968) |
| 肿瘤大小 | 0.184 | 0.277 | 0.442 | 0.506 | 1.202(0.699~2.069) |
| WHO分级 | 0.961 | 0.268 | 12.853 | 0.000 | 2.614(1.546~4.421) |
| KPS评分 | 0.089 | 0.244 | 0.134 | 0.715 | 1.093(0.678~1.762) |
| LAPTM4B蛋白表达 | 0.677 | 0.336 | 4.069 | 0.044 | 1.969(1.019~3.802) |
2.5 3组细胞中LAPTM4B基因表达
LAPTM4B mRNA在siRNA-LAPTM4B组、siRNA-NC组和空白组细胞中相对表达量分别为(0.17±0.07)、(1.03±0.05)和(1.00±0.02),差异有统计学意义(F=568.784,P < 0.001),LAPTM4B mRNA在siRNA-NC组和空白组细胞中相对表达量无差异(P=0.344),LAPTM4B mRNA在siRNA-LAPTM4B组细胞中相对表达量低于siRNA-NC组和空白组,差异有统计学意义(P < 0.05)。
2.6 LAPTM4B对胶质瘤细胞增殖活力的影响MTT实验结果显示,3组细胞12 h时D(490)值差异无统计学意义(P>0.05),siRNA-LAPTM4B组24、48、72、96 h时D(490)值显著低于siRNA-NC组和空白组(P < 0.01,表 3)。
| 组别 | 12 h | 24 h | 48 h | 72 h | 96 h |
| siRNA-LAPTM4B组 | 0.12±0.02 | 0.20±0.03ab | 0.33±0.07ab | 0.52±0.06ab | 0.63±0.10ab |
| siRNA-NC组 | 0.10±0.04 | 0.38±0.07 | 0.54±0.06 | 0.64±0.08 | 0.74±0.06 |
| 空白组 | 0.13±0.04 | 0.40±0.05 | 0.50±0.02 | 0.66±0.03 | 0.80±0.04 |
| F | 0.922 | 24.567 | 26.954 | 9.968 | 9.270 |
| P | 0.419 | < 0.001 | < 0.001 | 0.002 | 0.002 |
| a:P < 0.05,与空白组比较;b:P < 0.05,与siRNA-NC组比较 | |||||
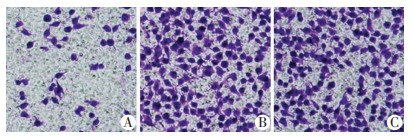
克隆形成实验结果显示,siRNA-LAPTM4B组、siRNA-NC组和空白组细胞克隆数分别为(40.62±5.73)、(154.24±9.14)、(148.29±13.73)个,组间比较差异有统计学意义(F=241.440,P < 0.001),siRNA-NC组和空白组细胞克隆数差异无统计学意义(P= 0.322),siRNA-LAPTM4B组细胞克隆数显著低于siRNA-NC组和空白组(P < 0.05),见图 3。

|
| A:siRNA-LAPTM4B组;B:siRNA-NC组;C:空白组 图 3 克隆形成实验检测3组细胞增殖能力(结晶紫染色) |
2.7 LAPTM4B对胶质瘤细胞迁移和侵袭力的影响
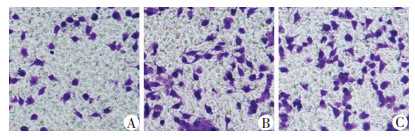
Transwell法检测细胞迁移和侵袭能力见图 4、5。迁移细胞数和侵袭细胞数在siRNA-NC组和空白组差异无统计学意义(P=0.229和0.405),siRNA-LAPTM4B组迁移细胞数和侵袭细胞数显著低于siRNA-NC组和空白组(P < 0.05,表 4)。
|
| A:siRNA-LAPTM4B组;B:siRNA-NC组;C:空白组 图 4 Transwell法检测细胞迁移能力(结晶紫染色×200) |
|
| A:siRNA-LAPTM4B组;B:siRNA-NC组;C:空白组 图 5 Transwell法检测细胞侵袭能力(结晶紫染色×200) |
| 组别 | 迁移细胞数 | 侵袭细胞数 |
| siRNA-LAPTM4B组 | 78.28±8.81ab | 69.50±7.39ab |
| siRNA-NC组 | 121.11±8.06 | 105.33±5.49 |
| 空白组 | 126.78±6.38 | 102.29±5.29 |
| F值 | 69.046 | 62.990 |
| P值 | < 0.001 | < 0.001 |
| a:P < 0.05,与空白组比较;b:P < 0.05,与siRNA-NC组比较 | ||
2.8 LAPTM4B对胶质瘤细胞中E-cadherin、N-cadherin和Vimentin蛋白表达的影响
siRNA-LAPTM4B组细胞中LAPTM4B、N-cadherin和Vimentin蛋白表达量低于siRNA-NC组和空白组,而E-cadherin蛋白表达量高于siRNA-NC组和空白组,差异均有统计学意义(P < 0.05),见表 5、图 6。
| 组别 | LAPTM4B蛋白 | E-cadherin蛋白 | N-cadherin蛋白 | Vimentin蛋白 |
| siRNA-LAPTM4B组 | 0.24±0.08ab | 0.78±0.06ab | 0.19±0.04ab | 0.27±0.05ab |
| siRNA-NC组 | 0.82±0.06 | 0.16±0.04 | 0.66±0.09 | 0.87±0.08 |
| 空白组 | 0.80±0.10 | 0.18±0.03 | 0.68±0.05 | 0.90±0.04 |
| F | 89.063 | 338.974 | 108.218 | 65.671 |
| P | < 0.001 | < 0.001 | < 0.001 | < 0.001 |
| a:P < 0.05,与空白组比较;b:P < 0.05,与siRNA-NC组比较 | ||||

|
| 1:siRNA-LAPTM4B组;2:siRNA-NC组;3:空白组 图 6 Western blot检测各组LAPTM4B、E-cadherin、N-cadherin和Vimentin蛋白的表达 |
3 讨论
胶质瘤占全部脑部肿瘤的50%左右,且发病率呈不断升高趋势[10]。由于该肿瘤呈侵袭性生长可破坏血脑屏障而侵犯周围正常脑组织,具有较高的致死和致残性,即使采取手术切除辅以放化疗治疗,患者术后复发率依然较高,病死率居高不下[11]。基因靶向治疗是目前有望治愈肿瘤的有效手段,但关键在于寻找可靠的治疗靶点[12]。LAPTM4B位于人染色体8q22.1,由7个外显子及6个内显子组成,广泛表达于机体组织中,在调控细胞增殖、凋亡、迁移、侵袭等多项生物学性能中发挥重要作用[13]。研究报道,LAPTM4B可发挥癌基因的特性而参与了多种恶性肿瘤发生及恶性化过程[14]。且与肿瘤多药耐药有关[15]。本研究结果显示,LAPTM4B蛋白在胶质瘤组织中呈高表达,可能参与了胶质瘤发生过程;LAPTM4B蛋白在WHO分级Ⅲ~Ⅳ级患者组织中阳性表达率明显高于Ⅰ~Ⅱ级,说明LAPTM4B蛋白表达与胶质瘤恶性程度有关,LAPTM4B可能参与了胶质瘤恶性进展。
研究报道,LAPTM4B表达升高是乳腺癌患者不良预后的标志[16]。LAPTM4B过表达时非小细胞肺癌复发和不良预后的生物标志物。本研究Kaplan-Meier生存分析结果显示,LAPTM4B蛋白阳性表达组患者中位生存时间和累积生存率均低于LAPTM4B蛋白阴性表达组患者,说明LAPTM4B蛋白表达与胶质瘤患者生存时间及生存率有关,Cox比例风险模型分析结果进一步显示,LAPTM4B蛋白表达是影响胶质瘤患者预后的风险因素,提示LAPTM4B蛋白表达与胶质瘤患者预后密切相关。这与DONG等[17]研究结果一致,LAPTM4B有望作为胶质瘤新的预后标志物。
本研究利用siRNA技术特异性下调U251细胞中LAPTM4B基因表达,结果显示,LAPTM4B mRNA和蛋白在siRNA-LAPTM4B组细胞中相对表达量低于siRNA-NC组和空白组,siRNA-LAPTM4B组细胞中LAPTM4B基因表达被抑制。本研究结果显示,siRNA-LAPTM4B组培养24、48、72、96 h时D(490)值及细胞克隆数低于siRNA-NC组和空白组,说明下调LAPTM4B基因表达可减少U251细胞增殖能力;siRNA-LAPTM4B组侵袭细胞数低于siRNA-NC组和空白组,说明LAPTM4B与细胞侵袭有关,下调LAPTM4B基因表达可有效抑制U251细胞侵袭力。研究表明,上皮-间质转化可促进肿瘤细胞失去上皮细胞特性,可促进肿瘤细胞增殖、迁移及侵袭而加速肿瘤恶性化进程[18]。本研究结果显示,siRNA-LAPTM4B组细胞中N-cadherin和Vimentin蛋白表达量低于siRNA-NC组和空白组,而E-cadherin蛋白表达量则升高,说明下调LAPTM4B基因表达可有效抑制细胞上皮-间质转化的发生,进一步提示LAPTM4B可能通过调控上皮-间质转化过程而参与了U251细胞恶性化过程。
综上所述,LAPTM4B蛋白在胶质瘤组织中阳性表达率升高,且与恶性程度有关,是影响患者预后的风险因素,特异性下调U251细胞中LAPTM4B基因表达可显著减少细胞增殖,抑制细胞侵袭,其机制可能与抑制上皮-间质转化有关,有望为胶质瘤临床诊疗提供新的靶位。
| [1] |
LAN F, QING Q, PAN Q, et al. Serum exosomal miR-301a as a potential diagnostic and prognostic biomarker for human glioma[J]. Cell Oncol (Dordr), 2018, 41(1): 25-33. DOI:10.1007/s13402-017-0355-3 |
| [2] |
LIPP E S, MCLENDON R E. Tissue is the issue:biomarkers of prognosis and classification in adult gliomas[J]. Semin Oncol Nurs, 2018, 34(5): 430-442. DOI:10.1016/j.soncn.2018.10.002 |
| [3] |
LV J, YANG H, WANG X, et al. Decreased BRMS1L expression is correlated with glioma grade and predicts poor survival in glioblastoma via an invasive phenotype[J]. Cancer Biomark, 2018, 22(2): 311-316. DOI:10.3233/CBM-171019 |
| [4] |
MENG Y, WANG L, CHEN D, et al. LAPTM4B:an oncogene in various solid tumors and its functions[J]. Oncogene, 2016, 35(50): 6359-6365. DOI:10.1038/onc.2016.189 |
| [5] |
DING H, CHENG X, DING N, et al. Association between LAPTM4B gene polymorphism and susceptibility to and prognosis of diffuse large B-cell lymphoma[J]. Oncol Lett, 2018, 15(1): 264-270. DOI:10.3892/ol.2017.7318 |
| [6] |
张静怡, 单丽珠, 张洁, 等. LAPTM4B-35和MMP-9在胃癌中表达及临床意义[J]. 中国肿瘤临床, 2017, 44(24): 1226-1231. ZHANG J Y, SHAN L Z, ZHANG J, et al. Expression and significance of LAPTM4B-35 and MMP-9 in patients with gastric cancer[J]. Chin J Clin Oncol, 2017, 44(24): 1226-1231. DOI:10.3969/j.issn.1000-8179.2017.24.822 |
| [7] |
MENG F, TAN S, LIU T, et al. Predictive significance of combined LAPTM4B and VEGF expression in patients with cervical cancer[J]. Tumour Biol, 2016, 37(4): 4849-4855. DOI:10.1007/s13277-015-4319-9 |
| [8] |
LOUIS D N, OHGAKI H, WIESTLER O D, et al. The 2007 WHO classification of tumours of the central nervous system[J]. Acta Neuropathol, 2007, 114(2): 97-109. DOI:10.1007/s00401-007-0243-4 |
| [9] |
李勐, 刘志慧, 马立新, 等. 趋化因子CCLl 8在胶质瘤中的表达及对其侵袭力影响的研究[J]. 中华神经医学杂志, 2018, 17(6): 548-553. LI M, LIU Z H, MA L X, et al. CCL18 is highly expressed in glioma tissues and promotes activity of glioblastoma ceils[J]. Chin J Neuromed, 2018, 17(6): 548-553. DOI:10.3760/cma.j.issn.1671-8925.2016.06.002 |
| [10] |
YAMANAKA R, HAYANO A, KANAYAMA T. Radiation-induced gliomas:a comprehensive review and meta-analysis[J]. Neurosurg Rev, 2018, 41(3): 719-731. DOI:10.1007/s10143-016-0786-8 |
| [11] |
LU V M, JUE T R, MCDONALD K L, et al. The survival effect of repeat surgery at glioblastoma recurrence and its trend:A systematic review and meta-analysis[J]. World Neurosurg, 2018, 115(6): 453-459. DOI:10.1016/j.wneu.2018.04.016 |
| [12] |
孙婷. 靶向肿瘤的溶瘤腺病毒制备策略的研究进展[J]. 中国肿瘤生物治疗杂志, 2018, 25(2): 198-205. SUN T. Research progress of preparation strategy of oncolytic adenovirus for targeted cancer[J]. Chin J Cancer Biother, 2018, 25(2): 198-205. DOI:10.3872/j.issn.1007-385x.2018.02.016 |
| [13] |
HASHEMI M, BAHARI G, TABASI F, et al. LAPTM4B gene polymorphism augments the risk of cancer:Evidence from an updated meta-analysis[J]. J Cell Mol Med, 2018, 22(12): 6396-6400. DOI:10.1111/jcmm.13896 |
| [14] |
BLOM T, LI S, DICHLBERGER A, et al. LAPTM4B facilitates late endosomal ceramide export to control cell death pathways[J]. Nat Chem Biol, 2015, 11(10): 799-806. DOI:10.1038/nchembio.1889 |
| [15] |
LI S, WANG L, MENG Y, et al. Increased levels of LAPTM4B, VEGF and survivin are correlated with tumor progression and poor prognosis in breast cancer patients[J]. Oncotarget, 2017, 8(25): 41282-41293. DOI:10.18632/oncotarget.17176 |
| [16] |
KONG F, GAO F, CHEN J, et al. Overexpressed LAPTM4B-35 is a risk factor for cancer recurrence and poor prognosis in non-small-cell lung cancer[J]. Oncotarget, 2016, 7(35): 56193-56199. DOI:10.18632/oncotarget.10907 |
| [17] |
DONG X, TAMURA K, KOBAYASHI D, et al. LAPTM4B-35 is a novel prognostic factor for glioblastoma[J]. J Neurooncol, 2017, 132(2): 295-303. DOI:10.1007/s11060-017-2369-0 |
| [18] |
WANG Y, SONG W, KAN P, et al. Overexpression of Epsin 3 enhances migration and invasion of glioma cells by inducing epithelial mesenchymal transition[J]. Oncol Rep, 2018, 40(5): 3049-3059. DOI:10.3892/or.2018.6691 |



