急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)是炎症引起的急性弥漫性肺损伤,主要的临床表现为非心源性肺水肿和顽固性低氧血症[1]。ARDS预后不良,病死率高,寻找有效的治疗方法是目前研究的重点。2012年制定的柏林定义根据氧合指数将ARDS分为轻、中、重三类,取消了急性肺损伤这个概念,但在动物实验中仍沿用这一术语。控制中性粒细胞为主的炎症反应对改善ARDS有积极意义。随着对ARDS发病机制的深入研究,已证实辅助性T细胞17(T helper 17 cells, Th17)在ARDS中发挥着重要作用[2]。Th17细胞通过分泌细胞因子白介素-17A(interleukin-17A, IL-17A),诱导产生集落刺激因子和趋化因子[3],募集中性粒细胞在炎症部位聚集并损伤肺组织。
1, 25二羟维生素D3,即钙三醇,是维生素D(vitamin D, VD)发挥作用的活性形式,维生素D除了在体内钙磷代谢中发挥着重要作用外,还参与机体免疫调节[4]。有研究表明,ARDS患者普遍存在维生素D缺乏的现象,且在缺乏维生素D的ARDS患者中更易出现不良后果[5]。维生素D能抑制Th17细胞特征性细胞因子IL-17A产生[6-7],减轻疾病的严重程度。维生素D在ARDS中的作用及机制尚未阐明。因此,本研究探讨维生素D在小鼠急性肺损伤中的作用及对Th17细胞介导的炎症反应可能的调节机制,希望能为ARDS的治疗提供理论依据。
1 材料与方法 1.1 材料6~8周龄雄性C57BL/6小鼠,SPF级,购买并饲养于重庆医科大学实验动物中心,实验前适应性饲养1周。1, 25二羟维生素D3购于MCE公司;胶原酶Ⅳ、DNaseⅠ、脂多糖(lipopolysaccharide, LPS)、HE试剂盒、吉姆萨染色液购自北京索莱宝科技有限公司;佛波酯-12-肉豆蔻酸酯-13-乙酸酯(PMA)、布雷菲德菌素A (BFA)、ionomycin购自Sigma公司;FITC标记的抗小鼠CD4抗体、PE标记的抗小鼠CD4抗体、PE标记的抗小鼠IL-17A抗体、PE标记的IgG1, κ同型对照抗体购买自美国biolegend公司;兔单克隆抗RORγt抗体购于艾博抗(上海)贸易有限公司;ELISA试剂盒购自欣博盛生物有限公司;RNA提取试剂、逆转录试剂盒、SYBR购买自日本TaKaRa公司;Western blot配胶试剂盒、BCA试剂盒购自碧云天生物技术有限公司;兔多克隆抗GAPDH抗体购自武汉三鹰;所用引物由上海生工生物工程技术服务有限公司设计合成。奥林巴斯显微镜、流式细胞仪(Beckman Coulter)、水平电泳仪(北京六一)和PCR仪(Bio-Rad)为实验所需主要仪器。
1.2 方法 1.2.1 动物分组及处理将45只雄性C57BL/6小鼠按随机数字表法分为3组(n=15):对照组、脂多糖组(LPS组)、维生素D补充组(VD+LPS组)。用二甲基亚砜(dimethylsulfoxide, DMSO)将1, 25二羟维生素D3配制成浓度为5 mg/mL的溶液,按25 μg/kg,用生理盐水稀释成总体积100 μL的溶液对VD+LPS组进行灌胃补充维生素D,LPS处理前48、24、1 h各灌胃1次,共3次;对照组及LPS组给予相同体积的0.1% DMSO灌胃。称取小鼠体质量,LPS组及VD+LPS组按3 mg/kg,总体积60 μL经气管注入LPS构建肺损伤模型,对照组予以相同体积生理盐水处理,于造模2 d后处死小鼠,收集标本进行各项检测。
1.2.2 支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)检测麻醉小鼠后,经气管插管取BALF。用1 mL PBS灌洗肺部,反复3次,获取的BALF经离心后取上清液,按照酶联免疫吸附实验(enzyme-linked immunosorbent assay, ELISA)试剂盒要求测定BALF中白细胞介素-6(interleukin-6, IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、IL-17A水平;用酶标仪检测BALF蛋白水平。PBS重悬细胞沉淀,细胞计数板计数细胞总数并作细胞推片,行吉姆萨染色,显微镜下计数中性粒细胞数目。
1.2.3 肺组织病理变化过量麻醉小鼠后剪断腹主动脉将其处死,取右中上肺用10%多聚甲醛固定48 h,石蜡包埋后制成4 μm薄片,行HE染色,在显微镜下观察小鼠肺组织形态。由2位研究员按照以下评分标准对小鼠肺损伤进行半定量分析:①肺泡出血;②肺泡水肿;③肺泡或血管腔内中性粒细胞浸润或聚集;④肺泡壁增厚和/或透明膜形成。依据病变轻重对各项评分(0分:无病变或非常轻微;1分:轻度病变;2分:中度病变;3分:重度病变;4分:极重度病变),总分相加。每个标本分析10个高倍视野,取平均值。将2位研究员评分取平均值,即为肺损伤评分。
1.2.4 小鼠肺组织湿/干质量比(wet to dry ratio, W/D)取小鼠左下肺称量,将其放置于锡箔纸上,在60 ℃烤箱中烘烤72 h至恒重后再次称量,计算肺组织W/D。
1.2.5 流式细胞术检测Th17细胞比例获取小鼠肺组织,用含青/链霉素的无菌PBS清洗3次。用胶原酶Ⅳ(1 mg/mL)、DNaseⅠ(200 μg/mL)混合酶液将肺组织充分消化后,经细胞筛过滤得到细胞悬液。1 500 r/min,离心5 min,PBS洗涤3次,用含10%胎牛血清的1640培养基培养细胞。用PMA(100 ng/mL)、ionomycin (500 ng/mL)、BFA(10 μg/mL)刺激细胞。4 h后收集细胞,2 500 r/min,离心5 min弃上清液,用含2%胎牛血清的PBS作为流式buffer,流式buffer洗涤细胞3次。加入抗小鼠CD4流式抗体,冰上避光孵育30 min;2 500 r/min,离心5 min弃上清液,流式buffer洗涤细胞3次;加入细胞固定液室温避光孵育20 min;3 000 r/min,离心5 min弃上清,破膜剂重悬细胞,3 000 r/min,离心5 min弃上清,破膜剂洗涤细胞3次;大鼠血清室温封闭细胞30 min,加入破膜剂和抗小鼠IL-17A流式抗体,室温避光孵育30 min;3 000 r/min,离心5 min弃上清液,破膜剂重悬细胞,3 000 r/min,离心5 min弃上清液,200 μL流式buffer重悬细胞,上机检测。
1.2.6 Western blot检测维甲酸相关孤核受体γt(retinoic acid-related orphan receptor γt, RORγt)蛋白水平表达收集小鼠左肺,加入RIPA裂解液对肺组织进行匀浆,冰上裂解30 min,4 ℃ 12 000 r/min,离心10 min,收集上清液,利用BCA法按试剂盒说明书测量蛋白浓度。蛋白定量后加入蛋白上样缓冲液,在沸水中变性10 min,-20 ℃保存备用。配制10% SDS-PAGE凝胶,每孔加入30 μg蛋白样品,以80 V恒压电泳至溴酚蓝抵达凝胶底部;250 mA恒流电转1 h,将蛋白转印至PVDF膜上;用含5%脱脂奶粉的TBST封闭1 h,加入相应的一抗4 ℃孵育过夜;TBST缓冲液洗膜3次,加入二抗37 ℃孵育1 h,TBST缓冲液洗膜3次,用化学发光液滴加到PVDF膜上,于暗室显影曝光。
1.2.7 qPCR检测RORγt核酸水平表达收集小鼠右下肺组织,加入RNAiso充分匀浆,经异丙醇沉淀、75%乙醇洗涤后,用无酶水溶解RNA。用核酸分析仪检测RNA浓度,将RNA逆转录为cDNA。引物序列:RORγt,上游5′-GTCCAGACAGCCACTGCATTCC-3′,下游5′-TGCCGTAGAAGGTCCTCCAGTC-3′;β-actin,上游5′-GTGCTATGTTGCTCTAGACTTCG-3′,下游5′-ATGCCA-CAGGATTCCATACC-3′。用SYBR作为检测信号,经预变性、变性、退火、延伸、再循环等过程进行PCR扩增。用2-△△Ct法进行数据分析。
1.3 统计学分析采用GraphPad Prism 5.0进行数据分析,计量资料以x±s表示,实验至少独立重复3次。多组间比较采用单因素方差分析,组内两两比较采用t检验。检验水准:α=0.05。
2 结果 2.1 小鼠肺组织病理改变及肺损伤评分LPS造模2 d后,小鼠全部存活,肺组织切片行HE染色观察病理学改变。对照组肺泡结构完整,肺泡间质无明显渗出;LPS组肺泡间质渗出明显,肺泡正常结构几乎消失,可见大量炎症细胞浸润;VD+LPS组肺泡间质可见炎性细胞渗出,肺泡结构可见,损伤较LPS组明显减轻(图 1)。说明补充维生素D能减轻LPS造模小鼠肺损伤严重程度。与对照组(0.67±0.58)相比,LPS组肺损伤评分(12.32±2.03)明显升高(P<0.05),与LPS组比较,VD+LPS组肺损伤评分(7.37±1.51)明显降低(P<0.05)。
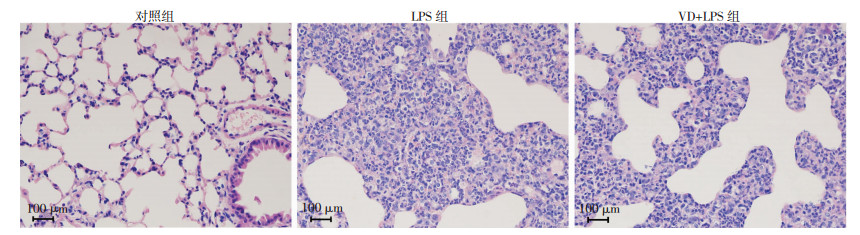
|
| 图 1 LPS造模2 d后HE染色观察各组小鼠肺组织病理学改变 |
2.2 小鼠肺组织W/D值比较
肺组织W/D值反映肺水肿严重程度,与对照组(4.58±0.66)相比,LPS组W/D值(9.82±1.33)显著增高(P<0.05)。与LPS组比较,VD+LPS组W/D值(6.78±0.55)明显降低(P<0.05)。提示补充维生素D能减轻LPS造模小鼠肺水肿程度。
2.3 BALF细胞总数、中性粒细胞比例及蛋白浓度比较相较于对照组,LPS组BALF细胞总数、中性粒细胞比例及蛋白浓度明显升高(P<0.05);相较于LPS组,VD+LPS组BALF细胞总数、中性粒细胞比例及蛋白浓度明显降低(P<0.05,图 2)。说明补充维生素D能降低LPS造模小鼠肺泡血管通透性并减轻肺部炎症反应。
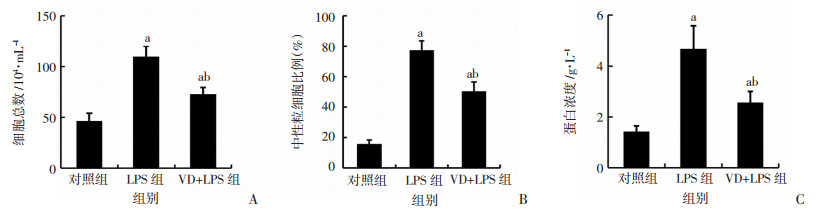
|
| a:P<0.05,与对照组比较;b:P<0.05,与LPS组比较 图 2 LPS造模2 d后检测各组小鼠BALF细胞总数(A)、中性粒细胞比例(B)和蛋白浓度(C)变化 (n=4, x±s) |
2.4 BALF中IL-6、TNF-α和IL-17A水平比较
IL-6、TNF-α及IL-17A是参与ARDS的重要炎症因子。IL-6、TNF-α及IL-17A的ELISA结果显示,LPS构建急性肺损伤模型后,BALF中IL-6、TNF-α及IL-17A显著升高,补充维生素D能明显降低3种炎症因子的表达,差异有统计学意义(P<0.05,图 3)。
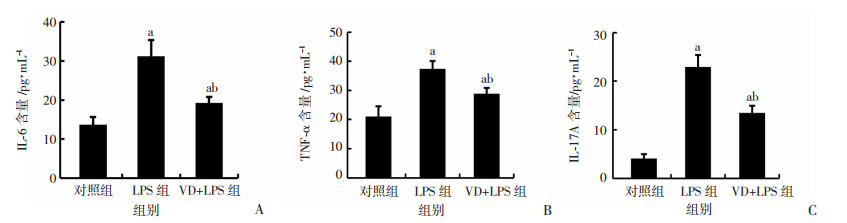
|
| a:P<0.05,与对照组比较;b:P<0.05,与LPS组比较 图 3 LPS造模2 d后各组小鼠BALF中IL-6(A)、TNF-α(B)和IL-17A(C)水平变化 (n=4, x±s) |
2.5 小鼠肺部Th17细胞比例变化
每组取3只小鼠,消化鼠肺得到单细胞悬液,PMA、ionomycin及BFA刺激细胞4 h后,用流式抗体进行染色。Th17细胞数占CD4+T细胞总数的比例分别为:对照组(1.21±0.15)%,LPS组(2.75±0.23)%,VD+LPS组(2.01±0.18)%。LPS组Th17细胞比例明显高于对照组,而VD+LPS组Th17细胞比例明显低于LPS组,差异有统计学意义(P<0.05,图 4)。
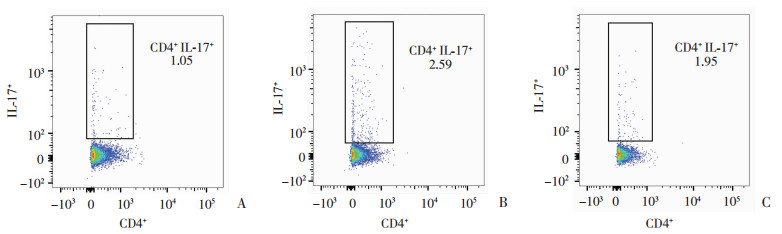
|
| A:对照组;B:LPS组;C:VD+LPS组 图 4 LPS造模2 d后各组小鼠肺组织Th17细胞的比例变化 |
2.6 Th17细胞特异性转录因子RORγt的表达
用Western blot及qPCR分别检测小鼠肺组织RORγt蛋白水平及核酸水平。校正内参后,RORγt蛋白水平在LPS组最高,VD+LPS组较LPS组明显降低,差异有统计学意义(P<0.05,图 5A、B)。在核酸水平,对照组、LPS组、VD+LPS组RORγt的相对表达量分别为:(0.54±0.13)、(2.49±0.33)、(1.17±0.24)。与对照组相比,LPS组RORγt表达升高;与LPS组相比,VD+LPS组RORγt表达降低,差异有统计学意义(P<0.05,图 5C)。
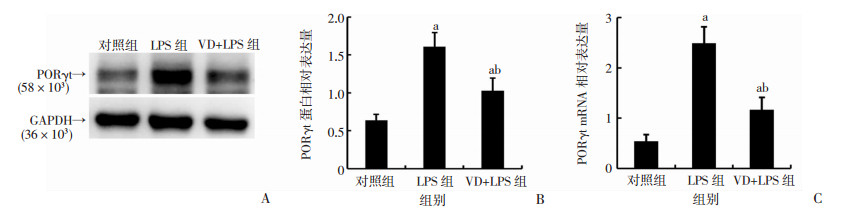
|
| A:RORγt蛋白水平表达;B:RORγt蛋白表达半定量分析;C:RORγt核酸水平表达 a:P<0.05,与对照组比较;b:P<0.05,与LPS组比较 图 5 LPS造模2 d后各组小鼠肺组织RORγt蛋白水平及核酸水平 (n=3, x±s) |
3 讨论
ARDS是临床常见危重症,除机械通气、液体管理、体外膜肺氧合(extracorporeal membrane oxygena-tion, ECMO)等一系列支持手段外,目前仍缺乏有效的药物治疗措施。ARDS的主要诱因是肺炎和脓毒症,以早期炎症细胞浸润为主要特征,中性粒细胞在肺部聚集,破坏肺泡结构,形成弥漫性肺损伤[8]。当肺部发生炎症时,中性粒细胞迁移至肺进行脱颗粒,释放杀菌蛋白、细胞因子和活性氧等物质并产生中性粒细胞胞外诱捕网以清除细菌感染,但同时中性粒细胞释放的毒性细胞因子会对肺组织造成损伤,失控的炎症反应是ARDS的重要特征[9]。抑制中性粒细胞胞外诱捕网的形成,能显著减轻LPS诱导的小鼠急性肺损伤[10]。我们前期研究发现,ARDS患者血清中IL-17A显著升高;在动物实验中,敲除小鼠IL-17A基因后,LPS造模引起的中性粒细胞浸润及肺部病理改变明显减轻,证实IL-17A参与中性粒细胞在肺部的募集[11]。抑制IL-17A的促炎作用可能是ARDS的潜在治疗手段。
维生素D主要产生于紫外线照射皮肤,少部分来源于食物。维生素D除了具有维持体内钙磷平衡这一经典作用外,越来越多的证据表明,维生素D能调节免疫反应并在自身免疫性疾病中发挥重要作用。近年来大量临床试验研究了补充维生素D对疾病的影响。克罗恩病是炎症性肠病的一种,研究者通过口服给药的方式观察维生素D对克罗恩病患者和健康人群肠道菌群的影响,证实口服维生素D能提高肠道有益菌丰度,对克罗恩病的治疗具有积极意义[12]。
大量研究证实了维生素D对炎症性疾病和免疫性疾病具有调节作用,但少有研究关注维生素D在ARDS中的作用与机制。IL-6、TNF-α及IL-17A是反映ARDS炎症程度的重要炎症因子。本研究发现,LPS诱导小鼠急性肺损伤后,BALF中IL-6、TNF-α及IL-17A水平显著升高。这些炎症因子的分泌涉及多种机制。激活的单核细胞及巨噬细胞是TNF-α主要的内源性来源,TNF-α具有促进IL-6分泌的作用[13-14]。IL-6参与naive T细胞分化为Th17细胞的过程,Th17细胞分泌的IL-17A能募集中性粒细胞在肺部聚集,加重肺损伤。基于此,我们利用小鼠急性肺损伤模型,研究补充维生素D在肺部炎症损伤中的作用。结果显示,补充维生素D后,LPS造模小鼠肺部损伤明显减轻,肺部炎症细胞浸润减少,肺血管通透性降低,BALF中炎症因子减少。补充维生素D明显减轻LPS诱导的小鼠急性肺损伤。
越来越多的研究表明,CD4+T细胞在ARDS中发挥重要作用。小鼠发生急性肺损后,促炎细胞Th1升高,抗炎细胞Treg减少并伴随肺损伤严重程度增加[15]。Treg细胞能抑制Th17细胞的功能,但在ARDS中Treg细胞抑制作用减弱,Th17细胞比例增高,致病性炎症因子增多,加重ARDS的炎症反应[16]。Treg细胞和Th17细胞的比例是预测ARDS预后的重要指标。我们前期研究证实了Th17细胞介导的炎症反应在ARDS中发挥重要作用[11]。为了研究维生素D是否通过抑制Th17细胞介导的炎症反应减轻小鼠急性肺损伤,我们检测了肺部Th17细胞的比例以及Th17细胞特征性转录因子RORγt在蛋白及核酸水平。发现补充维生素D后,LPS造模鼠肺部Th17细胞比例明显降低,RORγt核酸及蛋白水平下降。维生素D通过与维生素D受体(vitamin D receptor, VDR)结合对细胞功能进行调节,体内多种炎症细胞及免疫细胞表达VDR。维生素D诱导促炎的M1型巨噬细胞向抗炎的M2型巨噬细胞转化,降低炎症因子表达,促进抗炎因子IL-10表达,从而改善炎症[17]。树突细胞是连接固有免疫和获得性免疫的桥梁,维生素D能诱导树突状细胞免疫耐受,抑制Th1细胞及Th17细胞在炎症反应中的作用[18]。我们前期研究证实,经1, 25二羟维生素D3处理过的树突细胞有利于抗炎细胞Treg产生[19]。维生素D可能通过上述多种机制调节小鼠急性肺损伤中的炎症反应。维生素D抑制Th17细胞介导的炎症作用在其他疾病中得到证实。维生素D缺乏是多发性硬化症病因学最常见的环境因素之一。研究表明,在小鼠实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis, EAE)模型中补充维生素D能调节包括JAK/STAT3、ERK/MAPK及PI3K/Akt/mTOR在内的信号通路,影响CD4+T细胞的活化及其亚群分化,降低致病性Th17细胞比例[20]。
维生素D的临床应用还存在争议,目前尚未有确切证据证实维生素D水平与疾病的关系。通常将血清25羟维生素D3作为衡量人体维生素D水平的指标,但维生素D是以其活性形式1, 25二羟维生素D3发挥生物学作用[21]。由于目前检测技术的限制,不能准确测量1, 25二羟维生素D3水平,这可能是临床试验结果不一致的原因之一。相信随着灵敏度更高的检测方法的诞生,维生素D水平与疾病之间的关系将会被证实。
综上所述,本研究证实维生素D能减轻肺部炎症细胞浸润,降低肺部炎症因子水平,改善LPS诱导的小鼠急性肺损伤,其作用可能部分通过抑制Th17细胞介导的炎症反应实现。本研究为探索ARDS治疗方法提供了新思路。
| [1] | RANIERI V M, RUBENFELD G D, THOMPSON B T, et al. Acute respiratory distress syndrome: the berlin definition[J]. JAMA, 2012, 307(23): 2526–2533. DOI:10.1001/jama.2012.5669 |
| [2] | RIGHETTI R F, DOS SANTOS T M, CAMARGO LDN, et al. Protective effects of anti-IL17 on acute lung injury induced by LPS in mice[J]. Front Pharmacol, 2018, 9: 1021. DOI:10.3389/fphar.2018.01021 |
| [3] | LIU R, LAURIDSEN H M, AMEZQUITA R A, et al. IL-17 promotes neutrophil-mediated immunity by activating microvascular pericytes and not endothelium[J]. J Immunol, 2016, 197(6): 2400–2408. DOI:10.4049/jimmunol.1600138 |
| [4] | UMAR M, SASTRY K S, CHOUCHANE A I. Role of vitamin D beyond the skeletal function: A review of the molecular and clinical studies[J]. Int J Mol Sci, 2018, 19(6): E1618. DOI:10.3390/ijms19061618 |
| [5] | DANCER R C, PAREKH D, LAX S, et al. Vitamin D deficiency contributes directly to the acute respiratory distress syndrome (ARDS)[J]. Thorax, 2015, 70(7): 617–624. DOI:10.1136/thoraxjnl-2014-206680 |
| [6] | SHIRAZI H A, RASOULI J, CIRIC B, et al. 1, 25-Dihydroxyvitamin D3 suppressed experimental autoimmune encephalomyelitis through both immunomodulation and oligodendrocyte maturation[J]. Exp Mol Pathol, 2017, 102(3): 515–521. DOI:10.1016/j.yexmp.2017.05.015 |
| [7] | SUN D, LUO F, XING J C, et al. 1, 25(OH)2 D3 inhibited Th17 cells differentiation via regulating the NF-κB activity and expression of IL-17[J]. Cell Prolif, 2018, 51(5): e12461. DOI:10.1111/cpr.12461 |
| [8] | POTEY P M, ROSSI A G, LUCAS C D, et al. Neutrophils in the initiation and resolution of acute pulmonary inflammation: understanding biological function and therapeutic potential[J]. J Pathol, 2019, 247(5): 672–685. DOI:10.1002/path.5221 |
| [9] | THOMPSON B T, CHAMBERS R C, LIU K D. Acute respiratory distress syndrome[J]. N Engl J Med, 2017, 377(19): 1904–1905. DOI:10.1056/NEJMc1711824 |
| [10] |
卢尧, 王凌峰, 张晗, 等. 胞外DNA在急性呼吸窘迫综合征小鼠炎症损伤中的作用[J].
第三军医大学学报, 2018, 40(13): 1166–1170.
LU Y, WANG L F, ZHANG H, et al. Role of extracellular DNA in inflammatory injury of acute respiratory distress syndrome mice[J]. J Third Mil Med Univ, 2018, 40(13): 1166–1170. DOI:10.16016/j.1000-5404.201712077 |
| [11] | ZHAO Y, ZHANG X Y, SONG Z X, et al. Rapamycin attenuates acute lung injury induced by LPS through inhibition of Th17 cell proliferation in mice[J]. Sci Rep, 2016, 6: 20156. DOI:10.1038/srep20156 |
| [12] | SCHÄFFLER H, HERLEMANN D P, KLINITZKE P, et al. Vitamin D administration leads to a shift of the intestinal bacterial composition in Crohn's disease patients, but not in healthy controls[J]. J Dig Dis, 2018, 19(4): 225–234. DOI:10.1111/1751-2980.12591 |
| [13] | GUPTA S, KHAJURIA V, WANI A, et al. Murrayanine attenuates lipopolysaccharide-induced inflammation and protects mice from sepsis-associated organ failure[J]. Basic Clin Pharmacol Toxicol, 2018. DOI:10.1111/bcpt.13032 |
| [14] | CARDOSO G H, PETRY D M, PROBST J J, et al. High-intensity exercise prevents disturbances in lung inflammatory cytokines and antioxidant defenses induced by lipopolysaccharide[J]. Inflammation, 2018, 41(6): 2060–2067. DOI:10.1007/s10753-018-0849-9 |
| [15] | LI G G, CAO Y H, SUN Y, et al. Ultrafine particles in the airway aggravated experimental lung injury through impairment in Treg function[J]. Biochem Biophys Res Commun, 2016, 478(1): 494–500. DOI:10.1016/j.bbrc.2016.05.059 |
| [16] | YU Z X, JI M S, YAN J, et al. The ratio of Th17/Treg cells as a risk indicator in early acute respiratory distress syndrome[J]. Crit Care, 2015, 19(1): 82. DOI:10.1186/s13054-015-0811-2 |
| [17] | ZHU X D, ZHU Y, LI C J, et al. 1, 25 Dihydroxyvitamin D regulates macrophage polarization and ameliorates experimental inflammatory bowel disease by suppressing miR-125b[J]. Int Immunopharmacol, 2019, 67: 106–118. DOI:10.1016/j.intimp.2018.12.015 |
| [18] | XIE Z X, CHEN J T, ZHENG C, et al. 1, 25-dihydroxy vitamin D3 -induced dendritic cells suppress experimental autoimmune encephalomyelitis by increasing proportions of the regulatory lymphocytes and reducing T helper type 1 and type 17 cells[J]. Immunology, 2017, 152(3): 414–424. DOI:10.1111/imm.12776 |
| [19] | HUANG Y, ZHAO Y, RAN X M, et al. Increased expression of herpesvirus entry mediator in 1, 25-dihydroxyvitamin D3-treated mouse bone marrow-derived dendritic cells promotes the generation of CD4+CD25+Foxp3+ regulatory T cells[J]. Mol Med Rep, 2014, 9(3): 813–818. DOI:10.3892/mmr.2013.1874 |
| [20] | ZEITELHOFER M, ADZEMOVIC M Z, GOMEZ-CABRERO D, et al. Functional genomics analysis of vitamin D effects on CD4+ T cells in vivo in experimental autoimmune encephalomyelitis[J]. Proc Natl Acad Sci U S A, 2017, 114(9): E1678–E1687. DOI:10.1073/pnas.1615783114 |
| [21] | COLOTTA F, JANSSON B, BONELLI F. Modulation of inflammatory and immune responses by vitamin D[J]. J Autoimmun, 2017, 85: 78–97. DOI:10.1016/j.jaut.2017.07.007 |



