肝硬化患者常于出院后30 d内再次住院治疗[1]。当排除与肝硬化患者死亡相关的混杂因素后,早期(30 d)再入院的患者存活率下降,且这一效应至少维持至首次住院后1年[2]。肝硬化患者再入院的发生主要归因于该病的并发症,例如上消化道出血、自发性腹膜炎、水、电解质紊乱和肝性脑病。在一项多国、基于人群的队列研究中,研究者发现肝性脑病与早期再入院的发生联系最为紧密[1]。肝性脑病为肝衰竭的一个重要病症特点,也是患者急诊就医的常见原因之一。慢性肝病患者一旦发生肝性脑病,则预后不良,其1年生存率低于50%,3年生存率低于25%。所有表现出肝性脑病的患者都应考虑行肝移植治疗。对于既往6个月内因肝性脑病两次住院治疗的患者,若无妨碍手术的合并症,应考虑行肝移植治疗。然而,由于手术禁忌症或缺乏供体器官,实施肝移植并不容易[4]。同时,持续或频繁复发肝性脑病的患者其肌肉体积常迅速减少,即便行肝移植患者也不易存活[5]。其次,并发肝病脑病的患者可寻求体外人工肝支持系统,该系统可降低血氨、炎症因子、胆红素等毒素的水平[6],给肝脏提供自行恢复时间,避免肝移植,或者为必需肝移植患者争取等待时间。但3项系统性回顾研究表明人工肝系统对急性肝衰竭患者的死亡率无显著影响;7项随机对照试验显示人工肝并不增加肝衰竭患者的生存率,且值得注意的是人工肝本身也费用昂贵且耗费资源[7]。综上,最终结论可能是:有必要严密监测肝硬化患者中早期再入院风险较高的人群,尤其是首次住院并发肝性脑病的患者。在文献回顾的过程中,我们发现既往没有研究明确描述该队列人群,因此,我们进行了一项前瞻性研究,旨在分析肝硬化患者肝性脑病控制后出院30 d内再次入院及出院6个月内死亡的预测因素。
1 资料与方法 1.1 研究对象2018年1-2月在重庆医科大学附属第二医院消化内科及感染病科因肝性脑病住院治疗或住院期间并发肝性脑病的肝硬化患者。纳入标准:①基于临床、影像学和内镜检查确立的肝硬化诊断;②首次住院期间诊断为肝性脑病;③年龄18~80岁。排除标准:①合并活动性恶性肿瘤(诊断符合米兰标准的肝癌除外)或既往有恶性肿瘤史,随访结果为阴性,但随访时间<5年;②出现没有肝硬化基础的急性、亚急性肝衰竭;③合并严重的慢性阻塞性肺疾病[慢性阻塞性肺疾病全球倡议(GOLD)分级≥2];④合并中、重度慢性心力衰竭(纽约心脏协会(NYHA)分级≥2);⑤合并严重的精神疾病;⑥合并血液系统疾病;⑦口服华法林;⑧首次住院期间死亡;⑨合并HIV感染。
本研究基于加强流行病学中观察性研究报告声明(STROBE)的建议实施并在中国临床试验注册中心官网(http://www.chictr.org.cn)注册,注册号为Chi CTR1800014275。研究方案严格遵守赫尔辛基宣言并得到重庆医科大学附属第二医院伦理委员会批准(2017年科伦审第64号)。此外,每例患者都签署了知情同意书。
1.2 方法收集患者的人口学及临床资料(尤其是肝性脑病的诱因和分级),同时记录事件包括慢加急性肝衰竭、急性肾损伤和肝肾综合征的发生情况。治疗方面,肝性脑病和基础疾病(主要包括肝硬化、肝衰竭和原发性肝癌)的管理都基于相关国际指南[8-10]。人工肝(分子吸附再循环系统)的使用基于欧洲肝病学会实践指南[9]。随后,主治医师根据患者的临床和实验室资料决定其是否出院。自此,纳入首次住院期间存活的患者并收集他们的临床资料(尤其是抗肝性脑病疗程、出院时是否带药预防肝性脑病),包括再次评估这部分人群出院时的实验室数据。出院后,患者常规随访6个月或直至死亡或肝移植。随访期间,收集患者于外院住院的数据资料,同时患者本人记录每日口服药物的情况。若患者失访,我们会电话随访患者家属或其主治医师。本研究中,“早期再入院”被定义为未经计划的、紧急的出院后30 d内再次入院,因预约的诊疗措施(如预约的内镜检查或内镜下手术)而住院不考虑在此定义范围内。此外,患者再次入院的数据资料、6个月随访期间出现的死亡和死亡原因也被记录在案。总之,我们收集了每例患者诊断为肝性脑病时、住院期间、出院时和随访期间的人口学、临床和实验室资料。
1.3 诊断标准与定义肝性脑病的诊断基于美国肝病学会(AASLD)实践指南[8]。合并症被定义为糖尿病、高血压病或慢性肾脏病。肝肾综合征和慢加急性肝衰竭的诊断基于欧洲肝病学会(EASL)实践指南[9]。急性肾损伤的诊断基于肾脏疾病:改善全球预后(KDIGO)实践指南[11]。
1.4 统计学分析研究的主要终点事件为早期(30 d)再入院和中期(6个月)死亡的发生。出院后立即失访的患者不参与。数据采用SPSS 19.0统计软件进行分析。正态分布的计量资料用x±s表示,计数资料用数量(n)及百分数表示。计量资料采用t检验,计数资料采用χ2检验。对早期再入院组与未再入院组进行单因素分析,P值<0.1的变量纳入逐步后退淘汰的Logistic回归分析(P < 0.05纳入;P>0.10剔除), 以得出早期再入院发生的独立预测因素。结果用带有95%可信区间的OR值表示。生存曲线用Kaplan-Meier法绘制,组间生存曲线比较采用对数秩检验。对中期存活组与死亡组进行单因素分析,P值<0.1的变量纳入逐步后退淘汰的Cox回归分析(P < 0.05纳入;P>0.10剔除),以得出中期死亡发生的独立预测因素。结果用带有95%可信区间的HR值表示。以上检验均为双侧检验,检验水准:α=0.05。
2 结果 2.1 患者基本资料总共纳入260例肝性脑病得到控制后出院的患者,其中47例患者因出院后立即失访被剔除,最终纳入213例患者(所有患者服药依从性良好)。表 1和表 2总结了患者的基线特征。213例患者年龄(56.7±10.6)岁,其中男性153例(71.8%)。无明显诱因出现的肝性脑病最多见占53.5%,其次为高蛋白饮食和感染所致(分别为22.1%和7.5%)。所有肝性脑病事件中,Ⅰ度139例(65.3%),Ⅱ度49例(23.0%),最严重的Ⅳ度仅4例(1.9%)。肝性脑病治疗方面,139例(65.3%)患者使用乳果糖结合门冬氨酸鸟氨酸,仅1例(0.5%)患者使用门冬氨酸鸟氨酸或白醋灌肠结合门冬氨酸鸟氨酸以及乳果糖结合利福昔明。所有患者中,68例(31.9%)合并其他疾病,其中52例(24.4%)合并糖尿病,24例(11.3%)合并高血压病,6例(2.8%)合并慢性肾脏病。所有患者查尔森合并症评分为(3.6±1.2)。住院期间,患者中0.5%诊断为急性肾损伤,1.9%诊断为肝肾综合征,4.2%诊断为慢加急性肝衰竭。此外,27例(12.7%)患者住院期间首次发现肝癌。出院时,所有患者终末期肝病模型(MELD)评分为(12.9±5.8),住院时间(16.0±12.9) d,抗肝性脑病疗程(10.9±7.6) d。最后,多数患者(61.0%)出院带药预防肝性脑病。
| 组别 | 年龄/岁 | 性别/男 | 肝硬化病因 | 其他 | 合并症 | 糖尿病 | 慢性肾脏病 | 高血压病 | 查尔森合并症评分 | 白蛋白a /g·L-1 |
总胆红素a /μmol·L-1 |
白细胞计数a /×109·L-1 |
血钠a /mmol·L-1 |
血钾a /mmol·L-1 |
血肌酐a /μmol·L-1 |
凝血酶原活动度(%)a | 国际标准化比值a | 血红蛋白a /g·L-1 |
血小板计数a /×109·L-1 |
腹水a | 住院期间出现并发症 | 终末期肝病模型评分a | 住院时间a/d | 使用人工肝a | 抗肝性脑病疗程a/d | 出院带药预防肝性脑病 | 进展为原发性肝癌 | ||||
| 乙肝病毒 | 丙肝病毒 | 酒精 | 肝肾综合征a | 急性肾损伤a | 慢加急性肝衰竭a | ||||||||||||||||||||||||||
| 总人群(n=213) | 56.7±10.6 | 153 (71.8) | 116 (54.5) | 13 (6.1) | 34 (16.0) | 50 (23.5) | 68 (31.9) | 52 (24.4) | 6 (2.8) | 24 (11.3) | 3.6±1.2 | 30.3±3.6 | 47.7±57.7 | 3.8±2.0 | 139.0±4.6 | 3.9±0.5 | 84.7±94.6 | 52.4±16.6 | 1.7±0.5 | 92.1±19.9 | 86.7±68.1 | 21 (9.9) | 4 (1.9) | 1 (0.5) | 9 (4.2) | 12.9±5.8 | 16.0±12.9 | 4 (1.9) | 10.9±7.6 | 130 (61.0) | 27 (12.7) |
| 再入院组(n=65) | 56.0±11.0 | 44 (67.7) | 37 (56.9) | 4 (6.2) | 9 (13.8) | 15 (23.1) | 15 (23.1) | 12 (18.5) | 1 (1.5) | 5 (7.7) | 3.6±1.3 | 30.0±3.4 | 56.5±75.1 | 3.9±1.8 | 138.0±3.5 | 3.9±0.5 | 95.4±157.4 | 46.8±16.6 | 1.9±0.6 | 85.1±15.4 | 93.5±71.3 | 11 (16.9) | 2 (3.1) | 0 (0) | 2 (3.1) | 12.7±5.2 | 15.4±12.6 | 2 (3.1) | 12.2±9.1 | 40 (61.5) | 8 (12.3) |
| 未再入院组(n=148) | 57.0±10.5 | 109 (73.6) | 79 (53.4) | 9 (6.1) | 25 (16.9) | 35 (23.6) | 53 (35.8) | 40 (27.0) | 5 (3.4) | 19 (12.8) | 3.6±1.2 | 30.4±3.7 | 43.9±48.0 | 3.8±2.1 | 139.0±5.0 | 3.9±0.5 | 80.0±45.1 | 54.9±16.0 | 1.6±0.5 | 95.2±20.9 | 83.7±66.6 | 10 (6.8) | 2 (1.4) | 1 (0.7) | 7 (4.7) | 13.0±6.0 | 16.2±13.0 | 2 (1.4) | 10.4±6.8 | 90 (60.8) | 19 (12.8) |
| P值 | 0.527 | 0.374 | 0.946 | 0.066 | 0.180 | 0.455 | 0.274 | 0.934 | 0.454 | 0.141 | 0.895 | 0.523 | 0.775 | 0.275 | 0.001 | 0.001 | <0.001 | 0.336 | 0.022 | 0.393 | 0.507 | 0.581 | 0.719 | 0.646 | 0.393 | 0.114 | 0.92 | 0.915 | |||
| a:出院时采集的变量 | |||||||||||||||||||||||||||||||
| 组别 | 诱因 | 其他 | 分度 | 治疗 | ||||||||||||||
| 无明显诱因 | 高蛋白饮食 | 感染 | 消化道出血 | 电解质紊乱 | Ⅰ度 | Ⅱ度 | Ⅲ度 | Ⅳ度 | L+AO | L+R+AO | L | WVE+AO | AO | 无 | L+AO+WVE | |||
| 总人群(n=213) | 114 (53.5) | 47 (22.1) | 16 (7.5) | 15 (7.0) | 3 (1.4) | 18 (8.5) | 139 (65.3) | 49 (23.0) | 21 (9.9) | 4 (1.9) | 139 (65.3) | 1 (0.5) | 2 (0.9) | 1 (0.5) | 61 (28.6) | 3 (1.4) | 6 (2.8) | |
| 再入院组(n=65) | 35 (53.8) | 12 (18.5) | 6 (9.2) | 7 (10.8) | 1 (1.5) | 4 (6.2) | 39 (60.0) | 15 (23.1) | 10 (15.4) | 1 (1.5) | 48 (73.8) | 0 (0) | 1 (1.5) | 0 (0) | 15 (23.1) | 0 (0) | 1 (1.5) | |
| 未再入院组(n=148) | 79 (53.4) | 35 (23.6) | 10 (6.8) | 8 (5.4) | 2 (0.7) | 14 (9.5) | 100 (67.6) | 34 (23.0) | 11 (7.4) | 3 (2.0) | 91 (61.5) | 1 (0.7) | 1 (0.7) | 1 (0.7) | 46 (31.1) | 3 (2.0) | 5 (3.4) | |
| P值 | 0.645 | 0.341 | 0.523 | |||||||||||||||
| AO:门冬氨酸鸟氨酸, L:乳果糖, R:利福昔明, WVE:白醋灌肠 | ||||||||||||||||||
2.2 早期再入院情况
65例(30.5%)患者出院后30 d内再次入院治疗。再入院的原因包括:肝性脑病(32例),消化道出血(12例),腹腔积液(6例),感染(6例),腹胀(4例),低白蛋白血症(3例),重症肝炎(1例)和肝生化指标异常(1例)。表 1和表 2对再入院组与未再入院组进行了比较。相比未再入院组,再入院组患者出院时存在腹腔积液的概率(16.9% vs 6.8%;χ2值为5.252,P值为0.022)及INR水平(1.9 vs 1.6;t值为3.432,P值为0.001)显著升高;出院时凝血酶原活动度(46.8% vs 54.9%,t值为-3.398,P值为0.001)及血红蛋白水平(85.1 g/L vs 95.2 g/L;t值为-3.923,P < 0.001)显著降低。两组以下指标差异无统计学意义:年龄、性别、肝硬化病因、合并症、糖尿病、慢性肾脏病、高血压病的数量、查尔森合并症评分、白蛋白、总胆红素、白细胞计数、血小板计数、血钠、血钾、血肌酐、肝肾综合征、急性肾损伤、慢加急性肝衰竭和肝癌事件的数量、MELD评分、住院天数、肝性脑病诱因、分度和治疗、抗肝性脑病疗程、人工肝使用以及出院带药预防肝性脑病。
在Logistic回归分析中,出院时的INR水平(比值比为2.40;P值为0.003;表 3)为早期再入院的独立预测因子。出院时INR>1.62较INR≤1.62的患者早期再入院的发生率显著升高(44% vs 20%;χ2值为14.335,P < 0.001, 图 1)。同时,出院时的血红蛋白水平为早期再入院的保护因素(比值比为0.97;P值为0.005;表 3)。
| 变量 | 比值比 | 95%可信区间 | P值 |
| 血红蛋白(出院时) | 0.97 | 0.96~0.99 | 0.005 |
| 国际标准化比值(出院时) | 2.40 | 1.36~4.26 | 0.003 |
| 终末期肝病模型评分a | 1.11 | 1.00~1.24 | 0.048 |
| a:肝性脑病引发的早期再入院 | |||
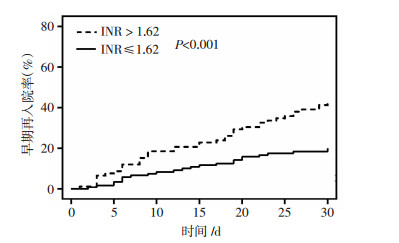
|
| 图 1 基于出院时的INR值分层的早期再入院率分析 |
65例再入院患者中,33例(50.8%)因肝性脑病再次入院。出院时的MELD评分为肝性脑病引起的早期再入院的独立预测因子(比值比为1.11;P值为0.048;表 3)。
2.3 中期生存情况6个月随访期间,34例(16.0%)患者死亡,179例(84.0%)患者存活。无人接受肝移植手术或失访。死亡原因包括消化道出血(12例)、终末期肝衰竭(4例)、呼吸、循环衰竭(4例)、肝性脑病(3例)、多器官衰竭(3例)、慢加急性肝衰竭(2例)以及晚期肝癌、终末期肾衰竭、失血性休克、败血症、感染性休克和不明原因(各1例)。
表 4和表 5对出院后6个月内存活组与死亡组进行了比较。6个月时,相比存活组,死亡组患者血钠水平显著降低(137.3 mmol/L vs 138.6 mmol/L;t值为-3.105,P值为0.003), 急性肾损伤发生率显著升高(2.9% vs 0%;χ2值为5.290,P值为0.021)。与此前结果相似的是,死亡组患者INR水平显著高于存活组(2.0 vs 1.7;t值为2.635,P值为0.012),而血红蛋白水平显著低于存活组(83.7 g/L vs 93.7 g/L;t值为-2.742,P值为0.007)。最后,死亡组患者出现肝癌及早期再入院事件的概率显著高于存活组(26.5% vs 10.1%;χ2值为6.955,P值为0.008;52.9% vs 26.3%;χ2值为9.595,P值为0.002)。
| 组别 | 年龄/岁 | 男性 | 病因 | 其他 | 合并症 | 糖尿病 | 慢性肾脏病 | 高血压病 | 查尔森合并症评分 | 白蛋白a /g·L-1 |
总胆红素a μmol·L-1 |
白细胞计数a /×109·L-1 |
血钠a /mmol·L-1 |
血钾a /mmol·L-1 |
血肌酐a /μmol·L-1 |
凝血酶原活动度(%)a | 国际标准化比值a | 血红蛋白a /g·L-1 |
血小板计数a /×109·L-1 |
腹水-n (%)a | 住院期间出现肝肾综合征-n(%)a | 出院期间出现急性肾损伤-n (%)a | 住院期间出现慢加急性肝衰竭-n (%)a | 终末期肝病模型评分a | 住院时间a/d | 使用人工肝a | 抗肝性脑病疗程a/d | 出院带药预防肝性脑病 | 进展为原发性肝癌 | 早期再入院 | ||
| HBV | HCV | 酒精 | ||||||||||||||||||||||||||||||
| 存活组(n=179) | 56.6±10.6 | 130 (72.6) | 95 (53.1) | 12 (6.7) | 29 (16.2) | 43 (24.0) | 61 (34.1) | 46 (25.7) | 4 (2.2) | 21(11.7) | 3.6±1.2 | 30.4±3.5 | 42.4±44.1 | 3.8±1.9 | 138.6±10.4 | 3.9±0.5 | 82.2±97.2 | 53.5±15.8 | 1.7±0.4 | 93.7±19.9 | 86.6±67.3 | 16 (8.9) | 2 (1.1) | 0 (0.0) | 7 (3.9) | 13.0±5.7 | 15.8±13.0 | 2 (1.1) | 11.0±8.0 | 112 (62.6) | 18 (10.1) | 47 (26.3) |
| 死亡组(n=34) | 56.8±10.9 | 23 (67.6) | 21 (61.8) | 1 (2.9) | 5 (14.7) | 7 (20.6) | 7 (20.6) | 6 (17.6) | 2 (5.9) | 3 (8.8) | 3.8±1.3 | 29.5±3.8 | 76.0±99.8 | 4.0±2.5 | 137.3±3.2 | 3.9±0.5 | 97.5±79.3 | 46.9±19.4 | 2.0±0.8 | 83.7±18.2 | 87.6±73.1 | 5 (14.7) | 2 (5.9) | 1 (2.9) | 2 (5.9) | 12.3±6.2 | 17.0±12.5 | 2 (5.9) | 10.4±5.7 | 18 (52.9) | 9 (26.5) | 18 (52.9) |
| P值 | 0.925 | 0.554 | 0.743 | 0.12 | 0.316 | 0.239 | 0.623 | 0.286 | 0.175 | 0.061 | 0.454 | 0.003 | 0.677 | 0.390 | 0.068 | 0.012 | 0.007 | 0.933 | 0.301 | 0.061 | 0.021 | 0.600 | 0.507 | 0.621 | 0.061 | 0.646 | 0.291 | 0.008 | 0.002 | |||
| a:出院时采集的变量 | ||||||||||||||||||||||||||||||||
| 组别 | 诱因 | 其他 | 分度 | 治疗 | ||||||||||||||
| 无明显诱因 | 高蛋白饮食 | 感染 | 消化道出血 | 电解质紊乱 | Ⅰ度 | Ⅱ度 | Ⅲ度 | Ⅳ度 | L+AO | L+R+AO | L | WVE+AO | AO | 无 | L+AO+WVE | |||
| 存活组(n=179) | 92 (51.4) | 40 (22.3) | 15 (8.4) | 13 (7.3) | 3 (1.7) | 16 (8.9) | 116 (64.8) | 42 (23.5) | 18 (10.1) | 3 (1.6) | 116 (64.8) | 1 (0.6) | 2 (1.1) | 1 (0.6) | 53 (29.6) | 1 (0.6) | 5 (2.8) | |
| 死亡组(n=34) | 22 (64.7) | 7 (20.6) | 1 (2.9) | 2 (5.9) | 0 (0.0) | 2 (5.9) | 23 (67.6) | 7 (20.6) | 3 (8.8) | 1 (2.9) | 23 (67.6) | 0 (0) | 0 (0) | 0 (0) | 8 (23.5) | 2 (5.9) | 1 (2.9) | |
| P值 | 0.689 | 0.935 | 0.329 | |||||||||||||||
| AO:门冬氨酸鸟氨酸, L:乳果糖, R:利福昔明, WVE:白醋灌肠 | ||||||||||||||||||
在Cox回归分析中,首次住院期间使用人工肝可独立预测中期死亡的发生(风险比为6.67, 95% CI: 1.33~33.49;P=0.021,图 2)。
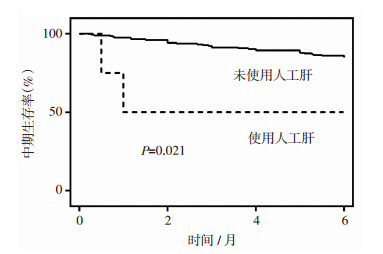
|
| 图 2 基于首次住院是否用人工肝分层的中期死亡率分析 |
此外,当用INR临界值1.62将患者分层为两组时,两组之间死亡率差异无统计学意义,可能是因为样本量不足(20% vs 12%;χ2值为2.456,P>0.05)。
3 讨论本研究的队列人群中,我们发现INR可独立预测肝硬化患者肝性脑病得到控制后早期再入院的发生。肝硬化,尤其是失代偿期肝硬化患者INR延长十分常见。既往研究曾提及INR可能是一项会在将来研究中重点评估的慢加急性肝衰竭的预后指标[12]。虽然没有涉及慢加急性肝衰竭人群,但由于失代偿期肝硬化患者常与前述患者相互包含,因此,本研究得出的结果在某种程度上证实了既往研究人员的推测。值得注意的是,当纳入所有早期再入院人群进行分析时,INR延长的预测效力强于其余所有指标,而当纳入因肝性脑病早期再入院的人群进行分析时,MELD评分是唯一的预测因子。以上结果可能解释如下。
本研究中早期再入院的原因包括肝性脑病、消化道出血、感染、腹腔积液、低白蛋白血症、腹胀、重症肝炎以及肝生化指标异常,其中一些并发症反映肝功能储备不足,另外一些则提示门脉高压。从病理生理角度出发,除服用华法林的患者,INR延长说明失代偿期肝硬化患者肝脏合成和储备功能减退,同时也是静脉曲张上消化道出血的预测因素[13],即INR延长与临床上显著的门脉高压有关。此外,我们的研究中,出院时INR>1.62的患者其血红蛋白水平、白细胞计数以及血小板计数显著低于INR≤1.62的患者(t值为-3.709,P < 0.001;t值为-3.469,P值为0.001;t值为-5.713,P < 0.001),提示肝合成及储备能力下降更明显的患者其脾功能亢进也更显著,而脾功能亢进主要由门脉高压引起的脾大所致,故也说明INR延长或许能提示门脉高压。肝功能不全及门脉高压是肝硬化失代偿期两大病理生理特征,而INR延长可反映前述两大特征。因此,我们或许可以采用该指标识别早期再入院风险较高的患者,以期改善他们的预后。指南指出,INR≥1.5是各型肝衰竭诊断标准之一[14],该阈值是在大样本人群中统计分析出来的;而我们的研究中大部分(59.6%)患者INR≥1.5,需考虑慢性肝衰竭或慢加急性肝衰竭诊断,同时我们得出的INR临界值为1.62,稍高于1.5这一经典阈值,可能是由于研究样本量有限,导致范围缩小(>1.62 vs ≥1.5)。值得注意的是,慢性肝衰竭及慢加急性肝衰竭患者是肝硬化患者中病情较重的一部分人群,尤其是后者,住院28 d死亡率高,短期预后差[9]。同时,SHALIMAR等[15]在2015年的研究中提到,在管理肝性脑病时,需积极纠正凝血功能障碍以达到INR<1.7的目标,与我们的研究结果相似。因此,1.62的INR临界值或许可用于识别病情较重,即早期再入院风险较高的肝硬化患者,以期防止或减少肝病相关再入院。然而,研究人员仍需要进行对照试验进一步评估此结果的可靠性,终点指标可以是30 d再入院率和3个月再入院率以及30 d死亡率和6个月死亡率。
本研究发现,出院时的MELD评分能独立预测肝性脑病引起的早期再入院的发生。众所周知,MELD评分能有效预测终末期肝病短期及中期死亡的发生[16-17]。虽然我们发现由肝性脑病所致的早期再入院和中期死亡发生之间没有显著的关联(r值为-0.078, P>0.05),但SCAGLIONE等[2]的研究强调失代偿期肝硬化患者早期再入院的发生可独立预测这部分人群首次出院后死亡的发生,且预测效力至少维持1年。因此,出院时的MELD评分或可预测由肝性脑病引发的早期再入院的发生。同前,研究人员最好采用对照试验进一步证实MELD评分与肝性脑病引发的早期再入院之间的关系。
其次,本研究发现血红蛋白是早期再入院的保护因素,即血红蛋白水平越高,早期再入院风险越低。与之相似的是,贫血可独立预测肝硬化患者慢加急性肝衰竭的发生[18],而慢加急性肝衰竭是肝硬化患者早期再入院的独立预测因素[19]。就其机制而言, 贫血导致人体外周血氧供减少,直接和/或进一步通过削弱大血管功能加速肝衰竭的发生、发展[16]。因此,贫血是防止早期再入院的潜在治疗靶点。
最后,本研究发现首次住院期间使用人工肝可独立预测中期死亡的发生。具体而言,这部分患者处于急性肝衰竭或慢加急性肝衰竭的病理生理状态,表现为肝功能急剧恶化、多器官功能衰竭以及短期死亡率高[20]。因此,此项指标或可预测中期死亡的发生。但需要指出的是,本研究中人工肝的使用与中期死亡发生之间不是剂量-效应关系。事实上,人工肝的使用可能是疾病严重程度的标志。此外,本研究中使用人工肝的患者样本量不足(死亡组2例vs存活组2例), 也需要研究人员在大样本研究中进一步证实以上结论。
综上,INR可用于识别出现肝性脑病的肝硬化患者中病情较为严重,即早期再入院率较高的患者,同时MELD评分可用于预测肝性脑病的早期复发。以上实践策略用于监测病重患者及降低早期再入院率的可靠性需临床研究进一步证实。此外,除贫血患者有明确治疗靶点外,如何防止INR延长和MELD评分升高的患者再次入院这一问题仍需今后的研究来解答。
| [1] | TAPPER E B, HALBERT B, MELLINGER J. Rates of and reasons for hospital readmissions in patients with cirrhosis: A multistate population-based cohort study[J]. Clin Gastroenterol Hepatol, 2016, 14(8): 1181–1188.e2. DOI:10.1016/j.cgh.2016.04.009 |
| [2] | SCAGLIONE S J, METCALFE L, KLIETHERMES S, et al. Early hospital readmissions and mortality in patients with decompensated cirrhosis enrolled in a large national health insurance administrative database[J]. J Clin Gastroenterol, 2017, 51(9): 839–844. DOI:10.1097/MCG.0000000000000826 |
| [3] | ELLUL M A, GHOLKAR S A, CROSS T J. Hepatic encephalopathy due to liver cirrhosis[J]. BMJ, 2015: h4187. DOI:10.1136/bmj.h4187 |
| [4] | GONZALEZ H C, JAFRI S M, GORDON S C. Management of acute hepatotoxicity including medical agents and liver support systems[J]. Clin Liver Dis, 2017, 21(1): 163–180. DOI:10.1016/j.cld.2016.08.012 |
| [5] | PRAKASH R K, MULLEN K D. Hepatic encephalopathy[M]//PRAKASH R K, MULLEN K D. eds. Schiff's diseases of the liver. Oxford: Wiley-Blackwell, 2011: 421-444. DOI: 10.1002/9781119950509.ch18 |
| [6] | BAÑARES R, CATALINA M V, VAQUERO J. Molecular adsorbent recirculating system and bioartificial devices for liver failure[J]. Clin Liver Dis, 2014, 18(4): 945–956. DOI:10.1016/j.cld.2014.07.011 |
| [7] | FLAMM S L, YANG Y X, SINGH S, et al. American gastroenterological association institute guidelines for the diagnosis and management of acute liver failure[J]. Gastroenterology, 2017, 152(3): 644–647. DOI:10.1053/j.gastro.2016.12.026 |
| [8] | VILSTRUP H, AMODIO P, BAJAJ J, et al. Hepatic encephalopathy in chronic liver disease: 2014 Practice Guideline by the American Association for the Study of Liver Diseases and the European Association for the Study of the Liver[J]. Hepatology, 2014, 60(2): 715–735. DOI:10.1002/hep.27210 |
| [9] |
汤勃, 陈玉琪, 赵敏. 欧洲肝病协会《酒精性肝病临床实践指南》解读[J].
军医进修学院学报, 2012, 33(9): 998–1001.
TANG B, CHEN Y Q, ZHAO M. Interpretation of European Association for the Study of the Liver: EASL clinical practical guidelines: management of alcoholic liver disease[J]. J Chin PLA Postgrad Med School, 2012, 33(9): 998–1001. DOI:10.3969/j.issn.1005-1139.2012.09.037 |
| [10] | European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma[J]. J Hepatol, 2018, 69(1): 182–236. DOI:10.1016/j.jhep.2018.03.019 |
| [11] | KELLUM J A, LAMEIRE N, ASPELIN P, et al. Kidney disease: improving global outcomes (KDIGO) acute kidney injury work group. KDIGO clinical practice guideline for acute kidney injury[J]. Kidney Int Suppl, 2012, 2(1): 89–115. DOI:10.1038/kisup.2011.35 |
| [12] | WLODZIMIROW K A, ESLAMI S, ABU-HANNA A, et al. A systematic review on prognostic indicators of acute on chronic liver failure and their predictive value for mortality[J]. Liver Int, 2013, 33(1): 40–52. DOI:10.1111/j.1478-3231.2012.02790.x |
| [13] | MATEI D, GROZA I, FURNEA B, et al. Predictors ofvariceal or nonvariceal source of upper gastrointestinal bleeding. An etiology predictive score established and validated in a tertiary referral center[J]. J Gastrointest Liver Dis, 2013, 22(4): 379–384. |
| [14] |
中华医学会感染病学分会肝衰竭与人工肝学组, 中华医学会肝病学分会重型肝病与人工肝学组. 肝衰竭诊治指南(2018年版)[J].
临床肝胆病杂志, 2019, 35(1): 38–44.
Liver Failure and Artificial Liver Group, Chinese Society of Infectious Diseases, Chinese Medical Association, Severe Liver Disease and Artificial Liver Group, Chinese Society of Hepatology, Chinese Medical Association. Guideline for diagnosis and treatment of liver failure (2018)[J]. J Clin Hepatol, 2019, 35(1): 38–44. DOI:10.3969/j.issn.1001-5256.2019.01.007 |
| [15] | SHALIMAR, ACHARYA S K. Management in acute liver failure[J]. J Clin Exp Hepatol, 2015, 5: S104–S115. DOI:10.1016/j.jceh.2014.11.005 |
| [16] | WIESNER R H, MCDIARMID S V, KAMATH P S, et al. MELD and PELD: application of survival models to liver allocation[J]. Liver Transpl, 2001, 7(7): 567–580. DOI:10.1053/jlts.2001.25879 |
| [17] | KAMATH P S, KIM W R, Advanced Liver Disease Study Group. The model for end-stage liver disease (MELD)[J]. Hepatology, 2007, 45(3): 797–805. DOI:10.1002/hep.21563 |
| [18] | PIANO S, TONON M, VETTORE E, et al. Incidence, predictors and outcomes of acute-on-chronic liver failure in outpatients with cirrhosis[J]. J Hepatol, 2017, 67(6): 1177–1184. DOI:10.1016/j.jhep.2017.07.008 |
| [19] | PIANO S, MORANDO F, CARRETTA G, et al. Predictors of early readmission in patients with cirrhosis after the resolution of bacterial infections[J]. Am J Gastroenterol, 2017, 112(10): 1575–1583. DOI:10.1038/ajg.2017.253 |
| [20] | ASRANI S K, O'LEARY J G. Acute-on-chronic liver failure[J]. Clin Liver Dis, 2014, 18(3): 561–574. DOI:10.1016/j.cld.2014.05.004 |



