2. 400042 重庆,陆军军医大学(第三军医大学)大坪医院:放射科
2. Department of Radiology, Daping Hospital, Army Medical University, Chongqing, 400010, China
神经影像学在急性缺血性卒中(acute ischemic stroke,AIS)治疗中的地位日趋关键,目前通过影像评估核心梗死与缺血半暗带是进行血管内治疗(endovascular treatment,ET)的前提[1-3]。五大研究中证实,ET可明显改善大血管闭塞(large vessel occlusion,LVO)患者的临床预后[4-8],但ET组的病死率却未见明显降低,一些患者介入治疗后病情反而出现加重[9],特别是大核心梗死患者可挽救脑组织小、血脑屏障破坏范围大以及缺血再灌注损伤发生风险高[10-11],是无效开通或有害开通的主要原因。因此,影像筛选排除大核心梗死的病例至关重要,也有报道患者良好预后相关的预测指标是核心梗死体积,而不是缺血半暗带[12]。
应用平扫CT(noncontrast computed tomographic,NCCT)低密度和灌注影像中脑血容量(cerebral blood volume,CBV)图像下降区域Alberta卒中项目早期CT评分(Alberta stroke program early CT score,ASPECTS)[13]均可以反映核心梗死情况。NCCT上低密度与细胞内含水量有关,被认为是脑梗死的最直接和最重要的征象。SWIFT-PRIME[6]和ESCAPE[5]研究将NCCT ASPECTS≤5作为评估核心梗死的标准,列入排除标准中。基于5大研究的荟萃分析也显示,NCCT ASPECTS<5患者无法从机械取栓中获益,但这些研究中多数没有经过灌注影像评估。而CBV ASPECTS在一些研究中提示与最终梗死体积关系更密切(敏感性78.6%,特异性75%)[14],也可以作为临床结局的预测指标。但CBV伪彩图变化区域包含核心梗死区与低灌注区相混合,视觉评估有高估核心区可能[15]。基于两者各自特点常有患者出现NCCT ASPECTS与CBV ASPECTS错配。其中NCCT-CBV ASPECTS≥0(N-C≥0)的患者已被证明可以从ET中获益,但NCCT-CBV ASPECTS<0(N-C<0)因其NCCT上低密度影较大,而被临床医师认为无法从ET中获益或再通后增加出血转化风险而成为有害再通,因此放弃手术治疗,即使CBV中核心梗死仍较小。
本研究通过回顾本中心既往进行ET的病例,旨在证明存在N-C<0的患者进行血管再通治疗可以获得同N-C≥0的患者一样的安全性与有效性,同时探寻相关预测指标对ET预后的作用。
1 资料与方法 1.1 研究对象收集本院2015年1月到2018年8月连续就诊的前循环颅内大血管闭塞的ET患者。患者均进行多模CT检查,包括头颅NCCT、头颈部CTA及CT灌注(CT perfusion, CTP)。根据指南推荐意见,发病4.5 h内到院患者给予阿替普酶静脉溶栓后桥接治疗,超过4.5 h的患者直接进行ET。使用目前市面可获得手术器械进行机械取栓或血管成形术,成功再通定义为脑梗死溶栓治疗分级(thrombolysis in cerebral infarction,TICI)[16]2b或3级。记录发病、到院、影像、穿刺、再通等时间点。术后即刻、(24±6)h复查头颅NCCT用来明确是否有颅内出血。症状性颅内出血(symptomatic intracranial hemorrhage,sICH)定义为美国国立卫生研究院卒中量表(National Institute of Health Stroke Scale,NIHSS)评分增加4分。入组标准:①年龄>18岁;②发病6~24 h;③入院NIHSS评分≥6分;④入院CTA证实颈内动脉颅内段或大脑中动脉M1/M2段闭塞;⑤CBV ASPECTS≥6分;⑥发病前mRS评分0~1分。排除标准:①入院NCCT证实为脑出血或蛛网膜下腔出血;②未完成多模影像检查或图像质量过低;③术中影响预后的严重并发症;④术后造影证实TICI分级未达到2b级或3级;⑤未完成90 d随访;⑥妊娠。安全性指标为90 d死亡、严重颅内出血、sICH,有效性指标为住院7 d、出院NIHSS评分及90 d改良RANKIN量表(modified RANKIN Score,mRS),良好功能预后定义为mRS≤2分。
1.2 资料收集 1.2.1 影像获取图像均在256排多层极速CT扫描仪上(BrillianceiCT,Philips,Healthcare,Best,The Netherlands)获取。扫描顺序为NCCT、CTP和CTA。NCCT采用5 mm层厚断层扫描,共获取24层图像。CTP以周期性螺旋扫描方式连续扫描大脑30次(Z轴80 mm,5 s延迟,2 s平均时间分辨率,采集时间为30×2=60 s)。双相注射方案包括高压注射非离子型碘对比剂(Iohexol,GE,Shanghai,China)50 mL,随后以5 mL/s的速率注射50 mL生理盐水追踪剂。注射过程通过肘部安置的18-gauge留置针完成。头颈部CTA联合扫描采用智能追踪法(注射方案为对比剂0.8 mL/kg,生理盐水50 mL,注射速率4~6 mL/s),扫描层厚0.625 mm,层间距0.4 mm,监测层面为气管分叉处,感兴趣区为降主动脉,扫描启动阈值为150 Hu。扫描完成后使用飞利浦EBW(Extended Brilliance Workspace)图像后处理工作站灌注软件以及用高级血管分析软件(advancedvesselanalysis,AVA)进行CTP和头颈部CTA重建。后处理时间约10 min,然后将NCCT、CTA及CTP图像存储。
1.2.2 影像分析由2名有经验的神经病学医师分别从阅片系统中调取患者入院NCCT、CTA、CTP图像,隐藏患者具体治疗过程及临床结局,2名医师独立记录NCCT、CBV图像ASPECTS和两者差值,将N-C<0和≥0分组记录。同时记录入院CTA图像侧支循环评分,采用改良Tan评分标准[17]:0分,无侧支循环;1分,软脑膜侧支动脉填充0%~50%;2分,侧支填充>50%~<100%;3分,侧支填充达100%。如出现两名记录者评分不一致时,需对图像进行重新分析,最终达成一致标准。术后NCCT出血转化评分根据ECASS-Ⅱ标准[18],严重颅内出血定义为≥脑实质血肿Ⅰ型(PH-Ⅰ)。
1.3 统计学分析采用SPSS 20.0统计软件进行数据整理、筛选与分析。计量资料数据以x±s表示,计数资料数据以例(%)表示,不同预后分组组间各计量指标的比较采用独立样本t检验,计数资料采用卡方检验(必要时辅以精确概率法)进行组间比较;对单因素分析中具有显著性意义变量进行多因素Logistic回归分析,探究影响预后的相关因素。采用Logistic回归法及线性回归法探究不同差值对安全性及有效性的影响。检验水准:α=0.05。
2 结果 2.1 两组间一般资料比较收集连续就诊前循环LVO患者290例,血管再通256例(88.3%),符合颈内动脉颅内段或大脑中动脉M1/M2段闭塞219例,最终纳入研究共144例,其中N-C<0有25例,N-C≥0有119例。两组基线资料比较,N-C<0组中具有更低的NCCT ASPECTS(6.96±1.77 vs 8.73±1.25,P < 0.001),同时两组间责任血管分型(P=0.036)、穿刺到再通时间(P=0.017)差异具有统计学意义,其余资料差异未见统计学意义。具体见表 1~4。
| 组别 | n | 男/女(例) | 年龄(x±s)/岁 | 入院NIHSS(x±s)/分 | 血糖(x±s)/mmol·L-1 | 低密度脂蛋白(x±s)/mmol·L-1 | 高血压[例(%)] | 糖尿病[例(%)] | 冠心病[例(%)] | 房颤[例(%)] | 脑卒中[例(%)] | 吸烟[例(%)] |
| N-C<0组 | 25 | 14/11 | 64.28±13.03 | 16.64±4.18a | 8.14±2.94 | 3.00±1.04` | 12(48.0) | 5(20.0) | 2(8.0) | 5(20.0) | 2(8.0) | 50(60.24) |
| N-C≥0组 | 119 | 58/61 | 65.92±12.16 | 17.29±5.56 | 8.34±3.29 | 3.02±0.98 | 56(47.1) | 20(16.8) | 27(22.7) | 35(29.4) | 17(14.3) | 44(72.13) |
| NIHSS:美国国立卫生研究院卒中量表;a:P < 0.05,与N-C≥0组比较 | ||||||||||||
| 组别 | n | 病因 | 责任血管 | |||||||
| 动脉粥样硬化 | 心源性栓塞 | 其他病因 | 不明原因 | ICA颅内段 | MCA-M1 | MCA-M2 | 串联 | |||
| N-C<0组 | 25 | 10(40.0) | 12(48.0) | 2(8.0) | 1(4.0) | 4(16.0)a | 18(72.0)a | 2(8.0)a | 1(4.0)a | |
| N-C≥0组 | 119 | 44(37.0) | 59(49.6) | 7(5.9) | 9(7.6) | 6(5.0) | 73(61.3) | 13(10.9) | 27(22.7) | |
| ICA:颈内动脉;MCA:大脑中动脉;a:P < 0.05,与N-C≥0组比较 | ||||||||||
| 组别 | n | NCCT ASPECTS(x±s)/分 | CBV ASPECTS(x±s)/分 | 改良Tan评分≥2[例(%)] | 桥接治疗[例(%)] | 术后TICI 2b级[例(%)] | 术后TICI 3级[例(%)] |
| N-C<0组 | 25 | 6.96±1.77a | 8.48±1.61 | 21(84.0) | 5(20.0) | 8(32.0) | 17(68.0) |
| N-C≥0组 | 119 | 8.73±1.25 | 7.97±1.32 | 83(70.3) | 35(29.4) | 34(28.6) | 85(71.4) |
| NCCT:平扫CT;CBV:脑血容量;ASPECTS:Alberta卒中项目早期CT评分;TICI:脑血管灌注分级;a:P < 0.05,与N-C≥0组比较 | |||||||
| 组别 | n | OTI时间/min | OTP时间/min | ITR时间/min | PTR时间/min |
| N-C<0组 | 25 | 429.16±282.52 | 535.16±300.69 | 158.76±40.29 | 57.72±27.61a |
| N-C≥0组 | 119 | 378.19±291.67 | 488.55±358.17 | 190.29±136.96 | 79.93±50.84 |
| OTI时间:发病到影像时间;OTP时间:发病到穿刺时间;ITR时间:影像到再通时间;PTR时间:穿刺到再通时间;a:P < 0.05,与N-C≥0比较 | |||||
2.2 安全性结果
控制变量为年龄及入院NIHSS评分,严重颅内出血为≥脑实质血肿I型。总体严重颅内出血12.5%(18/144),症状性颅内出血(sICH)3.5%(5/144),病死率5.6%(8/144)。两组在严重颅内出血、sICH和死亡方面差异均无统计学意义(P>0.05,表 5)。
| 组别 | n | 严重颅内出血[例(%)] | sICH[例(%)] | 死亡[例(%)] | 住院7 d NIHSS(x±s)/分 | 出院NIHSS(x±s)/分 |
| N-C<0组 | 25 | 3(12.0) | 1(4.0) | 1(4.0) | 9.92±6.32 | 8.44±8.65 |
| N-C≥0组 | 119 | 15(12.6) | 4(3.4) | 7(5.9) | 11.59±8.38 | 9.06±8.92 |
| OR | 0.865 | 1.409 | 0.759 | 1.112 | 1.007 | |
| 95%CI | 0.225~3.328 | 0.135~14.733 | 0.085~6.777 | -3.429~5.653 | -2.651~4.665 | |
| P值 | 0.833 | 0.775 | 0.805 | 0.626 | 0.587 |
2.3 有效性结果
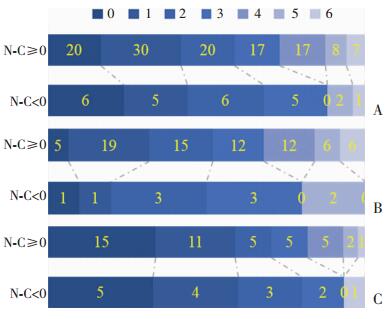
控制变量为年龄及入院NIHSS评分,总体良好预后(mRS≤2)率为60.4%(87/144)。两组患者经过血管内治疗后在住院7 d时NIHSS评分均明显下降,但两组间差异无统计学意义(P=0.626,表 5),出院时N-C<0组NIHSS评分更低,但两组差异仍无统计学意义(P=0.587,表 5)。90 d良好预后在N-C<0组中所占比例更高(68.0% vs 58.8%),但多因素回归分析显示两组差异无统计学意义(OR 1.041,95%CI 0.394~ 2.747,P=0.935,图 1A)。根据CBV ASPECTS分层分析可见,在CBV ASPECTS 6~8分中,N-C<0仍有50.0%(5/10)的良好预后率(图 1B);而CBV ASPECTS 9~10分中,N-C<0组良好预后率更高(80.0% vs 70.5%,图 1C)。
|
| A:总体情况N-C<0组中良好预后(mRS≤2)所占比例更高(68.0% vs 58.8%),但两组差异无统计学意义(P=0.935);B:CBV ASPECTS 6~8分N-C<0良好预后率达50.0%;C:CBV ASPECTS 9~10分N-C<0组良好预后率高于N-C≥0组 图 1 两组90 d mRS评分情况 |
2.4 良好预后的多因素分析
为了评估NCCT和CBV与预后的相关性,将良好预后(90 d mRS≤2)作为独立变量纳入回归模型。多因素回归模型分析(表 6)显示,CBV ASPECTS(OR=1.460,95% CI=1.095~1.945,P=0.010)是预测良好预后的独立指标,而NCCT ASPECTS并不具有这样的效力,桥接治疗也是良好预后的独立预测指标。同时入院NIHSS评分和PTR与良好预后呈负相关。
| 因素 | 良好预后(90 d mRS≤2) | ||
| OR | 95% CI | P值 | |
| CBV ASPECTS | 1.460 | 1.095~1.945 | 0.010 |
| 入院NIHSS | 0.879 | 0.813~0.951 | 0.001 |
| 桥接治疗 | 3.030 | 1.202~7.642 | 0.019 |
| PTR时间 | 0.991 | 0.984~0.999 | 0.032 |
2.5 典型病例
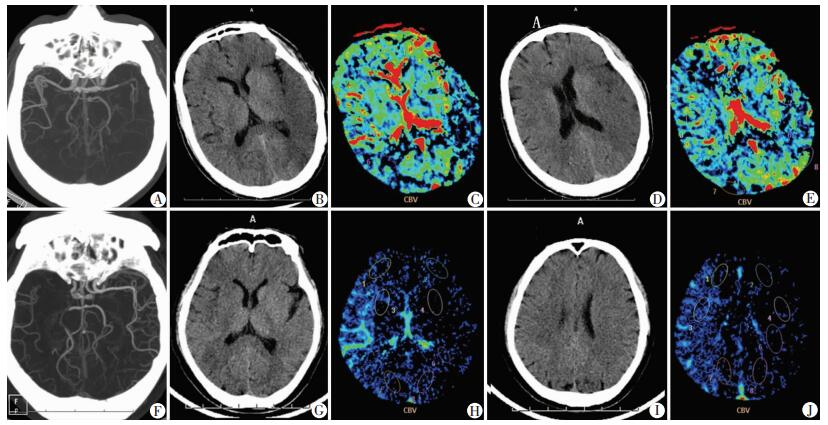
2例患者的影像学表现见图 2。患者1虽然入院NCCT ASPECTS评分5分,但CBV ASPECTS仍有7分,OTI时间302 min,PTR时间73 min,入院NIHSS评分22分,出院NIHSS评分12分,经ET治疗后90 d mRS评分3分。患者2入院NCCT ASPECTS 6分,CBV ASPECTS 9分,OTI时间791 min,PTR时间37 min,入院NIHSS评分14分,出院NIHSS评分10分,经ET治疗后90 d mRS评分2分。
|
| A~E:患者1 CTA提示左侧MCA-M1远端闭塞(A),入院NCCT ASPECTS 5分(B、D),CBV ASPECTS 7分(C、E);F~J:患者2 CTA提示右侧ICA-C7闭塞(F),入院NCCT ASPECTS 6分(G、I),CBV ASPECTS 9分(H、J) 图 2 两例AIS患者CTA和CBV影像学表现 |
3 讨论
本研究结果显示对于N-C<0的患者进行血管内治疗没有增加症状性颅内出血及病死率,并且有效性结果不劣于N-C≥0的患者。
ASPECTS最初被应用于NCCT中利于发现早期缺血表现,帮助预测静脉溶栓结局[13],之后因其快速、简便在多项ET研究中评估患者核心梗死。其中MR CLEAN研究的亚组分析[19]中提示ASPECTS分值越高,患者获益率也越高,但ASPECTS在中等核心梗死即5~7分的患者仍能获益,这可能和没有使用灌注影像评估而导致NCCT缺乏准确性有关。既往研究普遍认为NCCT低密度大于1/3大脑中动脉供血区域是ET禁忌,之后的研究证实NCCT ASPECTS≤6判断低密度>1/3区域具有高度敏感性(94%)与特异性(98%)[20],故实际工作中如出现NCCT ASPECTS≤6会明显影响ET决策的制定。而最近的研究指出,大核心梗死合并大可挽救脑组织的患者,经过ET可减小最终梗死体积,有改善预后的倾向[1]。本研究亚组分析中也发现,在CBV ASPECTS低分(6~8分)组,N-C<0中所有NCCT ASPECTS均≤6分,但仍有50%(5/10)的患者具有良好功能结局,且与N-C≥0组差异无统计学意义。因此NCCT上大核心梗死患者并非不能从血管内治疗中获益,但需要对核心梗死进行更详细的判定。如图 2A的患者,虽然NCCT ASPECTS评分<6分,但CBV ASPECTS仍有7分,入院时NIHSS评分22分,经ET治疗后mRS恢复至3分,仍有较大的获益。有研究提示NCCT ASPECTS与CTP核心体积比较在大核心患者中ASPECTS评分特异性降低(81% vs 93%),同时发现NCCT ASPECTS在8~10分的患者在CTP中已有了大面积梗死[21],NCCT ASPECTS的不准确性可能导致将部分患者被错误的分到其他治疗组中,影响治疗结局。本研究多因素回归分析也提示CBV ASPECTS是良好预后的独立预测指标,而NCCT ASPECTS并未体现出此效力,可见使用CBV ASPECTS评估更加可靠。
NCCT与CBV ASPECTS错配时常出现,本研究数据中有57.6%(83/144)的患者两者得分不同。NCCT早期低密度改变与细胞毒性和随后的细胞水肿有关,评分者观察到这些变化的能力受梗死的大小、缺血程度和CT时间的影响[22]。NCCT存在一定的时间依赖性,其超早期缺血性病灶检出率较低,且良好侧支循环患者可能导致梗死核心形成时间较长,BAL等[23]就发现NCCT在发病90 min内的可靠性差。而CTP直接分析造影剂通过血管容量获得脑灌注图像,敏感性更高,但它主要是一个血流动力学的测量指标,对于时间的依赖性与NCCT不同,随着时间的延长CBV判断核心梗死阈值更呈现动态变化过程[15]。PADRONI等[22]研究显示CBV ASPECTS低分患者更容易出现与NCCT ASPECTS不一致,此外发病最初的2 h使用CBV ASPECTS(r=-0.33, P < 0.01)预测最终梗死体积比NCCT ASPECTS(r<-0.20, P=0.08)更可靠。这间接提示NCCT与CBV ASPECTS不符可能存在可挽救脑组织,并且N-C<0代表NCCT上低密度灶有逆转可能。
上述结果中两组责任血管呈现出明显的统计学差异(P=0.036),N-C<0组中责任血管更多集中于ICA颅内段,而N-C≥0组有更多的串联病变,这也导致N-C≥0组从穿刺到再通的时间更长(P=0.036)。不同血管闭塞的患者,侧支循环不同可能导致NCCT低密度灶部位和范围也不同[24],串联病变常常为动脉粥样硬化型导致,发病前已有较好侧支代偿形成,对缺血耐受可能更好,而颅内段ICA容易失去前、后交通动脉代偿,对缺血耐受程度差,所以颅内ICA闭塞更容易出现视觉上的大片低密度灶。但NCCT低密度灶受显像对比度及像素影响,NCCT低密度灶阈值没有明确规定,是否存在视觉低密度而CT值未达阈值目前没有明确结果,NCCT上病灶轻度密度降低可能只是脑组织缺血而并未发展为全面梗死的表现,这也是存在N-C<0的可能性之一,因此单纯使用NCCT ASPECTS评估核心梗死筛选患者并不合适。
本研究有一定局限性。首先,本研究为回顾性研究,且样本量较小。其次,两组间病例数量相差较大,原因可能是N-C<0在既往临床工作中被认为无法从ET中获益,所以未行手术治疗,故数据量较少,在2017年DAWN和DEFUSE-3研究公布后,组织窗的概念更加能被大家接受,一些超窗或NCCT ASPECTS低分患者在多模影像仔细评估后逐渐被纳入手术标准中来,故可以进一步收集数据或进行数据匹配分析,增加证据力度。第三,ASPECTS评分为视觉评分,没有获取量化阈值,准确性有待验证,并且ASPECTS受评分者经验影响,一致性各不相同[25-26]。第四,没有收集最终核心梗死体积的数据,NCCT和CBV ASPECTS与术后NCCT或MRI ASPECTS一致性信息没有获取,故无法得知N-C<0中低密度灶是否可逆,这也许能帮助解释为什么部分NCCT上大片低密度患者仍能从ET中获益。
综上所述,本研究证实N-C<0的患者可以从血管内治疗中获益,并且未增加明显风险,不应该将此类患者排除。同时揭示了在临床工作中灌注影像的重要性,它并非只适用于发病6 h以后患者,进行多模影像检查可以明确脑组织学信息,其中NCCT ASPECTS低于CBV ASPECTS并非作为排除或判断ET预后不佳的标准,CBV ASPECTS更能预测临床预后的结局,而NCCT低密度可以保留进行ET的决定,但需根据CBV图像进一步详细评估。
| [1] | REBELLO L C, BOUSLAMA M, HAUSSEN D C, et al. Endovascular treatment for patients with acute stroke who have a large ischemic core and large mismatch imaging profile[J]. JAMA Neurol, 2017, 74(1): 34–40. DOI:10.1001/jamaneurol.2016.3954 |
| [2] | NOGUEIRA R G, JADHAV A P, HAUSSEN D C, et al. Thrombectomy 6 to 24 hours after stroke with a mismatch between deficit and infarct[J]. N Engl J Med, 2018, 378(1): 11–21. DOI:10.1056/NEJMoa1706442 |
| [3] | ALBERS G W, MARKS M P, KEMP S, et al. Thrombectomy for Stroke at 6 to 16 hours with selection by perfusion imaging[J]. N Engl J Med, 2018, 378(8): 708–718. DOI:10.1056/NEJMoa1713973 |
| [4] | BERKHEMER O A, FRANSEN P S, BEUMER D, et al. A randomized trial of intraarterial treatment for acute ischemic stroke[J]. N Engl J Med, 2015, 372(1): 11–20. DOI:10.1056/NEJMoa1411587 |
| [5] | GOYAL M, DEMCHUK A M, MENON B K, et al. Randomized assessment of rapid endovascular treatment of ischemic stroke[J]. N Engl J Med, 2015, 372(11): 1019–1030. DOI:10.1056/NEJMoa1414905 |
| [6] | SAVER J L, GOYAL M, BONAFE A, et al. Stent-retriever thrombectomy after intravenous t-PA vs. t-PA alone in stroke[J]. N Engl J Med, 2015, 372(24): 2285–2295. DOI:10.1056/NEJMoa1415061 |
| [7] | CAMPBELL B C, MITCHELL P J, KLEINIG T J, et al. Endovascular therapy for ischemic stroke with perfusion-imaging selection[J]. N Engl J Med, 2015, 372(11): 1009–1018. DOI:10.1056/NEJMoa1414792 |
| [8] | JOVIN T G, CHAMORRO A, COBO E, et al. Thrombectomy within 8 hours after symptom onset in ischemic stroke[J]. N Engl J Med, 2015, 372(24): 2296–2306. DOI:10.1056/nejmoa1503780 |
| [9] | GOYAL M, MENON B K, VAN ZWAM W H, et al. Endovascular thrombectomy after large-vessel ischaemic stroke: A meta-analysis of individual patient data from five randomised trials[J]. Lancet, 2016, 387(10029): 1723–1731. DOI:10.1016/S0140-6736(16)00163-X |
| [10] | MAN S M, AOKI J, HUSSAIN M S, et al. Predictors of infarct growth after endovascular therapy for acute ischemic stroke[J]. J Stroke Cerebrovasc Dis, 2015, 24(2): 401–407. DOI:10.1016/j.jstrokecerebrovasdis.2014.09.004 |
| [11] | BAI J L, LYDEN P D. Revisiting cerebral postischemic reperfusion injury: new insights in understanding reperfusion failure, hemorrhage, and edema[J]. Int J Stroke, 2015, 10(2): 143–152. DOI:10.1111/ijs.12434 |
| [12] | JOVIN T G, YONAS H, GEBEL J M, et al. The cortical ischemic core and not the consistently present penumbra is a determinant of clinical outcome in acute middle cerebral artery occlusion[J]. Stroke, 2003, 34(10): 2426–2433. DOI:10.1161/01.STR.0000091232.81947.C9 |
| [13] | BARBER P A, DEMCHUK A M, ZHANG J, et al. Validity and reliability of a quantitative computed tomography score in predicting outcome of hyperacute stroke before thrombolytic therapy. ASPECTS study group. Alberta stroke programme early CT score[J]. Lancet, 2000, 355(9216): 1670–1674. DOI:10.1016/S0140-6736(00)02237-6 |
| [14] | PADRONI M, BERNARDONI A, TAMBORINO C, et al. Cerebral blood volume ASPECTS is the best predictor of clinical outcome in acute ischemic stroke: A retrospective, combined semi-quantitative and quantitative assessment[J]. PLoS ONE, 2016, 11(1): e0147910. DOI:10.1371/journal.pone.0147910 |
| [15] | BONED S, PADRONI M, RUBIERA M, et al. Admission CT perfusion may overestimate initial infarct core: the ghost infarct core concept[J]. J Neurointerv Surg, 2017, 9(1): 66–69. DOI:10.1136/neurintsurg-2016-012494 |
| [16] | HIGASHIDA R T, FURLAN A J, ROBERTS H, et al. Trial design and reporting standards for intra-arterial cerebral thrombolysis for acute ischemic stroke[J]. Stroke, 2003, 34(8): e109–e137. DOI:10.1161/01.STR.0000082721.62796.09 |
| [17] | TAN I Y, DEMCHUK A M, HOPYAN J, et al. CT angiography clot burden score and collateral score: correlation with clinical and radiologic outcomes in acute middle cerebral artery infarct[J]. AJNR Am J Neuroradiol, 2009, 30(3): 525–531. DOI:10.3174/ajnr.A1408 |
| [18] | FORD G, FREEMANTLE N. ECASS-Ⅱ: intravenous alteplase in acute ischaemic stroke. European co-operative acute stroke study-Ⅱ[J]. Lancet, 1999, 353(9146): 65. DOI:10.1016/S0140-6736(98)00005-1 |
| [19] | YOO A J, BERKHEMER O A, FRANSEN P S S, et al. Effect of baseline alberta stroke program early CT score on safety and efficacy of intra-arterial treatment: A subgroup analysis of a randomised phase 3 trial (MR CLEAN)[J]. Lancet Neurol, 2016, 15(7): 685–694. DOI:10.1016/S1474-4422(16)00124-1 |
| [20] | DEMAERSCHALK B M, SILVER B, WONG E, et al. ASPECT scoring to estimate >1/3 middle cerebral artery territory infarction[J]. Can J Neurol Sci, 2006, 33(2): 200–204. DOI:10.1017/S0317167100004972 |
| [21] | DEMEESTERE J, GARCIA-ESPERON C, GARCIA-BERMEJO P, et al. Evaluation of hyperacute infarct volume using ASPECTS and brain CT perfusion core volume[J]. Neurology, 2017, 88(24): 2248–2253. DOI:10.1212/WNL.0000000000004028 |
| [22] | PADRONI M, BONED S, RIBÓ M, et al. CBVASPECTS improvement over CTASPECTS on determining irreversible ischemic lesion decreases over time[J]. Interv Neurol, 2016, 5(3/4): 140–147. DOI:10.1159/000446969 |
| [23] | BAL S, BHATIA R, MENON B K, et al. Time dependence of reliability of noncontrast computed tomography in comparison to computed tomography angiography source image in acute ischemic stroke[J]. Int J Stroke, 2015, 10(1): 55–60. DOI:10.1111/j.1747-4949.2012.00859.x |
| [24] | PUETZ V, DZIALOWSKI I, HILL M D, et al. Intracranial thrombus extent predicts clinical outcome, final infarct size and hemorrhagic transformation in ischemic stroke: the clot burden score[J]. Int J Stroke, 2008, 3(4): 230–236. DOI:10.1111/j.1747-4949.2008.00221.x |
| [25] | GROTTA J C, CHIU D, LU M, et al. Agreement and variability in the interpretation of early CT changes in stroke patients qualifying for intravenous rtPA therapy[J]. Stroke, 1999, 30(8): 1528–1533. DOI:10.1161/01.STR.30.8.1528 |
| [26] | KALAFUT M A, SCHRIGER D L, SAVER J L, et al. Detection of early CT signs of >1/3 middle cerebral artery infarctions: interrater reliability and sensitivity of CT interpretation by physicians involved in acute stroke care[J]. Stroke, 2000, 31(7): 1667–1671. DOI:10.1161/01.STR.31.7.1667 |



