阿尔茨海默病(Alzheimer’s disease, AD)是一种慢性神经退行性疾病,其临床特征是认知功能逐渐减退。研究人员预计中国60岁及以上的阿尔茨海默病患者比例将从2010年的12%增加到2050年的33%[1]。由于阿尔茨海默病在老年人中患病率高且患病时间长以及护理费用过高等原因,使其成为一个日益增长的公共卫生问题[2]。
目前关于AD的研究,主要集中于大脑的海马区域。有研究表明,最初的记忆活动出现在海马中,随着时间的推移,海马与内侧前额叶皮质的连接逐渐增加,记忆活动从海马逐渐转移到了内侧前额叶皮质[3]。已有研究通过功能性磁共振成像发现AD患者中内侧前额叶皮质存在功能紊乱的现象[4]。在APP/PS1双转基因AD模型小鼠的内侧前额叶皮质中也发现突触功能的长时程增强(LTP)受损[5],因此内侧前额叶皮质区域在AD发病过程中有着重要作用。ZOU等[6]通过体内双光子成像观察到4~5个月APP23小鼠的前额叶皮质中V锥体神经元的树突棘密度降低。树突棘作为构成突触的主要成分,其数量的改变参与了突触可塑性的变化,影响神经网络信息传递,是AD中主要改变的结构之一[7]。临床研究表明,体育锻炼作为一种简单而经济的生活方式因素,可以延缓AD进展[8]。我们团队前期研究发现,跑步锻炼可以减少APP/PS1双转基因小鼠海马DG区树突棘的丢失[9]。而跑步锻炼对AD小鼠内侧前额叶皮质树突棘数量作用的定量研究尚少见报道。
因此,为了研究跑步锻炼对AD小鼠空间学习记忆能力以及内侧前额叶皮质树突棘数量的影响,本实验对12月龄的APP/PS1双转基因小鼠进行4个月跑步锻炼干预。运用Morris水迷宫实验测试小鼠的空间学习记忆能力,并通过体视学方法精确定量AD小鼠内侧前额叶皮质树突棘总数。为进一步深入研究AD病理改变的分子机制提供重要参考依据。
1 材料与方法 1.1 实验动物及分组小鼠由南京大学动物模型研究所提供,并在重庆医科大学实验动物中心进行繁殖。根据美国国立卫生研究院实验动物护理和使用指南(NIH出版物No.85-23)饲养。将12月龄雄性APP/PS1转基因小鼠分为阳性对照组和跑步组,并将同窝生野生型小鼠作为野生组,每组10只小鼠,共30只小鼠。
1.2 跑步锻炼跑步组小鼠于12月龄时开始跑步锻炼干预。前2周,跑步速度从5 m/min逐渐增加到10 m/min。随后,跑步速度保持在10 m/min。每天20 min,每周5 d,持续4个月。
1.3 Morris水迷宫检测空间学习和记忆能力Morris水迷宫设备包括一个直径为90 cm的不锈钢圆形池。平台由透明塑料制成,直径为10 cm。池中的水用牛奶染色。在整个实验中将水温控制在22~25 ℃。将池分成4个象限,其中象限的分界线与池壁相交。测试的第1~6天,为定位航行实验:将平台置于水面下1 cm,先将小鼠放在平台上15 s,然后将动物头朝池壁沿着入水点轻轻放入水中。每次随机选取1个入水点。如果60 s后小鼠没找到平台,则把小鼠置于平台上15 s后,再取出小鼠。第7天,为空间探索实验:将隐蔽平台取出,将小鼠沿离平台最远的2个象限依次放入水中。使小鼠在水池内搜索平台60 s,观察小鼠穿过平台的次数和记录小鼠在平台所在象限停留的时间。整个实验过程中利用水池上的摄像机系统记录小鼠运动的时间、路程。
1.4 实验取材用1%戊巴比妥钠麻醉小鼠,然后用生理盐水加肝素进行心脏灌注,再用4%多聚甲醛灌注。灌注后,取出脑,切掉嗅球和小脑。将大脑的其余部分分为左右两个半球。随机选取每只小鼠大脑的一侧半球用于后续实验。将半脑分别在10%蔗糖、20%蔗糖和30%蔗糖中梯度脱水,各24 h。脱水后,将半球包埋在包埋剂中(O.C.T.ComPound,SAKURA,4583,USA),然后用冷冻超微切片机(Leica Microsystems,CM1950,Germany)沿冠状切面切取厚度为50 μm的连续冠状切片, 在含有内侧前额叶皮质的组织切片中按照1/6的抽样分数进行抽样,每个样本包含9张切片。切片储存于75%的酒精,在-20 ℃冰箱保存。这些冷冻组织切片将用于免疫荧光染色和免疫组织化学染色。
1.5 免疫荧光染色如上所述, 每只小鼠选择其中1组切片进行染色。将切片用PBS洗涤2次, 每次10 min,然后用含有0.3% Triton X-100的0.01 mol/L PBS缓冲液制剂洗涤10 min×6次。配制封闭液,在0.3% Triton X-100加入0.1%鱼明胶,1%胎牛血清和5%山羊血清。将切片置于封闭液中于37 ℃封闭2 h,然后吸取适量的封闭溶液以1 :200比例稀释Aβ (MAB3420,CST,USA)或spinophilin (Abcam, ab50184)一抗,将切片在4 ℃下与一抗孵育72 h。然后将切片放在37 ℃下,复温1 h,再用含有0.3% Triton X-100的0.01 mol/L PBS洗涤10 min×6次。配置二抗:在PBS缓冲液中以1 :100稀释的DyLight 488二抗(A23210, Abbkine, USA)或DyLight549(A23320, Abbkine, USA),将切片放入二抗中,37 ℃闭光孵育2 h,再用0.01 mol/L PBS洗涤10 min×6次。最后在载玻片上贴平切片,滴入抗荧光猝灭剂后封片。免疫荧光染色后,使用激光共聚焦显微镜(Nikon,Japan)观察所有切片。
1.6 免疫组织化学染色将切片用0.01 mol/L PBS洗涤10 min×2次,然后用含有0.3% Tween-20的0.01 mol/L PBS洗涤10 min×6次。配制封闭液,在0.3% Triton X-100加入0.1%鱼明胶,1%胎牛血清和5%山羊血清。将切片置于封闭液中于37 ℃封闭2 h,然后吸取适量的封闭溶液以1 :1 500比例稀释spinophilin的单克隆抗体(abcam, ab50184),将切片在4 ℃下与一抗孵育72 h。用含有0.3% Tween-20的0.01 mol/L PBS反复冲洗10 min×6次,去除残留的一抗。用0.3% Tween-20以1 :200比例稀释二抗(Aurion Ultra-Small Gold Reagents,Electron Microscopy Sciences)。然后将切片放入二抗中37 ℃温育3 h。用含有0.3% Tween-20的0.01 mol/L PBS和0.01 mol/L PBS分别漂洗5 min×6次,将切片在2%戊二醛中固定10 min。然后用0.01 mol/L PBS和蒸馏水分别漂洗切片5 min×6次。银增强试剂避光显色25 min。然后用去离子水和PBS分别漂洗切片5 min×6次,贴片,风干,加入苏木精复染2 min后,将切片在乙醇中梯度脱水,二甲苯透明,封片。使用改良的Olympus BX51显微镜(Olympus,Tokyo,Japan)观察所有切片。
1.7 内侧前额叶皮质分区小鼠内侧前额叶皮质(mPFC)包括前边缘皮质(PrL)、下边缘皮质(IL)和扣带皮层(Cg)。在冠状面上,最开始出现的是PrL,然后是Cg1,再是IL; 当PrL和IL消失时,出现Cg2。在随后的脑切片中,仅存在Cg1和Cg2。当后皮质出现时,Cg1和Cg2消失。然而,由于动物之间的差异,需要通过细胞构造细分边界[10]。mPFC的第4层细胞是天然缺陷的,因此这些区域之间的区别主要是层Ⅰ、Ⅱ、Ⅲ、Ⅴ和Ⅵ之间的差异[11]。
1.8 体视学分析在体视学分析中,使用光学分合计数法计算内侧前额叶皮质树突棘的总数,在(×100)油镜下统一设置参数:切片面积抽样分数为0.15%, 无偏计数框的面积为4.75 μm2, 计数框高度为15 μm, 保护高度为3 μm, 然后对内侧前额叶皮质区进行随机抽样计数。当切片表面聚焦时,设置Z轴为0刻度,然后移动Z轴离开保护区(3 m)。进入体视框开始计数。体视框的计数原则为:当树突棘第1次在体视框内清楚聚焦,且完全在计数框内或部分在计数框内但不接触任何排除线(红线)或其延长线。基于上述参数和计数,用公式计算树突棘的总数。
N=ΣQ-(1/ssf)×(1/asf)×(1/tsf)
其中N表示树突棘的总数,ΣQ-表示计数的树突棘的总数,ssf是组织切片的抽样分数,asf是组织切片面积的抽样分数,tsf为组织切片厚度的抽样分数(H/T),其中T为尼氏染色后组织切片的平均厚度(μm),H为15 μm,即光学体视框的测试高度。
1.9 统计学分析数据以x±s表示。使用SPSS 19.0统计软件进行分析。第1~6天两组之间的Morris水迷宫数据采用重复测量方差分析,第7天的结果和体视学结果采用方差分析,需检验数据的正态性以及方差齐性。检验水准:α=0.05。
2 结果 2.1 水迷宫结果在第1~6天的定位航行实验中,野生组、对照组和跑步组之间的逃避潜伏时间差异有统计学意义(F=15.738,P<0.001);对照组的逃避潜伏时间明显长于野生组和跑步组(P<0.001);跑步组和野生组之间的逃避潜伏时间差异没有统计学意义(P=1.000,图 1A)。在第7天的空间探索实验中,野生组、对照组和跑步组之间的穿台次数差异有统计学意义(F=10.095,P=0.001);对照组的穿台次数显著少于野生组和跑步组(P<0.001和P=0.016);并且跑步组和野生组之间的穿台次数差异没有统计学意义(P=0.068,图 1B)。野生组、对照组和跑步组之间的目标象限游泳时间差异有统计学意义(F=10.276,P<0.001);对照组的目标象限游泳时间显著短于野生组和跑步组(P=0.004,P<0.001),并且跑步组和野生组之间的目标象限游泳时间差异没有统计学意义(P=0.704,图 1C)。野生组、对照组和跑步组之间的目标象限游泳距离百分比差异有统计学意义(F=13.331,P<0.001);对照组的目标象限游泳距离百分比显著低于野生组和跑步组(P<0.001),并且跑步组和野生组之间的目标象限游泳时间差异没有统计学意义(P=0.408,图 1D)。
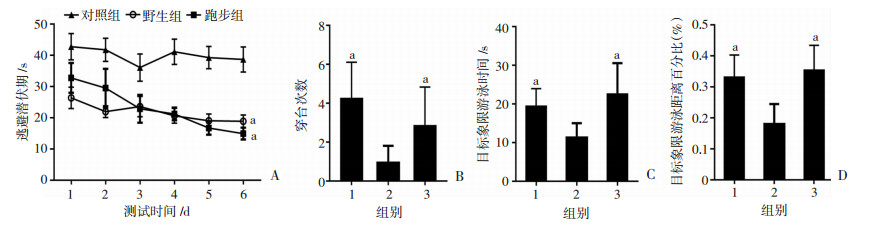
|
| A:隐藏平台实验中的逃避潜伏期;B:空间探索实验中的穿台次数;C:空间探索实验中的目标象限游泳时间;D:空间探索实验中的目标象限游泳距离百分比 1:野生组;2:对照组;3:跑步组;a:P<0.05,与对照组比较 图 1 3组小鼠的水迷宫结果比较 |
2.2 跑步锻炼减少APP/PS1小鼠内侧前额叶皮层淀粉样斑块(Aβ)的积累
通过对内侧前额叶皮质Aβ斑块进行免疫荧光染色,在激光共聚焦显微镜下观察到:对照组的内侧前额叶皮质内积累了大量的淀粉样斑块;野生组的内侧前额叶皮质内几乎观察不到淀粉样蛋白斑块;跑步组的内侧前额叶皮质中淀粉样斑块密度少于对照组(图 2)。
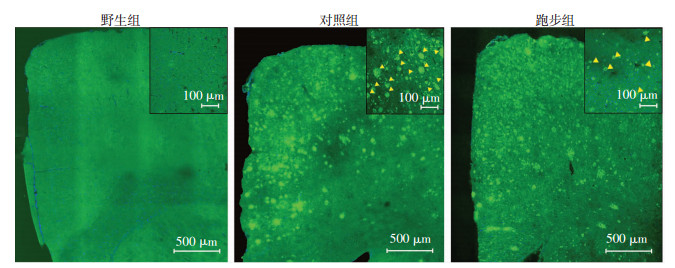
|
| 右上角方框内为局部淀粉样斑块放大;Δ:淀粉样斑块 图 2 激光共聚焦显微镜观察3组小鼠内侧前额叶皮质区淀粉样斑块聚集的比较 |
2.3 跑步锻炼对APP/PS1小鼠内侧前额叶皮层树突棘的作用 2.3.1 跑步锻炼减缓APP/PS1小鼠内侧前额叶皮层树突棘密度的降低
对3组小鼠内侧前额叶皮质spinophilin标记的免疫组化染色和免疫荧光染色分析,分析发现对照组内侧前额叶皮质区spinophilin标记的树突棘密度小于跑步组和野生组(图 3)。
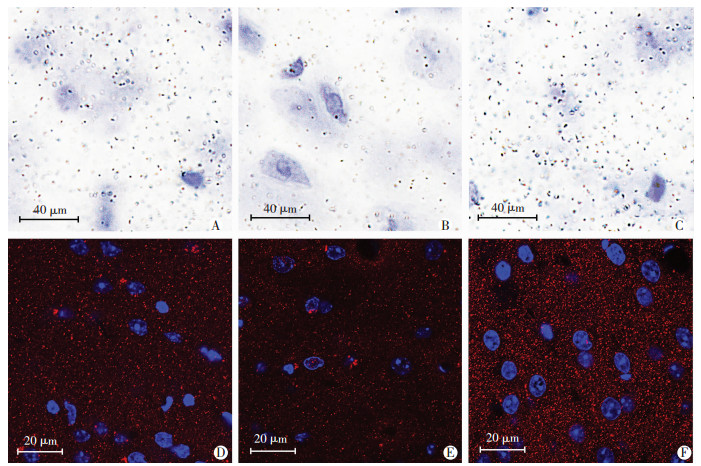
|
| A~C:分别为野生组、对照组和跑步组的内侧前额叶皮质区光学显微镜观察;D~F:分别为野生组、对照组和跑步组的内侧前额叶皮质区激光共聚焦荧光观察 图 3 3组小鼠内侧前额叶皮质区树突棘密度的比较 |
2.3.2 跑步锻炼减缓APP/PS1小鼠内侧前额叶皮层树突棘的丢失
为了进一步精确定量跑步锻炼对树突棘数量的作用,通过对体视学结果分析显示,野生组、对照组和跑步组之间内侧前额叶皮质区spinophilin标记的树突棘数量差异有统计学意义(F=6.152,P=0.014),对照组内侧前额叶皮质区的树突棘数量显著少于跑步组和野生组(P=0.029, P=0.005),并且跑步组和野生组之间的树突棘数量差异没有统计学意义(P=0.384,图 4)。
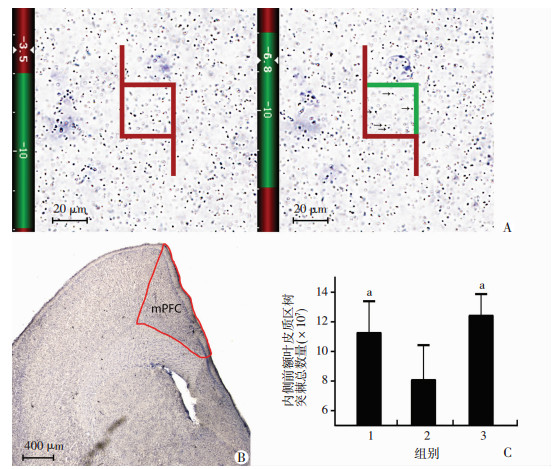
|
| A:光学体视框计数内侧前额叶皮质区树突棘数量示意图 左侧:Z轴位于3.5 μm(保护区域内); 右侧:Z轴位于6.8 μm(在计数框内);↑:第1次清晰聚焦的树突棘;B:内侧前额叶的分区图 红色线条为内侧前额叶皮质的边界;C:3组小鼠内侧前额叶皮质区树突棘总数量 1:野生组;2:对照组;3:跑步组;a:P<0.05,与对照组比较 图 4 小鼠内侧前额叶皮质区树突棘总数量比较 |
3 讨论
AD主要临床表现是认知功能逐渐减退,除了熟知的大脑海马与学习和记忆相关,前额皮质(PFC)区域在获取和编码信息、检索信息、回忆信息来源、评估事件的时间顺序和新进度方面起着关键作用[12]。LI等[4]分别对9例健康老年人、9例轻度认知障碍患者和10例阿尔茨海默病患者进行研究,在受试者进行Stroop任务(一种典型的认知神经科学范例,旨在探索注意力和执行现象)实验时,利用功能磁共振成像(fMRI, functional magnetic resonance image)观察受试者脑区的变化。他们观察到轻度认知障碍患者的前额叶皮质区域存在补偿活动,AD患者的前额叶皮质区域出现了功能障碍。而前额叶皮质主要分为背外侧区域和腹内侧区域,其中腹内侧区域包括内侧区域和腹侧眶额叶[13]。目前背外侧前额叶皮质因其具有控制工作记忆功能,在AD中有较多研究。但是, 最近也有研究表明内侧前额叶皮质区域与AD中的冷漠、洞察力丧失和回忆损伤等症状密切相关。HUEY等[14]通过对AD患者的神经精神病学症状评分量表和全脑ROI体积之间进行了多元回归分析,他们发现内侧前额叶皮质是AD冷漠症状独立相关的区域之一。HORNBERGER等[15]结合基于体素的形态测量法和新的洞察力问卷分析,发现整体洞察力丧失与内侧和额极前额叶萎缩相关。更多证据表明,内侧前额叶皮质通过选择与当前背景相关的记忆并抑制无关记忆来控制记忆检索[16]。在AD动物模型中,同样有研究发现APP/PS1转基因小鼠的内侧前额叶皮质中反应突触功能的长时程增强(LTP)受损[5]。因此内侧前额叶皮质区域在AD疾病发病过程中有着重要作用。
尽管世界各地的研究人员在AD相关研究中投入了大量精力,但仍然没有有效的治疗方法。越来越多的证据表明,运动改善了AD的认知能力。通过综合来自18项随机对照试验的802例患者的数据,一项Meta分析报道体育活动干预对痴呆患者的认知功能有积极影响[17]。为了进一步研究体育锻炼改善AD认知功能的机制,许多研究使用了动物模型。AD的主要病理特征有突触和神经元的丢失,Aβ斑块的沉积和过度磷酸化的Tau蛋白引起的神经纤维缠结[18]。因此选择合适的AD动物模型在AD疾病的研究中至关重要。APP/PS1双转基因小鼠[B6C3-Tg (APPswe, PSEN1de9) 85Dbo/J]作为一种能稳定表达突变的淀粉样前体蛋白[APP(Swe)]和PSEN1基因的DeltaE9的转基因小鼠。其中突变型APP基因会引起神经细胞外Aβ斑块的沉积、突触丢失、胶质细胞增生、胆碱能神经末梢变异和大脑神经元退行性改变;而突变型PS1基因则可在没有APP增加情况下,选择性地增加Aβ42表达。大量研究证明,APP/PS1转基因小鼠能够模拟与AD年龄相关的神经病理学改变,包括全脑萎缩、学习和记忆障碍、淀粉样斑块沉积、Tau蛋白过磷酸化引起的神经纤维缠结以及神经元的丢失等,因此APP/PS1转基因小鼠被认为是用来模拟AD的理想模型。然而,在以前的动物研究中,开始运动的最佳时间、运动的强度和时间并不总是相同的,因此关于运动对AD动物的作用仍然存在争论。例如,10月龄的AD模型小鼠经过6周的跑步机锻炼,未能改善其Morris水迷宫的行为学测试[19]。相反,27月龄的AD模型小鼠在经过12周跑步机锻炼后,小鼠大脑中Aβ斑块数和磷酸化的Tau蛋白表达均降低[20]。ZHAO等[21]报道,8月和17月龄的AD模型小鼠经过5个月跑步机锻炼后,小鼠大脑的可溶性Aβ42蛋白减少。综合以前的文献,跑步机锻炼训练持续3~5个月,每天运动280~700 m,可以显著性改善转基因小鼠Morris水迷宫测试结果和淀粉样蛋白病理的表现。因此,为了进一步研究跑步锻炼对AD的作用,我们选用12月龄的APP/PS1小鼠进行了为期4个月跑步锻炼,每天锻炼20 min,每周锻炼5 d。本研究发现,跑步锻炼减少了APP/PS1小鼠淀粉样斑块的沉积,并且显著改善了APP/PS1转基因小鼠的空间学习和记忆能力。
大量的证据显示,树突棘的丢失和功能障碍是AD疾病中显著的病理特征之一。LAMBERT等[22]早在1998年就发现可溶性的Aβ寡聚体能导致树突棘的丢失和干扰突触的正常功能,同时也能扰乱谷氨酸受体(NMDAR)依赖的长时程增强(LTP)。同时,ZOU等[6]通过体内双光子成像观察到4~5个月APP23小鼠的前额叶皮质中V锥体神经元的树突棘密度降低。本团队前期研究中已经证实了跑步锻炼可以减少APP/PS1双转基因小鼠海马DG区树突棘的丢失。然而,是否跑步锻炼也能延缓老年APP/PS1双转基因小鼠内侧前额叶皮质中树突棘的丢失,尚少见报道。本研究将免疫组织化学方法和新的体视学方法结合起来,定量研究中老年APP/PS1转基因AD模型小鼠内侧前额叶皮质树突棘的变化情况。通过标记树突棘中的树突棘素(spinophilin)来定量研究树突棘数目。spinophilin在树突棘的突触后膜上大量富集,具有定位于细胞膜支架蛋白的特性,在树突棘的形成和功能发挥中起着重要作用,有研究表明spinophilin标记了99%的树突棘且仅标记在树突棘,并且证实在体视学定量研究中使用spinophilin标记树突棘是稳定和可靠的[23]。因此,我们使用anti-spinophilin来作为标记树突棘的抗体然后对内侧前额叶皮质进行spinophilin免疫组化染色。同时采用光学分合法对内侧前额叶皮质内树突棘数目进行定量分析。光学分合法就是将分合法与光学体视框结合在一起的一种研究器官内待测粒子数目的体视学方法[24]。本方法严格遵循均匀系统随机抽样原则,通过均匀系统随机抽样保证所研究的整个研究区域的各个部分有均等的机会被抽取,这是本研究能够得到内侧前额叶皮质内树突棘数目无偏测量结果的重要保障。以往一些在电镜下的研究以密度值来反映总量,但密度值不能提供总量的信息,因为密度值的变化会因总量和体积的改变而变化; 并且参照空间体积的皱缩也会增加密度值,但不影响总数,所以密度值可能误导结果。在本研究中,我们运用三维定量方法计算出内侧前额叶皮质树突棘的总数,研究结果不会因参照空间体积的不同而受影响,也与组织皱缩无关。本研究发现16月龄阳性组APP/PS1双转基因小鼠的内侧前额叶皮层的树突棘数显著少于对照组。提示跑步锻炼能够延缓AD内侧前额叶皮质树突棘数量丢失的进程。
本研究发现长期和适度运动能够延缓中老年AD小鼠空间学习和记忆能力的下降,并能减少AD小鼠前额叶皮质区域Aβ淀粉样蛋白的沉积。结合免疫组织化学和精确的体视学方法,发现运动可以延缓中老年AD小鼠内侧前额叶皮质区域树突棘数量丢失的进程,这可能是运动改善AD认知功能的重要结果基础之一。本研究可望为将来寻找延缓AD进程的新手段提供一定的实验依据。
| [1] | KEOGH-BROWN M R, JENSEN H T, ARRIGHI H M, et al. The impact of Alzheimer's disease on the Chinese economy[J]. EBio Medicine, 2016, 4: 184–190. DOI:10.1016/j.ebiom.2015.12.019 |
| [2] | XIA X, JIANG Q L, MCDERMOTT J, et al. Aging and Alzheimer's disease: Comparison and associations from molecular to system level[J]. Aging Cell, 2018, 17(5): e12802. DOI:10.1111/acel.12802 |
| [3] | TOMPARY A, DAVACHI L. Consolidation promotes the emergence of representational overlap in the hippocampus and medial prefrontal cortex[J]. Neuron, 2017, 96(1): 228–241. DOI:10.1016/j.neuron.2017.09.005 |
| [4] | LI C M, ZHENG J, WANG J, et al. An fMRI stroop task study of prefrontal cortical function in normal aging, mild cognitive impairment, and Alzheimer's disease[J]. Curr Alzheimer Res, 2009, 6(6): 525–530. DOI:10.2174/156720509790147142 |
| [5] | LO A C, ISCRU E, BLUM D, et al. Amyloid and tau neuropathology differentially affect prefrontal synaptic plasticity and cognitive performance in mouse models of Alzheimer's disease[J]. J Alzheimers Dis, 2013, 37(1): 109–125. DOI:10.3233/JAD-122296 |
| [6] | ZOU C Y, MONTAGNA E, SHI Y, et al. Intraneuronal APP and extracellular Aβ independently cause dendritic spine pathology in transgenic mouse models of Alzheimer's disease[J]. Acta Neuropathol, 2015, 129(6): 909–920. DOI:10.1007/s00401-015-1421-4 |
| [7] | JACOBSEN J S, WU C C, REDWINE J M, et al. Early-onset behavioral and synaptic deficits in a mouse model of Alzheimer's disease[J]. Proc Natl Acad Sci U S A, 2006, 103(13): 5161–5166. DOI:10.1073/pnas.0600948103 |
| [8] | BROWN B M, PEIFFER J J, MARTINS R N. Multiple effects of physical activity on molecular and cognitive signs of brain aging: can exercise slow neurodegeneration and delay Alzheimer's disease?[J]. Mol Psychiatry, 2013, 18(8): 864–874. DOI:10.1038/mp.2012.162 |
| [9] |
唐炜, 晁凤蕾, 蒋林, 等. 跑步锻炼减少中老年APP/PS1双转基因AD小鼠海马齿状回内树突棘丢失[J].
重庆医科大学学报, 2017, 42(6): 707–712.
TANG W, CHAO F L, JIANG L, et al. Running exercise reduces dendritic spine loss in the dentate gyrus of the hippocampus in middle-aged APP/PS1 transgenic AD mice[J]. J Chongqing Med Univ, 2017, 42(6): 707–712. DOI:10.13406/j.cnki.cyxb.001184 |
| [10] | CROXSON P L, KYRIAZIS D A, BAXTER M G. Cholinergic modulation of a specific memory function of prefrontal cortex[J]. Nat Neurosci, 2011, 14(12): 1510–1512. DOI:10.1038/nn.2971 |
| [11] | KO J. Neuroanatomical substrates of rodent social behavior: the medial prefrontal cortex and its projection patterns[J]. Front Neural Circuits, 2017, 11: 41. DOI:10.3389/fncir.2017.00041 |
| [12] | BROD G, WERKLE-BERGNER M, SHING Y L. The influence of prior knowledge on memory: A developmental cognitive neuroscience perspective[J]. Front Behav Neurosci, 2013, 7: 139. DOI:10.3389/fnbeh.2013.00139 |
| [13] | VAN DE WERD H J, UYLINGS H B. Comparison of (stereotactic) parcellations in mouse prefrontal cortex[J]. Brain Struct Funct, 2014, 219(2): 433–459. DOI:10.1007/s00429-013-0630-7 |
| [14] | HUEY E D, LEE S, CHERAN G, et al. Brain regions involved in arousal and reward processing are associated with apathy in Alzheimer's disease and frontotemporal dementia[J]. J Alzheimers Dis, 2017, 55(2): 551–558. DOI:10.3233/JAD-160107 |
| [15] | HORNBERGER M, YEW B, GILARDONI S, et al. Ventromedial-frontopolar prefrontal cortex atrophy correlates with insight loss in frontotemporal dementia and Alzheimer's disease[J]. Hum Brain Mapp, 2014, 35(2): 616–626. DOI:10.1002/hbm.22200 |
| [16] | FRANKLAND P W, BONTEMPI B. Fast track to the medial prefrontal cortex[J]. Proc Natl Acad Sci U S A, 2006, 103(3): 509–510. DOI:10.1073/pnas.0510133103 |
| [17] | GROOT C, HOOGHIEMSTRA A M, RAIJMAKERS P G, et al. The effect of physical activity on cognitive function in patients with dementia: A meta-analysis of randomized control trials[J]. Ageing Res Rev, 2016, 25: 13–23. DOI:10.1016/j.arr.2015.11.005 |
| [18] | BLOOM G S. Amyloid-β and tau: the trigger and bullet in Alzheimer disease pathogenesis[J]. JAMA Neurol, 2014, 71(4): 505–508. DOI:10.1001/jamaneurol.2013.5847 |
| [19] | XU Z Q, ZHANG L Q, WANG Q, et al. Aerobic exercise combined with antioxidative treatment does not counteract moderate- or mid-stage Alzheimer-like pathophysiology of APP/PS1 mice[J]. CNS Neurosci Ther, 2013, 19(10): 795–803. DOI:10.1111/cns.12139 |
| [20] | CHO J, SHIN M K, KIM D, et al. Treadmill running reverses cognitive declines due to alzheimer disease[J]. Med Sci Sports Exerc, 2015, 47(9): 1814–1824. DOI:10.1249/MSS.0000000000000612 |
| [21] | ZHAO G, LIU H L, ZHANG H, et al. Treadmill exercise enhances synaptic plasticity, but does not alter β-amyloid deposition in hippocampi of aged APP/PS1 transgenic mice[J]. Neuroscience, 2015, 298: 357–366. DOI:10.1016/j.neuroscience.2015.04.038 |
| [22] | LAMBERT M P, BARLOW A K, CHROMY B A, et al. Diffusible, nonfibrillar ligands derived from A 1-42 are potent central nervous system neurotoxins[J]. Proc Natl Acad Sci U S A, 1998, 95(11): 6448–6453. DOI:10.1073/pnas.95.11.6448 |
| [23] | HAO J D, JANSSEN W G, TANG Y, et al. Estrogen increases the number of spinophilin-immunoreactive spines in the hippocampus of young and aged female rhesus monkeys[J]. J Comp Neurol, 2003, 465(4): 540–550. DOI:10.1002/cne.10837 |
| [24] | ZHOU C N, CHAO F L, ZHANG Y, et al. Fluoxetine delays the cognitive function decline and synaptic changes in a transgenic mouse model of early Alzheimer's disease[J]. J Comp Neurol, 2019, 527(8): 1378–1387. DOI:10.1002/cne.24616 |



