软骨是一种高度机械敏感的组织,对其进行力学压缩加载刺激可增加软骨细胞的合成代谢[1],而对体外培养的软骨细胞进行幅度为10%压缩应变、频率1 Hz正弦波动态刺激后可促进软骨细胞增殖和基质沉积[2]。从力学刺激角度探讨促进软骨损伤修复的措施可望为关节退变等疾病提供新的治疗方法。
低强度脉冲超声,已在临床上用于治疗新鲜骨折与骨不连[3]。早期,有学者发现LIPUS治疗后的大鼠股骨骨折处的骨痂中Ⅱ型胶原和蛋白聚糖的mRNA表达量增加,提示LIPUS可用于治疗软骨损伤[4]。研究报道,LIPUS可能通过作用软骨细胞周围流体诱导产生的剪切应力和循环静水压力等力学刺激,促进软骨细胞增殖和维持软骨的功能状态[5-7],而LIPUS的力学、生物学效应与超声参数(如声强度和占空比等)密切相关。目前,增强软骨细胞功能活性的最佳刺激参数以及具体作用机制仍不甚清楚。本研究采用三种不同参数的LIPUS处理新生小鼠的原代软骨细胞和胚胎跖骨,探讨其对软骨细胞增殖、分化、凋亡等功能的影响,并初步筛选LIPUS作用软骨的最佳参数。
1 材料与方法 1.1 材料C57BL/6J(2月龄,雌雄性)小鼠购自北京华阜康生物技术有限公司,并饲养在陆军军医大学第三附属医院SPF级动物中心经陆军军医大学实验动物管理委员会许可进行相关实验,符合动物实验的伦理要求。
试剂:DMEM-F12培养基、胎牛血清(美国HyClone公司)、BGJb培养基(美国Gibco公司)、DPBS粉末(美国HyClone公司)、青/链霉素(美国HyClone公司)、BSA(美国HyClone公司)、维生素C(Vc,美国Sigma公司)、β-甘油磷酸钠、EdU试剂盒(Invitrogen公司,美国)、TRIzol(Invitrogen公司,美国)、逆转录试剂盒(Exscript,TaKaRa公司,日本)、定量PCR反应试剂盒(SYBRTM Premix Ex Taq TM Kit,TaKaRa公司,日本)、TUNEL试剂盒(Roche公司,瑞士)。
1.2 方法 1.2.1 关节软骨细胞和跖骨的分离与培养取新生3~5 d的C57BL/6J小鼠,75%酒精浸泡消毒,灭菌器械剪开小鼠皮肤,暴露膝关节,分离截取膝关节软骨,适量胰酶37 ℃消化30 min,进一步剔除软组织后剪成1 mm3大小,加入0.1%Ⅱ型胶原酶置于培养箱中消化过夜;次日,观察软骨组织消化情况,筛除残渣,取滤液离心弃上清,用DMEM-F12培养基(含10%FBS)重悬细胞接种于细胞培养板中,于5%CO2、37 ℃培养箱常规培养。
查阴栓记为怀孕0.5 d,于胚胎期18.5 d取胎鼠于体视显微镜下分离跖骨,用含双抗的DPBS漂洗2次,放入加有BGJb培养基的48孔板中,于5%CO2、37 ℃培养箱常规培养。
1.2.2 LIPUS处理及分组实验随机分为对照组及3种不同声强度、占空比参数组合的LIPUS处理组(分别为LIPUSⅠ:声强度30 mW/cm2、占空比20%;LIPUSⅡ:声强度30 mW/cm2、占空比40%;LIPUSⅢ:声强度50 mW/cm2、占空比20%)共4组。各LIPUS处理组的基础参数为:中心频率1.5 MHz,脉冲重复频率1 KHz,作用时间20 min/d,LIPUS探头涂抹耦合剂,将其紧贴培养孔板下方,探头中心对准培养孔的中心,用固定器保持探头稳定。对照组以同样的方式行假超声处理。软骨细胞和跖骨组织于培养的第2天开始LIPUS处理,软骨细胞连续刺激3天(n = 3),跖骨组织连续刺激7天(n = 8)。
1.2.3 CCK-8法检测软骨细胞活性将软骨细胞悬液以每孔1×104个/100 μL接种于96孔板培养,各组分别设LIPUS处理0、1、2、3 d的4个时间点进行CCK-8检测每天的增殖活性,每组3个复孔,同时取3孔加入不含细胞的完全培养液作为调零组,即每天检测5组,共20组。检测时,于LIPUS处理后立即向每孔内加入10 μL的CCK-8溶液,混匀后将培养板放在培养箱内孵育4 h后,酶标仪450 nm波长处检测各组光密度值[D(450)],相对活性 = [D(450)处理组-D(450)调零组] /[D(450)对照组-D(450)调零组] ×100%。
1.2.4 EdU检测软骨细胞增殖小鼠原代软骨细胞以1×105个/孔接种于12孔板爬片,LIPUS处理3 d后,向每孔加入10 μmol/L EdU溶液,培养箱中孵育4 h后,固定并参照试剂说明进行荧光染色,拍照,采用Image Pro Plus软件统计阳性细胞数。
1.2.5 TUNEL检测凋亡小鼠原代软骨细胞以1×105个/孔接种于12孔板爬片,LIPUS处理3 d后,将细胞爬片取出,固定,参考罗氏TUNEL细胞凋亡检测方法说明进行凋亡检测。
1.2.6 定量RT-PCR方法检测软骨细胞相关基因表达按照说明书采用TRIzol法提取软骨细胞RNA,用定量RT-PCR试剂盒检测软骨细胞相关基因Acan、ColⅡ、ColⅩ的表达,Acan、ColⅡ、ColⅩ及内参基因Cyclophilin A的定量引物序列(正向/反向,5′-3′)分别如下:CCTGCTACTTCATCGACCCC/AGATGCTGTTGAC-TCGAACCT、GGGAATGTCCTCTGCGATGAC/GAAGGGGATCTCGGGGTTG、GCAGCATTACGACCAAGAT/CATGATTGCACTCCCTGAAG及CGAGCTCTGAGCACTGG-AGA/TGGCGTGTAAAGTCACCACC。
1.2.7 跖骨观察及计算分析体视显微镜放大倍数调至16倍观察拍照。Image Pro Plus软件测量LIPUS处理第0、7 d跖骨全长及两端软骨长度。计算全骨增长率、软骨增长率。增长率 = [(LIPUS处理7 d的长度-LIPUS处理0 d的长度) /LIPUS处理0 d的长度] ×100%[8]。
1.3 统计学分析采用GraphPad Prism v.6.0软件进行统计学分析,两组均数比较用独立样本t检验,多组均数比较用方差分析(ANOVA),组间两两比较采用LSD法,结果以x±s表示,以P < 0.05为差异显著。
2 结果 2.1 LIPUS对软骨细胞活性的影响由测得的D(450)值计算各处理组的相对细胞活性结果显示,未进行LIPUS处理前,各组的细胞活性一致;LIPUS处理软骨细胞2 d后,各处理组软骨细胞的细胞活性均相对对照组显著增强,差异有统计学意义(P < 0.01);以对照组的细胞活性为1,LIPUS处理3 d后,LIPUSⅡ组(2.24±0.13)与Ⅲ组(1.98±0.06)比LIPUSⅠ组(1.35±0.07)的细胞活性更强,其中LIPUSⅡ组的效果最为明显(图 1)。
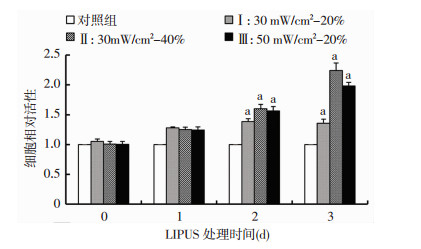
|
| a:P < 0.01,与对照组比较 图 1 各LIPUS处理组在不同时间对软骨细胞活性的影响 |
2.2 LIPUS对软骨细胞增殖的影响
LIPUS处理3 d后,各处理组的EdU阳性细胞率均较对照组明显增加,对照组、LIPUSⅠ、Ⅱ、Ⅲ组的EdU阳性细胞率分别为(9.59±1.22)%、(11.25±2.12)%、(25.81±2.42)%和(16.24±1.12)%,其中LIPUSⅡ、Ⅲ组的增殖能力显著高于对照组(P < 0.01),且LIPUSⅡ和Ⅲ组之间差异有统计学意义(P < 0.05)。我们的结果提示,LIPUSⅡ组的促增殖效果最为明显(图 2)。

|
| 图 2 EdU检测各组软骨细胞的增殖情况(×100) |
2.3 TUNEL检测细胞凋亡
LIPUS处理3 d后进行TUNEL染色,每组统计6个视野下(×200倍)凋亡细胞的数量(图 3中箭头所示,信号为绿色且定位于细胞核周围呈团状的细胞纳入计数),对照组、LIPUSⅠ、Ⅱ、Ⅲ组凋亡细胞率分别为(5.09±0.41)%、(2.33±0.51)%、(1.85±0.15)%和(1.51±0.25)%。LIPUS处理组凋亡细胞数均低于对照组(P < 0.05, 图 3)。

|
| 图 3 TUNEL检测各组软骨细胞的凋亡情况(×200) |
2.4 LIPUS对软骨细胞相关基因表达的影响
LIPUS处理3 d后,基因检测分析发现,以对照组的各基因mRNA表达水平为1,各LIPUS处理组的ColⅡ和Aggrecan的量较对照组显著增加,以LIPUSⅡ组的表达量最高。相反地,各LIPUS处理组ColⅩ的表达量均低于对照组,各处理组之间无明显差异(图 4)。
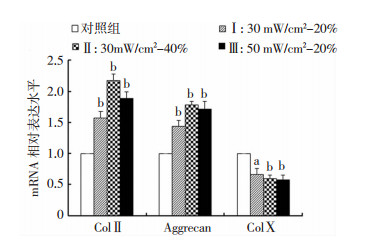
|
| a:P < 0.05,b:P < 0.01,与对照组比较 图 4 各LIPUS处理组对软骨细胞相关基因表达的影响 |
2.5 LIPUS对胚胎期小鼠跖骨生长的影响
LIPUS处理7 d后,跖骨形态正常,生长良好(图 5、6)。LIPUSⅡ和LIPUSⅢ组的软骨增长率和全长增长率均显著高于对照组(P < 0.01),提示Ⅱ、Ⅲ参数的LIPUS处理,可明显促进跖骨的软骨和全长生长,其中软骨对全长的生长贡献更大;而LIPUSⅠ组与对照组的差异无统计学意义(P>0.05)。
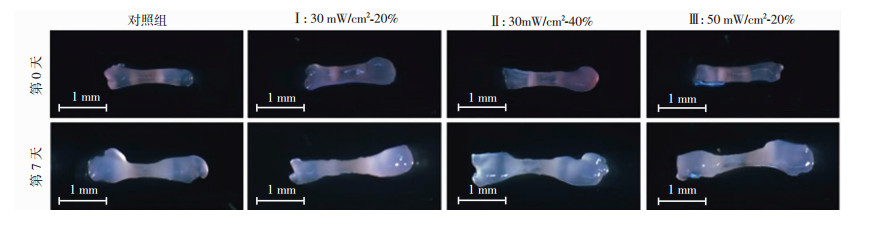
|
| 图 5 各LIPUS处理组跖骨生长的体视显微镜观察(×16) |
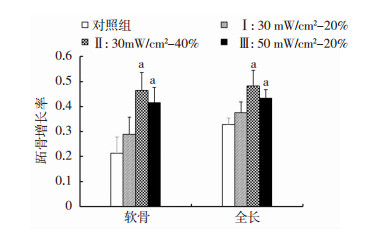
|
| a: P < 0.01, 与对照组比较 图 6 各LIPUS处理组培养跖骨增长率的比较 |
3 讨论
软骨形成包括软骨细胞的形成及软骨细胞的分化、成熟等阶段,其中富含Ⅱ型胶原和蛋白聚糖的软骨基质的沉积是软骨细胞形成的标志,处于分化和成熟阶段的肥大软骨细胞则特征性地表达X型胶原[9]。在骨关节退行性疾病中,退变软骨功能活性降低,表现为细胞增殖减少、肥大细胞增多、细胞凋亡增加等。软骨细胞的这种终极分化和凋亡,被认为是软骨组织不可修复的原因之一。
低强度脉冲超声(LIPUS)在临床上主要用于促进骨折愈合。目前,有部分研究[10-14]观察临床治疗骨折参数的LIPUS(中心频率1.5 MHz,强度30 mW/cm2,重复频率1 KHz,占空比20%)对软骨修复的影响。KORSTJENS等[11]发现此参数可促进人关节软骨细胞增殖和细胞外基质分泌;NAITO等[12]发现在大鼠骨关节炎模型中,该参数LIPUS可促进Ⅱ型胶原的表达,但不影响软骨细胞增殖。而ZHANG等[13]利用此参数处理胚胎期16 d鸡肋软骨细胞,并未发现Ⅱ型胶原和蛋白聚糖基因表达的改变。LIPUS主要靠机械力作用,不同组织的力学感受元件不同[15]。上述研究中的不一致结果提示我们需要充分考虑不同细胞和组织的特性,在安全剂量范围内筛选更适用于软骨的LIPUS参数。
目前有较多关于不同声强度LIPUS对软骨细胞影响的研究。TIEN[16]等用不同强度的LIPUS处理人关节软骨细胞,使用酶联免疫吸附法测量蛋白聚糖合成以及蛋白免疫印迹检测Ⅱ型胶原产物,发现强度为48 mW/cm2的超声促进蛋白聚糖和Ⅱ型胶原生成的效果最强。NISHIDA等[17]采用定量PCR检测软骨分化相关基因表达和钙离子荧光探针检测Ca2+的流向,发现声强度为60 mW/cm2的LIPUS通过刺激Ca2+内流激活MAPK通路介导CCN2生成从而增强蛋白聚糖和Ⅱ型胶原的表达,而声强度为30 mW/cm2的LIPUS作用低于60 mW/cm2。以上研究提示LIPUS有促进基质合成代谢的效应与超声强度有关。
除声强度外,LIPUS的生物学效应与占空比密切相关。本实验采用3种不同声强度和占空比组合的LIPUS处理培养的软骨细胞和跖骨组织,LIPUSⅠ组为前文描述的临床治疗骨折愈合的参数;LIPUSⅡ组的声强度与LIPUSⅠ组相同,但占空比是其2倍,即一个周期作用时间内的超声波脉冲持续时间更长;LIPUSⅢ组的声强度大于LIPUSⅠ组,但占空比相同;3组LIPUS的其余参数均相同。从声-力能量转换来说,LIPUSⅡ组所产生的机械力比LIPUSⅠ组更持久,LIPUSⅢ组所产生的机械力较LIPUSⅠ组更强。由于高频率的机械应力可能导致细胞死亡,在评估LIPUS的作用时,首先需考虑其对细胞活性的影响。CCK-8细胞活性检测结果提示,LIPUS处理3 d期间,本研究使用的参数对软骨细胞活性均无负面影响,且各LIPUS处理组自处理第2天后细胞活性较对照组显著增加,LIPUSⅡ和Ⅲ组在处理第3天的细胞活性比LIPUSⅠ组更强。TUNEL检测发现LIPUS可降低软骨细胞凋亡,而各处理组之间无统计学差异。WILTINK等[18]对比一系列中等声强度的超声对小鼠跖骨的作用,发现0.77 mW/cm2可促进胚胎期的跖骨软骨细胞增殖,但对其分化没有明显影响。我们的研究显示LIPUS可促进新生小鼠的软骨细胞增殖及ColⅡ和Acan的基因表达水平,且LIPUSⅡ组的效果最为明显,表明LIPUS对软骨细胞的作用与声强度和占空比有关。各LIPUS处理组ColⅩ的表达均下降,提示LIPUS可能无明显促软骨细胞分化成熟的作用。骨培养实验中,经过LIPUSⅡ和Ⅲ组处理后的跖骨的全长增长率和软骨增长率高于对照组,而LIPUSⅠ组与对照组无明显差异,进一步说明LIPUSⅡ和Ⅲ组促软骨细胞增殖效果更明显,对分化成熟的作用不大。
综上所述,三组不同声强度和占空比的LIPUS均可促进体外培养的软骨细胞的活性、增殖以及ColⅡ、Acan的表达,抑制细胞凋亡和ColⅩ的表达,对维持软骨功能活性具有一定的作用。其中声强度30 mW/cm2、占空比40%的LIPUS是三组中的最佳参数。本研究结果可为LIPUS治疗软骨损伤和关节退行性病变提供初步理论依据。
| [1] | COLOMBO V, CADOVÁ M, GALLO L M. Mechanical behavior of bovine nasal cartilage under static and dynamic loading[J]. J Biomech, 2013, 46(13): 2137–2144. DOI:10.1016/j.jbiomech.2013.07.001 |
| [2] | BIAN L M, ZHAI D Y, ZHANG E C, et al. Dynamic compressive loading enhances cartilage matrix synthesis and distribution and suppresses hypertrophy in hMSC-laden hyaluronic acid hydrogels[J]. Tissue Eng Part A, 2012, 18(7/8): 715–724. DOI:10.1089/ten.TEA.2011.0455 |
| [3] | HARRISON A, LIN S, POUNDER N, et al. Mode & mechanism of low intensity pulsed ultrasound (LIPUS) in fracture repair[J]. Ultrasonics, 2016, 70: 45–52. DOI:10.1016/j.ultras.2016.03.016 |
| [4] | YANG K H, PARVIZI J, WANG S J, et al. Exposure to low-intensity ultrasound increases aggrecan gene expression in a rat femur fracture model[J]. J Orthop Res, 1996, 14(5): 802–809. DOI:10.1002/jor.1100140518 |
| [5] | GUO G P, MA Y, GUO Y, et al. Enhanced porosity and permeability of three-dimensional alginate scaffolds via acoustic microstreaming induced by low-intensity pulsed ultrasound[J]. Ultrason Sonochem, 2017, 37: 279–285. DOI:10.1016/j.ultsonch.2017.01.016 |
| [6] | HOSSEINI M S, TAFAZZOLI-SHADPOUR M, HAGHIGHIPOUR N, et al. The synergistic effects of shear stress and cyclic hydrostatic pressure modulate chondrogenic induction of human mesenchymal stem cells[J]. Int J Artif Organs, 2015, 38(10): 557–564. DOI:10.5301/ijao.5000433 |
| [7] | GHARRAVI A M, ORAZIZADEH M, HASHEMITABAR M. Fluid-induced low shear stress improves cartilage like tissue fabrication by encapsulating chondrocytes[J]. Cell Tissue Bank, 2016, 17(1): 117–122. DOI:10.1007/s10561-015-9529-2 |
| [8] | XIE Y L, SU N, JIN M, et al. Intermittent PTH (1-34) injection rescues the retarded skeletal development and postnatal lethality of mice mimicking human achondroplasia and thanatophoric dysplasia[J]. Hum Mol Genet, 2012, 21(18): 3941–3955. DOI:10.1093/hmg/dds181 |
| [9] | GOLDRING M B, TSUCHIMOCHI K, IJIRI K. The control of chondrogenesis[J]. J Cell Biochem, 2006, 97(1): 33–44. DOI:10.1002/jcb.20652 |
| [10] | NOLTE P A, KLEIN-NULEND J, ALBERS G H R, et al. Low-intensity ultrasound stimulates endochondral ossification in vitro[J]. J Orthop Res, 2001, 19(2): 301–307. DOI:10.1016/s0736-0266(00)00027-9 |
| [11] | KORSTJENS C M, VAN DER RIJT R H, ALBERS G H, et al. Low-intensity pulsed ultrasound affects human articular chondrocytes in vitro[J]. Med Biol Eng Comput, 2008, 46(12): 1263–1270. DOI:10.1007/s11517-008-0409-9 |
| [12] | NAITO K, WATARI T, MUTA T, et al. Low-intensity pulsed ultrasound (LIPUS) increases the articular cartilage type Ⅱ collagen in a rat osteoarthritis model[J]. J Orthop Res, 2010, 28(3): 361–369. DOI:10.1002/jor.20995 |
| [13] | ZHANG Z J, HUCKLE J, FRANCOMANO C A, et al. The effects of pulsed low-intensity ultrasound on chondrocyte viability, proliferation, gene expression and matrix production[J]. Ultrasound Med Biol, 2003, 29(11): 1645–1651. DOI:10.1016/j.ultrasmedbio.2003.08.011 |
| [14] | ZAHOOR T, MITCHELL R, BHASIN P, et al. Effect of low-intensity pulsed ultrasound on joint injury and post-traumatic osteoarthritis: An animal study[J]. Ultrasound Med Biol, 2018, 44(1): 234–242. DOI:10.1016/j.ultrasmedbio.2017.09.014 |
| [15] | SUN H B. Mechanical loading, cartilage degradation, and arthritis[J]. Ann N Y Acad Sci, 2010, 1211: 37–50. DOI:10.1111/j.1749-6632.2010.05808.x |
| [16] | TIEN Y C, LIN S D, CHEN C H, et al. Effects of pulsed low-intensity ultrasound on human child chondrocytes[J]. Ultrasound Med Biol, 2008, 34(7): 1174–1181. DOI:10.1016/j.ultrasmedbio.2007.12.019 |
| [17] | NISHIDA T, KUBOTA S, AOYAMA E, et al. Low-intensity pulsed ultrasound (LIPUS) treatment of cultured chondrocytes stimulates production of CCN family protein 2 (CCN2), a protein involved in the regeneration of articular cartilage: mechanism underlying this stimulation[J]. Osteoarthr Cartil, 2017, 25(5): 759–769. DOI:10.1016/j.joca.2016.10.003 |
| [18] | WILTINK A, NIJWEIDE P J, OOSTERBAAN W A, et al. Effect of therapeutic ultrasound on endochondral ossification[J]. Ultrasound Med Biol, 1995, 21(1): 121–127. DOI:10.1016/0301-5629(94)00092-1 |



