2. 400016 重庆,重庆医科大学:基础医学院病原生物学教研室,分子医学与肿瘤研究中心
2. Department of Pathogen Biology, Molecular Medicine and Tumor Research Center, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016, China
干扰素(interferon,IFN)是具有广泛生物学活性的糖蛋白,不仅可抗病毒,也可增强免疫和抗肿瘤[1]。目前干扰素是肝癌和慢性肝炎治疗过程中的常用药物。干扰素家族主要包括Ⅰ型(IFN-α、IFN-β)和Ⅱ型(IFN-γ)。不同IFN在肝癌和慢性肝炎中的作用不甚相同[2]。
IFN可诱导大量干扰素刺激相关基因的表达。这些基因进而发挥调控病毒复制或肿瘤发生、发展的作用[1]。腺苷脱氨酶(adenosine deaminases acting on RNA,ADAR)是其中一种,广泛存在于各种组织中,参与多种生理过程。ADAR1经可变剪切产生两种蛋白(ADAR1 P150和P110)。这两种蛋白在肝脏中含量都较丰富,其中ADAR1 P150可被诱导表达[3]。近来研究表明ADAR1参与常见肿瘤的发生、发展(如肝癌和肺腺癌)[4],同时也调控临床重要病毒的复制,如以肝脏为靶器官的病毒HCV、HDV和以CD4+ T免疫细胞为靶细胞的HIV[3]。IFN也参与肝癌和病毒复制这一过程。因此,本研究观察肝癌细胞中IFN对ADAR1表达水平的影响,以进一步探讨ADAR1介导肝癌发生、发展和病毒复制的意义。
1 材料与方法 1.1 实验材料人肝癌细胞系Huh7和HepG2均为感染性疾病分子生物学教育部重点实验室保存;胎牛血清购自以色列BI公司;青/链霉素及胰酶购自美国Gibco公司;MEM和DMEM购自美国HyClone公司;ADAR1抗体购自英国Abcam公司;GAPDH抗体购自上海碧云天生物技术公司;地高辛抗体标记试剂盒、PCR产物纯化试剂盒均购自德国Roche公司;质粒抽提试剂盒购自德国QIAGEN公司;DNA转染试剂(lipofectamine 3000)购自美国Thermo Fisher公司。引物合成与测序均由上海Invitrogen公司完成。HBV复制质粒pCH9/3091由陆军军医大学第一附属医院全军感染病研究所兰林副研究员惠赠,带有HBV基因组全长1.1倍体序列。
1.2 细胞培养与siRNA转染适量Huh7和HepG2细胞根据需要接种于6孔板或60 mm平板,37 ℃、5% CO2条件下培养,第2天加药或干扰处理。干扰素按照药物终浓度加入相应体积处理适当时间:不同浓度IFN-α(0、200、500、1 000、2 000 U/mL)、IFN-β(0、200、1 000 U/mL)和IFN-γ(0、200、1 000 U/mL)分别处理肝癌细胞(Huh7和HepG2)24 h;1 000 U/mL IFN-α处理肝癌细胞0、2、4、8、16 h。转染步骤严格按照Thermo Fisher公司的说明书操作。采用si-ADAR1(终浓度20 nmol/L)处理Huh7细胞,36 h后转染HBV复制质粒pCH9/3091,转染24 h后加入IFN-α(1 000 IU/mL)处理24 h,以siNC作为对照。根据需要更换培养基,收集细胞,Western blot和RT-qPCR检测肝癌细胞中ADAR1 mRNA和蛋白的表达,Southern blot检测HBV复制中间体水平。
1.3 蛋白质提取与Western blot检测Huh7和HepG2细胞处理后,根据需要提取细胞总蛋白,检测ADAR1表达。具体方法:细胞中加入200 μL RIPA裂解液,4 ℃摇床30 min,离心弃去细胞碎片,BCA法测蛋白浓度,取30 μg蛋白煮沸变性,经10% SDS-PAGE电泳后电转至PVDF膜上,5%脱脂牛奶4℃封闭2 h,兔抗ADAR1抗体(1 :1 000)4 ℃孵育过夜,TBST洗膜3次,每次5 min,再加入二抗羊抗兔(1 :20 000)或羊抗鼠(1 :5 000)IgG抗体室温孵育1 h,TBST洗膜3次,每次5 min,加底物ECL显色。GAPDH作为内参。Image J软件分析目的条带的灰度值。目的条带的相对表达量=目的片段灰度值/内参GAPDH灰度值。
1.4 RNA提取与相对定量RT-qPCR检测采用TRIzol说明书提取干扰素处理后细胞内总RNA,并逆转录成cDNA,根据SYBR Green试剂盒说明书以cDNA为模板检测基因表达。ADAR1上游引物:5′-GCCAAAGACACTCCCTC-3′,下游引物:5′-GAT-TCCCTGTTCCCAAG-3′。GAPDH作为内参,其上游引物为5′-GAAGGTGAAGGTCGGAGTC-3′,下游引物为5′-GAAGATGGTGATGGGATTTC-3′。
1.5 HBV DNA提取与Southern blot检测Huh7细胞先转染HBV复制质粒pCH9/3091,24 h后加IFN-α处理(终浓度分别为0、20、100、1 000和2 000 U/mL),继续培养72 h后,提取核心颗粒内的HBV复制中间体,并进行检测。具体步骤如下:PBS溶液洗涤细胞2次后,加入500 μL细胞裂解液(10 mmol/L Tris-HCl pH=8.0,1 mmol/L EDTA,1% NP-40和2%蔗糖),室温摇床孵育10 min,15 000×g离心5 min弃去细胞碎片。收集上清液至1.5 mL EP管中,加入微管酶(德国Roche公司)37 ℃消化1 h。后加入含1.5 mol/L NaCl的35% PEG 8 000 200 μL冰浴沉淀1 h,12 000×g离心5 min。弃上清后的沉淀中加入500 μL含有终浓度为1 mg/mL的蛋白酶K的消化液(25 mmol/L Tris-HCl pH=8.0,10 mmol/L EDTA,5% SDS和150 mmol/L NaCl)消化过夜。第2天,常规酚氯仿抽提2次,无水乙醇沉淀获得HBV复制中间体,并溶解于Elution缓冲液中。1%琼脂糖凝胶电泳分离HBV复制中间体,碱变性后转膜,紫外交联固定。42 ℃预杂交1 h后杂交过夜。隔天洗膜,37 ℃封闭30 min后地高辛DNA探针杂交30 min。再次洗膜,加底物CSPD显色,采集图片。
1.6 统计学分析采用GraphPad Prism 7.0进行统计学分析。数据以x±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。检验水准:α= 0.05。
2 结果 2.1 Ⅰ型IFN诱导人肝癌细胞中ADAR1表达在人肝癌细胞系Huh7和HepG2细胞中添加不同浓度的Ⅰ型干扰素(IFN-α和IFN-β),24 h后提取蛋白,运用Western blot检测ADAR1的表达。结果显示,在Huh7细胞中,IFN-α可以刺激ADAR1 P110和P150的表达,ADAR1 P110表达明显增加(P<0.05),而ADAR1 P150表达变化更加显著(P<0.01,图 1A)。IFN-β同样也可显著增加ADAR1 P110和P150的表达(P<0.05,图 1B)。IFN-α和IFN-β刺激P150蛋白表达呈现明显的IFN浓度梯度依赖性。HepG2细胞中ADAR1在IFN-α和IFN-β诱导下呈现相似的趋势(图 1C、D)。

|
| A、C:Western blot检测IFN-α处理后Huh7(A)和HepG2(C)细胞中蛋白表达和半定量分析1:未添加IFN-α组;2~5:分别为200、500、1 000、2 000 U/mL IFN-α处理组;a:P<0.05,b:P<0.01,与未添加IFN-α组比较;B、D:Western blot检测IFN-β处理后Huh7(B)和HepG2(D)细胞中蛋白表达和半定量分析1:未添加IFN-β组;2、3:分别为200、1 000 U/mL IFN-β处理组;a:P<0.05,b:P<0.01,与未添加IFN-β组比较 图 1 Ⅰ型IFN影响肝癌细胞中ADAR1蛋白的表达 |
2.2 Ⅱ型干扰素刺激后ADAR1的表达变化
利用Ⅱ型干扰素(IFN-γ)刺激人肝癌Huh7细胞,24 h后分别提取蛋白,Western blot分别检测ADAR1表达水平。实验结果显示IFN-γ处理前后ADAR1 P110和P150蛋白水平无明显变化(图 2),ADAR1 mRNA水平呈现相似趋势。结果显示ADAR1 P110和P150表达受IFN-γ的影响较小。

|
| A、B:Western blot检测蛋白表达与半定量分析;C:RT-qPCR检测结果 1:未添加IFN-γ组;2:200 U/mL IFN-γ处理组;3:1 000 U/mL IFN-γ处理组 图 2 Ⅱ型IFN对Huh7细胞中ADAR1表达的影响 |
2.3 IFN-α诱导肝癌细胞中ADAR1的表达
Huh7和HepG2细胞铺板后,1 000 U/mL的IFN-α处理后,在不同时间取蛋白行Western blot检测。结果显示,经IFN-α处理8 h,细胞中ADAR1明显增加,ADAR1 P150蛋白水平增加明显(图 3)。因此,IFN-α诱导ADAR1 P150表达,具有时间依赖性。
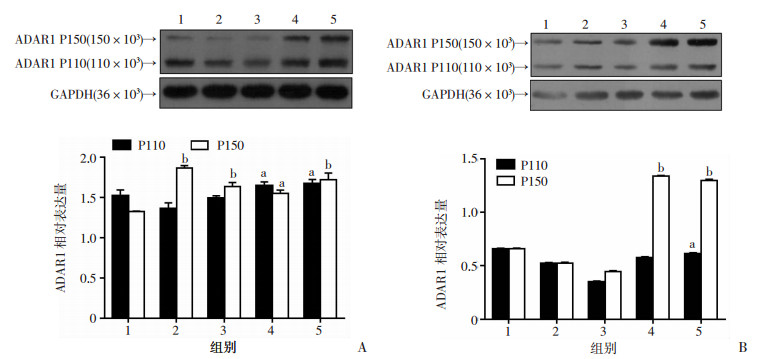
|
|
A:Western blot检测Huh7细胞蛋白表达与半定量分析;B:Western blot检测HepG2细胞中蛋白表达与半定量分析 1:未添加IFN-α组;2~4:分别为1 000 U/mL IFN-α处理2、4、8、16 h组;a:P<0.05,b:P<0.01,与未添加IFN-α组比较 图 3 IFN-α刺激人肝癌细胞中ADAR1表达具有时间依赖性 |
2.4 IFN-α抑制Huh7细胞中HBV复制
HBV复制质粒pCH9/3091瞬时转染Huh7细胞,转染后24 h采用不同浓度IFN-α处理细胞。Southern blot检测HBV复制中间体水平,ELISA法检测HBsAg水平。结果显示,HBV DNA的复制水平随着IFN-α浓度的增加而降低,与药物浓度呈负相关(图 4)。
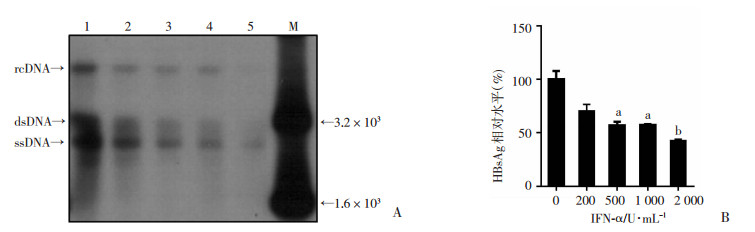
|
| A:Southern blot检测HBV复制中间体 1:未添加IFN-α组;2~5:分别为200、500、1 000、2 000 U/mL IFN-α处理组;M:核酸分子量标准;B:ELISA检测HBsAg水平 a:P<0.05,b:P<0.01,与未添加IFN-α组比较 图 4 IFN-α抑制Huh7细胞中HBV复制,并呈剂量依赖性 |
2.5 ADAR1参与Huh7细胞中IFN-α对HBV复制抑制作用
为探讨ADAR1是否参与调控IFN-α对HBV复制抑制作用,利用siADAR1降低Huh7细胞中ADAR1表达(图 5),36 h后转染HBV复制质粒pCH9/3091,24 h后加入IFN-α(1 000 U/mL)处理24 h,收集细胞,Western blot检测ADAR1蛋白水平,Southern blot检测HBV复制中间体水平。结果显示在IFN-α处理前,siADAR1组HBV复制中间体水平下降至siNC对照组的41%;而IFN-α处理后,siADAR1组HBV复制中间体水平下降至siNC对照组的29%,差异均有统计学意义(P<0.05)。表明ADAR1参与了IFN-α的抗HBV作用。
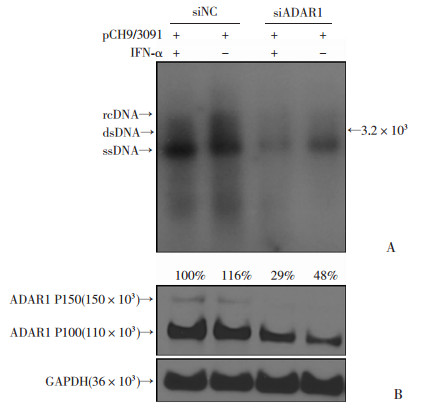
|
| A:Southern blot检测HBV DNA水平;B:Western blot检测Huh7中ADAR1的表达 图 5 ADAR1参与了IFN-α抗HBV能力 |
3 讨论
乙型肝炎病毒严重危害人类健康。目前核苷类似物和IFN是临床治疗慢性乙型肝炎的常用药物[2]。IFN可经调节机体免疫反应和诱导细胞表达多种抗病毒蛋白进而影响病毒复制[1]。虽然如此,但目前IFN抗HBV复制的具体机制并未完全阐明。ADAR1是一种RNA依赖的腺苷脱氨酶,可经IFN诱导表达[3]。近来研究表明,细胞内ADAR1可以调控IFN的产生,同时也可以介导IFN的抗病毒作用[5-6]。基于此,本实验初步探讨了肝癌细胞中IFN诱导ADAR1产生情况,继而探讨了细胞内ADAR1介导IFN的抗HBV作用。结果显示,肝癌细胞Huh7和HepG2中ADAR1 P150为诱导表达,且只经Ⅰ型IFN诱导, ADAR1 P110受IFN影响相对较小;IFN-α抑制Huh7细胞中HBV复制,ADAR1参与了这一抑制作用。
IFN抗HBV的作用机制复杂。IFN-α抗病毒作用与HBV基因型、HBV遗传变异和宿主免疫状况密切相关[7]。此外,IFN激活Jak-STAT信号通路诱导产生的干扰素刺激表达基因(ISGs)在介导IFN抗HBV复制中发挥重要作用。ISGs可直接抑制HBV复制从而加强IFN抗病毒效果,如RIG-I[8]、BST[9-10]、ISG20[11-12]、TRIM25[13]、APOBECs[14-15]、SAMHD1[16-17];同时,有些ISGs低表达能抑制HBV复制,而高水平表达促进HBV复制[18-19]。由于受到IFN素诱导表达,一些ISGs会反馈性的调控IFN抗病毒作用。如SOCS3激活会抑制病毒蛋白表达和IFN信号通路激活[20];抑制IFN-α对泛素特异性蛋白酶18(USP18)和热休克蛋白gp96上调作用会增强IFN-α抗HBV的能力[18, 21]。IFN诱导的ISGs调控HBV复制的矛盾性和介导IFN-α作用的复杂性可能与临床上HBV持续感染和IFN-α治疗不应答的现象相关。已有研究证实,外周血和肝脏标本中ISGs的动态变化与干扰素的治疗疗效强相关[22-23]。这些相关性研究有助于预测干扰素治疗的疗效。因此,阐明ISGs参与HBV复制和IFN-α抗病毒作用有积极的临床意义。
ADAR1是多功能的蛋白,可经RNA编辑酶依赖或非依赖方式进而调控天然免疫和病毒复制[3]。ADAR1也可经抑制PKR等IFN调节基因表达或活性抑制Ⅰ型IFN的产生,进一步抑制丙型肝炎病毒[3]和麻疹病毒[5]的复制。临床研究表明,ADAR1基因的多态性可能与临床HBsAg清除有关[24]。最近研究证实ADAR1经过RNA编辑作用调控HBV复制[25]。但关于肝癌细胞中ADAR1表达,及其介导的IFN抗HBV复制作用少见报道。本研究揭示IFN刺激肝癌细胞中ADAR1表达,并发现干扰ADAR1增强Huh7细胞中IFN-α的抗HBV作用。研究表明IFN-α促进ADAR1的泛素化降解,进而削弱其对抗病毒信号的抑制作用,从而增强IFN-α抗病毒效果[26]。ADAR1参与IFN-α的抗HBV作用是否有泛素化等因素的参与有待进一步研究。
| [1] | SCHNEIDER W M, CHEVILLOTTE M D, RICE C M. Interferon-stimulated genes: a complex web of host defenses[J]. Annu Rev Immunol, 2014, 32: 513–545. DOI:10.1146/annurev-immunol-032713-120231 |
| [2] | TRÉPO C, CHAN H L, LOK A. Hepatitis B virus infection[J]. Lancet, 2014, 384(9959): 2053–2063. DOI:10.1016/s0140-6736(14)60220-8 |
| [3] | SAMUEL C E. Adenosine deaminases acting on RNA (ADARs) are both antiviral and proviral[J]. Virology, 2011, 411(2): 180–193. DOI:10.1016/j.virol.2010.12.004 |
| [4] | CHAN T H, LIN C H, QI L, et al. A disrupted RNA editing balance mediated by ADARs (Adenosine Deaminases that act on RNA) in human hepatocellular carcinoma[J]. Gut, 2014, 63(5): 832–843. DOI:10.1136/gutjnl-2012-304037 |
| [5] | LI Z, OKONSKI K M, SAMUEL C E. Adenosine deaminase acting on RNA 1 (ADAR1) suppresses the induction of interferon by measles virus[J]. J Virol, 2012, 86(7): 3787–3794. DOI:10.1128/JVI.06307-11 |
| [6] | LI Z, WOLFF K C, SAMUEL C E. RNA adenosine deaminase ADAR1 deficiency leads to increased activation of protein kinase PKR and reduced vesicular stomatitis virus growth following interferon treatment[J]. Virology, 2010, 396(2): 316–322. DOI:10.1016/j.virol.2009.10.026 |
| [7] | CROAGH C M, DESMOND P V, BELL S J. Genotypes and viral variants in chronic hepatitis B: A review of epidemiology and clinical relevance[J]. World J Hepatol, 2015, 7(3): 289–303. DOI:10.4254/wjh.v7.i3.289 |
| [8] | SATO S, LI K, KAMEYAMA T, et al. The RNA sensor RIG-I dually functions as an innate sensor and direct antiviral factor for hepatitis B virus[J]. Immunity, 2015, 42(1): 123–132. DOI:10.1016/j.immuni.2014.12.016 |
| [9] | LV M, ZHANG B, SHI Y, et al. Identification of BST-2/tetherin-induced hepatitis B virus restriction and hepatocyte-specific BST-2 inactivation[J]. Sci Rep, 2015, 5: 11736. DOI:10.1038/srep11736 |
| [10] | YAN R, ZHAO X, CAI D, et al. The interferon-inducible protein tetherin inhibits hepatitis B virus virion secretion[J]. J Virol, 2015, 89(18): 9200–9212. DOI:10.1128/JVI.00933-15 |
| [11] | LEONG C R, FUNAMI K, OSHIUMI H, et al. Interferon-stimulated gene of 20 kDa protein (ISG20) degrades RNA of hepatitis B virus to impede the replication of HBV in vitro and in vivo[J]. Oncotarget, 2016, 7(42): 68179–68193. DOI:10.18632/oncotarget.11907 |
| [12] | LIU Y, NIE H, MAO R, et al. Interferon-inducible ribonuclease ISG20 inhibits hepatitis B virus replication through directly binding to the epsilon stem-loop structure of viral RNA[J]. PLoS Pathog, 2017, 13(4): e1006296. DOI:10.1371/journal.ppat.1006296 |
| [13] | TAN G, XIAO Q, SONG H, et al. Type I IFN augments IL-27-dependent TRIM25 expression to inhibit HBV replication[J]. Cell Mol Immunol, 2018, 15(3): 272–281. DOI:10.1038/cmi.2016.67 |
| [14] | CHEN Y, HU J, CAI X, et al. APOBEC3B edits HBV DNA and inhibits HBV replication during reverse transcription[J]. Antiviral Res, 2018, 149: 16–25. DOI:10.1016/j.antiviral.2017.11.006 |
| [15] | BONVIN M, ACHERMANN F, GREEVE I, et al. Interferon-inducible expression of APOBEC3 editing enzymes in human hepatocytes and inhibition of hepatitis B virus replication[J]. Hepatology, 2006, 43(6): 1364–1374. DOI:10.1002/hep.21187 |
| [16] | HU J, QIAO M, CHEN Y, et al. Cyclin E2-CDK2 mediate SAMHD1 phosphorylation to abrogate its restriction of HBV replication in hepatoma cells[J]. FEBS Lett, 2018, 592(11): 1893–1904. DOI:10.1002/1873-3468.13105 |
| [17] | JEONG G U, PARK I H, AHN K, et al. Inhibition of hepatitis B virus replication by a dNTPase-dependent function of the host restriction factor SAMHD1[J]. Virology, 2016, 495: 71–78. DOI:10.1016/j.virol.2016.05.001 |
| [18] | LI L, LEI Q S, ZHANG S J, et al. suppression of USP18 potentiates the anti-HBV activity of interferon alpha in HepG2.2.15 cells via JAK/STAT signaling[J]. PLoS ONE, 2016, 11(5): e0156496. DOI:10.1371/journal.pone.0156496 |
| [19] | LI Y, LI S, DUAN X, et al. Interferon-stimulated gene 15 conjugation stimulates hepatitis B virus production independent of type Ⅰ interferon signaling pathway in vitro[J]. Mediators Inflamm, 2016, 2016: 7417648. DOI:10.1155/2016/7417648 |
| [20] | KOEBERLEIN B, ZUR HAUSEN A, BEKTAS N, et al. Hepatitis B virus overexpresses suppressor of cytokine signaling-3 (SOCS3) thereby contributing to severity of inflammation in the liver[J]. Virus Res, 2010, 148(1/2): 51–59. DOI:10.1016/j.virusres.2009.12.003 |
| [21] |
郜衍周, 范红霞, 邱立鹏, 等. IFN-α对gp96的上调降低其抗HBV的效率[J].
微生物学报, 2013, 53(8): 867–874.
HAO Y Z, FAN H X, QIU L P. et al IFN-α-induced gp96 upregulation negatively affects the anti-HBV efficiency of IFN-α[J]. Acta Microbiol Sinica, 2013, 53(8): 867–874. |
| [22] | XIAO C, QIN B, CHEN L, et al. Preactivation of the interferon signalling in liver is correlated with nonresponse to interferon alpha therapy in patients chronically infected with hepatitis B virus[J]. J Viral Hepat, 2012, 19(2): e1–e10. DOI:10.1111/j.1365-2893.2011.01471.x |
| [23] | HAN M, LI Y, WU W, et al. Altered expression of interferon-stimulated genes is strongly associated with therapeutic outcomes in hepatitis B virus infection[J]. Antiviral Res, 2017, 147: 75–85. DOI:10.1016/j.antiviral.2017.10.003 |
| [24] | WU X, SHI W, WU J, et al. A functional polymorphism in ADAR 1 gene affects HBsAg seroclearance both spontaneously and interferon induced[J]. Liver Int, 2014, 34(10): 1560–1565. DOI:10.1111/liv.12444 |
| [25] |
李京源, 李涛, 朱席琳, 等. ADAR1通过RNA编辑上调ZNF655表达并促进人肝癌细胞系HepG2中HBV复制[J].
基础医学与临床, 2018, 38(3): 312–316.
LI J Y, LI T, ZHU X L, et al. ADAR1 up-regulates ZNF655 expression via RNA editing and enhances HBV replication in HepG2 cell line[J]. Basic Clin Med, 2018, 38(3): 312–316. DOI:10.16352/j.issn.1001-6325.2018.03.006 |
| [26] | LI L, QIAN G, ZUO Y, et al. Ubiquitin-dependent turnover of adar1 is required for efficient antiviral activity of type Ⅰ interferon[J]. J Biol Chem, 2016, 291(48): 24974–24985. DOI:10.1074/jbc.M116.737098 |



