2. 550004 贵阳,贵州医科大学:组织工程与干细胞中心,中国医学科学院成体干细胞转化研究重点实验室;
3. 563006 贵州 遵义,遵义医科大学儿科学教研室
2. Tissue Engineering and Stem Cell Center, Guizhou Medical University, Key Laboratory of Adult Stem Cell Transformation Research of Chinese Academy of Medical Sciences, Guiyang, Guizhou Province, 550004;
3. Department of Pediatrics, Zunyi Medical University, Zunyi, Guizhou Province, 563006, China
1-萘酚(1-naphthol, 1-NAP)作为芳香族化合物的衍生物,是萘类似物中最重要的污染物之一,广泛用于生产各种工业材料,如染料、塑料、药品和橡胶等,它可以通过排放工业废水等释放到环境中,因其急性毒性对生态系统构成威胁[1],特别是在发展中国家[2]。因其巨大潜力的环境毒性、致突变性和致癌性,已被美国环境保护署(EPA)和欧盟列为优先污染物[3]。研究表明1-NAP具有遗传毒性,能降低人体睾酮水平,影响血液循环,损害肝脏和肾脏[4]。研究表明继发于使用染发剂的过敏性接触性皮炎的病例,归因于其对1-萘酚的接触性过敏[5]。目前,每年产生约4万吨1-NAP,以满足生产除草剂、杀虫剂、药物和染料前体的需要[6]。因而,进行1-NAP的毒性研究具有重要的社会价值和现实意义。斑马鱼被广泛用于研究胚胎发育、毒理学、遗传学和人类疾病[7-8]。斑马鱼胚胎透明,便于显微镜下观察胚胎发育的整个过程,产胚量大,生长发育快,成本低,利于大规模筛选化学毒性药物。目前国内外关于1-NAP对胚胎发育的毒性及机制的研究还比较缺乏, 而1-萘酚诱导的氧化应激与胚胎发育之间的关系还有待进行探讨。因此,本研究初步分析了1-萘酚胚胎期暴露对斑马鱼发育的毒性作用,揭示了1-NAP诱导的氧化应激与胚胎发育毒性密切相关。
1 材料与方法 1.1 实验动物Tubingen系野生型斑马鱼成鱼由贵州医科大学组织工程与干细胞实验中心实验室繁育。
1.2 材料1-萘酚纯度为99.0%购自索莱宝公司;N-乙酰半胱氨酸(NAC)购自美国Sigma公司;过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、总巯基(-SH)、还原型谷胱甘肽(GSH)、丙二醛(MDA)、活性氧(ROS)检测试剂盒均为南京建成生物工程研究所;凋亡蛋白Caspase3、Bax抗体均购自Abcam公司,其他试剂均为国产分析纯。
1.3 方法 1.3.1 鱼卵的收集成年斑马鱼,水温(28.5±0.3)℃,pH为7.0~7.5,光周期为14 h/10 h(光照/黑暗),每日喂2次活丰年虾。在收集胚胎的前1 d晚,按雌雄比例1 :2或1 :1放进交配缸里,用隔板将其隔开,第2天光照30 min后移去隔板,观察产卵时间,收集斑马鱼受精的鱼卵,放入胚胎培养液中,并置于28.5~30 ℃生化培养箱中养育孵化。
1.3.2 1-NAP暴露浓度梯度显微镜下挑选受精后24 h(hours post tertilization, hpf)同时相发育的斑马鱼胚胎置于6孔板中,加入含不同浓度(0、40、80、160、200 μmol/L)1-萘酚的胚胎培养液,每浓度设胚胎30枚,重复3次。每24小时更换1次药液,并且在显微镜下观察胚胎发育状况,统计1次胚胎死亡数、孵化数及畸形数,直至120 hpf,记录分析胚胎暴露在各个浓度的死亡率、孵化率和畸形率,计算半数致死浓度,具体相关斑马鱼发育毒性分析方法参考相关文献[9]。
1.3.3 NAC干预实验收集24 hpf胚胎,设置空白对照组(胚胎培养液)、NAC(0.5 mmol/L)处理组、1-NAP(50 μmol/L)处理组(经反复试验选择该浓度可以导致明显的发育毒性表型,同时在该浓度试验暴露时间内不会导致胚胎死亡,保证试验组胚胎数目的统一,便于进行统计学分析,也便于使用NAC进行干预)、NAC预处理组(用含有0.5 mmol/L NAC的胚胎培养液预处理后1 h后,再用含有50 μmol/L浓度1-NAP胚胎培养液处理),每处理组设胚胎60枚。处理至96 hpf,显微镜下观察斑马鱼胚胎发育状况,并采集图像保存分析,记录分析胚胎和/或幼鱼畸形率的变化。
1.3.4 ROS水平测定按1.3.3方法处理24 hpf胚胎至96 hpf,每处理组选取60枚胚胎,转移到离心管中,1×PBS清洗胚胎3次后,用研磨棒把幼鱼研磨成组织匀浆,加入500 μL胰酶,37 ℃恒温水浴消化30 min,终止消化后1 000×g离心10 min去上清,并用PBS洗1~2次,重悬制备单细胞悬液,并加入DCFH-DA,探针总体稀释倍数为1 :750,37 ℃恒温水浴孵育细胞60 min,取200 μL上清加入96孔酶标板,于酶标仪中测定荧光强度(激发波长485 nm,发射波长525 nm)。
1.3.5 MDA含量测定按1.3.3方法处理24 hpf胚胎至96 hpf,每处理组取胚胎60枚,转移到离心管中,以1×PBS洗涤胚胎3次,吸干表面液体,准确称取斑马鱼组织质量,按质量(g) :体积(mL)=1 :9的比例加入9倍的生理盐水,冰水浴条件下制备成10%的斑马鱼组织匀浆,4 000 r/min,离心10 min,取上清,按试剂盒说明TBA比色法测定胚胎脂质过氧化水平。
1.3.6 SOD、CAT活性以及GSH、-SH含量的测定按1.3.3方法处理24 hpf胚胎至96 hpf,每处理组取胚胎60枚,按1.3.5方法制备10%的斑马鱼组织匀浆,2 500 r/min,离心10 min,取上清,参照试剂盒说明WST-1法测定SOD活性,可见光法测定CAT活性,DTNB比色法测定GSH水平,微量酶标法测定-SH含量。
1.3.7 Western blot检测凋亡蛋白Caspase3、Bax的表达按1.3.3方法处理24 hpf胚胎至96 hpf,每处理组取60枚胚胎,转移到离心管中,以1×PBS洗涤胚胎3次,吸干表面液体,准确称取斑马鱼组织质量,根据全蛋白提取试剂盒(索莱宝)说明方法,配置组织裂解液,每处理组加入200 μL裂解液,冰上研磨至没有明显的组织块,4 ℃、12 000×g离心30 min,取上清至新的离心管中,对蛋白进行定量或变性,加样、电泳,转膜,封闭,孵育一抗(Caspase3、Bax稀释度均为1 :5 000)、二抗(稀释度1 :2000),洗膜,曝光。
1.4 统计学分析实验均重复3次。实验数据以x±s表示,组间统计学的差异通过GraphPad Prism 5软件的单因素方差分析。Western blot实验得到的结果用Image Lab软件进行分析。检验水准:α=0.05。
2 结果 2.1 1-NAP暴露对斑马鱼胚胎发育的毒性效应随着药物暴露浓度、时间的增加,胚胎死亡率逐渐增加(图 1),说明了1-NAP对斑马鱼胚胎的发育毒性具有明显的浓度和时间依赖性。48 hpf时,与对照组相比,40 μmol浓度暴露组没有变化,而其他浓度暴露组斑马鱼胚胎的死亡率有所增加;72 hpf时,160、200 μmol/L浓度暴露组斑马鱼胚胎死亡率明显增加(P<0.001),至120 hpf时,200 μmol/L组胚胎死亡率了达到83.3%。根据各时间点的死亡率进行统计分析,采用线性回归分析法计算出1-NAP的半数抑制浓度IC50为111.31 μmol/L。
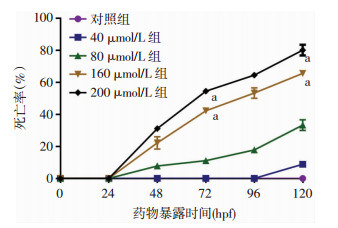
|
| a:P<0.001,与对照组比较 图 1 暴露于不同浓度1-NAP的斑马鱼胚胎及幼鱼死亡率分析 |
2.2 1-NAP对斑马鱼胚胎孵化率的影响
48 hpf时,与对照组相比,随着药物暴露浓度的增加,其他各浓度组胚胎孵化率有所降低;72 hpf时,当药物浓度大于80 μmol/L时孵化率显著下降(P<0.001),当药物浓度为200 μmol/L时孵化率仅为33.3%,表明1-NAP药物暴露浓度、时间的增加对斑马鱼胚胎的发育以及孵化有一定的抑制作用(图 2)。
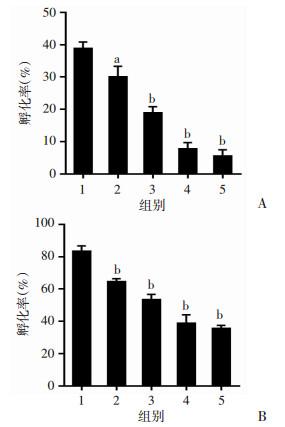
|
| A:48 hpf;B:72 hpf 1:对照组(0 μmol/L);2:40 μmol/L组;3:80 μmol/L组;4:160 μmol/L组;5:200 μmol/L组;a: P<0.01, b: P<0.001,与对照组比较 图 2 暴露于不同浓度1-NAP的斑马鱼胚胎孵化率分析 |
2.3 1-NAP对斑马鱼胚胎畸形率的影响
与对照组相比,随着药物浓度的增加,幼鱼的畸形率明显增加,差异有统计学意义(P<0.001),表明1-NAP暴露对斑马鱼发育毒性作用很显著,当药物浓度为200 μmol/L时,幼鱼的畸形率高达94.4%,见图 3。
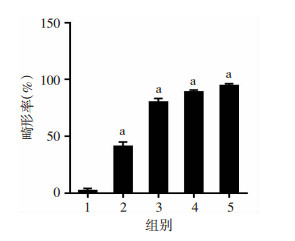
|
| 1:对照组(0 μmol/L);2:40 μmol/L组;3:80 μmol/L组;4:160 μmol/L组;5:200 μmol/L组;a:P<0.001,与对照组比较 图 3 暴露于不同浓度1-NAP的斑马鱼幼鱼畸形率分析 |
2.4 抗氧化剂NAC对1-NAP暴露导致的发育毒性的保护作用
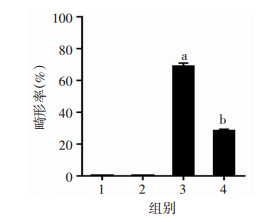
与对照组比较,0.5 mmol/L浓度NAC单独处理组胚胎的畸形率无变化,50 μmol/L浓度的1-NAP单独处理斑马鱼幼鱼心包、卵黄囊明显肿大,脊柱弯曲(图 4),畸形率显著增加(P<0.001),采用0.5 mmol/L浓度NAC预处理组斑马鱼胚胎,与单独50 μmol/L浓度1-NAP处理组相比,胚胎畸形率明显降低(P<0.001, 图 5)。表明NAC对1-NAP所致的斑马鱼胚胎发育毒性有一定保护作用。
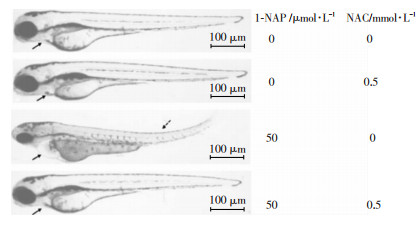
|
| ↗:示心包、卵黄囊明显肿大;↙:示脊柱弯曲 图 4 显微镜下观察96 hpf时各处理组野生型斑马鱼发育表型 |
|
| 1:对照组(0 μmol/L);2:0.5 mmol/L NAC处理组;3:50 μmol/L 1-NAP处理组;4:NAC预处理组(0.5 mmol/L NAC+50 μmol/L 1-NAP);a:P<0.001,与对照组比较;b:P<0.001, 与50 μmol/L 1-NAP处理组比较 图 5 96 hpf时各处理组野生型斑马鱼畸形率分析 |
2.5 1-NAP暴露导致斑马鱼胚胎发生氧化应激损伤
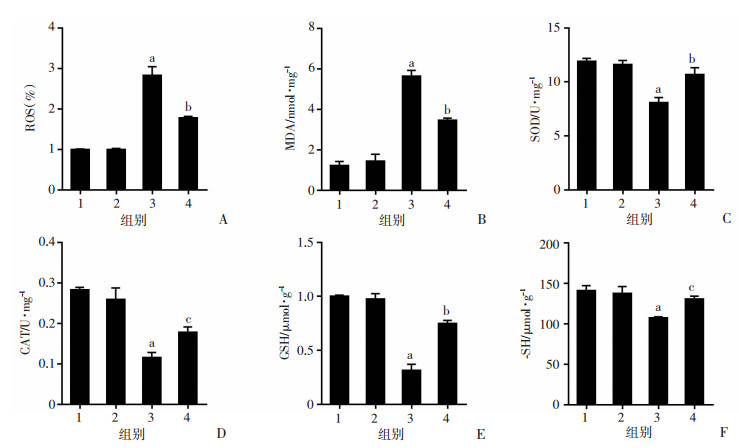
与对照组相比,50 μmol/L浓度的1-NAP处理组斑马鱼胚胎ROS(图 6A)、MDA(图 6B)水平明显增高(P<0.001),SOD(图 6C)、CAT(图 6D)活性水平及GSH(图 6E)、-SH(图 6F)含量明显降低(P<0.001),表明1-NAP暴露导致斑马鱼胚胎发生了严重的氧化应激损伤。采用0.5 mmol/L浓度NAC预处理组,与单独1-NAP处理组相比,胚胎组织中ROS和MDA水平明显降低(P<0.001),而SOD(P<0.001)、CAT活性水平(P<0.01)及GSH(P<0.001)、-SH(P<0.01)含量明显有所恢复,表明NAC对1-NAP所致斑马鱼胚胎氧化应激损伤有一定保护作用。
|
| A:ROS;B:MDA;C:SOD;D:CAT;E:GSH;F:-SH 1:对照组(0 μmol/L);2:0.5 mmol/L NAC处理组;3:50 μmol/L 1-NAP处理组;4:NAC预处理组(0.5 mmol/L NAC+50 μmol/L 1-NAP);a: P<0.001,与对照组比较;b: P<0.001,c: P<0.01;与50 μmol/L 1-NAP处理组比较 图 6 1-NAP暴露对斑马鱼胚胎氧化应激状态的影响 |
2.6 1-NAP暴露对斑马鱼胚胎凋亡蛋白的影响
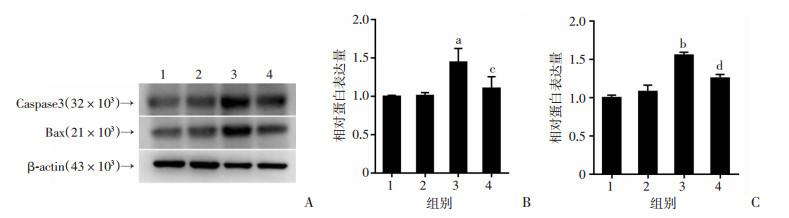
与对照组相比,50 μmol/L浓度的1-NAP处理组斑马鱼胚胎,胚胎凋亡蛋白Caspase3的表达量明显增加(P<0.01),Bax的表达量也显著增加(P<0.001,图 7),而0.5 mmol/L浓度NAC预处理组斑马鱼胚胎与单独1-NAP处理组相比,胚胎凋亡蛋白Caspase3的表达量有所下降(P<0.05),Bax的表达量明显下降(P<0.001)。表明1-NAP药物暴露导致斑马鱼胚胎细胞的凋亡增加,而NAC对1-NAP所致斑马鱼胚胎细胞的凋亡有保护作用。
|
| A: Western blot检测结果;B~C:Caspase3、Bax的半定量分析 1:对照组(0 μmol/L);2:0.5 mmol/L NAC处理组;3:50 μmol/L 1-NAP处理组;4:NAC预处理组(0.5 mmol/L NAC+50 μmol/L 1-NAP);a: P<0.01,b: P<0.001,与对照组比较;c: P<0.05,d: P<0.001,与50 μmol/L 1-NAP处理组比较 图 7 Western blot检测1-NAP暴露对斑马鱼胚胎凋亡蛋白表达的影响 |
3 讨论
正常情况下,组织细胞产生的ROS维持在生理水平。当遭受外源刺激时,产生大量的ROS[10],机体通过改变细胞内SOD、CAT、GSH等抗氧化酶的活性进行调节,以提高机体清除ROS的能力,减少氧化损害,当机体抗氧化酶的活性受损时,大量的ROS不能及时清除, 导致分子(脂质、DNA、蛋白质)的氧化和细胞的死亡[11]。据文献[12-14]报道,ROS的增加导致细胞凋亡,而Caspase3是细胞凋亡过程中最主要的终末剪切酶,Bax是线粒体凋亡途径中一种关键蛋白,两者在促进凋亡的过程中发挥着重要的作用。而NAC作为谷胱甘肽前体能促进还原型谷胱甘肽的合成,在大量的自由基对细胞造成伤害之前对其进行中和,恢复细胞的抗氧化能力[15], 研究表明用NAC预处理可以清除过量的ROS并阻止体细胞的凋亡[16]。
本研究发现,斑马鱼胚胎暴露于不同浓度1-NAP后,胚胎的死亡率、畸形率明显升高,胚胎孵化延迟,心包肿大、卵黄囊吸收延迟,脊柱弯曲,并且具有浓度和时间依赖性。卵黄囊在早期发育阶段起着重要作用,而不同程度毒物的积累,乙酰胆碱酯酶活性的抑制和神经肌肉协调的缺乏可导致脊柱弯曲[17], 这说明了1-NAP暴露在斑马鱼体内不断地累积后对其造成了一定的发育毒性。
进一步研究表明,1-NAP暴露可致斑马鱼胚胎ROS水平以及氧化损伤产物MDA的含量增加,抗氧化酶SOD、CAT的活性受到明显的抑制,GSH、-SH的含量明显降低,胚胎凋亡蛋白Caspase3、Bax的表达量明显增加。氧化应激的有害影响包括脂质过氧化、谷胱甘肽储存的消耗、细胞死亡和蛋白质损伤[18]。细胞凋亡是细胞死亡的正常生理过程,可能由生理刺激引发,还可能由环境毒物引发[19]。SOD、CAT、GSH是机体已知的重要的抗氧化酶,MDA是一种主要的氧化产物,已被用于监测和评估因接触药物而引起的氧化损伤[20]。活性巯基(-SH)具有维持蛋白质和细胞膜完整性的作用,它作为还原反应的重要基团,对于维持机体内重要抗氧化酶GSH的还原状态起到非常重要的作用。这说明了1-NAP的暴露导致斑马鱼体内产生大量的ROS,由于主要抗氧化酶活性的抑制以及还原性谷胱甘肽的减少,无法及时对大量的ROS进行代谢,从而发生氧化应激损伤,-SH含量的减少,无法维持蛋白质和细胞膜的完整性,造成了细胞的死亡和蛋白质的损伤,从而对斑马鱼胚胎的正常发育造成一定的影响。
本研究发现,与1-NAP单独处理组相比,NAC预处理组斑马鱼幼鱼畸形率明显降低,并且活性氧水平和MDA含量明显降低,抗氧化酶SOD、CAT的活性以及GSH、-SH含量明显有所恢复,凋亡蛋白Caspase3、Bax的表达量明显降低。这说明了抗氧化剂NAC可以有效保护1-NAP暴露造成斑马鱼胚胎的氧化应激损伤和发育毒性,并且能减轻1-NAP暴露导致的胚胎细胞凋亡,更进一步证明了1-NAP暴露对斑马鱼胚胎的发育毒性作用与氧化应激损伤密切相关。既往的研究中把1-NAP作为促氧化剂暴露于野生型的斑马鱼检测到ROS呈剂量反应性的增加[21];并且有研究用1-NAP作为促氧化剂诱导G6PD缺乏模型斑马鱼红细胞溶血[22]。虽然1-NAP作为促氧化剂广泛用于研究一些疾病动物模型,但是将1-NAP诱导的氧化应激作为评估其导致发育毒性的作用模式还很少见,目前关于1-NAP暴露诱导的发育毒性的研究还少见报道,而本研究对于1-NAP暴露导致的氧化应激损伤对发育造成的影响以及两者之间的关系进行了初步的探讨,这为进一步的研究其他可能相关的机制奠定了基础,同时也为临床干预和治疗提供了相关的依据。但是本研究主要是局限在氧化应激损伤介导这方面,而其他与发育毒性相关的机制还有待更深入的研究。
| [1] | YAN X L, HU X Y, CHEN T, et al. Adsorptive removal of 1-naphthol from water with Zeolitic imidazolate framework-67[J]. J Phys Chem Solid, 2017, 107: 50–54. DOI:10.1016/j.jpcs.2017.03.024 |
| [2] | YANG X Z, ZHANG Y Z, WANG L P, et al. Preparation of a thermally modified diatomite and a removal mechanism for 1-naphthol from solution[J]. Water, 2017, 9(9): 651. DOI:10.3390/w9090651 |
| [3] | HU W Y, MIN X B, LI X Y, et al. Enhanced degradation of 1-naphthol in landfill leachate using Arthrobacter sp[J]. Environ Technol, 2019, 40(7): 835–842. DOI:10.1080/09593330.2017.1408695 |
| [4] | QIANG Y, WANG W F, DHODARY B, et al. Zeolitic imidazolate framework 8 (ZIF-8) reinforced macroporous resin D101 for selective solid-phase extraction of 1-naphthol and 2-naphthol from phenol compounds[J]. Electrophoresis, 2017, 38(13/14): 1685–1692. DOI:10.1002/elps.201600569 |
| [5] | ZHENG H L, GAO Y, ZHU K R, et al. Investigation of the adsorption mechanisms of Pb(Ⅱ) and 1-naphthol by β-cyclodextrin modified graphene oxide nanosheets from aqueous solution[J]. J Colloid Interface Sci, 2018, 530: 154–162. DOI:10.1016/j.jcis.2018.06.083 |
| [6] | MOLINA-ESPEJA P, CAÑELLAS M, PLOU F J, et al. Synthesis of 1-naphthol by a natural peroxygenase engineered by directed evolution[J]. Chembiochem, 2016, 17(4): 341–349. DOI:10.1002/cbic.201500493 |
| [7] | WANG C, YANG X, ZHENG Q, et al. Halobenzoquinone-induced developmental toxicity, oxidative stress, and apoptosis in zebrafish embryos[J]. Environ Sci Technol, 2018, 52(18): 10590–10598. DOI:10.1021/acs.est.8b02831 |
| [8] | MU X Y, SHEN G M, HUANG Y, et al. The enantioselective toxicity and oxidative stress of beta-cypermethrin on zebrafish[J]. Environ Pollut, 2017, 229: 312–320. DOI:10.1016/j.envpol.2017.05.088 |
| [9] |
胡荣英, 孙琮杰, 金璐, 等. 长春碱增加班马鱼肿瘤耐药基因abcb4的表达[J].
基础医学与临床, 2017, 37(6): 758–762.
HU R Y, SUN C J, JIN L, et al. Vinblastine enhances the expression of tumor resistance gene abcb4 in zebrafish[J]. Basic Clin Med, 2017, 37(6): 758–762. DOI:10.16352/j.issn.1001-6325.2017.06.003 |
| [10] | MUGONI V, CAMPOREALE A, SANTORO M M. Analysis of oxidative stress in zebrafish embryos[J]. J Vis Exp, 2014(89). DOI:10.3791/51328 |
| [11] | FÉLIX L M, VIDAL A M, SERAFIM C, et al. Ketamine induction of p53-dependent apoptosis and oxidative stress in zebrafish (Danio rerio) embryos[J]. Chemosphere, 2018, 201: 730–739. DOI:10.1016/j.chemosphere.2018.03.049 |
| [12] | WANG Z K, LI G Y, WU Q, et al. Microcystin-LR exposure induced nephrotoxicity by triggering apoptosis in female zebrafish[J]. Chemosphere, 2019, 214: 598–605. DOI:10.1016/j.chemosphere.2018.09.103 |
| [13] | ALDERMAN S L, LEISHMAN E M, FUZZEN M L M, et al. Corticotropin-releasing factor regulates caspase-3 and may protect developing zebrafish from stress-induced apoptosis[J]. Gen Comp Endocrinol, 2018, 265: 207–213. DOI:10.1016/j.ygcen.2018.05.025 |
| [14] | ZENG C, SUN H, XIE P, et al. The role of apoptosis in MCLR-induced developmental toxicity in zebrafish embryos[J]. Aquat Toxicol, 2014, 149: 25–32. DOI:10.1016/j.aquatox.2014.01.021 |
| [15] | KHAYYAT A, TOBWALA S, HART M, et al. N-acetylcysteine amide, a promising antidote for acetaminophen toxicity[J]. Toxicol Lett, 2016, 241: 133–142. DOI:10.1016/j.toxlet.2015.11.008 |
| [16] | ZHAO S J, LIU Y, WANG F, et al. N-acetylcysteine protects against microcystin-LR-induced endoplasmic reticulum stress and germ cell apoptosis in zebrafish testes[J]. Chemo- sphere, 2018, 204: 463–473. DOI:10.1016/j.chemosphere.2018.04.020 |
| [17] | ZOU Y, ZHANG Y, HAN L W, et al. Oxidative stress-mediated developmental toxicity induced by isoniazide in zebrafish embryos and larvae[J]. J Appl Toxicol, 2017, 37(7): 842–852. DOI:10.1002/jat.3432 |
| [18] | USENKO C Y, ABEL E L, KUDELA M, et al. Comparison of PBDE congeners as inducers of oxidative stress in zebrafish[J]. Environ Toxicol Chem, 2015, 34(5): 1154–1160. DOI:10.1002/etc.2922 |
| [19] | LIU H, GOONERATNE R, HUANG X, et al. A rapid in vivo zebrafish model to elucidate oxidative stress-mediated PCB126-induced apoptosis and developmental toxicity[J]. Free Radic Biol Med, 2015, 84: 91–102. DOI:10.1016/j.freeradbiomed.2015.03.002 |
| [20] | NI H, PENG L, GAO X G, et al. Effects of maduramicin on adult zebrafish (Danio rerio): Acute toxicity, tissue damage and oxidative stress[J]. Ecotoxicol Environ Saf, 2019, 168: 249–259. DOI:10.1016/j.ecoenv.2018.10.040 |
| [21] | KRAMER A C, WEBER J, ZHANG Y, et al. TP53 modulates oxidative stress in gata1+ erythroid cells[J]. Stem Cell Reports, 2017, 8(2): 360–372. DOI:10.1016/j.stemcr.2016.12.025 |
| [22] | PATRINOSTRO X, CARTER M L, KRAMER A C, et al. A model of glucose-6-phosphate dehydrogenase deficiency in the zebrafish[J]. Exp Hematol, 2013, 41(8): 697–710. DOI:10.1016/j.exphem.2013.04.002 |



