2. 638001 四川 广安,广安市人民医院胃肠外科;
3. 400016 重庆,重庆医科大学附属第一医院:肿瘤科
2. Department of Gastrointestinal Surgery, Guang'an People's Hospital, Guang'an, Sichuan Province, 638001, China, China;
3. Department of Oncology, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016
全球范围内,2型糖尿病患者逐渐增多[1]。糖尿病患者体内过多的葡萄糖与体内的蛋白质、脂质或核酸的自由氨基经过一系列复杂的非酶触反应,大量形成一种被叫作晚期糖基化终末产物(advanced glycation end products, AGEs)的物质[2]。晚期糖基化终末产物受体(receptor of advanced glycation end products, RAGE)作为AGEs的受体,其数量随着AGEs的升高而升高。在合并糖尿病的肿瘤患者体内,AGEs与RAGE的相互作用导致氧化应激,增强炎症反应,进而促进肿瘤的生长、新生血管形成及肿瘤转移[3]。
由于肿瘤生长速度较快,肿瘤内部异常的血管不能满足肿瘤生长对氧气的需求,所以50%~60%的实体肿瘤都存在缺氧区域[4-5]。缺氧激活HIF-1α信号通路,导致下游数以百计的基因被激活[6-8], 这些被激活的基因使得肿瘤细胞在缺氧环境下得以存活,并通过直接激活上皮间质转化(epithelial-mesenchymal transition, EMT)相关基因如Twist、Snail、ZEB1[9-11],或通过Notch[12]、TGF-β[13]、Wnt[14]等信号通路诱导肿瘤细胞侵袭和EMT,以促进肿瘤细胞的侵袭、转移。
已有针对结直肠癌的研究结果提示,AGEs通过RAGE及其下游MAPK/ERK[15-16]、JAK2/STAT3[17-18]等信号通路促进结直肠癌的EMT及侵袭迁移。缺氧激活HIF-1α, 进而直接激活EMT相关基因或下游EMT相关信号通路,促进结直肠癌的侵袭、迁移[9-14]。有研究表明:缺氧状态下,HIF-1α表达增加可使肿瘤细胞表面的RAGE表达增加[19]。但AGEs在缺氧微环境下对结肠癌细胞的增殖、侵袭、迁移、EMT等生物学行为的研究较少。本研究旨在研究AGEs在缺氧微环境下对结肠癌细胞的增殖、侵袭、迁移、EMT等生物学行为的影响。
1 材料与方法 1.1 主要材料RPMI1640细胞培养基购自美国HyClone公司,胎牛血清购自德国PAN-Biotech GmbH公司,牛血清白蛋白(bovine serum albumin,BSA)和D-glucose购自德国Sigma公司,兔抗人E-cadherin、Vimentin单克隆抗体由美国Abcam公司购得,兔抗人N-cadherin、RAGE单克隆抗体购于中国沈阳万类生物科技有限公司,GAPDH单克隆抗体购自北京博奥森公司,MMP2鼠抗人单克隆抗体购自Santa Cruz Biotechnology公司,兔抗人HIF-1α单克隆抗体、辣根过氧化物标记的山羊抗兔及山羊抗鼠IgG(二抗)均购于美国CST公司,CCK-8试剂盒购于美国Bimake公司,ECL发光液、全蛋白提取试剂盒、BCA全蛋白浓度测定试剂盒购自上海碧云天生物技术研究所,8 μm孔径Transwell小室、Martrigel基质胶购自美国BD公司。
1.2 AGEs的制备参考HORIUCHI等[20]的方法配制AGEs:取50 mL灭菌离心管,加入4.8 g BSA第5片段和9 g葡萄糖,pH值为7.4的PBS溶解,定容至30 mL。用0.22 μm细菌滤器过滤该溶液后装入另一50 mL灭菌离心管中,将氮气充入该离心管内隔绝氧气,旋紧离心管盖并用封口胶密封后放入37 ℃细胞培养箱中避光孵育90 d。对照组中不加葡萄糖,其余条件一致。用pH值为7.4的PBS透析除去没有结合的葡萄糖。AGEs的浓度用特异的荧光即激发波长360 nm,发射波长440 nm进行检测。对照组的荧光值作为基础值。荧光值达到基础值的70倍以上者才可用于实验[21]。鉴定后的AGEs溶液用细菌滤器过滤除菌后分装,并保存于-30 ℃冰箱中备用。
1.3 CCK-8法筛选出促进HCT116细胞增殖的最佳AGEs浓度人结肠癌HCT116细胞株由重庆医科大学附属第一医院分子肿瘤及表观遗传学重庆市重点实验室惠赠。收集未经处理的对数生长期的HCT116细胞,接种于96孔板中,5 000个/孔,于普通细胞培养箱培养。分别加入0、50、100、200、400 μg/mL的AGEs,于加药后6、24、48和72 h更换新鲜培养液后加入CCK-8试剂,10 μL/孔,继续于普通细胞培养箱培养细胞1 h,酶标仪测450 nm波长各组细胞的光密度值[D(450)]。以时间为横坐标,[D(450)]值为纵坐标绘制细胞生长曲线。
1.4 细胞培养与分组CCK-8实验确定最佳AGEs浓度为200 μg/mL, 最佳作用时间为48 h。后将细胞分为:空白对照组(常氧、无AGEs)、AGEs(200 μg/mL)组(常氧)、缺氧组(O2 1%, 无AGEs)及缺氧(O2 1%)+ AGEs(200 μg/mL)组。所有HCT116细胞均用含有10%胎牛血清的RPMI1640培养基培养,空白对照组及AGEs(200 μg/mL)组于37 ℃、CO2 5%的普通细胞培养箱中培养;缺氧组及缺氧+AGEs(200 μg/mL)组HCT116细胞放入37 ℃、O2 1%,CO2 5%、N2 94%的三气细胞培养箱中缺氧培养。待细胞融合度达70%~90%时,收集此时对数期HCT116细胞进行后续实验。
1.5 流式细胞术检测细胞周期将空白对照组、AGEs(200μg/mL)组、缺氧组及缺氧+AGEs(200μg/mL)组细胞按分组情况加药处理48 h。然后用胰酶消化各组细胞后,1 200 r/min离心5 min;弃上清,加3 mL PBS重悬细胞,然后离心;再弃上清,加入3 mL 70% 4 ℃乙醇重悬,4 ℃固定24 h以上;2 000 r/min离心5 min;弃上清,加入5~7 mL PBS重悬细胞,2 000 r/min离心5 min;弃上清后加入1 200 μL PBS重悬细胞;将细胞悬液分装至3个EP管中,每管400 μL;每个EP管加入2.5 μL RNA酶抑制剂,37 ℃孵育30 min;后再向每个EP管中加入5 μL PI(碘化丙啶),常温避光孵育15~30 min,流式细胞术检测细胞周期。
1.6 Tranwell体外迁移、侵袭实验Transwell小室及细胞准备:Transwell小室放置于24孔板中,正反面均在紫外线下照射30~60 min灭菌。
取常氧及缺氧培养48 h,对数期生长的HCT116细胞。对照组及缺氧组细胞用1640,AGEs(200 μg/mL)组及缺氧+ AGEs(200 μg/mL)组用含200 μg/mL AGEs的1640培养基稀释成1×106/mL(侵袭实验用),2.5×105/mL(迁移实验用)两种浓度细胞悬液。
体外侵袭实验:提前将基质胶置于4 ℃冰箱融解,然后用冰1640以7 :1的比例稀释基质胶并混匀。吸取稀释并混匀的基质胶加入小室上室面,每个小室100 μL,37 ℃孵育4 h待其凝固。吸取各组用于侵袭实验的细胞悬液100 μL加于基质胶面上。下室加700 μL含10%胎牛血清的培养基。空白对照、AGEs(200 μg/mL)组细胞置于普通细胞培养箱中培养;缺氧及缺氧+AGEs(200 μg/mL)组细胞置于三气培养箱中缺氧培养;48 h后,取出小室。用棉签蘸净上室面的基质胶、培养基及未穿出的细胞,5%甲醛固定30 min并风干,吸取1 mL结晶紫加入24孔板孔内,放入小室染色10 min,染色结束后PBS清洗并风干。
体外迁移实验:吸取各组用于侵袭实验的细胞悬液200 μL加入小室上室面。下室加700 μL含10%胎牛血清的培养基。空白对照及AGEs(200 μg/mL)组细胞置于普通细胞培养箱中培养;缺氧及缺氧+AGEs(200 μg/mL)组细胞置于三气培养箱中培养;36 h后,取出小室,此后操作步骤同Transwell体外侵袭实验。
将小室风干后,于显微镜下随机选取5个视野(×200)拍照,ImageJ软件计数穿出的细胞数目。
1.7 Western blot实验空白对照组及AGEs(200μg/mL)组细胞置于普通细胞培养箱中培养48 h;缺氧及缺氧+AGEs(200 μg/mL)组细胞置于三气培养箱中缺氧培养48 h。按照说明书进行总蛋白提取,蛋白提取后用BCA试剂盒测蛋白浓度。蛋白样品加入Loading Buffer并热变性后进行SDS-PAGE电泳,每孔蛋白上样量为40 μg;250 mA恒流转膜;用5%脱脂奶粉室温封闭2~4 h;孵育一抗,4 ℃过夜。次晨复温,TBST洗膜3次,每次10 min。摇床上常温孵育二抗1~2 h(稀释比例均为1 :3 000)。TBST洗膜3次,每次10 min。ECL化学发光液显影并保存结果。
1.8 统计学分析各项实验均独立重复3次。应用SPSS 20.0软件对各项试验数据进行统计学分析,计量资料以x±s表示,2独立样本间的比较采用t检验,多组间的均数比较采用方差分析。检验水准:α=0.05。
2 结果 2.1 CCK-8法筛选出最佳AGEs浓度为200 μg/mL用0、50、100、200 μg/mL和400 μg/mL的AGEs处理HCT116细胞6、24、48 h和72 h后,应用CCK-8法检测各组细胞的增殖情况。不同时间点各组光密度值[D(450)]依次为:24 h(0.985 0±0.026 40)、(1.017 9±0.010 8)、(1.060 5±0.038 7)、(1.060 8±0.03)、(1.197 9±0.029 1); 48 h(1.499 1±0.094 2)、(1.575 3±0.033 7)、(1.588 7±0.042 3)、(1.720 8±0.016 2)、(1.688 9±0.033)。
结果显示:在24~48 h内,当AGEs浓度在100 μg/mL以上时,均可促进HCT116细胞的增殖,且有时间及浓度依赖性(P < 0.05)。在24 h,400 μg/mL的AGEs促进细胞增殖的作用最明显(P < 0.05)。在48 h,200 μg/mL的AGEs促进细胞增殖的作用最明显(P < 0.05),48 h后AGEs对细胞增殖作用逐渐减弱(图 1)。由此确定最佳AGEs浓度为200 μg/mL,最佳作用时间为48 h。
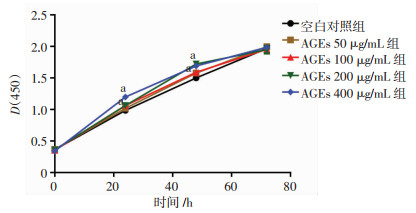
|
| a: P < 0.05,与空白对照组比较 图 1 CCK-8法筛选最佳AGEs浓度 |
2.2 缺氧促进HCT116细胞增殖,AGEs仅增加S期细胞比例
细胞周期的结果显示,G1期各组细胞比例分别为空白对照组(52.47±0.82)%、AGEs组(200 μg/mL)(52.62±0.14)%、缺氧组(41.60±1.47) %、缺氧+AGEs组(200 μg/mL) (40.65±0.66)%;S期各组细胞比例分别为空白对照组(24.05±0.65)%、AGEs组(200 μg/mL) (26.09±1.38)%、缺氧组(29.40±2.45)%、缺氧+AGEs组(200 μg/mL) (32.80±1.77);G2期各组细胞比例分别为空白对照组(23.48±1.11)%、AGEs组(200 μg/mL)(21.29±1.44)%、缺氧组(29.00±2.91)%、缺氧+AGEs组(200 μg/mL) (26.55±1.25)%。与空白对照组比较,其余3组S期细胞比例逐渐增加(P < 0.05,图 2)。与常氧组比较,缺氧组G0/G1期细胞比例明显降低,S期及G2期细胞比例明显升高(P < 0.05,图 2)。但同时也发现AGEs(200 μg/mL)仅增加S期细胞比例(P < 0.05,图 2),对G0/G1期及G2期没有明显影响(P>0.05,图 2)。
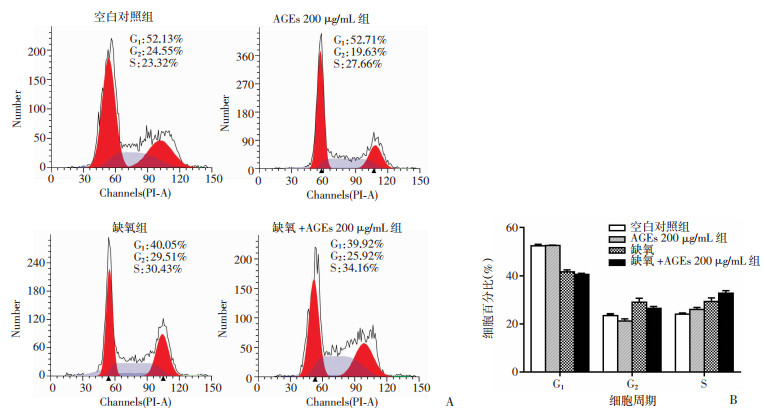
|
| A:流式细胞术检测各组HCT116细胞周期变化;B:各组HCT116细胞周期分布统计分析, a:P < 0.05,与空白对照组或AGE 200 μg/mL(常氧)组比较 图 2 流式细胞术检测各组HCT116细胞周期分布 |
2.3 Transwell实验检测缺氧环境下AGEs促进结肠癌HCT116细胞的体外侵袭、迁移
Transwell体外侵袭实验检测结果显示,各组穿出基质胶的细胞数目分别为空白对照组(84.8±3.96)个、AGEs组(200 μg/mL) (126±6.75)个、缺氧组(175±8.75)个、缺氧+ AGEs组(200 μg/mL) (270.8±8.93)个。与空比对照组比较,AGEs组(200 μg/mL), 缺氧组和缺氧+ AGEs组(200 μg/mL),穿出基质胶细胞数逐渐增加(P < 0.05),图 3)。说明缺氧和AGEs (200 μg/mL)均可促进HCT116细胞的侵袭(P < 0.05);同时,缺氧环境下,AGEs (200 μg/mL)进一步增强HCT116细胞侵袭能力(P < 0.05)。
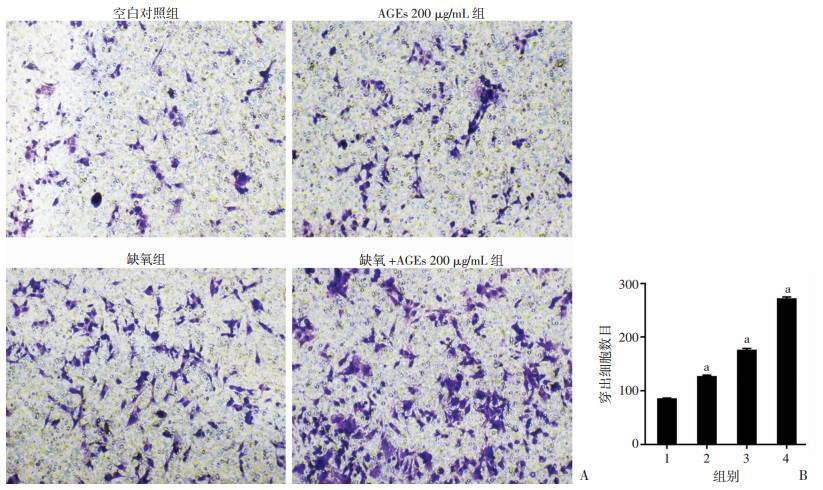
|
| A: Transwell侵袭实验检测各组HCT116细胞体外侵袭结果; B:各组HCT116细胞体外侵袭统计分析1:空白对照组;2:AGEs 200 μg/mL组;3:缺氧组;4:缺氧+AGEs 200μg/mL组a: P < 0.05,与空白对照组比较 图 3 Transwell侵袭实验检测各组细胞的体外侵袭能力(结晶紫×200) |
Transwell体外迁移实验检测结果显示,各组穿出的细胞数目分别为:空白对照组(131.4±7.5)个、AGEs组(200 μg/mL) (205.4±15.09)个、缺氧组(318±12.6)个、缺氧+ AGEs组(200 μg/mL) (425.4±17.34)个。与空折对照组比较,其余3组穿膜细胞数逐渐增加(P < 0.05,图 4)。说明缺氧和AGEs(200 μg/mL)均可促进HCT116细胞的迁移(P < 0.05);同时,缺氧环境下,AGEs(200 μg/mL)可进一步增强HCT116细胞的迁移(P < 0.05)。

|
| A: Transwell迁移实验检测各组HCT116细胞体外迁移; B:各组HCT116细胞体外迁移统计分析1:空白对照组;2:AGEs 200μg/mL组;3:缺氧组;4:缺氧+AGEs 200 μg/mL组a:P < 0.05,与空白对照组比较 图 4 Transwell迁移实验检测各组HCT116细胞的体外迁移能力(结晶紫×200) |
2.4 Western blot检测缺氧环境下AGEs增强结肠癌HCT116细胞的侵袭及EMT
本实验采用GAPDH作为内参,通过ImageJ软件定量分析各目的蛋白条带的灰度值,计算各目的蛋白相对表达量:目的蛋白/GAPDH灰度值。Western blot检测结果显示:HIF-1α在常氧环境下表达水平较低,在缺氧状态下表达水平显著升高;与此同时,在缺氧状态下加入AGEs(200 μg/mL)后,HIF-1α表达量进一步升高。在常氧及缺氧环境下加入AGEs后RAGE表达均升高;但缺氧环境下升高更明显。与空白对照组相比,其余3组上皮相关标志物E-cadherin依次降低,而间质相关标志物N-cadherin、Vimentin及侵袭相关蛋白MMP2依次升高(P < 0.05, 图 5)。提示:AGEs(200 μg/mL)和缺氧均可促进HCT116细胞的侵袭及EMT(P < 0.05);同时,在缺氧环境下,AGEs(200 μg/mL)可进一步增强HCT116细胞的侵袭及EMT(P < 0.05)。
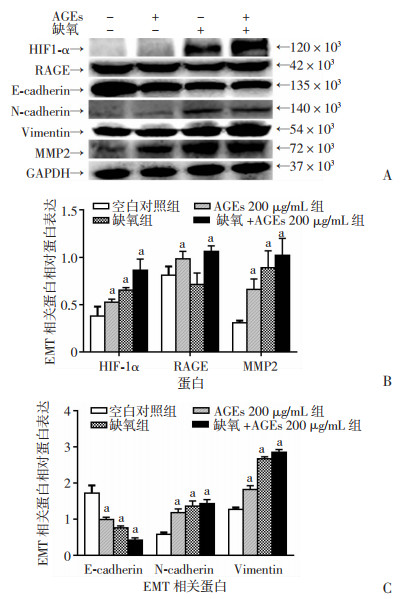
|
| A: Western blot检测结果; B: HIF-1α、RAGE、MMP2蛋白相对表达分析; C:EMT相关蛋白相对表达分析a: P < 0.05,与空白对照组或缺氧组比较 图 5 Western blot检测HIF-1α、RAGE、E-cadherin、N-cadherin、Vimentin和MMP2在各组中的表达 |
3 讨论
糖尿病及结直肠癌发病率高,均已成为全球较为严峻的公共卫生问题[1, 22]。伴随糖尿病的结直肠肿瘤,恶性程度更高,更容易发生淋巴结及远处转移,直接导致患者的生存期明显缩短,治疗难度加大,使得原本棘手的问题更加复杂[23-24]。
糖尿病患者体内大量累积的AGEs与RAGE结合,促进肿瘤的增殖。本研究用CCK-8法筛选出促进HCT116细胞增殖的最佳AGEs浓度为200 μg/mL,最佳作用时间为48 h,这与文献[16]报道的结果一致。合并糖尿病的结直肠癌患者,肿瘤内部存在缺氧、高浓度AGEs蓄积的病理微环境。缺氧环境下,细胞代谢由糖的有氧氧化转向无氧糖酵解。HIF-1α与HIF-1β结合呈稳定态HIF-1,稳定态HIF-1与靶基因中的缺氧反应元件(HREs)结合,介导适应缺氧环境的相关蛋白质表达[25]。HIF-1增加葡萄糖转运蛋白和糖酵解酶以及乳酸脱氢酶A(LDHA)和丙酮酸脱氢酶激酶1(PDK1)的转录,使丙酮酸转化为乳酸[26]。同时,HIF-2α通过诱导关键干细胞基因(如OCT4、NANOG和MYC)等的表达,使细胞获得干细胞样表型,使得肿瘤细胞成瘤能力增强[27]。同时HIF-2α促使肠道铁转运相关基因过表达,引起局部铁稳态失衡,提高细胞存活和增殖能力,最终促进肿瘤进展[28]。本研究的细胞周期实验证实:缺氧环境(O2 1%)能明显减少HCT116细胞G1期细胞比例,增加S期及G2期细胞比例(P < 0.05),促进结肠癌HCT116细胞的分裂增殖。而AGEs(200 μg/mL)只增加了S期细胞的比例(P < 0.05),提示AGEs(200 μg/mL)促进结肠癌HCT116细胞的增殖作用较弱。这可能与AGEs/RAGE对细胞选择性作用有关[29-30]。故未进一步就AGEs(200 μg/mL)在缺氧环境下促进结直肠癌细胞增殖的具体机制做深入研究。
AGEs能通过RAGE-ERK[15-16]、JAK2/STAT3[17-18]等通路促进结直肠肿瘤的EMT,导致肿瘤的侵袭、转移。结直肠肿瘤内部的缺氧微环境可激活HIF-1α基因的表达,HIF-1α基因的激活不仅可直接导致肿瘤细胞的EMT及侵袭力的增加[9-11],而且可以通过增加RAGE的表达,激活其下游相关信号通路,促进肿瘤的增殖,侵袭,迁移[19]。本研究发现,缺氧环境下代表肿瘤侵袭能力的指标MMP2较常氧环境下明显升高,上皮相关标志物E-cadherin较常氧环境下明显降低,而间质相关标志物N-cadherin、Vimentin较常氧环境下明显升高。与此同时,缺氧环境下,于结肠癌HCT116细胞中加入AGEs(200 μg/mL)后,侵袭力指标MMP2,间质相关标志物N-cadherin、Vimentin较单纯缺氧进一步升高;而上皮相关标志物E-cadherin较常氧环境下进一步降低。上述结果提示:缺氧微环境及AGEs在促进结肠癌HCT116细胞的侵袭力上可能有叠加效应。因此推测合并糖尿病的结直肠癌患者,肿瘤中的缺氧微环境,引起HIF-1α表达增加,除可直接激活下游信号通路,促进肿瘤的EMT及侵袭外;还可以刺激细胞表达更多的RAGE,患者体内的高浓度AGEs与数量庞大的RAGE充分结合,激活下游与细胞侵袭相关的信号通路,如JAK2/STAT3、ERK等信号通路促进肿瘤细胞的侵袭、扩散及转移。
本研究初步探索了缺氧环境下AGEs对结肠癌HCT116细胞增殖、侵袭、迁移、EMT等生物学行为的影响。结果显示:缺氧与AGEs可共同促进结肠癌HCT116细胞的侵袭与迁移。缺氧可促进结肠癌HCT116细胞的增殖,但AGEs促进结肠癌HCT116细胞的增殖作用较弱。本研究与之前单独AGEs或单独缺氧对结肠癌细胞生物学行为的相关研究相比,能够更真实的模拟合并糖尿病的结肠癌患者体内结肠癌细胞所处的缺氧合并高浓度AGEs的独特微环境。但缺氧环境与高浓度AGEs是通过各自的信号通路,还是共同信号通路作用于结直肠癌细胞,并最终导致结直肠癌细胞侵袭能力增强的具体机制仍不清楚,需进一步研究。
| [1] |
ZIMMET P, ALBERTI K G, MAGLIANO D J, et al. Diabetes mellitus statistics on prevalence and mortality:facts and fallacies[J]. Nat Rev Endocrinol, 2016, 12(10): 616-622. DOI:10.1038/nrendo.2016.105 |
| [2] |
BUCALA R. Diabetes, aging, and their tissue complications[J]. J Clin Invest, 2014, 124(5): 1887-1888. DOI:10.1172/JCI75224 |
| [3] |
ALEXANDER K L, MEJIA C A, JORDAN C, et al. Differential receptor for advanced glycation end products expression in preeclamptic, intrauterine growth restricted, and gestational diabetic placentas[J]. Am J Reprod Immunol, 2016, 75(2): 172-180. DOI:10.1111/aji.12462 |
| [4] |
DHANI N, FYLES A, HEDLEY D, et al. The clinical significance of hypoxia in human cancers[J]. Semin Nucl Med, 2015, 45(2): 110-121. DOI:10.1053/j.semnuclmed.2014.11.002 |
| [6] |
GREENALD D, JEYAKANI J, PELSTER B, et al. Genome-wide mapping of Hif-1α binding sites in zebrafish[J]. BMC Genomics, 2015, 16: 923. DOI:10.1186/s12864-015-2169-x |
| [7] |
CHOUDHRY H, HARRIS A L. Advances in hypoxia-inducible factor biology[J]. Cell Metab, 2018, 27(2): 281-298. DOI:10.1016/j.cmet.2017.10.005 |
| [8] |
ASAI H, HIRATA J, WATANABE-AKANUMA M. Indoxyl glucuronide, a protein-bound uremic toxin, inhibits hypoxia-inducible factor-dependent erythropoietin expression through activation of aryl hydrocarbon receptor[J]. Biochem Biophys Res Commun, 2018, 504(2): 538-544. DOI:10.1016/j.bbrc.2018.09.018 |
| [9] |
CHEN Z, ZHU Y D, DONG Y F, et al. Overexpression of TrpC5 promotes tumor metastasis via the HIF-1α-Twist signaling pathway in colon cancer[J]. Clin Sci, 2017, 131(19): 2439-2450. DOI:10.1042/CS20171069 |
| [10] |
CHOI B J, PARK S A, LEE S Y, et al. Hypoxia induces epithelial-mesenchymal transition in colorectal cancer cells through ubiquitin-specific protease 47-mediated stabilization of Snail:A potential role of Sox9[J]. Sci Rep, 2017, 7(1): 15918. DOI:10.1038/s41598-017-15139-5 |
| [11] |
ZHANG W J, SHI X P, PENG Y, et al. HIF-1α promotes epithelial-mesenchymal transition and metastasis through direct regulation of ZEB1 in colorectal cancer[J]. PLoS ONE, 2015, 10(6): e0129603. DOI:10.1371/journal.pone.0129603 |
| [12] |
SONOSHITA M, ITATANI Y, KAKIZAKI F, et al. Promotion of colorectal cancer invasion and metastasis through activation of NOTCH-DAB1-ABL-RHOGEF protein TRIO[J]. Cancer Discov, 2015, 5(2): 198-211. DOI:10.1158/2159-8290.CD-14-0595 |
| [13] |
RANKIN E B, GIACCIA A J. Hypoxic control of metastasis[J]. Science, 2016, 352(6282): 175-180. DOI:10.1126/science.aaf4405 |
| [14] |
BAHRAMI A, AMERIZADEH F, SHAHIDSALES S, et al. Therapeutic potential of targeting wnt/β-catenin pathway in treatment of colorectal cancer:rational and progress[J]. J Cell Biochem, 2017, 118(8): 1979-1983. DOI:10.1002/jcb.25903 |
| [15] |
ZHAO J K, OU B C, HAN D P, et al. Tumor-derived CXCL5 promotes human colorectal cancer metastasis through activation of the ERK/Elk-1/Snail and AKT/GSK3β/β-catenin pathways[J]. Mol Cancer, 2017, 16: 70. DOI:10.1186/s12943-017-0629-4 |
| [16] |
伍鑫, 程勇, 庞云, 等. 终末糖基化产物对结肠癌SW620细胞EMT及肿瘤干细胞标志物的影响[J]. 中国肿瘤生物治疗杂志, 2016, 23(3): 355-359. DOI:10.3872/j.issn.1007-385X.2016.03.010 |
| [17] |
WU X, CHENG Y, PANG Y, et al. Effects of advanced glycation end products on epithelial-mesenchymal transition and cancer stem cell associated markers in human colon cancer cell line SW620[J]. Chin J Cancer Biother, 2016, 23(3): 355-359. DOI:10.1038/s41419-017-0176-3 |
| [18] |
王五艺, 程勇, 万林, 等. AGEs通过JAK2/STAT3信号通路诱导结肠癌SW480细胞增殖、侵袭及上皮间质转化[J]. 第三军医大学学报, 2017, 39(24): 2390-2395. DOI:10.16016/j.1000-5404.201708199 |
| [19] |
WANG W Y, CHENG Y, WAN L, et al. Advanced glycation end products enhance proliferation and invasion of human colon cancer SW480 cells through JAK2/STAT3 pathway[J]. J Third Mil Med Univ, 2017, 39(24): 2390-2395. DOI:10.1016/j.bbrc.2017.12.084 |
| [20] |
HORIUCHI S, ARAKI N, MORINO Y. Immunochemical approach to characterize advanced glycation end products of the maillard reaction[J]. J Biol Chem, 1991, 266(12): 7329-7332. |
| [21] |
韩晓群.晚期糖基化终末产物促进初始CD4~+T细胞向促炎症反应方向分化及机制研究[D].武汉: 武汉大学, 2014.
|
| [22] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016, 66(1): 7-30. DOI:10.3322/caac.21332 |
| [23] |
KOYASU S, KOBAYASHI M, GOTO Y, et al. Regulatory mechanisms of hypoxia-inducible factor 1 activity:Two decades of knowledge[J]. Cancer Sci, 2018, 109(3): 560-571. DOI:10.1111/cas.13483 |
| [24] |
LOO J M, SCHERL A, NGUYEN A, et al. Extracellular metabolic energetics can promote cancer progression[J]. Cell, 2015, 160(3): 393-406. DOI:10.1016/j.cell.2014.12.018 |
| [25] |
BALAMURUGAN K. HIF-1 at the crossroads of hypoxia, inflammation, and cancer[J]. Int J Cancer, 2016, 138(5): 1058-1066. DOI:10.1002/ijc.29519 |
| [26] |
MACKLIN P S, MCAULIFFE J, PUGH C W, et al. Hypoxia and HIF pathway in cancer and the placenta[J]. Placenta, 2017, 56: 8-13. DOI:10.1016/j.placenta.2017.03.010 |
| [27] |
ALHAWARAT F M, HAMMAD H M, HIJJAWI M S, et al. The effect of cycling hypoxia on MCF-7 cancer stem cells and the impact of their microenvironment on angiogenesis using human umbilical vein endothelial cells (HUVECs) as a model[J]. Peer J, 2019, 7: e5990. DOI:10.7717/peerj.5990 |
| [28] |
RAMAKRISHNAN S K, SHAH Y M. Role of intestinal HIF-2α in health and disease[J]. Annu Rev Physiol, 2016, 78: 301-325. DOI:10.1146/annurev-physiol-021115-105202 |
| [29] |
RAMASAMY R, SHEKHTMAN A, SCHMIDT A M. The multiple faces of RAGE:opportunities for therapeutic intervention in aging and chronic disease[J]. Expert Opin Ther Targets, 2016, 20(4): 431-446. DOI:10.1517/14728222.2016.1111873 |
| [30] |
CHEN H B, WU L F, LI Y K, et al. Advanced glycation end products increase carbohydrate responsive element binding protein expression and promote cancer cell proliferation[J]. Mol Cell Endocrinol, 2014, 395(1/2): 69-78. DOI:10.1016/j.mce.2014.07.021 |



