骨关节炎(osteoarthritis,OA)是一种常见的退行性骨关节疾病,其病理发展与机械损伤及炎症反应密切相关[1]。OA患者主要的临床症状有关节肿胀、疼痛以及关节活动度受限等。OA的治疗目的是防止关节软骨进一步退化,缓解疼痛,改善关节活动能力等[2]。目前OA的治疗主要有全身服用非甾体类抗炎药物或者关节局部注射药物等,晚期患者往往需要关节置换[3-4]。此外,物理治疗也广泛应用于临床上缓解关节炎症状,可以改善由于半月板撕裂导致的OA患者的临床症状,甚至可以作为一种替代早期手术的手段用来缓解关节症状[5]。因此,开发新的治疗手段以及建立物理、药物治疗的综合方法对治疗OA有重要意义。
低强度脉冲超声(low-intensity pulsed ultrasound,LIPUS)是一种无创、安全的物理治疗手段,在1994年被PDA批准用于骨折的保守治疗[6]。大量临床和基础研究提示,LIPUS能缓解膝关节软骨退变,是一种潜在的治疗膝关节OA的手段[7]。最新一项荟萃分析提示:LIPUS可以缓解OA患者的疼痛,改善膝关节的功能,并且无明显副作用[8]。进一步研究表明,LIPUS可能通过促进软骨细胞增殖和软骨基质分泌缓解关节炎[7]。此外,在佐剂诱导的小鼠关节炎模型中,LIPUS可以降低滑膜中炎症因子的表达,减少炎症细胞浸润[9-10]。在脂多糖诱导U937巨噬细胞体外炎症模型中,LIPUS能抑制IL-6和IL-8等炎症因子的释放[11]。LIPUS可能通过抗炎作用治疗OA,其具体的细胞、分子机制还有待进一步研究。
本研究采用内侧半月板不稳定(destabilisation of medial meniscus,DMM)手术制作创伤后骨关节炎小鼠模型,实验结果显示LIPUS处理可以缓解关节炎滑膜表型,并进一步探究LIPUS对创伤后骨关节炎滑膜巨噬细胞极化的影响。利用THP-1和Raw 264.7细胞系在体外模型中探究了LIPUS对巨噬细胞极化的影响。文献[12-13]报道,NF-κB和JNK信号通路的激活能调节巨噬细胞的极化,本课题进一步研究LIPUS对这些通路的影响,旨在探索LIPUS治疗OA的新机制。
1 材料与方法 1.1 主要材料与试剂雄性3月龄C57BL/6小鼠购自北京华阜康生物技术有限公司,饲养于陆军军医大学(第三军医大学)大坪医院实验动物中心。THP-1细胞系和Raw 264.7细胞系购自美国模式培养物集存库(American type culture collection,ATCC);α-MEM培养基、胎牛血清购自美国Gibco公司;苏木精、DAPI、鼠抗ACTB/β-actin抗体、佛波酯(phorbol-12-myristate-13-acetate,PMA)、脂多糖购自美国Sigma公司;伊红试剂购自北京中杉公司;逆转录试剂盒、实时定量PCR试剂盒购自日本TaKaRa公司;大鼠抗F4/80抗体、兔抗iNOS抗体、兔抗CD206抗体、驴抗兔荧光二抗、驴抗大鼠荧光二抗购自美国Abcam公司;兔抗p-JNK抗体, 兔抗JNK抗体, 兔抗NF-κB p65抗体, 兔抗NF-κB p-p65抗体购自美国CST公司;冰冻切片机、共聚焦显微镜购自德国Leica公司;显微镜购自日本Olympus公司;定量PCR仪器购自美国Agilent公司;低强度脉冲超声波治疗仪为Exogen 4000(美国),参数:频率1.5 MHz,声强30 mW/cm2,占空比20%。
1.2 实验方法 1.2.1 动物模型的建立DMM手术采用文献[14]报道的常规方法,小鼠腹腔注射1%戊巴比妥钠(0.1 mL/10 g)麻醉,右膝关节备皮,酒精消毒,切开膝关节处皮肤暴露髌韧带,镊子掀开髌韧带暴露髌下脂肪垫,用镊子清除部分脂肪,切断连接内侧半月板胫骨的韧带,髌韧带复位缝合,皮肤缝合。待小鼠苏醒,给予自由活动。小鼠按随机数字表法分为3组:对照组(n=7,不建模)、DMM组(n=7,建立DMM模型)、DMM+LIPUS组(n=7,建立DMM模型后给予LIPUS治疗)。实验过程中,对照组和DMM组分别死亡1只小鼠,未纳入统计学处理。
1.2.2 LIPUS治疗流程手术后小鼠休息1 d,为了防止小鼠膝关节和LIPUS探头接触不良,LIPUS治疗前麻醉固定小鼠,刮除右膝关节毛发,皮肤涂上耦合胶,LIPUS探头紧贴膝关节。DMM+LIPUS组小鼠每天采用LIPUS治疗20 min,每周6次,具体见图 1A。DMM均在同一时间点和DMM+LIPUS进行麻醉。DMM手术2周后小鼠取材。4%多聚甲醛固定右膝关节12 h,15% EDTA脱钙14 d,30%蔗糖脱水,OCT包埋,冰冻切片。

|
| A:LIPUS治疗流程;B:HE染色观察各组小鼠膝关节滑膜的变化 图 1 LIPUS对DMM手术小鼠膝关节滑膜的影响 |
1.2.3 HE染色方法
冰冻切片置于37 ℃温箱中30 min,PBS洗2遍后,苏木精染色3 min,自来水浸泡3 min,伊红染色10 s,使用95%乙醇脱色,最后封片并采集图片。选取每只小鼠右膝关节滑膜最厚部位,用Image J软件测量滑膜厚度。
1.2.4 免疫荧光染色方法冰冻切片放置在37 ℃温箱中30 min,PBS清洗2遍,封闭液封闭1 h后,加入一抗4 ℃过夜,清洗2遍后荧光二抗孵育1 h,PBS清洗3遍后加入DAPI染核,PBS清洗后封片, 共聚焦显微镜下拍照。培养的细胞免疫荧光染色采取相似的方法。
1.2.5 细胞培养和处理THP-1和Raw 264.7细胞均培养于α-MEM培养基中,培养基中含有10%胎牛血清和1%青链霉素。细胞放于37 ℃、5% CO2孵育箱培养。THP-细胞使用100 ng/mL PMA处理72 h,诱导分化为成熟的巨噬细胞。100 ng/mL的LPS处理巨噬细胞12 h,使其分化为M1型巨噬细胞。LIPUS探头涂上耦合剂,紧贴培养皿底部,打开LIPUS开关,处理20 min,1 h后收集细胞。将THP-1细胞系分为对照组、LIPUS组、LPS(lipopolysaccharide)组和LPS+LIPUS组,将Raw 264.7细胞分为LPS组和LPS+LIPUS组,分别进行后续研究。
1.2.6 实时荧光定量PCR检测依据说明书上使用TRIzol法提取细胞总RNA,反转RNA后用SYBR Green RT-PCR试剂盒进行定量PCR检测。GAPDH引物上游:5′-CGGAGTCAACGGATTTGGTC-3′,下游:5′-GACAAGCTTCCCGTTCTCAG-3′;IL-1β引物上游:5′-GCCATGGACAAGCTGAGGAAG-3′,下游:5′-GTG-CTGATGTACCAGTTGGG-3′;TNF-α引物上游:5′-CA-GCCTCTTCTCCTTCCTGA-3′,下游:5′-CAGCTTGAGG-GTTTGCTACA-3′;IL-10引物上游:5′-GACTTTAAGG-GTTACCTGGGTTG-3′,下游:5′-TCACATGCGCCTTGA-TGTCTG-3′;Arg1引物上游:5′-ACGGAAGAATCAGCCTGGTG-3′,下游:5′-GTCCACGTCTCTCAAGCCAA-3′。GAPDH作为内参标准化数据。
1.2.7 Western blot检测细胞蛋白表达水平细胞裂解液提取细胞总蛋白,30 μg的蛋白上样于12%的SDS-PAGE胶进行电泳,电泳后蛋白转移到PVDF膜中,用5%的脱脂牛奶常温封闭PVDF膜1 h,加入一抗4 ℃孵育过夜,PBST清洗3遍后加入二抗37 ℃孵育1 h。PBST洗膜3遍,用ECL化学发光法显影,采用Bio-Rad图像分析系统进行分析。
1.3 统计学分析采用GraphPad Prism 7进行统计学分析,数据以x±s表示,两组间比较使用独立样本t检验。多组间比较采用单因素方差分析,两两比较采用Post Hoc检验比较组间差异, 检验水准:α=0.05。
2 结果 2.1 LIPUS缓解DMM手术导致的滑膜异常增生各组小鼠膝关节滑膜的变化见图 1B。对照组小鼠膝关节滑膜厚度为(14.57±2.48)μm,小鼠DMM手术后2周的滑膜厚度为(73.17±5.83)μm,比未做手术对照组显著增加(P < 0.01),并且可以看到滑膜中有大量巨噬细胞浸润。2周的LIPUS治疗后滑膜厚度为(54.10±4.84)μm,较DMM组显著降低(P < 0.05)。说明LIPUS治疗缓解了DMM手术导致的早期滑膜增生。
2.2 LIPUS调节PTOA小鼠滑膜巨噬细胞的极性DMM手术增加了小鼠膝关节滑膜F4/80阳性巨噬细胞中iNOS阳性细胞即M1型巨噬细胞的比例(P < 0.05, 表 1,图 2A)。与DMM组比较,LIPUS降低了iNOS阳性巨噬细胞比例(P < 0.05)。DMM手术小鼠的滑膜CD206阳性M2型巨噬细胞占总巨噬细胞的比例和对照组相比差异无统计学意义(P>0.05),而LIPUS处理组的滑膜巨噬细胞CD206阳性比例较单纯DMM手术组增多(P < 0.05,表 1,图 2B)。结果提示,DMM手术2周后的滑膜巨噬细胞大部分极化为M1型巨噬细胞,而2周的LIPUS治疗处理可降低M1型巨噬细胞比例,增加了M2型巨噬细胞的比例。

|
| M:半月板;T:胫骨;S:滑膜;虚线为滑膜组织的边界线;白框为局部放大区域A:小鼠右膝关节F4/80和iNOS共染;B:小鼠右膝关节F4/80和CD206共染 图 2 免疫荧光检测LIPUS对DMM小鼠滑膜巨噬细胞极化的影响 |
| 组别 | iNOS阳性细胞比例 | CD206阳性细胞比例 |
| 对照组 | 46.44±2.00 | 51.39±6.94 |
| DMM组 | 76.68±4.75a | 44.86±2.86 |
| DMM+LIPUS组 | 41.39±3.39b | 65.00±2.50b |
| a: P < 0.05, 与对照组比较;b: P < 0.05, 与DMM组比较 | ||
2.3 LIPUS对THP-1和RAW264.7巨噬细胞极化相关基因表达的影响
PMA诱导分化72 h后的THP-1细胞中,LIPUS处理组的IL-1β和TNF-α mRNA表达量和对照组相比有增高趋势,但差异无统计学意义(P>0.05)。与对照组比较,LIPUS处理组的IL-10和Arg1 mRNA表达量增加(P < 0.05)。LPS处理PMA诱导分化的THP-1细胞12 h后,和LPS组相比,LIPUS+LPS组的IL-1β和TNF-α的mRNA表达量减少(P < 0.05),而IL-10和Arg1的mRNA表达量增加(P < 0.05)。LPS处理Raw 264.7细胞12 h,LIPUS+LPS组的IL-1β和TNF-α mRNA表达量比LPS组减少(P < 0.05),IL-10和Arg1的表达量较LPS组增加(P < 0.05, 图 3)。

|
| A:THP-1细胞IL-1β mRNA水平的变化 1:对照组;2:LIPUS组;3:LPS组;4:LPS+LIPUS组;a:P < 0.05,与LPS组比较;B:THP-1细胞TNF-α mRNA的变化 1:对照组;2:LIPUS组;3:LPS组;4:LPS+LIPUS组;a:P < 0.05,与LPS组比较;C:THP-1细胞IL-10 mRNA的变化 1:对照组;2:LIPUS组;3:LPS组;4:LPS+LIPUS组;a:P < 0.05,与对照组比较;b:P < 0.05,与LPS组比较;D:THP-1细胞Arg 1 mRNA的变化 1:对照组;2:LIPUS组;3:LPS组;4:LPS+LIPUS组;a:P < 0.05,与对照组比较;b:P < 0.05,与LPS组比较;E:Raw264.7细胞IL-β、TNF-α、IL-10和Arg1的mRNA的变化 a:P < 0.05,与LPS组比较 图 3 LIPUS对THP-1和Raw264.7巨噬细胞系极化相关基因的mRNA水平影响 |
2.4 LIPUS抑制活化巨噬细胞JNK和NF-κB信号通路
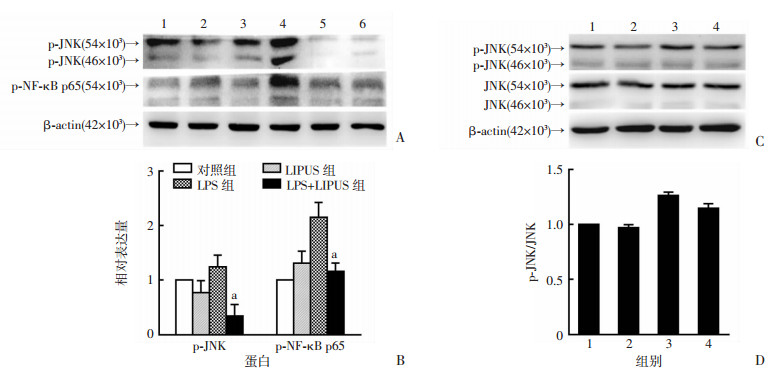
与对照组比较,LIPUS处理对小鼠腹腔来源的Raw 264.7细胞的磷酸化JNK(p-JNK)和磷酸化NF-κB p65(p-NF-κB p65)的蛋白表达量没有显著影响(P>0.05), 而LIPUS能显著下调LPS导致的p-JNK和p-NF-κB p65的高蛋白表达水平(P < 0.05,图 4)。PMA诱导分化的THP-1巨噬细胞中,LIPUS组与对照组比较,p-JNK和JNK蛋白表达量的比值差异无统计学意义,而LPS+LIPUS组与LPS组比较,p-JNK和JNK蛋白表达量的比值有下降趋势(P>0.05, 图 4)。说明LPS炎症刺激条件下,LIPUS抑制了JNK信号通路,同时也抑制了NF-κB p65的磷酸化。利用免疫荧光染色,发现DMM手术增加了小鼠滑膜组织中p-JNK和p-NF-κB p65的表达水平;而LIPUS治疗后的小鼠,p-JNK和p-NF-κB p65在滑膜中的表达水平较DMM组显著降低(P < 0.05,图 5, 表 2)。
|
| A、B:Raw 264.7细胞的Western blot检测及半定量分析结果 1:对照组;2、3:LIPUS组;4:LPS组;5、6:LPS+LIPUS组a:P < 0.05,与LPS组比较;C、D:THP-1细胞的Western blot检测及半定量分析结果 1:对照组;2:LIPUS组;3:LPS组;4:LPS+LIPUS组 图 4 Western blot检测各组p-JNK和p-NF-κB p65蛋白的表达 |

|
| M:半月板;T:胫骨;F:股骨;S:滑膜;白色虚线为滑膜组织边界线A:小鼠右膝关节F4/80和p-JNK共染;B:小鼠右膝关节F4/80和p-NF-κB p65共染 图 5 LIPUS对各组p-JNK和p-NF-κB p65蛋白表达的影响 |
| 组别 | p-JNK阳性细胞比例 | p-NF-κB p65阳性细胞比例 |
| 对照组 | 15.05±1.01 | 18.87±1.58 |
| DMM组 | 53.17±2.47a | 54.48±2.67a |
| DMM+LIPUS组 | 22.58±1.43b | 14.51±1.59b |
| a: P < 0.05, 与对照组比较;b: P < 0.05, 与DMM组比较 | ||
2.5 LIPUS抑制LPS诱导的THP-1细胞NF-κB p65入核
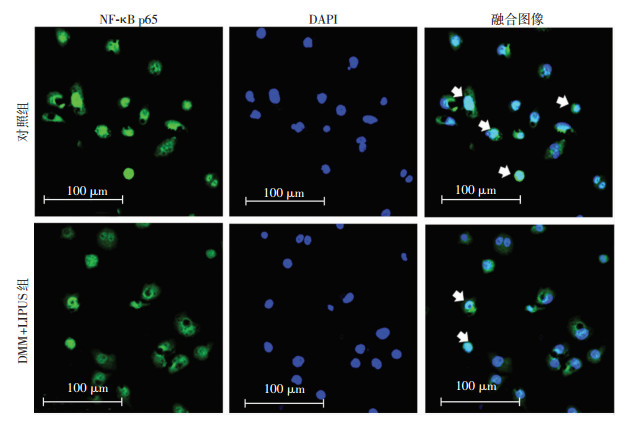
共聚焦显微镜观察可见,LPS+LIPUS组核内NF-κB p65阳性THP-1细胞数(36.50±2.33)较LPS组(74.08±3.35)显著减少(P < 0.01)。说明在LPS诱导的炎症环境下,LIPUS可以抑制THP-1细胞NF-κB p65进入细胞核,见图 6。
|
 :示典型核内NF-κB p65阳性细胞
图 6
LIPUS对THP-1细胞NF-κB p65入核的影响 :示典型核内NF-κB p65阳性细胞
图 6
LIPUS对THP-1细胞NF-κB p65入核的影响
|
3 讨论
骨性关节炎患者在临床上表现为关节疼痛、活动受限等,晚期患者只能行关节置换术,可导致劳动力丧失,给社会带来严重的经济负担。因此OA的预防以及延缓早期OA进程显得尤为重要[1]。临床上的非手术治疗包括非甾体类药物、激素、生物因子等[15]。研究表明无创的物理治疗也可有效缓解创伤导致的关节炎症状,如疼痛和关节活动受限[5]。LIPUS是临床上常用的非侵入性物理治疗方法,临床研究提示其可缓解OA患者症状[8]。OA患者的疼痛症状与滑膜炎密切相关,滑膜炎是治疗OA的靶向组织[16]。本研究利用DMM手术小鼠模型模拟创伤后骨关节炎,发现2周的LIPUS处理可缓解OA引起的小鼠膝关节滑膜的厚度,提示LIPUS的治疗对OA的滑膜炎有一定的抑制作用。
滑膜炎表现为滑膜肥厚、畸形生长,血管增生与炎症反应,89%的膝关节OA患者有严重的滑膜炎[17]。膝关节的滑膜组织中主要有两种细胞:成纤维细胞和巨噬细胞。在OA患者关节局部可以看到大量活化的巨噬细胞聚集[18]。活化的巨噬细胞可分泌大量可溶性促炎因子,如IL-1β,TNF-α等,加速了OA的病理进程[19]。F4/80是巨噬细胞的特异性标志物,本研究中也发现DMM手术2周后的小鼠滑膜中,有大量F4/80阳性的巨噬细胞浸润。巨噬细胞具有异质性,在不同的微环境刺激下,巨噬细胞可以被极化为经典活化的巨噬细胞(即M1型巨噬细胞)和替代性活化的巨噬细胞(即M2型巨噬细胞)[20]。近期研究提示OA患者的滑膜中聚集着大量的M1型巨噬细胞,而M2型巨噬细胞在滑膜中的比例较少[21]。M1型巨噬细胞和M2型巨噬细胞的比例与OA的严重程度正相关[22]。促进M1型巨噬细胞向M2型巨噬细胞的转化可能是缓解OA滑膜炎的一种新策略[23]。研究报道,在急性肌肉组织损伤的大鼠模型中,LIPUS处理减少了损伤肌肉部位M1型巨噬细胞,而增加了M2型巨噬细胞的数量[24]。iNOS是M1型巨噬细胞的标志物,CD206是M2型巨噬细胞标志物。本研究发现,LIPUS可减少DMM手术后2周滑膜中iNOS阳性的巨噬细胞数量,增加CD206阳性巨噬细胞数, 提示LIPUS抑制OA滑膜中M1型巨噬细胞的极化,而促进M2型巨噬细胞极化可能是LIPUS缓解OA的一种重要机制。
本研究进一步用体外细胞模型探究LIPUS对巨噬细胞极化的影响,发现在正常培养条件下,LIPUS对THP-1和Raw 264.7巨噬细胞的M1型标志物IL-β和TNF-α没有明显影响,但可以促进巨噬细胞M2型标志物IL-10和Arg1的表达。LPS是激活巨噬细胞向M1型极化的刺激因子[25]。本研究进一步利用LPS诱导巨噬细胞极化,结果提示LIPUS抑制了M1型标志物的表达,而促进了M2型标志物的表达,在炎症刺激条件下,LIPUS对巨噬细胞的极化作用和体内实验的结果吻合。总之,研究的结果提示LIPUS可能通过促进滑膜M2型巨噬细胞和M1型巨噬细胞的比例缓解了OA的进程。
巨噬细胞的极化和JNK通路密切相关,使用JNK的抑制剂可以抑制巨噬细胞M1相关标志物的蛋白表达而促进M2型巨噬细胞的标志物表达[26]。NF-κB信号通路的活化也能促进M1型巨噬细胞的活化,导致炎症反应[27]。LIPUS调节巨噬细胞极化的具体分子机制并不完全清楚。本研究发现,在巨噬细胞中,LIPUS可以下调LPS诱导的磷酸化JNK和磷酸化p65蛋白的高表达,提示LIPUS抑制了炎症条件下JNK和NF-κB信号通路。有研究表明LIPUS能抑制LPS诱导成骨细胞的NF-κB核转位[28],本研究同样发现LIPUS抑制了LPS处理THP-1巨噬细胞所致的NF-κB p65入核,进一步提示LIPUS能抑制炎症条件下NF-κB信号通路的活化。总之,在炎症条件下,LIPUS可能通过抑制JNK和NF-κB信号通路的活化,进而抑制M1型巨噬细胞的极化,而促进巨噬细胞向M2型极化。
本研究在DMM手术模型中验证了LIPUS抑制滑膜炎,进一步用新的动物模型证实了LIPUS具有抗炎的功能。以往有研究表明LIPUS可以调控急性肌肉组织损伤部位巨噬细胞的极化[24],本研究在DMM手术模型中发现LIPUS能调控滑膜中巨噬细胞的极化状态,这可能也是LIPUS治疗OA的一种新的机制。本课题在体外水平研究了LIPUS对活化的巨噬细胞极化的影响,发现LIPUS能减少M1型巨噬细胞的标志物表达,而增加M2型巨噬细胞的标志物表达。在机制研究方面,本课题在体内外水平发现LIPUS能抑制炎症状态下的JNK和NF-κB信号通路,与之前在肌肉损伤模型中的报道结果一致[29],而文献[26-27]报道这两条通路均可以调控巨噬细胞的极化,因此LIPUS可能通过该机制调控巨噬细胞的极化。综上所述,LIPUS可通过抑制滑膜巨噬细胞向M1型极化,促进向M2型极化而抑制OA滑膜炎,该调控作用可能与LIPUS抑制JNK和NF-κB信号通路有关,该研究为LIPUS在临床上治疗OA提供了理论基础。
本研究存在一定局限性:本课题发现LIPUS可以降低炎症状态下巨噬细胞中JNK和NF-κB p65的磷酸化水平,抑制NF-κB p65入核,但LIPUS调控JNK和NF-κB信号通路具体分子机制需要下一步研究。LIPUS采用治疗骨折的临床参数,而LIPUS治疗OA的最优参数(频率、强度、占空比、处理时间)组合需要进一步研究,以达到最佳治疗效果。
| [1] | GLYN-JONES S, PALMER A J, AGRICOLA R, et al. Osteoarthritis[J]. Lancet, 2015, 386(9991): 376–387. DOI:10.1016/S0140-6736(14)60802-3 |
| [2] | HUNTER D J. Osteoarthritis[J]. Ann Int Med, 2007, 147(3): 8–16. |
| [3] | BAY-JENSEN A C, THUDIUM C S, GUALILLO O, et al. Biochemical marker discovery, testing and evaluation for facilitating OA drug discovery and development[J]. Drug Discov Today, 2018, 23(2): 349–358. DOI:10.1016/j.drudis.2017.10.008 |
| [4] | PRICE A J, ALVAND A, TROELSEN A, et al. Knee replacement[J]. Lancet, 2018, 392(10158): 1672–1682. DOI:10.1016/s0140-6736(18)32344-4 |
| [5] | VAN DE GRAAF V A, NOORDUYN J C A, WILLIGENBURG N W, et al. Effect of early surgery vs physical therapy on knee function among patients with nonobstructive meniscal tears[J]. JAMA, 2018, 320(13): 1328. DOI:10.1001/jama.2018.13308 |
| [6] | RUBIN C, BOLANDER M, RYABY J P, et al. The use of low-intensity ultrasound to accelerate the healing of fractures[J]. J Bone Joint Surg Am, 2001, 83-A(2): 259–270. |
| [7] | ROTHENBERG J B, JAYARAM P, NAQVI U, et al. The role of low-intensity pulsed ultrasound on cartilage healing in knee osteoarthritis: A review[J]. PM & R, 2017, 9(12): 1268–1277. DOI:10.1016/j.pmrj.2017.05.008 |
| [8] | ZHOU X Y, ZHANG XX, YU G Y, et al. Effects of low-intensity pulsed ultrasound on knee osteoarthritis: A meta-analysis of randomized clinical trials[J]. Bio Med Res Int, 2018, 2018: 1–7. DOI:10.1155/2018/7469197 |
| [9] | CHUNG J I, BARUA S, CHOI B H, et al. Anti-inflammatory effect of low intensity ultrasound (LIUS) on complete Freund's adjuvant-induced arthritis synovium[J]. Osteoarthr Cartilage, 2012, 20(4): 314–322. DOI:10.1016/j.joca.2012.01.005 |
| [10] | NAKAMURA T, FUJIHARA S, YAMAMOTO-NAGATA K, et al. Low-intensity pulsed ultrasound reduces the inflammatory activity of synovitis[J]. Ann Biomed Eng, 2011, 39(12): 2964–2971. DOI:10.1007/s10439-011-0408-0 |
| [11] | ZHANG X, HU B, SUN J C, et al. Inhibitory effect of low-intensity pulsed ultrasound on the expression of lipopolysaccharide-induced inflammatory factors in U937 cells[J]. J Ultrasound Med, 2017, 36(12): 2419–2429. DOI:10.1002/jum.14239 |
| [12] | ZHOU D X, HUANG C, LIN Z, et al. Macrophage polarization and function with emphasis on the evolving roles of coordinated regulation of cellular signaling pathways[J]. Cell Signal, 2014, 26(2): 192–197. DOI:10.1016/j.cellsig.2013.11.004 |
| [13] | PORTA C, RIMOLDI M, RAES G, et al. Tolerance and M2 (alternative) macrophage polarization are related processes orchestrated by p50 nuclear factor B[J]. Proc Nat Acad Sci U S A, 2009, 106(35): 14978–14983. DOI:10.1073/pnas.0809784106 |
| [14] | GLASSON SS, BLANCHET T J, MORRIS E A. The surgical destabilization of the medial meniscus (DMM) model of osteoarthritis in the 129/SvEv mouse[J]. Osteoarthr Cartilage, 2007, 15(9): 1061–1069. DOI:10.1016/j.joca.2007.03.006 |
| [15] | CHEVALIER X, EYMARD F, RICHETTE P. Biologic agents in osteoarthritis: hopes and disappointments[J]. Nat Rev Rheumatol, 2013, 9(7): 400–410. DOI:10.1038/nrrheum.2013.44 |
| [16] | O'NEILL T W, PARKES M J, MARICAR N, et al. Synovial tissue volume: A treatment target in knee osteoarthritis (OA)[J]. Ann Rheum Dis, 2016, 75(1): 84–90. DOI:10.1136/annrheumdis-2014-206927 |
| [17] | ROEMER F W, KASSIM JAVAID M, GUERMAZI A, et al. Anatomical distribution of synovitis in knee osteoarthritis and its association with joint effusion assessed on non-enhanced and contrast-enhanced MRI[J]. Osteoarthr Cartilage, 2010, 18(10): 1269–1274. DOI:10.1016/j.joca.2010.07.008 |
| [18] | KRAUS V B, MCDANIEL G, HUEBNER J L, et al. Directin vivo evidence of activated macrophages in human osteoarthritis[J]. Osteoarthr Cartil, 2016, 24(9): 1613–1621. DOI:10.1016/j.joca.2016.04.010 |
| [19] | BONDESON J, BLOM A B, WAINWRIGHT S, et al. The role of synovial macrophages and macrophage-produced mediators in driving inflammatory and destructive responses inosteoarthritis[J]. Arthritis Rheum, 2010, 62(3): 647–657. DOI:10.1002/art.27290 |
| [20] | LAWRENCE T, NATOLI G. Transcriptional regulation of macrophage polarization: enabling diversity withidentity[J]. Nat Rev Immunol, 2011, 11(11): 750–761. DOI:10.1038/nri3088 |
| [21] | ZHANG H Y, LIN C X, ZENG C, et al. Synovial macrophage M1 polarisation exacerbates experimental osteoarthritis partially through R-spondin-2[J]. Ann Rheum Dis, 2018, 77(10): annrheumdis-2018-213450. DOI: 10.1136/annrheumdis-2018-213450. |
| [22] | LIU B L, ZHANG M Q, ZHAO J M, et al. Imbalance of M1/M2 macrophages is linked to severity level of kneeosteoarthritis[J]. Exp Ther Med, 2018, 16(6): 5009–5014. DOI:10.3892/etm.2018.6852 |
| [23] | MANFERDINI C, PAOLELLA F, GABUSI E, et al. Adipose stromal cells mediated switching of the pro-inflammatory profile of M1-like macrophages is facilitated by PGE2: in vitro evaluation[J]. Osteoarthr Cartilage, 2017, 25(7): 1161–1171. DOI:10.1016/j.joca.2017.01.011 |
| [24] | DA SILVA JUNIOR E M, MESQUITA-FERRARI R A, FRANÇA C M, et al. Modulating effect of low intensity pulsed ultrasound on the phenotype of inflammatory cells[J]. Biomed Pharmacother, 2017, 96: 1147–1153. DOI:10.1016/j.biopha.2017.11.108 |
| [25] | ZHU L N, ZHAO Q J, YANG T, et al. Cellular metabolism and macrophage functional polarization[J]. Int Rev Immunol, 2015, 34(1): 82–100. DOI:10.3109/08830185.2014.969421 |
| [26] | GAO S, LI C W, ZHU Y J, et al. PEDF mediates pathological neovascularization by regulating macrophage recruitment and polarization in the mouse model of oxygen-induced retinopathy[J]. Sci Rep, 2017, 7: 42846. DOI:10.1038/srep42846 |
| [27] | SICA A, MANTOVANI A. Macrophage plasticity and polarization: in vivo veritas[J]. J Clin Invest, 2012, 122(3): 787–795. DOI:10.1172/JCI59643 |
| [28] | MAYU N G, TANABE N, MANAKA S, et al. LIPUS suppressed LPS-induced IL-1α through the inhibition of NF-κB nuclear translocation via AT1-PLCβ pathway in MC3T3-E1 cells[J]. J Cell Physiol, 2017, 232(12): 3337–3346. DOI:10.1002/jcp.25777 |
| [29] | ENGELMANN J, VITTO M F, CESCONETTO P A, et al. Pulsed ultrasound and dimethylsulfoxide gel treatment reduces the expression of pro-inflammatory molecules in an animal model of muscle injury[J]. Ultrasound Med Biol, 2012, 38(8): 1470–1475. DOI:10.1016/j.ultrasmedbio.2012.03.020 |



