目前,肺癌的受体显像和治疗已成为肿瘤学领域一个重要的研究方向。肺癌中80%~90%为非小细胞肺癌(non-small cell lung carcinoma,NSCLC),其中85%~90%的NSCLC细胞表面又过表达表皮生长因子受体(epidermal growth factor receptor,EGFR)[1-2]。EGFR是细胞增殖和信号传导的受体,与肿瘤细胞的增殖、血管生成、肿瘤侵袭、转移及细胞凋亡的抑制有关,是目前国内外最理想的肿瘤分子显像与靶向治疗的研究靶点[3-5]。
目前,针对EGFR受体显像与治疗研究的靶向药物主要为EGFR-TKI、单克隆抗体以及多肽。较EGFR-TKI和抗体而言,多肽拥有以下优点:对靶蛋白的亲和性较高、血液中清除速度快、免疫源性低、容易合成和修饰等。因此,多肽作为靶向肺癌的药物越来越受到青睐[6-7]。新型多肽GE11是通过噬菌体肽库筛选技术获得的小分子多肽,由12个氨基酸组成[7]。研究表明,GE11可以与EGFR特异性结合,高效靶向EGFR[8]。GE11作为靶向EGFR受体的载体,已经得到了较多的应用,并且在治疗NSCLC裸鼠荷瘤模型实验中有显著疗效。但是,通过核素标记小分子多肽GE11是否能达到分子显像和治疗的目的尚不清楚。因此,本研究拟用99mTc标记小分子多肽GE11制备靶向EGFR的小分子核素探针,鉴定其理化性质,并探讨其在荷瘤裸鼠体内生物分布及显像情况,旨在进一步为肺腺癌患者的早期诊治提供实验基础。
1 材料与方法 1.1 主要实验试剂及仪器小分子多肽GE11(相对分子质量为1 868,化学纯度为98.28%)委托强耀公司(江苏)合成;A549细胞株由本校生科院肿瘤放射医学实验室提供;BALB/c裸鼠购于重庆医科大学实验动物中心;新鲜人血清来自重庆医科大学附属第一医院血库;Na99mTcO4由原子高科股份有限公司提供;磷酸钠、氯化亚锡购于广东光华科技股份有限公司;氨水、冰醋酸、无水乙醇、浓盐酸购于重庆川东化工有限公司;丙酮购于上海展云化工厂;醋酸钠购于重庆博艺化学试剂有限公司;铝酸二氢钠购于成都市科龙化工试剂厂;GC-911型γ-免疫计数器购于中加光电仪器公司;Siemens Symbia T2 SPECT/CT显像仪购于德国Siemens公司。
1.2 方法 1.2.1 99mTc-GE11的制备参考查林等[9]的标记方法,即以GAGG作为双功能螯合剂进行多肽的99mTc标记,并重新探索确定标记试剂的用量。室温下,向含有GE11的2 mL EP管(15 μg/15 μL)中依次加入:0.05 mol/L盐酸溶液(pH=1.0)溶解的氯化亚锡10 μL (52 μg)、0.067 mol/L磷酸钠溶液(pH=13)300 μL、新鲜淋洗的高锝酸钠溶液100 μL(222 MBq),反应总体积为425 μL。然后充入氮气进行保护,用封口胶封闭EP管管口,在室温下以400 r/min的速度振荡30 min完成标记。然后加入20 μL 1 mol/L的磷酸二氢钠将标记溶液pH值调节到7.1左右。将100 μL反应后混合液上Sephadex G50柱纯化。
1.2.2 标记率、比活度及放化纯度的计算99mTc-GE11的标记率及放化纯度采用纸层析法进行检测,固定相为新华Ⅰ号滤纸,流动相分别为丙酮(展开剂Ⅰ)和乙醇/氨水/水(体积比为2 :1 :5)混合液(展开剂Ⅱ),纸层析后采用薄层色谱(TLC)计算各组分的放射性占比,然后根据公式计算标记率、比活度及放化纯度。99mTc-GE11的标记率(放化纯度)=100%-(展开剂Ⅰ前沿部分+展开剂Ⅱ原点部分)RCR。
1.2.3 最大结合实验采用不同活度(222、370、555、740 MBq)的99mTc标记GE11,每个活度采用3复管。探讨每管GE11螯合99mTc的最大活度。
1.2.4 体外稳定性实验将标记多肽99mTc-GE11密封后(充入氮气进行保护)分别置于常温下放置1、2、4、6、12 h,然后取微量样品进行纸层析,测定5个时间点的放化纯度(每个时间点采用3个复管)。
1.2.5 人血浆结合实验将100 μL标记多肽与100 μL的正常人血浆混匀,然后将其置于恒温箱中温育2 h。取出混合液,用Sephadex G50柱进行层析,用含有1% PSA的0.01 mol/L PBS作为平衡液和洗脱液,依次收集洗脱液(0.5 mL/管),然后测定每管的放射性。取100 μL标记多肽(放射性活度相同)与100 μL PBS混合液,同法进行柱层析,作为对照组。
1.2.6 HPLC分析实验采用SunfireTM C18色谱柱,99mTc-GE11进样50 μL,泵流速度为0.6 mL/min,分析25 min后,用试管收集其洗脱液(0.25 mL/管),然后用γ免疫计数仪测量每管的放射性,然后绘制时间-放射性曲线(T-A曲线)。
1.2.7 脂/水分配实验将100 μL标记多肽、400 μL 50 mmol/L PBS和500 μL辛醇加入细胞冻存管中混匀,常温下静置数分钟,等辛醇和其他液体分开后,用离心机离心4 min(12 000 r/min)。从水相和脂相中分别取出10 μL与100 μL样品,用γ放射计数仪分别测量其放射性。然后进行体积矫正后,按公式lgP=lg(有机相RC/水相RC)计算脂水分配系数。
1.2.8 半胱氨酸置换实验用0.01 mol/L PBS配置浓度为50、100、200、300 mmol/L的半胱氨酸溶液,各取50 μL上述半胱氨酸及0.01 mol/L PBS(对照组)(每个浓度3个复孔)加入到2 mL EP管中,各管中加入99mTc-GE11 50 μL(222 MBq)后混匀,置于37 ℃恒温箱中温育1 h。然后取样本进行纸层析(丙酮作为展开剂),计算游离99mTc的百分比。
1.2.9 细胞饱和实验实验组:在48孔板上接种对数期生长的A549细胞(2×104个/孔),继续培养12 h。分别在每孔加入浓度梯度为1、10、50、100、150、200 nmol/L的99mTc-GE11,每个浓度3个复孔。对照组:每孔同时加入1 000倍未标记的GE11。混匀后置于37 ℃孵育4 h。然后,用PBS洗涤3次。采用0.125%的胰酶消化细胞,用γ放射计数仪测量细胞悬液的cpm(1 cpm=1/60 Bq),并绘制多肽与受体饱和结合曲线。
1.2.10 99mTc-GE11在正常裸鼠体内生物分布选取正常裸鼠36只,按随机抽样法分为6组,每组6只,尾静脉注射100 μL新鲜99mTc-GE11(7.4 MBq),分别于注射后10、30、60、120、240、360 min将裸鼠颈椎脱臼法处死,取血液,心脏、肝脏、肺、脾、肾、胃、肠、股骨、脑、右大腿肌肉等组织器官称量,并用γ-免疫计数器测定其放射性计数,结果经参考源矫正后计算它们的每克组织百分注射剂量率。
1.2.11 荷人肺腺癌裸鼠模型的构建用RPMI 1640培养基培养A549细胞,取对数期生长的细胞,将细胞数调至5×107/mL,将0.2 mL细胞悬液接种至4周龄裸鼠右侧大腿皮下,待肿块体积大于1 cm3后,即可以用于99mTc-GE11 SPECT显像研究。
1.2.12 荷瘤裸鼠的SPECT受体显像提前2周用1%KI封闭荷瘤裸鼠的甲状腺组织,显像时取生长状况良好的裸鼠3只,采用戊巴比妥经腹腔麻醉后,通过尾静脉注射0.1 mL新鲜99mTc-GE11,俯卧位固定在木质试验台上,探头视野中心对准胸腹部中心,分别于注射1、2、4、16 h时进行SPECT静态显像,SPECT采集条件:采用低能准直器,采集Zoom为3.20,能峰为140 keV,矩阵为256×256,采集计数均为400 k,采集时间为5 min,显像仪器为双探头SPECT/CT。显像结束后,使用ROI技术计算肿瘤部位与对侧相应部位的放射性比值,并对肿瘤/非肿瘤放射性比值进行半定量分析。
1.3 统计学分析用SPSS 20.0统计软件分析,数据以x±s表示,计量资料采用单因素方差分析和t检验。检验水准:α=0.05。
2 结果 2.1 99mTc-GE11的标记率及比活度根据标记混合物中各放射性组分的比移值,计算99mTc-GE11的标记率为(93.12±0.83)%,比活度为(26.19±0.42)TBq/mmol,纯化后的放化纯度为(93.64±0.56)%。
2.2 不同活度99mTc标记GE11的标记率不同放射性活度99mTc标记GE11的标记率分别为:(93.12±0.83)%、(92.37±0.60)%、(91.07± 0.46)%与(90.22±0.27)%,差异无统计学意义(P>0.05)。其中,222 MBq 99mTc与GE11的结合率最大(图 1)。
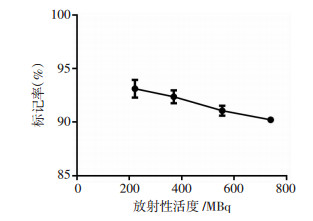
|
| 图 1 不同活度99mTc标记GE11的标记率分析 |
2.3 体外常温稳定性
99mTc-GE11溶液室温放置1、2、4、6、12 h后,其放化纯度分别为(92.17±0.55)%、(91.38±0.52)%、(91.06±0.49)%、(90.98±0.29)%、(90.01±0.27)%,其差异无统计学意义(P>0.05)。
2.4 人血浆结合实验99mTc-GE11与正常人血浆37 ℃温育2 h,然后经柱层析后显示:99mTc-GE11与血浆组的洗脱液放射峰有2个,即主峰出现在41管左右、次峰出现在18管左右;而99mTc-GE11与PBS组的洗脱液就一个峰值,出现在41管左右(图 2)。
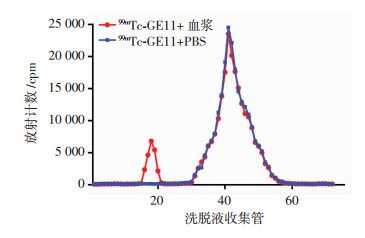
|
| 图 2 99mTc-GE11与血浆蛋白混合物柱层析洗脱液的T-A曲线分析 |
2.5 HPLC分析实验
99mTc-GE11放射峰的时间约为8.100 min(图 3),而GE11保留的时间约为8.087 min,两者的时间基本一致。
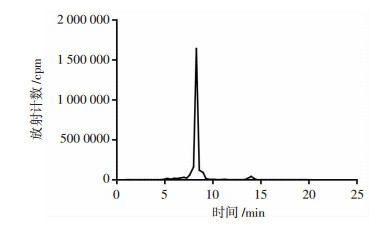
|
| 图 3 99mTc-GE11 HPLC洗脱液的时间-放射性曲线(T-A曲线)分析 |
2.6 脂/水分配实验
99mTc-GE11脂/水分配系数lgP为-(1.87±0.05)。
2.7 半胱氨酸置换实验游离99mTc百分比与对照组相比未见明显增加,均<0.75%(图 4)。游离99mTc随半胱氨酸的浓度增加而略有下降。
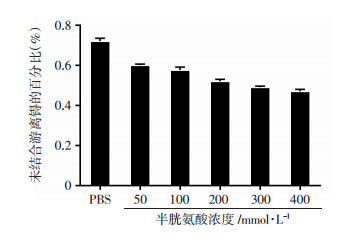
|
| 图 4 99mTc-GE11与不同浓度半胱氨酸温育1 h后游离锝的变化 |
2.8 99mTc-GE11体外生物活性鉴定
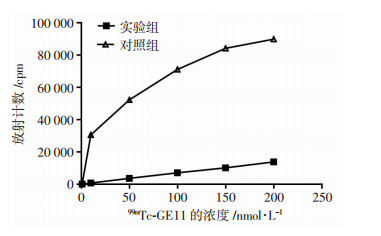
细胞饱和曲线分析结果显示:实验组A549细胞表面的放射性随着99mTc-GE11浓度的增加而升高,并逐渐趋于饱和;对照组随着99mTc-GE11浓度的增加,放射性计数逐步升高,但无饱和趋势,且其放射性远低于实验组(图 5)。
|
| 图 5 99mTc-GE11细胞饱和结合曲线分析 |
2.9 正常裸鼠体内生物分布实验
标记多肽经尾静脉注入裸鼠体内后,在60 min时,血液、肾脏的放射性较10 min时分别下降了90.2%、67%,肠的放射性在30 min时最高,肝、脾的放射性持续下降,心、肺的放射性快速减少,肺的放射性在1 h时下降了85.3%,表现为低放射性,肌肉、骨的放射性逐步减少,脑内放射性持续降低(表 1)。
| 组织器官 | 10 min | 30 min | 1 h | 2 h | 4 h |
| 血 | 1.43±0.29 | 0.43±0.10 | 0.14±0.05 | 0.08±0.01 | 0.06±0.02 |
| 心 | 0.44±0.11 | 0.16±0.06 | 0.08±0.04 | 0.05±0.08 | 0.03±0.01 |
| 肝 | 2.58±0.56 | 1.62±0.53 | 0.85±0.56 | 0.50±0.21 | 0.51±0.03 |
| 脾 | 1.20±0.68 | 1.01±0.24 | 0.75±0.32 | 0.32±0.15 | 0.48±0.05 |
| 肺 | 1.50±0.41 | 0.60±0.21 | 0.22±0.08 | 0.15±0.09 | 0.08±0.02 |
| 肾 | 6.32±1.16 | 4.43±1.12 | 2.10±0.32 | 2.12±0.58 | 1.98±0.32 |
| 胃 | 1.81±2.56 | 1.32±1.47 | 0.95±0.31 | 0.62±0.34 | 0.40±0.06 |
| 肠 | 0.45±0.07 | 3.90±1.60 | 1.32±0.98 | 1.18±1.64 | 1.15±1.09 |
| 骨 | 0.85±0.41 | 0.33±0.09 | 0.18±0.04 | 0.15±0.10 | 0.13±0.10 |
| 肌 | 0.50±0.30 | 0.19±0.06 | 0.15±0.07 | 0.12±0.05 | 0.14±0.04 |
| 脑 | 0.16±0.03 | 0.07±0.03 | 0.03±0.02 | 0.01±0.01 | 0.01±0.01 |
2.10 荷瘤裸鼠的SPECT受体显像
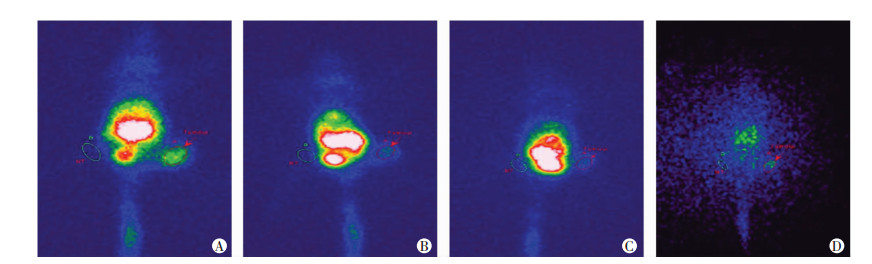
荷瘤裸鼠经尾静脉注射0.1 mL新鲜99mTc-GE11,裸鼠的肝、脾、肾显影随着时间延长,肠、膀胱显影逐渐清晰。在1 h时,肿瘤组织就显影清晰且肿瘤/非肿瘤放射性比值最高(图 6A),比值为(12.94±2.65),随着时间的延长,肿瘤/非肿瘤放射性比值逐渐降低(图 6B、C)。在16 h时,除了肿瘤组织和肠残留少量放射性分布外,裸鼠其余各部位基本未见明显放射性分布(图 6D)。
|
| A:1 h;B:2 h;C:4 h;D:16 h 图 6 99mTc-GE11在荷瘤裸鼠不同时间SPECT显像 |
3 讨论
近年来,肿瘤的发病率和病死率逐渐增加,严重威胁着人类的健康,建立肿瘤早期、特异性的诊断和治疗方法已成为亟待解决的重要问题之一。受体显像在肿瘤的早期诊断、早期治疗方面发挥着重要的作用,而受体显像最需要解决的是特异性显像剂(靶向药物)的问题[10]。目前,在靶向药物的研究中,常用的分子靶点,即受体主要有EGFR、VEGF、BRAF、HER-2、MET、ALT、K-ras、c-kit、PDGFR-α等[11]。本研究选择的EGFR是在肿瘤领域内应用较多的靶点之一[12]。EGFR属于酪氨酸激酶型受体,是一种糖蛋白,相对分子质量170。在恶性肿瘤中,EGFR的过表达起着重要的作用。在肺癌、乳腺癌、前列腺癌、胰腺癌、肾癌等肿瘤组织中都有不同程度的EGFR过表达[13-14]。
肿瘤细胞的生长、转移、凋亡受抗体、多肽、核酸以及其他小分子化合物等多种生物分子的干扰[15-16],其中,因为抗体、核酸类药物自身缺点(包括成本较高、生物结构复杂、细胞吸收困难、肝毒性较大、易产生免疫刺激等[17-18])而限制它们的广泛应用。本研究选择的小分子多肽GE11作为靶向药物的递送系统,已被广泛应用于基因和药物的肿瘤靶向导入,为EGFR高表达肿瘤患者带来了福音[19]。GE11是一种氨基酸序列为酪氨酸-组氨酸-色氨酸-酪氨酸-甘氨酸-酪氨酸-苏氨酸-脯氨酸-谷氨酰胺-天冬酰胺-缬氨酸-异亮氨酸(YHWYGYTPQNVI)的12肽。它由李宗海团队于2005年通过噬菌体肽库技术获得的[7],并发现其对高表达EGFR肿瘤细胞具有高度的亲和力。本研究选择了临床上最常用的放射性核素99mTc作为多肽的标记用核素,其具有物理性质优良,价格较便宜,来源方便,图像质量较好等优点。
目前,国内外对多肽的标记主要分为直接标记法和间接标记法,本研究采用的是间接标记法。首先委托江苏强耀公司将双功能螯合剂(GAGG)与多肽反应形成螯合剂-多肽复合物,再用99mTc与螯合剂结合形成络合物而完成标记。该方法的优点是螯合剂对标记分子的生物活性影响较小,标记稳定性较好[20]。而且采用间接标记法,可以为以后采用188Re、177Lu、153Sm等金属放射性核素标记小分子多肽提供实验基础。本研究发现,放射性核素99mTc能够成功对GE11进行标记,标记率为(93.12±0.83)%,能较好地满足实验的要求,纯化后放化纯度无明显提高,可能与纯化液中未结合99mTc较少、锝标记纯化液中其他杂质和纯化液因辐射自分解产生的少量杂质有关。99mTc-GE11的比活度为(24.21±0.42)TBq/mmol,比活度较高。标记多肽室温放置6 h后,其放化纯度仍有(90.98±0.29)%,提示其有良好的体外稳定性。人血清蛋白结合实验中第18管出现蛋白结合峰,说明标记多肽与血浆蛋白有结合,但结合量小,其放射性占比约为4.8%。HPLC实验中,两者保留时间基本一致,表明多肽的成分单一。脂/水分配实验lgP为-(1.87±0.05),表明标记多肽为亲水性,提示泌尿系统是标记多肽主要排泄途径。半胱氨酸置换实验显示实验组未结合99mTc与对照组相比无明显增加,提示99mTc与GE11螯合牢固。体外细胞实验显示99mTc-GE11与A549细胞可以特异性的结合,当加入过量的非标记GE11后,为非特异性结合,证实了标记后多肽仍具有良好的受体结合能力,其与EGFR结合的能力与非标记多肽相比无明显变化。正常裸鼠体内分布提示:99mTc-GE11在血液、肾脏中的放射性清除迅速。在1 h时,肺脏表现为低放射性分布,提示99mTc-GE11可以作为显像剂用于肺癌的显像研究。荷瘤裸鼠SPECT显像显示:肿瘤组织可以选择性浓聚99mTc-GE11,在注射1 h时,肿瘤/肌肉比值达到最大,且肿瘤组织显影最清晰,与传统显像剂的肿瘤/非肿瘤放射性比值大多数在2 h才达到最高峰不一致,可能是因为多肽分子量较小,肿瘤穿透能力较高所致。在16 h时,裸鼠肿瘤组织仍有少量放射性分布,说明99mTc-GE11在肿瘤内滞留时间较长。另外,裸鼠脑表现为持续低放射性,提示99mTc-GE11标记多肽不易穿过血脑屏障,可以将其用于对血脑屏障完整性的评估。
本实验结果显示:应用GAGG作为双功能螯合剂进行肺癌特异性靶向小分子多肽GE11的核素标记,具有标记方法简单可靠、标记率高、进入肿瘤的时间早、肿瘤与非肿瘤的放射性比值较高、稳定性较好、体内清除速度快等特点。因此,99mTc-GE11作为靶向EGFR的核素分子探针有潜力成为一种诊疗肺癌的新型靶向显像剂。但是,从基础研究转化成临床应用,99mTc-GE11不仅要克服多肽自身易于降解,细胞膜穿透性较低的缺陷,而且要面临人具有更系统更全面免疫机制保护的障碍,这也是本课题组以后研究的重点。
| [1] | SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2017, 67(1): 7–30. DOI:10.3322/caac.21332 |
| [2] | PASSIGLIA F, RIZZO S, DI MAIO M, et al. The diagnostic accuracy of circulating tumor DNA for the detection of EGFR-T790M mutation in NSCLC: A systematic review and meta-analysis[J]. Sci Rep, 2018, 8(1): 13379. DOI:10.1038/s41598-018-30780-4 |
| [3] | XU L, HAUSMANN M, DIETMAIER W, et al. Expression of growth factor receptors and targeting of EGFR incholangiocarcinoma cell lines[J]. BMC Cancer, 2010, 10: 302. DOI:10.1186/1471-2407-10-302 |
| [4] | WANG J S, WANG G B, LI B, et al. MiR-141-3p is a key negative regulator of the EGFR pathway in osteosarcoma[J]. Oncotargets Ther, 2018, 11: 4461–4478. DOI:10.2147/OTT.S171304 |
| [5] | SHEN J, ZHANG T, CHENG Z, et al. Lycorine inhibits glioblastoma multiforme growth through EGFR suppression[J]. J Exp Clin Cancer Res, 2018, 37(1): 157. DOI:10.1186/s13046-018-0785-4 |
| [6] | MENG Q Q, LI Z. Molecular imaging probes for diagnosis and therapy evaluation of breast cancer[J]. Int J Biomed Imaging, 2013, 2013: 230487. DOI:10.1155/2013/230487 |
| [7] | LI Z H, ZHAO R J, WU X H, et al. Identification and characterization of a novel peptide ligand of epidermal growth factor receptor for targeted delivery oftherapeutics[J]. FASEB J, 2005, 19(14): 1978–1985. DOI:10.1096/fj.05-4058com |
| [8] |
郭妍, 李宗海, 顾健人, 等. 新多肽配体GE11与表皮生长因子受体的结合能力分析[J].
分析测试学报, 2008, 27(12): 1318–1321.
GUO Y, LI Z H, GU J R, et al. Study on the binding ability of new peptide ligand GE11 and EGFR[J]. J Instrum Anal, 2008, 27(12): 1318–1321. DOI:10.3969/j.issn.1004-4957.2008.12.012 |
| [9] |
查林, 冯世斌, 郑磊, 等. 整合素αvβ3放射性配体99Tcm-TP1326的制备及其正常兔显像研究[J].
第三军医大学学报, 2012, 34(3): 235–238.
CHA L, FENG S B, ZHENG L, et al. Preparation of 99Tcm-TP1326 targeting integrin αvβ3 receptor and its imaging in rabbits[J]. J Third Mil Med Univ, 2012, 34(3): 235–238. DOI:10.16016/j.1000-5404.2012.03.024 |
| [10] |
丁小江, 郑磊, 黄定德, 等. 99Tcm标记VPAC1配体TP1724及其在动物体内分布与显像研究[J].
第三军医大学学报, 2016, 38(19): 2107–2113.
DING X J, ZHENG L, HUANG D D, et al. Distribution and imaging of a 99Tcm-labeled linear peptide derived from vasoactive intestinal peptide receptor in vivo[J]. J Third Mil Med Univ, 2016, 38(19): 2107–2113. DOI:10.16016/j.1000-5404.201603049 |
| [11] |
邹丹丹, 窦骏. 恶性肿瘤的分子靶点检测和靶向治疗[J].
临床与实验病理学杂志, 2012, 28(9): 1026–1029.
ZOU D D, DOU J. Molecular target detection and targeted therapy for malignant tumors[J]. Chin J Clin Exp Pathol, 2012, 28(9): 1026–1029. DOI:10.13315/j.cnki.cjcep.2012.09.035 |
| [12] | XU N Q, FANG W F, MU L B, et al. Overexpression of wildtype EGFR is tumorigenic and denotes a therapeutic target in non-small cell lung cancer[J]. Oncotarget, 2016, 7(4): 3884–3896. DOI:10.18632/oncotarget.6461 |
| [13] | LEE M. Is EGFR expression important in non-small cell lung cancer?[J]. Thorax, 2006, 61(2): 98–99. DOI:10.1136/thx.2005.047936 |
| [14] | CONSTANTINOU C, PAPADOPOULOS S, KARYDA E, et al. Expression and clinical significance of claudin-7, PDL-1, PTEN, c-kit, c-met, c-myc, ALK, CK5/6, CK17, p53, EGFR, ki67, p63 in triple-negative breast cancer-A single centre prospective observational study[J]. In Vivo, 2018, 32(2): 303–311. DOI:10.21873/invivo.11238 |
| [15] | LOUD J T, PETERS J A, FRASER M, et al. Applications of advances in molecular biology and genomics to clinical cancer care[J]. Cancer Nurs, 2002, 25(2): 110–122. DOI:10.1097/00002820-200204000-00007 |
| [16] | HOPKINSA L, GROOM C R. The druggable genome[J]. Nat Rev Drug Discov, 2002, 1(9): 727–730. DOI:10.1038/nrd892 |
| [17] | GOLDENBERG D M. Advancing role of radiolabeled antibodies in the therapy of cancer[J]. Cancer Immunol, Immunother, 2003, 52(5): 281–296. |
| [18] | TARHINI A A, KIRKWOOD J M. Clinical and immunologic basis of interferon therapy in melanoma[J]. Ann N Y Acad Sci, 2009, 1182: 47–57. DOI:10.1111/j.1749-6632.2009.05073.x |
| [19] |
李宗海.表皮生长因子受体介导的靶向性基因治疗导入系统[D].上海: 复旦大学, 2005.
LI Z H. Epidermal growth factor receptor-targeted gene delivery system[D]. Shanghai: Fudan University, 2005. |
| [20] |
李贵平, 黄宝丹, 杜丽, 等. 99mTc标记的新型肺癌多肽分子探针及其生物学分布[J].
南方医科大学学报, 2013, 33(8): 1169–1172.
LI G P, HUANG B D, DU L, et al. 99mTc radiolabeling of a novel polypeptide molecular probe for lung cancer and its biodistribution in animals[J]. J South Med Univ, 2013, 33(8): 1169–1172. DOI:10.3969/j.issn.1673-4254.2013.08.15 |



