2. 110016 沈阳,北部战区总医院干一科
2. First Cadre Ward, General Hospital of Northern Theater Command, Shenyang, Liaoning Province, 110016, China
抑郁症是一种慢性、反复发作、会危及生命的情绪障碍疾病,其临床表现主要为情绪消极、易疲劳、集中精力能力差、自我的内疚感以及自杀倾向、甚至自杀[1]。有关抑郁症的病理机制研究表明,环境因素与遗传因素导致的过度炎症反应是其重要的发病机制[2],而脑内的炎症反应则与小胶质细胞的极化状态密切相关,当小胶质细胞处于M1型时,会导致过度的炎症反应,而当其处于M2型时,可以有效地抑制炎症反应。已有众多研究证实,调节小鼠海马中的小胶质细胞向M2型转化可以有效地改善抑郁症小鼠模型的抑郁样行为[3]。而沉默信息调节因子2相关酶1(silent mating-type information regulation 2 homolog 1, Sirt1)作为组蛋白去乙酰化酶的一种,可以有效地调节炎症反应,同时近期通过全基因组测序发现,在重度抑郁患者中存在Sirt1的基因突变位点[4]。那么,Sirt1能否通过调控小胶质细胞的极化来改善小鼠的抑郁样行为?本研究通过建立抑郁症小鼠模型,向颅内注射Sirt1激动剂,观察其对小鼠抑郁样行为以及海马中小胶质细胞极化情况的影响,并探讨其中的分子机制。
1 材料与方法 1.1 主要材料与试剂主要材料和试剂包括:Sirt1激动剂SRT2104(美国Selleck公司), 二甲亚砜(DMSO,美国Sigma公司), Sirt1抗体、离子钙接头蛋白(ionized calcium binding adapter molecule 1,Iba-1)抗体(英国Abcam公司), 主要组织相容性复合体Ⅱ (major histocompatibility complex,MHC-Ⅱ)抗体、CD206抗体(美国Biolegend公司), CD45抗体(美国Ebioscience公司), CD11b抗体(美国San Diego公司), GAPDH抗体(美国Boster公司), 糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK3β)抗体、P-GSK3β抗体、第10号染色体缺失的磷酸酶及张力蛋白同源的基因(phosphatase and tensin homolog deleted from chromosome 10, PTEN)抗体、P-PTEN抗体(美国Cell Signaling Technolog公司)等。
1.2 实验动物8周龄C57BL/6雄性小鼠(体质量18~22 g)购自陆军军医大学实验动物中心,小鼠饲养在温度恒定(21 ℃左右)和湿度适宜(50%左右)的洁净环境中,自由进食,分笼饲养。动物实验按照陆军军医大学实验动物管理及保护的有关规定进行。
1.3 实验分组与小鼠抑郁模型的建立共纳入60只8周龄C57BL/6雄性小鼠,按随机数字表法将小鼠完全随机分为空白对照组(Control,n=20)、CUMS组(n=20)和CUMS+Sirt1组(n=20),参考文献[5]报道的慢性温和不可预知性应激模型(chronic mild unpredictable stress,CUMS)的建立方法建立抑郁症小鼠模型,简述如下:食物与水剥夺20 h,水剥夺18 h,将笼子倾斜45°17 h,持续照明36 h,脏笼放置21 h,4 ℃水中游泳5 min,成对配笼2 h。以上过程随机反复进行,总共进行28 d。CUMS+Sirt1组:在CUMS完成前倒数第3天,配置Sirt1的激动剂SRT2104,浓度1 mol/L,用微量注射泵将其缓慢地注入到小鼠的双侧海马中,每侧海马注射5 μL,其定位坐标为:前囟向后2.0 mm, 向左或者向右1.5 mm和2.0 mm深。注射结束后10 min,缓慢拔出微量注射针,并缝合头皮。空白对照组采用相同的方法,向海马中注入相同剂量的生理盐水。
1.4 糖水偏好实验在给药4 d后,对小鼠进行糖水偏好实验。每组7只小鼠进行行为学检测,参考文献[6]方法进行,简述如下:首先将小鼠的食物与水剥夺24 h,用2个相同的瓶子分别盛满小鼠饮用水和1%浓度的糖水,并分别称体质量,让小鼠自由饮用1 h后,再次称体质量,计算小鼠对糖水的偏好程度, 具体算法如下:糖水偏好程度=饮用糖水量/(饮用糖水量+饮用普通水量)×100%。
1.5 强迫游泳实验在给药5 d后,对小鼠进行强迫游泳实验,参考文献[7]报道的方法进行,简述如下:首先将小鼠放入行为学检测室适应24 h后,将小鼠放于50 cm×20 cm大小并盛有25 ℃、40 cm深的水中,录像6 min,记录后4 min内小鼠的不动时间。
1.6 悬尾实验在给药6 d后,对小鼠进行悬尾实验,参考文献[8]方法进行,简述如下:进行悬尾实验前,将小鼠放入行为学检测室适应24 h后,将小鼠的尾巴用胶带固定于挂钩上,距离地面40 cm,录像6 min,记录后4 min内小鼠的不动时间。
1.7 免疫荧光检测小鼠抑郁模型建成后,取材,利用4%多聚甲醛固定24 h,并用30%蔗糖+4%多聚甲醛脱水48 h,冰冻切片。用0.01 mol/L PBS漂洗切片,加入一抗(rabbit anti-Iba-1),4 ℃孵育12 h,漂洗,加入荧光二抗(Cy3 anti-rabbit),放入37℃孵箱中反应2 h,加入DAPI染细胞核,漂洗,贴片,等待切片干燥后进行封片。利用荧光显微镜采图,并统计海马中Iba-1阳性细胞的密度,具体计数方法如下:先计算出海马的面积S,再计算出Iba-1阳性细胞N,细胞密度=N/S。每组共采用4个样本进行检测。
1.8 Western blot检测将海马组织放入组织裂解液中,并加入蛋白酶抑制剂,进行充分研磨,离心,取上清。利用BCA法绘制标准蛋白曲线,并算出样本的蛋白浓度。配置SDS-PAGE凝胶,加入等量的蛋白样品,进行SDS-PAGE电泳、转膜,分别加入Sirt1、GSK3β、P-GSK3β、PTEN、P-PTEN和GAPDH的抗体,孵育12 h,漂洗,加入对应的二抗,在37 ℃孵箱中反应2 h,漂洗,加入发光液曝光,用Bio-Rad ChemiDoc MP多功能成像系统显影成像。并用ImageJ软件进行灰度值计算,以GAPDH为内参,计算出目的蛋白表达量,并以Control组为对照,分别计算出CUMS组与CUMS+Sirt1组的相对表达量,进行统计学分析。每组共采用4个样本进行检测。
1.9 流式细胞分析取一侧脑组织加入2 mL组织解离液,剪碎,37 ℃消化45 min,终止消化,用滤网过滤,离心,再加入10 mL 37% Percoll重悬,差速离心,吸取中间层,加入DPBS重悬,制备得到单细胞悬液,分别取200 mL加入MHC-Ⅱ抗体、CD206抗体、CD45抗体、CD11b抗体孵育20 min,离心,清洗,上流式细胞仪进行分析。每组共采用4个样本进行检测。
1.10 实时定量PCR将海马组织放入1.5 mL无酶管中,加入1 mL的TRIzol,充分研磨,并加入200 μL的氯仿,剧烈震荡后离心,取上层无色水相,加入等体积的异丙醇,颠倒混匀,静置10 min,离心后弃上清,洗涤沉淀,室温放置晾干,加入20 μL的无酶水,用紫外分光光度仪检测RNA浓度及纯度。按照试剂盒说明书上的步骤去除DNA杂质、逆转录成cDNA,最后分别加入不同的引物进行实时定量PCR检测。每组共采用4个样本进行检测。
1.11 统计学分析采用SPSS 20.0统计软件分析,计量资料以x±s表示,多组间比较采用单因素方差分析,两组间比较进行LSD-t检验。检验水准:α=0.05。
2 结果 2.1 Sirt1激动剂对CUMS小鼠抑郁样行为的影响行为学检测结果显示,注射Sirt1激动剂可以有效降低CUMS小鼠在强迫游泳实验的不动时间(P<0.01,图 1A)以及在悬尾实验中的不动时间(P<0.01,图 1B),并可有效促进CUMS小鼠对糖水的偏好程度(P<0.01,图 1C)。
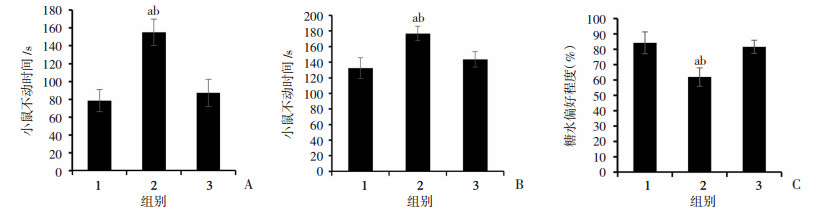
|
| A:小鼠进行强迫游泳实验的不动时间;B:小鼠进行悬尾实验的不动时间;C:小鼠糖水偏好程度 1: Control组; 2: CUMS组; 3: CUMS+Sirt1组; a:P<0.01,与Control组比较;b:P<0.01,与CUMS+Sirt1组比较 图 1 Sirt1激动剂对CUMS小鼠抑郁样行为的影响 |
2.2 Sirt1激动剂对CUMS小鼠海马中小胶质细胞的影响
免疫荧光染色结果显示,注射Sirt1激动剂对CUMS小鼠海马中小胶质细胞的密度无影响(P>0.05,图 2)。另外,流式细胞术检测结果显示,Sirt1激动剂注射后,小鼠脑中CD45+ CD11b+(小胶质细胞)的细胞数差异也无统计学意义(P>0.05,图 3A、D),然而,注射Sirt1激动剂会使CUMS小鼠脑中CD11b+ MHCⅡ+(M1型小胶质细胞)的细胞数显著减少(P<0.01,图 3B、E),同时使CUMS小鼠脑中CD11b+ CD206+(M2型小胶质细胞)的细胞数显著增加(P<0.01,图 3C、F),并显著降低CUMS小鼠脑中M1/M2的比率(P<0.01,图 3G)。
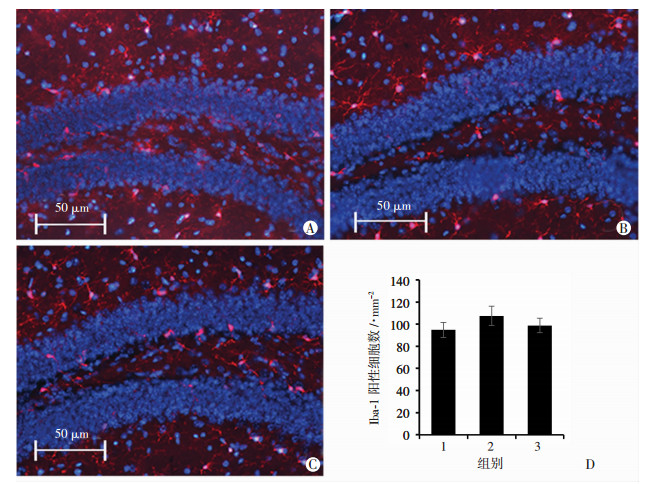
|
|
A~C:Control组、CUMS组和CUMS+Sirt1组小鼠海马中Iba-1免疫荧光染色;D:小鼠海马中Iba-1阳性细胞密度统计分析 1: Control组; 2: CUMS组; 3: CUMS+Sirt1组 图 2 Sirt1激动剂对CUMS小鼠海马中小胶质细胞数量的影响 |
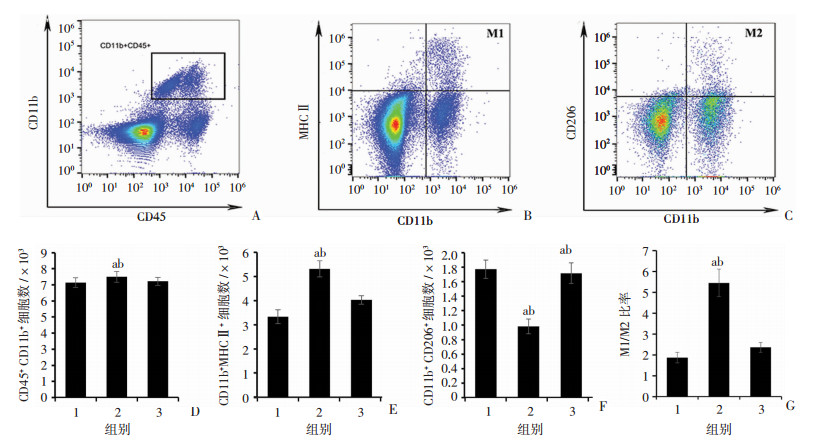
|
|
A:流式细胞术检测CD45+ CD11b+细胞;B:流式细胞术检测CD11b+ MHCⅡ+细胞;C:流式细胞术检测CD11b+ CD206双阳性细胞;D:小鼠脑中CD45+ CD11b+细胞总数统计分析;E:小鼠脑中CD11b+ MHCⅡ+细胞(M1型小胶质细胞)总数统计分析;F:小鼠脑中CD11b+ CD206+细胞(M2型小胶质细胞)总数统计分析;G:小鼠脑中M1/M2型小胶质细胞细胞比率统计分析 1: Control组; 2: CUMS组; 3: CUMS+Sirt1组; a:P<0.01,与Control组比较;b:P<0.01,与CUMS+Sirt1组比较 图 3 Sirt1激动剂对CUMS小鼠脑中小胶质细胞细胞极化的影响 |
2.3 Sirt1激动剂对CUMS小鼠海马中炎症因子的影响
实时定量PCR检测结果显示,注射Sirt1激动剂会显著下调CUMS小鼠海马中M1型小胶质细胞相关的炎症因子IL-6与IL-1β的表达量(P<0.01,图 4A、B),并且会显著地上调M2型小胶质细胞相关的炎症因子IL-10与TGF-β的表达量(P<0.01,图 4C、D)。
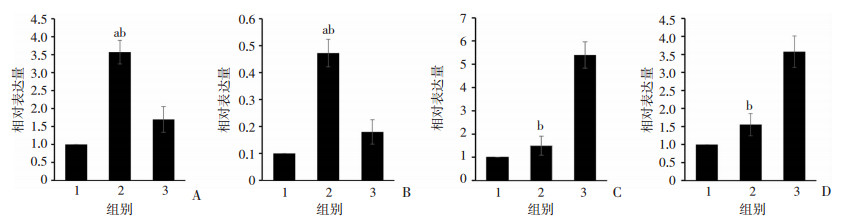
|
| A:IL-6 mRNA表达;B:IL-1β mRNA表达;C:IL-10 mRNA表达;D:TGF-β mRNA表达 1: Control组; 2: CUMS组; 3: CUMS+Sirt1组; a:P<0.01,与Control组比较;b:P<0.01,与CUMS+Sirt1组比较 图 4 Sirt1激动剂对CUMS小鼠海马中炎症因子表达量的影响 |
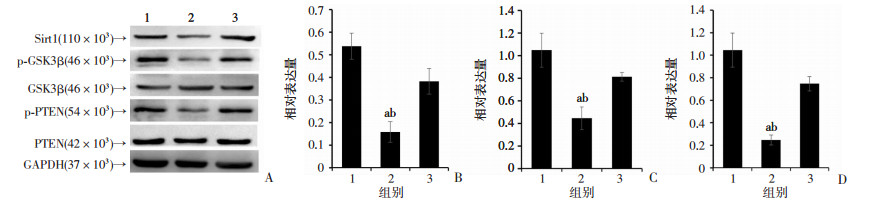
2.4 Sirt1激动剂对CUMS小鼠海马中GSK3β/PTEN信号通路的影响
Western blot检测结果显示,注射Sirt1激动剂会显著上调CUMS小鼠海马中Sirt1蛋白的表达(P<0.01,图 5A、B),同时会促进CUMS小鼠海马中GSK3β的磷酸化水平(P<0.01,图 5A、C)以及PTEN蛋白的磷酸化水平(P<0.01,图 5A、D)。
|
|
A:Western blot检测结果;B:Sirt1蛋白表达半定量分析;C:p-GSK3β蛋白表达半定量分析;D:p-PTEN蛋白表达半定量分析 1: Control组; 2: CUMS组; 3: CUMS+Sirt1组; a:P<0.01,与Control组比较;b:P<0.01,与CUMS+Sirt1组比较 图 5 Sirt1激动剂对CUMS小鼠海马中Sirt1表达量及GSK3β/PTEN磷酸化水平的影响 |
3 讨论
本研究发现,在CUMS诱导的小鼠抑郁模型中,海马组织中的Sirt1表达显著降低,当上调抑郁小鼠海马中Sirt1的表达后,可以有效地改善相关的抑郁样行为,同时可以使抑郁小鼠脑内的M1型小胶质细胞向M2型转化,减轻脑内的炎症反应,其中相关的分子机制则和GSK3β/PTEN信号通路相关。本研究结果提示,Sirt1是CUMS导致小鼠抑郁样行为的关键分子,通过上调海马中Sirt1的表达可为治疗抑郁症提供新的方法。
目前,炎症反应在抑郁症发生、发展中的作用日益得到广泛的关注。在众多的抑郁症动物模型中,包括CUMS、慢性限制性应激等抑郁症模型,脑内的小胶质细胞都处于过度的激活状态,相关炎症因子的表达水平也会显著上调[9-10]。同时,有研究通过检测抑郁症患者血液中的炎症因子表明,相关的促炎因子都处于较高的水平,比如IL-1β、IL-6、TNF-α等[11-12]。另外,众所周知的是,脑内的炎症反应与小胶质细胞的极化密切相关,当小胶质细胞处于M1型时,会起到促炎的作用,导致过度的炎症反应。而当小胶质细胞处于M2型时,可以有效地抑制炎症反应。其中小胶质细胞的极化状态受众多分子调控,比如IL-6、IL-1β、TNF-α等因子会使小胶质细胞向M1型转化,而IL-10、TGF-β、IL-4等因子可以使小胶质细胞朝着M2型转化[13-14]。已有研究证实GSK3β/PTEN信号通路是介导小胶质细胞表型转化的重要通路。这也在本研究中得到了进一步的证实[15-16]。既往有关小胶质细胞与抑郁症发生的相关性研究表明,在抑郁症小鼠脑内的小胶质细胞更多处于M1型,当通过干预手段,比如丹酚酸B通过促使抑郁症小鼠脑内的小胶质细胞向M2型转化后,可以有效改善抑郁症小鼠的相关症状[17-18]。这也充分说明了小胶质细胞的极化状态在抑郁症的发生、发展以及治疗中扮演着至关重要的作用。
沉默信息调节因子2(silent information regulator 2,Sir2)-相关酶类(Sir2-related enzymes,sirtuins)是最近发现的烟酰胺腺嘌呤二核苷酸依赖的第Ⅲ类组蛋白去乙酰化酶类,包括Sirt1~Sirt7七种家族成员。而Sirt1作为Sirtuins家族重要的成员之一, 研究证明Sirt1与细胞增殖、分化、衰老、凋亡和代谢等密切相关[19],并且最新研究证实Sirt1是重度抑郁症患者中重要的突变位点,可能介导了抑郁症的发生[4]。同时,在许多其他疾病模型中发现,Sirt1能够抑制过度的炎症反应来起到治疗的效果,比如在颅脑创伤小鼠模型中,ω-3不饱和脂肪酸能够通过促进Sirt1的表达来抑制颅脑创伤引起的过度炎症反应,进而起到治疗的效果[20]。而SRT2104,作为Sirt1的一种选择性激动剂,在既往研究中发现能够显著促进Sirt1的表达[21]。本研究发现,CUMS小鼠海马中的Sirt1水平明显降低,而通过注射SRT2104以后可以显著上调Sirt1的表达,并能有效使CUMS小鼠脑内的M1型小胶质细胞向M2型转化,进而改善CUMS小鼠相关的抑郁症状,进一步提示Sirt1可作为抑郁症治疗的关键靶点。
综上所述,本研究从小胶质细胞极化的角度探讨了Sirt1在抑郁症发生、发展中的作用。发现在抑郁症小鼠海马中Sirt1的表达水平存在明显下调,而当促进Sirt1的表达后,可以有效地改善小鼠的抑郁相关症状,并发现了Sirt1激动剂治疗抑郁症的相关分子机制可能与GSK3β/PTEN信号通路介导的小胶质细胞表型转化有关。因此,下一步可以进行Sirt1涉及相关通路的阻断研究,可为将来进行抑郁症患者的相关研究提供更充分的理论依据。
| [1] | MOUSSAVI S, CHATTERJI S, VERDES E, et al. Depression, chronic diseases, and decrements in health: results from the World Health Surveys[J]. Lancet, 2007, 370(9590): 851–858. DOI:10.1016/S0140-6736(07)61415-9 |
| [2] | LEE Y, SUBRAMANIAPILLAI M, BRIETZKE E, et al. Anti- cytokine agents for anhedonia: targeting inflammation and the immune system to treat dimensional disturbances in depression[J]. Ther Adv Psychopharmacol, 2018, 8(12): 337–348. DOI:10.1177/2045125318791944 |
| [3] | ZHANG L J, ZHANG J Q, YOU Z L. Switching of the microglial activation phenotype is a possible treatment for depression disorder[J]. Front Cell Neurosci, 2018, 12: 306. DOI:10.3389/fncel.2018.00306 |
| [4] | CONVERGE CONSORTIUM. Sparse whole-genome sequenc-ing identifies two loci for major depressive disorder[J]. Nature, 2015, 523(7562): 588–591. DOI:10.1038/nature14659 |
| [5] | TANG C Z, YANG J T, LIU Q H, et al. Up-regulated miR-192-5p expression rescues cognitive impairment and restores neural function in mice with depression via the Fbln2-mediated TGF-β1 signaling pathway[J]. FASEB J, 2019, 33(1): 606–618. DOI:10.1096/fj.201800210RR |
| [6] | SU W J, ZHANG Y, CHEN Y, et al. NLRP3 gene knockout blocks NF-κB and MAPK signaling pathway in CUMS-induced depression mouse model[J]. Behav Brain Res, 2017, 322(Pt A): 1–8. DOI:10.1016/j.bbr.2017.01.018 |
| [7] | LIU L, ZHANG Q, CAI Y L, et al. Resveratrol counteracts lipopolysaccharide-induced depressive-like behaviors via enhanced hippocampal neurogenesis[J]. Oncotarget, 2016, 7(35): 56045–56059. DOI:10.18632/oncotarget.11178 |
| [8] | NI Y F, WANG H, GU Q Y, et al. Gemfibrozil has antidepressant effects in mice: Involvement of the hippocampal brain-derived neurotrophic factor system[J]. J Psychopharmacol (Oxford), 2018, 32(4): 469–481. DOI:10.1177/0269881118762072 |
| [9] | WANG Y H, XU J J, LIU Y, et al. TLR4-NF-κB signal involved in depressive-like behaviors and cytokine expression of frontal cortex and hippocampus in stressed C57BL/6 and ob/ob mice[J]. Neural Plast, 2018, 2018: 7254016. DOI:10.1155/2018/7254016 |
| [10] | TAN S J, WANG Y, CHEN K, et al. Ketamine alleviates depressive-like behaviors via down-regulating inflammatory cytokines induced by chronic restraint stress in mice[J]. Biol Pharm Bull, 2017, 40(8): 1260–1267. DOI:10.1248/bpb.b17-00131 |
| [11] | DEL GRANDE DA SILVA G, WIENER C D, BARBOSA L P, et al. Pro-inflammatory cytokines and psychotherapy in depression: Results from a randomized clinical trial[J]. J Psychiatr Res, 2016, 75: 57–64. DOI:10.1016/j.jpsychires.2016.01.008 |
| [12] | ZOU W, FENG R J, YANG Y. Changes in the serum levels of inflammatory cytokines in antidepressant drug-naïve patients with major depression[J]. PLoS ONE, 2018, 13(6): e0197267. DOI:10.1371/journal.pone.0197267 |
| [13] | CHERRY J D, OLSCHOWKA J A, O'BANION M K. Neuroinflammation and M2 microglia: the good, the bad, and the inflamed[J]. J Neuroinflammation, 2014, 11: 98. DOI:10.1186/1742-2094-11-98 |
| [14] | YANG J P, ZHAO Y Y, ZHANG L, et al. RIPK3/MLKL-mediated neuronal necroptosis modulates the M1/M2 polarization of microglia/macrophages in the ischemic cortex[J]. Cerebral Cortex, 2018, 28(7): 2622–2635. DOI:10.1093/cercor/bhy089 |
| [15] | ZHOU K, ZHONG Q, WANG Y C, et al. Regulatory T cells ameliorate intracerebral hemorrhage-induced inflammatory injury by modulating microglia/macrophage polarization through the IL-10/GSK3β/PTEN axis[J]. J Cereb Blood Flow Metab, 2017, 37(3): 967–979. DOI:10.1177/0271678X16648712 |
| [16] | WANG G H, SHI Y J, JIANG X Y, et al. HDAC inhibition prevents white matter injury by modulating microglia/macrophage polarization through the GSK3β/PTEN/Akt axis[J]. Proc Natl Acad Sci U S A, 2015, 112(9): 2853–2858. DOI:10.1073/pnas.1501441112 |
| [17] | ZHANG J Q, XIE X F, TANG M M, et al. Salvianolic acid B promotes microglial M2-polarization and rescues neurogenesis in stress-exposed mice[J]. Brain Behav Immun, 2017, 66: 111–124. DOI:10.1016/j.bbi.2017.07.012 |
| [18] | ZHAO Q Y, WU X H, YAN S, et al. The antidepressant-like effects of pioglitazone in a chronic mild stress mouse model are associated with PPARγ-mediated alteration of microglial activation phenotypes[J]. J Neuroinflammation, 2016, 13(1): 259. DOI:10.1186/s12974-016-0728-y |
| [19] | BUHRMANN C, BUSCH F, SHAYAN P, et al. Sirtuin-1 (SIRT1) is required for promoting chondrogenic differentiation of mesenchymal stem cells[J]. J Biol Chem, 2014, 289(32): 22048–22062. DOI:10.1074/jbc.M114.568790 |
| [20] | CHEN X R, CHEN C N, FAN S N, et al. Omega-3 polyunsaturated fatty acid attenuates the inflammatory response by modulating microglia polarization through SIRT1-mediated deacetylation of the HMGB1/NF-κB pathway following experimental traumatic brain injury[J]. J Neuroinflammation, 2018, 15(1): 116. DOI:10.1186/s12974-018-1151-3 |
| [21] | WU H, WU J, ZHOU S, et al. SRT2104 attenuates diabetes-induced aortic endothelial dysfunction via inhibition of P53[J]. J Endocrinol, 2018, 237(1): 1–14. DOI:10.1530/JOE-17-0672 |



