非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是以脂肪过度贮积于肝细胞内和肝细胞脂肪变性为特征的临床病理征,随着人们生活质量的提高和生活习惯、饮食结构的改变,脂肪肝的患病率逐年增加,并且患病年龄日趋年轻化[1]。NAFLD的发病机制目前尚未完全清楚,由DAY和JAMES[2]共同提出的“二次打击”学说受到普遍认可,即肝细胞内脂质沉积(第一次打击)导致一系列内质网应激、氧化应激等细胞毒性事件(第二次打击)。研究表明,若NAFLD在早期未得到及时的干预,可进一步发展为脂肪性肝炎,甚至肝硬化、肝癌[3]。
AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)是调节肝脏和脂肪组织等器官中葡萄糖和脂质代谢的能量传感器[4]。AMPK磷酸化后抑制下游脂肪酸从头合成关键靶标基因的表达,包括胆固醇调节元件结合蛋白(sterol regulatory element binding proteins,SREBPs)、脂肪酸合成酶(fatty acid synthase,FAS)和乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)。因此,AMPK逐渐成为代谢综合征的治疗靶点之一[5]。
人参皂苷Rg1(gensinoside Rg1)是人参中有效的活性成分之一,且无明显的细胞毒作用[6]。我们前期研究发现Rg1可以通过改善C57小鼠肝细胞脂质过氧化、内质网应激和炎症反应来缓解非酒精性脂肪肝[7],但该研究并未涉及Rg1在脂肪肝形成早期的关键脂质沉积环节中的作用以及可能的作用靶点。本研究旨在探讨Rg1是否通过抑制肝细胞内脂质沉积来缓解NAFLD以及探索AMPK在其中可能的作用,为NAFLD的治疗提供新的思路。
1 材料与方法 1.1 材料HepG2 cell细胞株购自武汉普诺赛生命科技有限公司; 人参皂苷Rg1(纯度>98%)购自大连美仑生物技术有限公司; 棕榈酸、DMSO均购自美国Sigma-Aldrich公司; Compound C(CC)购自美国Selleck生物技术有限公司; 胎牛血清购自美国GIBCO公司;高糖DMEM培养基购自美国HyClone公司;盐酸二甲双胍(metformin,MET)、不含游离脂肪酸BSA、油红染色试剂盒、甘油三酯(TG)含量检测试剂盒均购自北京索莱宝科技有限公司;总RNA提取试剂盒(离心柱)购自北京百泰克生物技术有限公司;引物由美国Invitrogen公司设计;逆转录试剂盒、All-in-one cDNA Synthesis SuperMix、SYBR greenⅡ均购自上海毕傲图生物科技有限公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体、胆固醇调节元件结合蛋白-1C(sterol regulatory element binding protein-1c,SREBP-1C)抗体均购自万类生物技术公司;腺苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK)、p-AMPK(Thr172)抗体、乙酰辅酶A羧化酶(acetyl-CoA carboxylase a,ACCa)抗体、p-ACCa(Ser79)抗体、脂肪酸合成酶(fatty acid synthase,FAS)抗体、抗兔IgG HRP辣根过氧化物酶标记均购自美国Cell Signaling Technology公司。
1.2 方法 1.2.1 细胞培养及分组将HepG2细胞培养在含10%胎牛血清的高糖DMEM培养基中,置于含5% CO2的37 ℃恒温培养箱中。当6孔板内的细胞密度达到60%~70%时,分成6组,分别于不同的处理。对照组:普通培养基培养(含等浓度溶解介质);模型组:0.25 mmol/L棕榈酸培养24 h后换普通培养基;人参皂苷Rg1组:0.25 mmol/L棕榈酸培养24 h,继以40 μg/mL Rg1干预6 h;二甲双胍组:0.25 mmol/L棕榈酸培养24 h,继以5 mmol/L二甲双胍干预6 h。模型+抑制剂组:0.25 mmol/L棕榈酸培养24 h,10 μmol/L CC(Compound C)处理1 h,换普通培养基培养6 h。人参皂苷Rg1+抑制剂组:0.25 mmol/L棕榈酸培养24 h,10 μmol/L CC预处理1 h,再以40 μg/mL Rg1干预6 h。
1.2.2 油红O染色4%多聚甲醛固定细胞30 min,PBS去除多余的甲醛,加入新鲜配制的油红O染色液(油红储存液:去离子水=3 :2)染色15 min,蒸馏水冲洗数次后置于显微镜下观察并拍照。异丙醇溶解染料后,置于酶标仪下,在485nm波长下测定各组光密度值D(485)。
1.2.3 TG测定收集细胞后,按照TG检测试剂盒说明书测定细胞内的TG含量。
1.2.4 实时荧光定量PCR采用SYBR greenⅡ预混液于荧光定量PCR仪上进行测定。β-actin基因作为内对照。基因引物序列见表 1。
| 基因 | 引物序列 | 片段大小/bp |
| SREBP-1C | 上游:5′-CGGAACCATCTTGGCAACAGT-3′ | 141 |
| 下游: 5′-CGCTTCTCAATGGCGTTGT-3′ | ||
| FAS | 上游:5′-AGATTGTGTGATGAAGGACATGG-3′ | 175 |
| 下游:5′-TGTTGCTGGTGAGTGTGCATT-3′ | ||
| β-actin | 上游:5′-GCCGACAGGATGCAGAAGG-3′ | 131 |
| 下游: 5′-TGGAAGGTGGACAGCGAGG-3′ |
1.2.5 Western blot检测
收集细胞,超声破碎仪超3次,每次持续15 s;4 ℃离心机14 000×g,离心15 min;留取上清液;BCA法测蛋白浓度后用6×蛋白上样缓冲液稀释配平,沸水中充分变性5 min;蛋白样品加样后经电泳、转膜至PVDF膜上;5%的脱脂奶粉封闭1 h;4 ℃冷藏室摇床过夜孵育相应一抗;PBST洗膜3次×10 min;室温摇床上孵育二抗1 h;PBST洗膜3次×10 min;ECL试剂显影。
1.3 统计学分析采用SPSS 20.0统计软件,所有数据以x±s表示。多组间比较单因素方差分析,分析前行方差齐性检验,方差齐用SNK-q法,方差不齐用非参数检验。检验标准:α=0.05。
2 结果 2.1 人参皂苷Rg1改善NAFLD细胞模型肝细胞脂质沉积油红O染色结果显示:与对照组比较,模型组细胞内[D(485)]值增加,脂滴聚集明显增加(P<0.05)。而与模型组比较,人参皂苷Rg1组与二甲双胍组[D(485)]值均有不同程度的降低,细胞内脂滴减少(P<0.05,图 1)。与对照组(1.87±0.15)mg/mL比较,模型组细胞内甘油三酯含量明显增加[(4.91±0.26)mg/mL,P<0.05], 经Rg1或二甲双胍干预后,细胞内甘油三酯含量均有所下降[(3.11±0.42)mg/mL, (2.56±0.48)mg/mL, P<0.05],且两组间差异无统计学意义(P>0.05)。
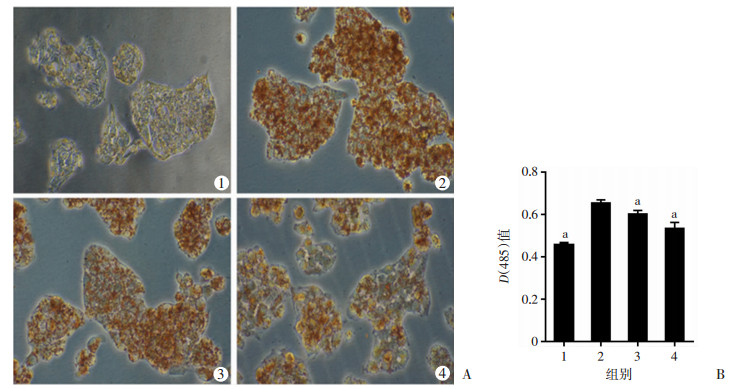
|
| A:油红O染色观察细胞内脂滴的沉积(×200);B:各组光密度值比较 1:对照组;2:模型组;3:人参皂苷Rg1组;4:二甲双胍组;a: P<0.05,与模型组比较 图 1 油红O染色观察各组细胞内脂滴的聚集 |
2.2 人参皂苷Rg1对AMPK的激活作用
Western blot检测结果显示:与对照组比较,模型组AMPK与ACCa的磷酸化明显减少(P<0.05);与模型组相比,人参皂苷Rg1组与二甲双胍组AMPK与ACCa的磷酸化均有不同程度增加(P<0.05), 且两组间差异无统计学意义(P>0.05)。但各组间总AMPK和总ACCa的表达差异无统计学意义(P>0.05,图 2)。
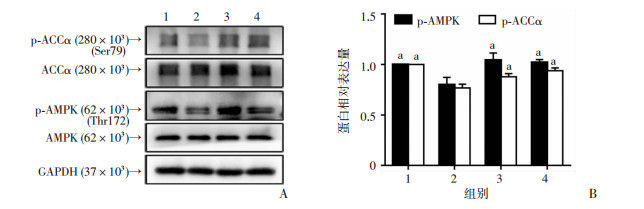
|
| A:Western blot检测结果;B:半定量分析 1:对照组;2:模型组;3:人参皂苷Rg1组;4:二甲双胍组;a: P<0.05,与模型组比较 图 2 Western blot检测AMPK通路蛋白的表达 |
2.3 人参皂苷Rg1能减少脂质代谢相关SREBP-1C和FAS的表达
Western blot检测结果显示:与对照组比较,模型组SREBP-1C前体、活化的SREBP-1C与FAS的表达均明显增加(P<0.05),与模型组比较,人参皂苷Rg1组和二甲双胍组SREBP-1C与FAS蛋白的表达明显下降(P<0.05)。且SREBP-1C在Rg1组与二甲双胍组之间表达差异无统计学意义(P>0.05,图 3A、B)。RT-qPCR检测结果显示, 模型组的SREBP-1C与FAS表达较对照组明显增加(P<0.05);与模型组比较,人参皂苷Rg1组及二甲双胍组SREBP-1C与FAS基因的表达均不同程度的下降(P<0.05),但两组间差异无统计学意义(P>0.05,图 3C)。
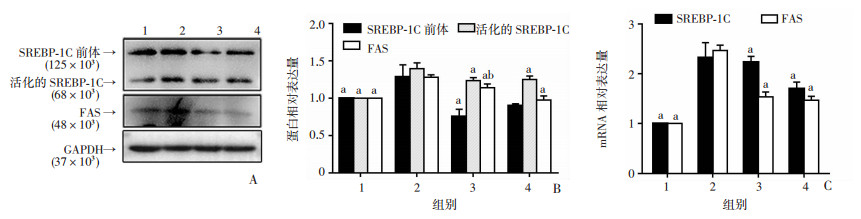
|
| A:Western blot检测结果;B:半定量分析;C:RT-qPCR检测结果 1:对照组;2:模型组;3:人参皂苷Rg1组;4:二甲双胍组;a: P<0.05,与模型组比较,b: P<0.05,与二甲双胍组比较 图 3 Western blot与RT-qPCR检测SREBP-1C、FAS的表达 |
2.4 AMPK抑制剂CC削弱人参皂苷Rg1对脂质沉积的改善作用
与人参皂苷Rg1组比较,CC预处理能增加细胞内脂滴的形成,人参皂苷Rg1+抑制剂组油红染色的[D(485)]值明显高于Rg1组,差异具有统计学意义(P<0.05,图 4);对照组、模型组、模型+抑制剂组细胞内TG含量分别为(2.08±0.27)、(5.01±0.27)、(6.50±0.31)mg/mL,人参皂苷Rg1+抑制剂组细胞内TG含量(4.38±0.19)mg/mL明显高于人参皂苷Rg1组(3.28±0.53)mg/mL,差异具有统计学意义(P<0.05)。
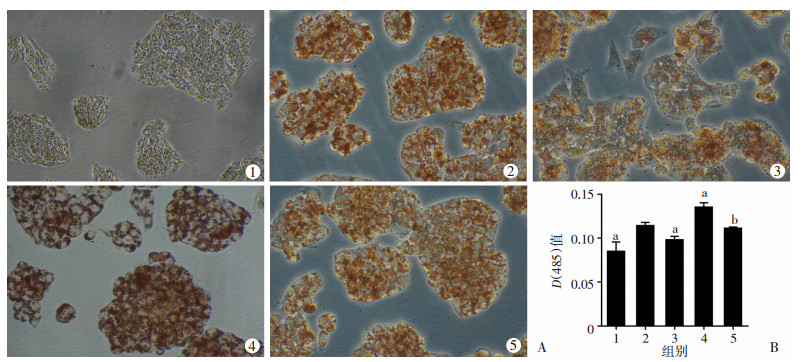
|
| A:油红O染色观察细胞内脂滴的沉积(×200);B:各组油红O染色分析 1:对照组;2:模型组;3:人参皂苷Rg1组;4:模型+抑制剂组;5:人参皂苷Rg1+抑制剂组;a: P<0.05,与模型组比较,b: P<0.05,与人参皂苷Rg1组比较 图 4 油红O染色观察CC对细胞内脂滴聚集的影响 |
2.5 AMPK抑制剂CC削弱人参皂苷Rg1对AMPK的激活作用
Western blot检测结果显示:与人参皂苷Rg1组比较,人参皂苷Rg1+抑制剂组的p-AMPK与p-ACCa表达明显降低(P<0.05)。但两组间总的AMPK和ACCa的表达差异无统计学意义(P>0.05,图 5)。

|
| A:Western blot检测结果;B:半定量分析 1:对照组;2:模型组;3:人参皂苷Rg1组;4:模型+抑制剂组;4:人参皂苷Rg1+抑制剂组;5:人参皂苷Rg1+抑制剂组;a: P<0.05,与模型组比较;b: P<0.05,与人参皂苷Rg1组比较 图 5 Western blot检测CC对AMPK、ACCa磷酸化的影响 |
2.6 AMPK抑制剂CC削弱Rg1对SREBP-1C、FAS的抑制作用
Western blot检测结果显示:与人参皂苷Rg1组比较,人参皂苷Rg1+抑制剂组SREBP-1C前体、活化的SREBP-1C与FAS蛋白的表达均明显增加(P<0.05,图 6)。RT-qPCR检测结果显示:与人参皂苷Rg1组比较,人参皂苷Rg1+抑制剂组SREBP-1C与FAS的mRNA表达也明显增加(P<0.05,图 6)。
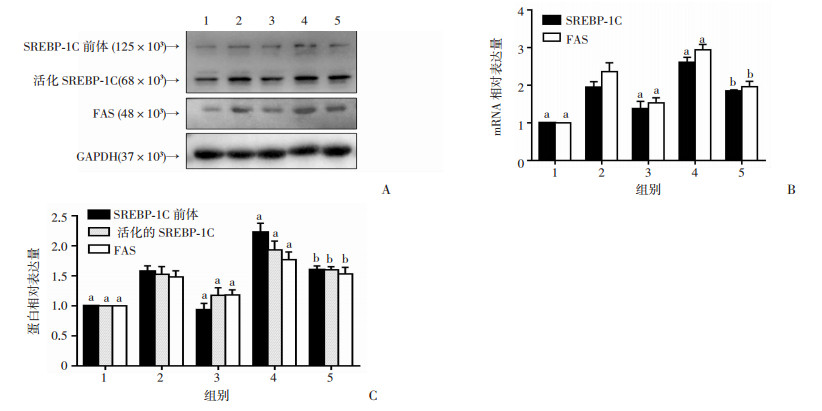
|
|
A:Western blot检测结果;B:RT-qPCR检测结果;C:半定量分析 1:对照组;2:模型组;3:人参皂苷Rg1组;4:模型+抑制剂组;4:人参皂苷Rg1+抑制剂组;a: P<0.05,与模型组比较;b: P<0.05,与人参皂苷Rg1组比较 图 6 Western blot与RT-qPCR检测CC对SREBP-1C、FAS的影响 |
3 讨论
NAFLD因其极高的发病率、巨大的经济负担而受到广泛关注,然而目前除了饮食和运动控制外,尚缺乏明确的药物治疗策略[8];因此,寻找NAFLD的新疗法格外紧迫。传统中药对肝病的治疗作用及分子机制近年来也得到越来越多的认可和关注,如白藜芦醇、甘草酸、绿茶提取物等[9]。我们前期的研究发现传统中药人参皂苷Rg1对肝脏也具有一定的保护作用[10-11],本研究探讨了Rg1在NAFLD形成初期对脂滴聚集的阻遏作用以及可能的机制。
棕榈酸是我们日常饮食中最充足的饱和脂肪酸之一,已知其可通过多种机制引起脂毒性。既往大量研究表明,二甲双胍可通过激活AMPK降低甘油三酯在肝细胞中的累积[12-13]。本研究采用0.25 mmol/L棕榈酸在HepG2细胞中成功建立了肝细胞脂质沉积模型,然后使用40 μg/mL Rg1或5 mmol/L二甲双胍探讨其在脂质沉积模型中的作用。研究发现棕榈酸可诱导肝细胞内脂质沉积,增加甘油三酯的总量。人参皂苷Rg1和二甲双胍均可改善棕榈酸诱导NAFLD细胞模型的脂滴聚集、降低甘油三酯的含量,且两者之间的改善作用差异较小。本研究发现人参皂苷Rg1在代谢中所起的作用与前期的报道一致:Rg1既往被报道能改善Ⅱ型糖尿病大鼠的糖代谢和肝损伤[14],且能在高脂诱导的肥胖小鼠中降低血糖和改善胰岛素抵抗[15]。
AMPK作为能量感受器,能系统地调节能量平衡,其活性受其上游肝激酶蛋白(liver kinase B1,LKB1)和钙调蛋白依赖性蛋白激酶(Calmodulin- dependent protein kinasekinase,CaMKK)的调节。CaMKK主要通过调节细胞内Ca2+浓度而激活AMPK;而当机体能量生成减少消耗增加时,主要由LKB1激活AMPK信号通路[16]。肥胖动物和人的脂肪组织中AMPK活性降低,限制营养摄入能够提高AMPK的活性,从而阻止肥胖的进展[4]。既往的研究表明,人参皂苷Rg1能通过调节AMPK在HepG2细胞和糖尿病小鼠模型内调节糖原生成[17-18]。本研究也发现Rg1可以提高HepG2细胞中AMPK的磷酸化水平。AMPK是下游ACC、SREBP-1C和FAS的主要激酶调节因子。其中ACC主要存在于合成脂类的组织(如肝脏和脂肪)的细胞质中;在肝脏中,ACC催化乙酰辅酶A形成丙二酰辅酶A,合成长链脂肪酸前体。AMPK磷酸化后促进ACC发生磷酸化导致ACC失活,从而减低游离脂肪酸的生成[16, 19]。本研究发现人参皂苷Rg1能够通过上调模型组的p-AMPK从而使ACC失活,抑制脂肪酸的合成,减轻肝脏的脂质代谢障碍。SREBP-1C作为重要转录因子,是调控脂肪酸合成过程中的关键酶,FAS则是催化乙酰辅酶A和丙二酰辅酶A、参与长链脂肪酸生成的内源性蛋白酶[20]。本研究发现Rg1能抑制脂质从头合成关键基因SREBP-1C和FAS的活性,减少脂质的生成。此外,通过抑制剂CC阻断AMPK能显著地减弱Rg1对棕榈酸诱导的HepG2细胞脂质沉积的保护作用以及Rg1对AMPK的激活作用,但其作用的具体上游分子还有待探究。已知AMPK还参与多种通路的调控,如激活过氧化酶活化增生受体-γ(Peroxisome proliferator-activated receptor, PPAR-γ)调节脂代谢[21],调控雷帕霉素蛋白(rapamycin, mTOR)促进细胞自噬等[22]。人参皂苷Rg1既往被报道通过激活AMPK增加自噬流抑制Raw264.7巨噬细胞的凋亡[23],通过自噬预防小鼠脓毒症相关脑病[24]。Rg1是否通过脂质自噬以缓解NAFLD还需进一步探索。
本研究仅探讨人参皂苷Rg1对体外肝细胞脂质沉积的影响,还需通过动物模型进一步探讨Rg1调控AMPK通路的具体机制,包括其上游可能的直接作用环节,以期能够发现NAFLD新的治疗靶点。
综上所述,本研究发现人参皂苷Rg1可以改善棕榈酸诱导的HepG2细胞中脂滴的聚集和TG的累积,这些有益作用至少部分归因于AMPK通路。尽管Rg1的潜在脱靶效应不容忽视,但Rg1可能是治疗NAFLD的有效药物,对开发新型且无细胞毒性的临床用药具有重要的价值。
| [1] | ANDRONESCU C I, PURCAREA M R, BABES P A. Nonalcoholic fatty liver disease: epidemiology, pathogenesis and therapeutic implications[J]. J Med Life, 2018, 11(1): 20–23. |
| [2] | DAY C P, JAMES O F. Steatohepatitis: a tale of two "hits"?[J]. Gastroenterology, 1998, 114(4): 842–845. DOI:10.1016/S0016-5085(98)70599-2 |
| [3] | KHAN R, BRIL F, KEN C S, et al. Modulation of insulin resistance in NAFLD[J]. Hepatology, 2018. DOI:10.1002/hep.30429 |
| [4] | ZHANG H A, YANG X Y, XIAO Y F. AMPKα1 overexpression alleviates the hepatocyte model of nonalcoholic fatty liver disease via inactivating p38MAPK pathway[J]. Biochem Bioph Res Com, 2016, 474(2): 364–370. DOI:10.1016/j.bbrc.2016.04.111 |
| [5] | CHOI Y J, LEE K Y, JUNG S H, et al. Activation of AMPK by berberine induces hepatic lipid accumulation by upregulation of fatty acid translocase CD36 in mice[J]. Toxicol Appl Pharmacol, 2017, 316: 74–82. DOI:10.1016/j.taap.2016.12.019 |
| [6] | NING C Q, GAO X G, WANG C Y, et al. Protective effects of ginsenoside Rg1 against lipopolysaccharide/d-galactosamine-induced acute liver injury in mice through inhibiting toll-like receptor 4 signaling pathway[J]. Int Immunopharm, 2018, 61: 266–276. DOI:10.1016/j.intimp.2018.06.008 |
| [7] | 徐雅姝, 黄文祥, 阳成, 等.人参皂苷Rg1对小鼠非酒精性脂肪肝的改善作用和机制研究[J/OL].重庆医科大学学报. [2019-05-31]. |
| [8] | SINGH S, OSNA N A, KHARBANDA K K. Treatment options for alcoholic and non-alcoholic fatty liver disease: A review[J]. World J Gastroenterol, 2017, 23(36): 6549–6570. DOI:10.3748/wjg.v23.i36.6549 |
| [9] |
桑婷婷, 郭铖洁, 郭丹丹, 等. 中医药通过调节肠道菌群抑制肥胖和炎症相关疾病的进展研究[J].
中国中药杂志, 2018, 43(16): 3235–3242.
SANG T T, GUO C J, GUO D D, et al. Effect of traditional Chinese medicine in inhibiting obesity and inflammatory diseases by regulating gut microbiota[J]. China J Chin Materia Medica, 2018, 43(16): 3235–3242. DOI:10.19540/j.cnki.cjcmm.20180423.003 |
| [10] | ZHAO J Q, SHI Z Y, LIU S, et al. Ginsenosides Rg1 from panax ginseng: A potential therapy for acute liver failure patients?[J]. Evid Based Complement Alternat Med, 2014, 2014: 538059. DOI:10.1155/2014/538059 |
| [11] | LI J, YANG C, ZHANG S, et al. Ginsenoside Rg1 inhibits inflammatory responses via modulation of the nuclear factor-κB pathway and inhibition of inflammasome activation in alcoholic hepatitis[J]. Int J Mol Med, 2018, 41(2): 899–907. DOI:10.3892/ijmm.2017.3297 |
| [12] | WOODS A, WILLIAMS J R, MUCKETT P J, et al. Liver-specific activation of AMPK prevents steatosis on a high-fructose diet[J]. Cell Rep, 2017, 18(13): 3043–3051. DOI:10.1016/j.celrep.2017.03.011 |
| [13] | NIGRO D, MENOTTI F, CENTO A S, et al. Chronic administration of saturated fats and fructose differently affect SREBP activity resulting in different modulation of Nrf2 and Nlrp3 inflammasome pathways in mice liver[J]. J Nutr Biochem, 2017, 42: 160–171. DOI:10.1016/j.jnutbio.2017.01.010 |
| [14] | TIAN W, CHEN L, ZHANG L, et al. Effects of ginsenoside Rg1 on glucose metabolism and liver injury in streptozotocin-induced type 2 diabetic rats[J]. Genet Mol Res, 2017, 16(1). DOI:10.4238/gmr16019463 |
| [15] | LI J B, ZHANG R, HAN X, et al. Ginsenoside Rg1 inhibits dietary-induced obesity and improves obesity-related glucose metabolic disorders[J]. Braz J Med Biol Res, 2018, 51(4): e7139. DOI:10.1590/1414-431X20177139 |
| [16] | YAN Y, ZHOU X E, XU H E, et al. Structure and physiological regulation of AMPK[J]. Int J Mol Sci, 2018, 19(11): E3534. DOI:10.3390/ijms19113534 |
| [17] | KIM S J, YUAN H D, CHUNG S H. Ginsenoside Rg1 suppresses hepatic glucose production via AMP-activated protein kinase in HepG2 cells[J]. Biol Pharm Bull, 2010, 33(2): 325–328. DOI:10.1248/bpb.33.325 |
| [18] | SONG Y, KIM M B, KIM C, et al. 5, 7-dimethoxyflavone attenuates obesity by inhibiting adipogenesis in 3T3-L1 adipocytes and high-fat diet-induced obese C57BL/6J mice[J]. J Med Food, 2016, 19(12): 1111–1119. DOI:10.1089/jmf.2016.3800 |
| [19] |
顾业芸, 周启程, 公欣华, 等. 二氢山奈酚衍生物调控AMPK/PGC-1α通路抑制棕榈酸诱导的C2C12成肌分化细胞脂质沉积[J].
第三军医大学学报, 2017, 39(16): 1606–1611.
GU Y Y, ZHOU Q C, GONG X H, et al. Dihydrokaempferol derivatives inhibit palmitic acid-induced lipid deposition in C2C12 myotubes through AMPK/PGC-1a pathway[J]. J Third Mil Med Univ, 2017, 39(16): 1606–1611. DOI:10.16016/j.1000-5404.201612097 |
| [20] |
高燕翔, 张勇, 刘裕, 等. SREBP-1c在白藜芦醇预防大鼠非酒精性脂肪肝发生中的作用[J].
第三军医大学学报, 2015, 37(17): 1704–1708.
GAO Y X, ZHANG Y, LIU Y, et al. SREBP-lc is involved in preventive effect of resveratrol on pathogenesis of nonalcoholic fatty liver disease in rats[J]. J Third Mil Med Univ, 2015, 37(17): 1704–1708. DOI:10.16016/j.1000-5404.201412125 |
| [21] | ZHONG J, GONG W Q, LU L, et al. Irbesartan ameliorates hyperlipidemia and liver steatosis in type 2 diabetic db/db mice via stimulating PPAR-γ, AMPK/Akt/mTOR signaling and autophagy[J]. Int Immunopharmacol, 2017, 42: 176–184. DOI:10.1016/j.intimp.2016.11.015 |
| [22] | CORONA VELAZQUEZ A F, JACKSON W T. So many roads: the multifaceted regulation of autophagy induction[J]. Mol Cell Biol, 2018, 38(21). DOI:10.1128/mcb.00303-18 |
| [23] | YANG P, LING L, SUN W J, et al. Ginsenoside Rg1 inhibits apoptosis by increasing autophagy via the AMPK/mTOR signaling in serum deprivation macrophages[J]. Acta Biochim Biophys Sin (Shanghai), 2018, 50(2): 144–155. DOI:10.1093/abbs/gmx136 |
| [24] | LI Y J, WANG F, LUO Y. Ginsenoside Rg1 protects against sepsis-associated encephalopathy through beclin 1-independent autophagy in mice[J]. J Surg Res, 2017, 207: 181–189. DOI:10.1016/j.jss.2016.08.080 |



