2. 610041 成都,四川大学华西医院病理研究室
2. Department of Pathology, West China Hospital, Sichuan University, Chengdu, Sichuan Province, 610041, China
心力衰竭(heart failure, HF)是一种由于各种原因引起心脏结构和功能损害导致心脏舒张或者收缩功能障碍以致心输出量无法满足组织代谢需要的复杂的临床综合征。这种临床综合征的出现是各种心脏疾病发展到最后阶段的结果[1-2]。在中国,有240万人患有心力衰竭,每年诊断出的新病例约50万,而35~74岁成人慢性心力衰竭的患病率高达0.9%,迫切需要寻找一些新的有效的治疗方式[3-4]。目前,心力衰竭的药物治疗主要基于对症治疗,以及针对肾素血管紧张素系统和交感神经系统的治疗,然而这种策略并不能从根本上治疗心力衰竭。越来越多的研究表明心力衰竭的发生、发展与某些基因的表达及功能发挥密切相关,基因治疗越来越成为一种治疗心力衰竭的新的前景[5-7]。
microRNAs(miRNAs)是一类内源性的长度约为22个核苷酸的RNA分子[8-9]。研究表明,心力衰竭的发展与miRNAs密切相关,在心力衰竭患者的心脏组织中普遍存在着大量miRNAs的异常表达[10-11]。鉴于此,我们推测抑制心力衰竭后上调miRNAs的表达,或外源性增加下调miRNAs的表达可能用于治疗心力衰竭,而这些miRNA可能构成治疗心力衰竭的新策略。miR-1是心肌细胞中表达量最高的miRNA,具有抗细胞肥大的作用,同时在小鼠心脏特异性Dicer基因缺陷的环境下能够抑制心脏重构[12-16]。但是Dicer基因缺陷建立的心脏重构小鼠模型与临床心力衰竭有较大的差异。因此,有必要探讨miR-1在非心脏特异性Dicer缺陷型小鼠心力衰竭中是否具有治疗作用,以期为心力衰竭患者,特别是晚期心力衰竭患者的治疗提供新的思路。本研究通过异丙肾上腺素建立小鼠心力衰竭模型,然后治疗性地输入miR-1以探讨miR-1对心力衰竭小鼠心脏功能和结构的影响,并初步探索其作用机制。
1 材料与方法 1.1 实验动物C57BL/6小鼠由华西医院病理研究室提供,选取8~10周龄C57BL/6雄性小鼠,体质量22~26 g。
1.2 主要实验试剂异丙肾上腺素购自美国Sigma公司,miR-1序列为5′-UGGAAUGUAAAGAAGUAUGUAU-3′,miRNA agomir是经过特殊化学修饰的可以模拟内源性miRNA发挥作用的miRNA激动剂,miR-1 agomir及agomir对照试剂购自中国广州市锐博生物科技有限公司,线粒体钙单向转运蛋白(mitochondrial calcium uniporter,MCU)抗体购自中国北京博奥森生物技术有限公司,β-actin抗体及辣根过氧化物酶标记羊抗兔/抗小鼠IgG购自中国北京中杉金桥生物技术有限公司,WGA荧光抗体购自美国Life Technology公司,HE染色试剂盒、Masson三色染色试剂盒、天狼星红染色试剂盒均购自中国珠海贝索生物技术有限公司, Ki67抗体购自美国Thermo公司, DAPI及荧光二抗购自美国Invitrogen公司,DAB显色剂购自丹麦Dako公司。
1.3 实验模型建立及给药方法将15只成年C57BL/6雄性小鼠按照随机数字表法分为对照组、模型组及miR-1治疗组,每组5只。模型组及miR-1治疗组均腹腔注射异丙肾上腺素60 mg/kg,对照组腹腔注射等量的生理盐水,每天1次,持续注射28 d。第29天每组小鼠进行超声心动图检测,评估模型建立情况。模型建立后,miR-1治疗组尾静脉注射miR-1 agomir 100 μL (100 nmol/mL,溶剂为生理盐水),模型组尾静脉注射agomir对照试剂100 μL,对照组尾静脉注射生理盐水100 μL,每周2次(图 1)。
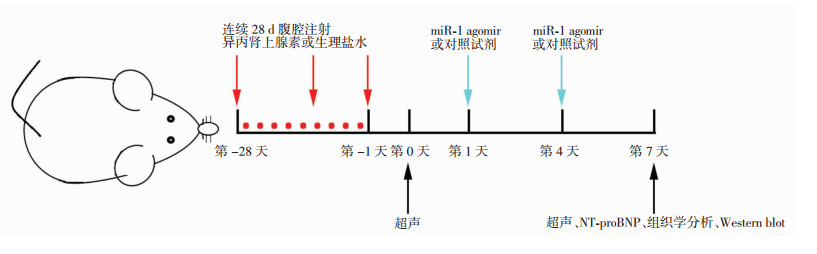
|
| 图 1 实验流程示意图 |
1.4 检测方法 1.4.1 小鼠超声心动图
各组小鼠连续28 d腹腔注射异丙肾上腺素或生理盐水后,以及miR-1 agomir治疗1周后行超声心动图检测。小鼠鼻腔吸入2%异氟烷进行全身麻醉,将麻醉后的小鼠左侧卧位固定于操作台上,然后将高频探头置于胸骨旁乳突肌水平心室短轴切面采集图像。测量反应舒张功能的相关指标:舒张末期左心室内径(LVIDD)、舒张末期左心室容积(EDV)及舒张末期左室后壁厚度(LVPWd)等,测量反应收缩功能的相关指标:收缩末期左心室内径(LVIDS)、收缩末期左心室容积(ESV)、射血分数(EF)及左心室短轴缩短率(FS)等。第2次超声检测后,在小鼠麻醉状态下断颈处死小鼠,立即打开胸腔游离心脏,并称取全心质量。取心脏中段组织浸泡于10%中性福尔马林固48 h,用于观察病理组织改变;剩余心脏组织在-80 ℃条件下保存,用于相关检测。
1.4.2 心脏大体观及心脏质量与体质量比称量小鼠,处死后游离完整心脏组织观察心脏外观,称量全心质量,计算全心质量(mg)/体质量(g)。
1.4.3 心脏组织病理分析将已固定的心脏组织进行包埋,然后做4 μm连续切片,进行脱蜡处理后进行HE染色观察心肌细胞形态及其排列等情况,进行Masson三色染色和天狼星红染色, 镜下观察心肌纤维化,行WGA免疫荧光染色显示心肌细胞膜,抗体浓度为1:300。
1.4.4 Ki67增殖细胞检测切片脱蜡后行Ki67免疫荧光染色,Ki67一抗浓度为1:100,DAPI染细胞核,在荧光显微镜下采集图像, 每个样本随机选取3个视野,每组3个样本进行Ki67阳性率统计分析。
1.4.5 Western blot检测电子天平称取15~20 mg小鼠心脏组织置于已加入组织强裂解混合液的匀浆管中进行匀浆,4 ℃冰箱内静置1 h后,放入4 ℃离心机以12 000 r/min进行离心10 min,提取上清液,用BCA检测试剂盒检测总蛋白浓度后加入缓冲液,混匀后,于沸水浴5~10 min。采用SDS-PAGE配置凝胶,蛋白上样后,经过电泳、转膜、封闭后,添加一抗β-actin(1: 4 000)、MCU(1:1 000)4 ℃过夜孵育,将一抗取出置于室温下复温30 min后,二抗(1:5 000)孵育1 h,ECL显影,凝胶成像仪器曝光。采用Image Lab软件分析条带灰度值,用目的蛋白与内参蛋白的比值来衡量蛋白的相对表达量。
1.4.6 免疫组织化学染色检测将4 μm的心脏石蜡切片行二甲苯脱蜡及乙醇梯度脱水处理后,置于10 mmol/L柠檬酸盐缓冲液中,在微波炉中修复抗原16 min;自然冷却至室温后,加入3% H2O2于室温下孵育10 min,PBS洗3次,5 min/次;滴加MCU一抗(浓度为1:500),置于4 ℃冰箱孵育过夜;然后置于室温30 min,PBS洗3次,5 min/次,滴加辣根过氧化物酶标记羊抗兔IgG于室温孵育1 h;进行DAB显色,苏木精复染。
1.5 统计学分析采用GraphPad Prism 7.0统计软件进行分析,数据以x±s表示,两组间数据比较采用t检验,多组间数据比较采用单因素方差分析。检验水准:α=0.05。
2 结果 2.1 超声心动图检查异丙肾上腺素诱导28 d后,模型组及miR-1治疗组各仅有3只小鼠存活。异丙肾上腺素诱导28 d后(即第0天)和予以miR-1 agomir输注后(即第7天)均行超声心动图检测。结果显示:在第0天,与对照组比较,模型组及miR-1治疗组小鼠出现明显的心功能恶化,体现在心腔扩大,心脏射血功能明显下降,LVIDS及ESV明显增加(P < 0.05,表 1),EF及FS明显降低(P < 0.05,表 1),提示异丙肾上腺素诱导了小鼠的心功能恶化;在第7天,与模型组比较,miR-1治疗组LVIDS及ESV明显下降(P < 0.05,表 1),EF及FS明显增加(P < 0.05,表 1),提示miR-1治疗后可以改善异丙肾上腺素诱导的小鼠心功能恶化。
| 组别 | n | LVIDS/mm | ESV/mL | EF(%) | FS(%) | |||||||
| 第0天 | 第7天 | 第0天 | 第7天 | 第0天 | 第7天 | 第0天 | 第7天 | |||||
| 对照组 | 5 | 1.81± 0.06 | 1.96±0.15 | 0.016 0±0.002 4 | 0.022 0±0.003 7 | 80.40±0.98 | 79.40±0.75 | 43.00±1.05 | 42.20±0.73 | |||
| 模型组 | 3 | 2.54± 0.08a | 3.10±0.14a | 0.043 3±0.003 3a | 0.080 0±0.011 6a | 51.67±4.70a | 49.33±1.45a | 22.33±2.85a | 21.00±0.58a | |||
| miR-1治疗组 | 3 | 2.90± 0.06ab | 2.21±0.17b | 0.063 3±0.003 3ab | 0.030 0±0.005 8b | 48.67±6.39a | 73.67±4.18b | 20.67±3.18a | 37.00±3.51b | |||
| a:P < 0.05,与对照组比较;b:P < 0.05,与模型组比较 | ||||||||||||
2.2 小鼠血清NT-proBNP水平
与对照组比较,模型组及miR-1治疗组的血清NT-proBNP水平明显增高;与模型组相比,miR-1治疗组血清NT-proBNP水平明显下降(图 2)。此结果提示:miR-1可以改善异丙肾上腺素诱导的小鼠心功能障碍,但不能完全恢复。
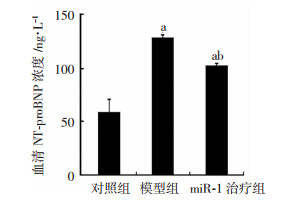
|
| a:P < 0.05,与对照组比较;b:P < 0.05,与模型组比较 图 2 各组小鼠血清NT-proBNP水平比较 |
2.3 小鼠心脏大体观察
与对照组比较,模型组小鼠大体外观明显增大,并且小鼠心脏质量与体质量的比值明显增加(P < 0.05,图 3);与模型组比较,miR-1治疗组小鼠以上指标明显改善(P < 0.05,图 3)。
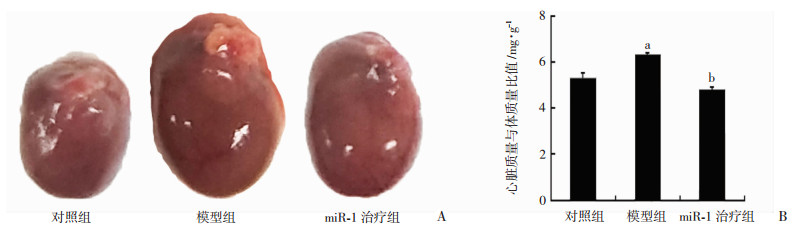
|
| A:各组心脏大体外观;B:各组心脏质量/体质量比较 a:P < 0.05,与对照组比较;b:P < 0.05,与模型组比较 图 3 各组小鼠心脏大体外观及相关指标定量分析 |
2.4 小鼠心脏组织病理学分析
HE染色、天狼星红染色、Masson三色染色及WGA免疫荧光染色检测结果显示:与对照组比较,模型组出现了明显的心肌细胞排列紊乱、心肌纤维化及心肌细胞肥大;与模型组比较,miR-1治疗组心肌细胞排列紊乱、心肌纤维化及心肌细胞肥大明显减轻(图 4)。提示miR-1输注后可以明显改善异丙肾上腺素诱导的心室重塑。

|
| 图 4 输注miR-1改善异丙肾上腺素诱导的心力衰竭小鼠心室重塑 |
2.5 细胞增殖检测
结果显示,模型组的增殖阳性率为1.93%,较对照组明显增高(P < 0.05), 而miR-1治疗组的增殖阳性率为0.97%,明显低于模型组,但仍然高于对照组,差异均有统计学意义(P < 0.05,图 5)。

|
| A:Ki67免疫荧光染色检测各组细胞增殖;B:各组细胞增殖阳性率比较 a:P < 0.05,与对照组比较;b:P < 0.05,与模型组比较 图 5 输注miR-1改善异丙肾上腺素诱导的心力衰竭小鼠心脏组织中的细胞增殖 |
2.6 miR-1靶基因MCU的表达
miR-1与MCU的结合位点见图 6A。Western blot检测、MCU免疫组织化学染色检测结果均显示:与对照组比较,模型组小鼠心脏组织中MCU表达量增加(P < 0.05,图 6);与模型组比较,miR-1治疗组小鼠心脏组织中MCU的表达量降低(P < 0.05,图 6)。提示输注miR-1可以降低心脏组织MCU的表达。
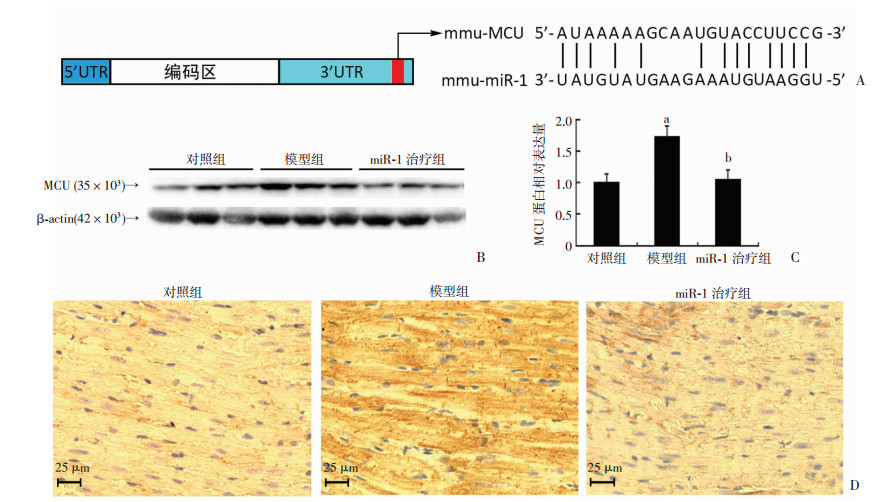
|
| A:靶基因结合位点;B:Western blot检测结果;C:半定量分析;D:免疫组织化学染色检测MCU的表达(二步法) a:P < 0.05,与对照组比较;b:P < 0.05,与模型组比较 图 6 输注miR-1对各组小鼠心脏组织MCU表达的影响 |
3 讨论
心脏移植是晚期心力衰竭患者的首选治疗方式,尽管采取最佳的药物治疗方式,但是仍然存在着症状[17-18]。虽然miR-1抑制细胞肥大已经明确,但是大多为体外实验无法真正模拟体内环境,体内实验也仅限于心力衰竭早期阶段的研究,即仅出现了心肌肥大,尚未出现心肌纤维化、心室射血障碍的代偿时期。以往的研究表明miR-1能够抑制小鼠心脏特异性Dicer基因缺陷引起心脏重构[15-16]。但是这种心室重构小鼠模型与临床心力衰竭具有较大的差异,因此,本研究重点集中在探讨补充miR-1是否对用异丙肾上腺素诱导的心力衰竭小鼠有治疗作用并且初步探讨其机制,以期为临床晚期心力衰竭患者寻求新的治疗靶点。本研究发现,尾静脉输注miR-1可以改善异丙肾上腺素诱导的心功能障碍和心室重构,这种治疗作用可能是通过调节MCU的表达引起的。
在建立小鼠心力衰竭模型后,补充miR-1能够改善异丙肾上腺素诱导的小鼠心功能恶化及心室重构,对于心脏来说,无法获取同一只小鼠在不同时间点的心脏组织,因而无法确定输注miR-1是否可以逆转心肌纤维化。值得注意的是,本研究发现miR-1治疗性输入后可以明显改善细胞增殖情况,但是不能完全纠正,基于心肌细胞属于永久性细胞,我们推测增殖的细胞可能为成纤维细胞,miR-1可能通过抑制成纤维细胞的增殖来减轻心肌纤维化,以达到改善小鼠心脏功能的作用,当然这样的假设还需要进一步实验的证明。再者,已有研究表明单独使用miR-1可以诱导心脏的重新编程[19]。因此,我们推测补充miR-1也可能通过诱导心脏重编程以逆转心肌纤维化。
线粒体作为一个独立的细胞器,其功能与心力衰竭的发生、发展密切相关。在心脏组织中,由于其能量的需求,线粒体代谢的精细而有效的调节是必需的。细胞内Ca2+是收缩代谢偶联的中枢介质,在同一心脏组织中,不仅可以调节收缩,而且能够进入线粒体刺激ATP的产生。MCU作为一种跨膜蛋白,具有促使Ca2+从细胞的细胞质转运入线粒体的作用,而线粒体Ca2+摄取对线粒体功能至关重要,其中包括了各种细胞信号传导过程和ATP产生。MCU的活性受线粒体Ca2+摄取1(MICU1)和线粒体Ca2+摄取2(MICU2)的调节,MCU、MICU1、MICU2及MCUb一起构成线粒体钙单向转运复合物(MCUC)。MCU作为MCUC的核心通道亚基,是线粒体摄取Ca2+的主要来源之一,其流动依赖于线粒体内膜的膜电位和细胞质与线粒体中Ca2+浓度差。平衡Ca2+浓度是增加细胞能量供应和调节细胞死亡所必需的。在细胞内,MCU与钠钙交换器一起平衡Ca2+浓度[20-23]。
已有研究表明,在产后发育、慢性运动和压力超载依赖性心肌细胞肥大的代偿阶段,线粒体MCU的表达量是增加的,而miR-1的表达量是降低的[20]。这可能一方面会促进Ca2+摄取,刺激ATP生成,以维持细胞生长的能量需求,然而另一方面可能会导致细胞处于线粒体Ca2+超载的风险中。此外,该研究仅限于病理性肥大时期,此时并未出现收缩性功能障碍,即代偿阶段,但是MCU的miR-1依赖性调节是否在从代偿到失代偿阶段的肥大进展中起作用是不明确的。本实验证实在心脏出现收缩性功能障碍后, MCU的表达上调,而输注miR-1后MCU表达降低。我们推测,在心力衰竭发展到失代偿阶段后,MCU上调可能导致了Ca2+超载的发生,进一步损伤心肌细胞、损害心脏功能,当输注miR-1后降低了MCU的表达,可以看作是Ca2+超载的保护机制,保护心肌细胞、维持心脏功能。因此,我们认为调节MCU的表达可能是miR-1改善心力衰竭小鼠心脏功能的原因之一,当然其具体机制还需要进一步实验证明。
综上所述,本研究发现miR-1对心力衰竭有一定的改善作用,miR-1通过部分纠正心肌肥大、心肌纤维化、细胞增殖,部分纠正了异丙肾上腺素诱导的心室重塑,此外,miR-1可能通过调节MCU的表达来改善异丙肾上腺素诱导的心功能恶化。然而,由于治疗时间较短,无法评估其长期疗效。因此,在未来的研究中,应延长治疗时间以评估长期疗效。
| [1] | JOHNSON F L. Pathophysiology and etiology of heart failure[J]. Cardiol Clin, 2014, 32(1): 9–19. DOI:10.1016/j.ccl.2013.09.015 |
| [2] | YANCY C W, JESSUP M, BOZKURT B, et al. 2013 ACCF/AHA guideline for the management of heart failure: A report of the american college of cardiology foundation/american heart association task force on practice guidelines[J]. J Am Coll Cardiol, 2013, 62(16): e147–e239. DOI:10.1016/j.jacc.2013.05.019 |
| [3] | LAM C S, TENG T K, TAY W T, et al. Regional and ethnic differences among patients with heart failure in Asia: the Asian sudden cardiac death in heart failure registry[J]. Eur Heart J, 2016, 37(41): 3141–3153. DOI:10.1093/eurheartj/ehw331 |
| [4] | WEIWEI C, RUNLIN G, LISHENG L, et al. Outline of the report on cardiovascular diseases in China, 2014[J]. Eur Heart J Suppl, 2016, 18: F2–F11. DOI:10.1093/eurheartj/suw030 |
| [5] | ROSIK J, SZOSTAK B, MACHAJ F, et al. Potential targets of gene therapy in the treatment of heart failure[J]. Expert Opin Ther Targets, 2018, 22(9): 811–816. DOI:10.1080/14728222.2018.1514012 |
| [6] | WAHLQUIST C, JEONG D, ROJAS-MUÑOZ A, et al. Inhibition of miR-25 improves cardiac contractility in the failingheart[J]. Nature, 2014, 508(7497): 531–535. DOI:10.1038/nature13073 |
| [7] | RINCON M Y, VANDENDRIESSCHE T, CHUAH M K. Gene therapy for cardiovascular disease: advances in vector development, targeting, and delivery for clinical translation[J]. Cardiovasc Res, 2015, 108(1): 4–20. DOI:10.1093/cvr/cvv205 |
| [8] | ZHU Z D, YE J Y, NIU H, et al. Effects of microRNA-292-5p on myocardial ischemia-reperfusion injury through the peroxisome proliferator-activated receptor-α/-γ signaling pathway[J]. Gene Ther, 2018, 25(3): 234–248. DOI:10.1038/s41434-018-0014-y |
| [9] | XU L J, WANG Q X, JIANG W, et al. MiR-34c ameliorates neuropathic pain by targeting NLRP3 in a mouse model of chronic constriction injury[J]. Neuroscience, 2019, 399: 125–134. DOI:10.1016/j.neuroscience.2018.12.030 |
| [10] | NIE X, FAN J H, LI H P, et al. Mir-217 promotes cardiac hypertrophy and dysfunction by targeting PTEN[J]. Mol Ther Nucleic Acids, 2018, 12: 254–266. DOI:10.1016/j.omtn.2018.05.013 |
| [11] | KALOZOUMI G, YACOUB M, SANOUDOU D. MicroRNAs in heart failure: Small molecules with major impact[J]. Glob Cardiol Sci Pract, 2014, 2014(2): 79–102. DOI:10.5339/gcsp.2014.30 |
| [12] | WU M F, WU D, WANG C G, et al. Hexabromocyclododecane exposure induces cardiac hypertrophy and arrhythmia by inhibiting miR-1 expression via up-regulation of the homeobox gene Nkx2.5[J]. J Hazard Mater, 2016, 302: 304–313. DOI:10.1016/j.jhazmat.2015.10.004 |
| [13] | DINIZ G P, LINO C A, MORENO C R, et al. MicroRNA-1 overexpression blunts cardiomyocyte hypertrophy elicited by thyroid hormone[J]. J Cell Physiol, 2017, 232(12): 3360–3368. DOI:10.1002/jcp.25781 |
| [14] | CURCIO A, TORELLA D, IACONETTI C, et al. MicroRNA-1 downregulation increases connexin 43 displacement and induces ventricular tachyarrhythmias in rodent hypertrophic hearts[J]. PLoS ONE, 2013, 8(7): e70158. DOI:10.1371/journal.pone.0070158 |
| [15] | KARAKIKES I, CHAANINE A H, KANG S, et al. Therapeutic cardiac-targeted delivery of miR-1 reverses pressure overload-induced cardiac hypertrophy and attenuates pathological remodeling[J]. J Am Heart Assoc, 2013, 2(2): e000078. DOI:10.1161/JAHA.113.000078.DOI:10.1161/JAHA.113.000078 |
| [16] |
罗水莲, 陈宇航, 石毓君, 等. microRNA-1抑制心肌特异性Dicer基因缺失小鼠心脏病理性重构[J].
第三军医大学学报, 2017, 39(14): 1469–1475.
LUO S L, CHEN Y H, SHI Y J, et al. MicroRNA-1 prevents cardiac remodeling in mice with heart failure induced by Dicer ablation[J]. J Third Mil Med Univ, 2017, 39(14): 1469–1475. DOI:10.16016/j.1000-5404.201611030 |
| [17] | SZCZUREK W, SZYGUŁA-JURKIEWICZ B, SIEDLECKI Ł, et al. Prognostic scales in advanced heart failure[J]. Kardiochir Torakochirurgia Pol, 2018, 15(3): 183–187. DOI:10.5114/kitp.2018.78444 |
| [18] | COWGER J A, RADJEF R. Advanced heart failure therapies and cardiorenal syndrome[J]. Adv Chronic Kidney Dis, 2018, 25(5): 443–453. DOI:10.1053/j.ackd.2018.08.012 |
| [19] | JAYAWARDENA T M, EGEMNAZAROV B, FINCH E A, et al. MicroRNA-mediated in vitro and in vivo direct reprogramming of cardiac fibroblasts to cardiomyocytes[J]. Circ Res, 2012, 110(11): 1465–1473. DOI:10.1161/CIRCRESAHA.112.269035 |
| [20] | ZAGLIA T, CERIOTTI P, CAMPO A, et al. Content of mitochondrial calcium uniporter (MCU) in cardiomyocytes is regulated by microRNA-1 in physiologic and pathologic hypertrophy[J]. Proc Natl Acad Sci USA, 2017, 114(43): E9006–E9015. DOI:10.1073/pnas.1708772114 |
| [21] | KIM J C, SON M J, WOO S H. Regulation of cardiac calcium by mechanotransduction: Role of mitochondria[J]. Arch Biochem Biophys, 2018, 659: 33–41. DOI:10.1016/j.abb.2018.09.026 |
| [22] | YU Z Q, CHEN R Z, LI M H, et al. Mitochondrial calciumuniporter inhibition provides cardioprotection in pressure overload-induced heart failure through autophagy enhancement[J]. Int J Cardiol, 2018, 271: 161–168. DOI:10.1016/j.ijcard.2018.05.054 |
| [23] | TOMAR D, DONG Z W, SHANMUGHAPRIYA S, et al. MCUR1 is a scaffold factor for the MCU complex function and promotes mitochondrial bioenergetics[J]. Cell Rep, 2016, 15(8): 1673–1685. DOI:10.1016/j.celrep.2016.04.050 |



